Изобретение относится к области органической и медицинской химии, к новым биологически активным веществам класса замещенных пирроло[4,5-a]тиено[3,2-e]пиримидинов, а именно к (E)-5-амино-2-оксо-1-((E)-2-оксо-4-фенилбут-3-ен-1-илиден)-1,2,6,7,8,9-гексагидробензо[4,5]тиено[3,2-e]пирроло[1,2-a]пиримидин-3-карбоксамиду формулы:

которое обладает противораковой активностю в терапии меланомы легких, что позволяет предположить его использование в медицине в качестве лекарственных средств с цитотоксическими свойствами и низкой токсичностью.
Ближайшим аналогом по структуре для заявляемого соединения является (E)-2,5-диоксо-1-(2-(4-метоксифенил)-2-оксоэтилиден)-1,2,4,5,7,8,9,10-октагидро-6H-циклогепта[4,5]тиено[3,2-e]пирроло[1,2-a]пиримидин-3-карбонитрил 2, обладающий противораковой активностью [European Journal of Medicinal Chemistry, 2023, Vol. 254, pp. 115325] формулы:
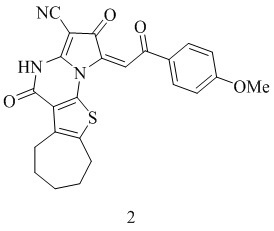
Приведены данные по противораковой активности.
B16-F10
MEF NF2
Эталоном сравнения биологической активности был выбран Вемурафениб формулы:
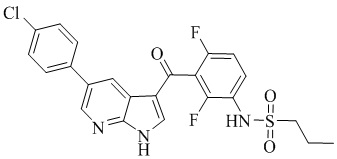
который был одобрен FDA для лечения метастатической меланомы и является аналогом по действию [Geoffrey K. FDA approval summary: vemurafenib for treatment of unresectable or metastatic melanoma with the BRAFV600E mutation / K. Geoffrey // Clin Cancer Res. - 2014. - Vol. 20(19). - P. 4994-5000. - [Electronical resource]. - URL: DOI: 10.1158/1078-0432.CCR-14-0776], [HIGHLIGHTS OF PRESCRIBING INFORMATION // ZELBORAF® (vemurafenib) tablet for oral use Initial U.S. Approval: 2011. - [Electronical resource]. - URL: https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/202429s012lbl.pdf].
Задачей изобретения является поиск в ряду производных замещенных пирроло[4,5-a]тиено[3,2-e]пиримидинов веществ с выраженной противораковой активностью в терапии меланомы легких и низкой токсичностью в отношении здоровых тканей для расширения арсенала цитотоксических средств.
Технический результат достигается химическим синтезом и применением (E)-5-амино-2-оксо-1-((E)-2-оксо-4-фенилбут-3-ен-1-илиден)-1,2,6,7,8,9-гексагидробензо[4,5]тиено[3,2-e]пирроло[1,2-a]пиримидин-3-карбоксамида, который обладает противораковой активностью в терапии меланомы легких и низкой токсичностью в отношении здоровых тканей.
Заявляемое соединение 1 синтезируют взаимодействием нитрила 2-(((E)-2-оксо-5-стирилфуран-3(2H)-илиден)амино)-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоновой кислоты с амидом цианоуксусной кислоты в присутствии 2 эквивалентов диизопропилэтиламина. Реакция протекает в диоксане при перемешивании и температуре 80°С в течении 1 часа, с последующим выделением целевых продуктов известными методами по схеме:

Однако из патентной и научно-технической литературы не выявлено применение соединения 1 в качестве средств с цитотоксическими свойствами в терапии меланомы легких.
Изобретение иллюстрируется примерами исследования фармакологических свойств.
Пример 1. Получение соединения 1.
К раствору 3.60 г (0.01 моль) нитрила 2-(((E)-2-оксо-5-стирилфуран-3(2H)-илиден)амино)-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоновой кислоты в 50 мл безводного диоксана прибавляли 0.89 г (0.01 моль) амида цианоуксусной кислоты, затем к полученной смеси добавляли 2.58 г (0.02 моль) диизопропилэтиламина, полученный раствор выдерживали 1 час при температуре 80°С при интенсивном перемешивании. Смесь охлаждали до 0°С, выпавший осадок отфильтровывали и перекристаллизовывали.
Выход 80 %, т. пл. 232-234°С (диоксан). Спектр ЯМР 1Н (CDCl3+CF3COOH), δ, м. д.: 2.00 (м, 4H), 2.92 (м, 4H), 7.15 (м, 2Н), 7.42 (м, 4Н), 7.63 (м, 2Н), 7.82 (м, 1Н), 8.33 (уш. с, 1Н), 8.76 (уш. с, 1Н). Спектр ЯМР 13C (CDCl3+CF3COOH), δ, м. д.: 20.9, 21.3, 24.1, 24.5, 90.0, 112.5, 120.6, 124.5, 128.8, 128.9, 132.2, 132.7, 132.8, 136.8, 145.3, 150.2, 156.5, 157.3, 165.8, 174.7, 190.3. Найдено, %: C, 64.83; H, 4.55; N, 12.61; S, 7.22. C24H20N4O3S. Вычислено, %: C, 64.85; H, 4.54; N, 12.60; S, 7.21
Полученное соединение 1 представляет собой желтое кристаллическое вещество, растворимое в ДМСО, при нагревании в толуоле, ацетоне, не растворимое в воде и гексане.

Пример 2. Для оценки противоопухолевой активности соединения 1 использовался стандартный тест с использованием резазурина [Lancaster MV, Fields RD (1996) Antibiotic and cytotoxic drug susceptibility assays using resazurin and poisoning agents. U.S. Patent No. 5,501,959]. Клеточная линия B16-F10 культивировалась с использованием среды αМЕМ (Биолот) + 10% ФБС (фетальной бычьей сыворотки) (Биолот), линия MEF NF2 - ДМЕМ (Биолот) +10% ФБС при температуре 37°С в увлажненной атмосфере 5% CO2 (СО2 инкубатор с воздушной рубашкой Panasonic (Sanyo) MCO-18AC (MCO-18AC-PE)). Пассажировали дважды в неделю (при 80% конкуренции) при плотности 4 × 104 клеток на см2.
В 96 луночный планшет (TC-treated Culture Microplate, Corning) заносили клетки в размере 10 тыс. кл. на лунку + 100 мкл среды. Перед добавлением к клеточным культурам все тестируемые соединения растворяли в ДМСО (500 мкл - 10 мМ); затем разводили в клеточной среде (40 мкл в среде 960 мкл) и получали раствор 400 мкМ. После этого в лунки с клетками (B16-F10 и MEF NF2) добавляли несколько концентраций тестируемых соединений (5, 10, 15, 20 мкМ). Спустя 24 часа среду заменяли раствором среды + 10% резазурина (Resazurin sodium salt, Sigma-Aldrich) и инкубировали 4 часа. В качестве положительного контроля использовали лунки с клетками без внесения вещества. В качестве отрицательного контроля - лунки без клеток с добавлением среды с резазурином. После инкубации среду с резазурином из всех лунок переносили на чистый планшет и оценивали на спектрофотометре на длинах волн 570 нм и 600 нм. Жизнеспособность оценивали по стандартным формулам.
Пример 3. Острую токсичность (ЛД50, мг/мл) соединения 1 определяли по методу Г. Н. Першина [Першин Г. Н. Методы экспериментальной химиотерапии // М., С. 100, 109-117 (1971)]. Соединение 1 вводили внутрибрюшинно белым мышам массой 16-18 г в виде взвеси в 2% крахмальной слизи и наблюдали за поведением и гибелью животных в течение 10 суток. Для исследуемого соединения 1 ЛД50 составляет > 1500 мг/кг.
Согласно классификации токсичности препаратов соединение 1 относится к V классу практически нетоксичных препаратов [Измеров Н.Ф., Саноцкий И.В., Сидоров К.К. Параметры токсикометрии промышленных ядов при однократном воздействии: Справочник. М., 1977. - с. 196]. Результаты испытаний представлены в таблице:
Противораковая активность соединения 1.
B16-F10
MEF NF2
Как видно из таблицы, заявляемое соединение 1 проявляет выраженную противораковую активность и превышает таковую препарата сравнения, используемого в медицинской практике по отношению к терапии меланомы легких. Таким образом, (E)-5-амино-2-оксо-1-((E)-2-оксо-4-фенилбут-3-ен-1-илиден)-1,2,6,7,8,9-гексагидробензо[4,5]тиено[3,2-e]пирроло[1,2-a]пиримидин-3-карбоксамид проявляет более высокую активность по сравнению с используемым в медицине препаратом сравнения, что делает возможным его использование для создания новых лекарственных средств целенаправленного действия с низкой токсичностью в отношении здоровых тканей.
Изобретение относится к области органической и медицинской химии, к новым биологически активным веществам класса замещенных пирроло[4,5-a]тиено[3,2-e]пиримидинов, а именно к (E)-5-амино-2-оксо-1-((E)-2-оксо-4-фенилбут-3-ен-1-илиден)-1,2,6,7,8,9-гексагидробензо[4,5]тиено[3,2-e]пирроло[1,2-a]пиримидин-3-карбоксамиду формулы 1, который обладает противораковой активностью в терапии меланомы легких, что позволяет использовать его в медицине в качестве лекарственных средств с цитотоксическими свойствами и низкой токсичностью. 1 табл., 3 пр.
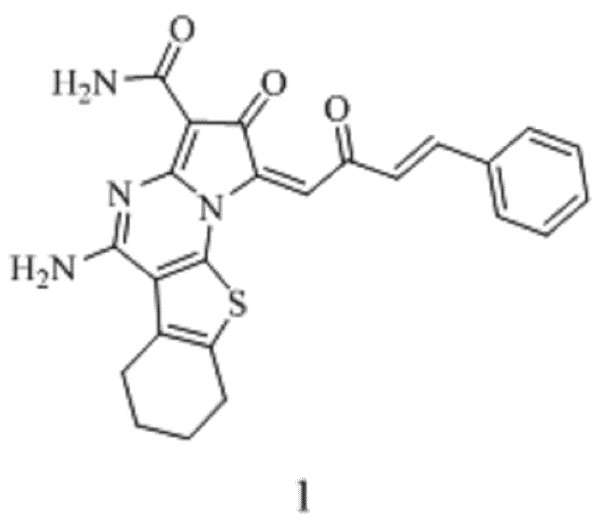
(E)-5-амино-2-оксо-1-((E)-2-оксо-4-фенилбут-3-ен-1-илиден)-1,2,6,7,8,9-гексагидробензо[4,5]тиено[3,2-e]пирроло[1,2-a]пиримидин-3-карбоксамид формулы

применяющийся как противораковое средство в терапии меланомы легких.
| S | |||
| A | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Гонок для ткацкого станка | 1923 |
|
SU254A1 |
| Шипиловских Сергей Александрович, "Синтез и химические | |||
Авторы
Даты
2024-03-11—Публикация
2023-07-14—Подача