Изобретение относится к биотехнологии, конкретно к биофармакологии, к областям получения и производства иммунобиологических препаратов, медицинской микробиологии, созданию фармакологических и вакцинных композиций, биотехнологиям продукции рекомбинантных белков, и касается разработки нового способа получения рекомбинантного мембранного белка rLptD Brucella abortus.
Основной сферой применения предлагаемого способа получения рекомбинантного белка rLptD являются биомедицина, создание медицинских профилактических препаратов, лабораторные биологические и медицинские исследования.
Белки наружной мембраны уникальны для грамотрицательных бактерий. Несколько особенностей, включая экспонирование на поверхности, консервативность среди штаммов и способность индуцировать иммунный ответ, делают их привлекательными кандидатами для использования в качестве вакцинных антигенов и иммунотерапевтических препаратов (Cloeckaert A., Vizcaíno N., Paquet J.Y., Bowden R.A., Elzer P.H. / Major outer membrane proteins of Brucella spp.: past, present and future. // Vet Microbiol. - 2002. – V. 90(1-4). – P.229-47. DOI: 10.1016/s0378-1135(02)00211-0. PMID: 12414146).
Белок внешней мембраны бруцелл LptD входит в комплекс из 7 транспортных белков (LptAB2CDEFG), которые транспортируют молекулы липополисахарида (ЛПС) из места их сборки на внутренней мембране на внешнюю мембрану. LptD участвует в транспорте ЛПС с периплазматической стороны внешней мембраны к его конечному местоположению на клеточной поверхности (Chimalakonda G., Ruiz N., Chng S.S., Garner R.A., Kahne D., Silhavy T.J. / Lipoprotein LptE is required for the assembly of LptD by the beta-barrel assembly machine in the outer membrane of Escherichia coli // Proc Natl Acad Sci U S A. -2011. – V.108(6). -V.2492-7. DOI: 10.1073/pnas.1019089108).
Бруцеллы, как и другие микроорганизмы порядка ризобиевые, демонстрируют униполярный рост клетки, включая компоненты оболочки, в том числе ЛПС, на полюсе роста у неделящихся бактерий и в месте сужения у делящихся бактерий (Servais C., Vassen V., Verhaeghe A., et al. / Lipopolysaccharide biosynthesis and traffic in the envelope of the pathogen Brucella abortus // Nat Commun. – 2023. – V.14. - P. 911. https://doi.org/10.1038/s41467-023-36442-y). Наибольшее количество белка LptD обнаруживается на полюсе роста клетки, где осуществляется активный транспорт ЛПС у бруцелл (Vassen V., Valotteau C., Feuillie C., Formosa-Dague C., Dufrêne YF, De Bolle X. / Localized incorporation of outer membrane components in the pathogen Brucella abortus // EMBO J. - 2019. – V. 38(5). - P.e100323. DOI: 10.15252/embj.2018100323. Owens T.W., Taylor R.J., Pahil K.S., Bertani B.R., Ruiz N., Kruse A.C., Kahne D. Structural basis of unidirectional export of lipopolysaccharide to the cell surface. // Nature. – 2019. – V.567 (7749). - P.550-553. DOI: 10.1038/s41586-019-1039-0). Таким образом, блокирование функции данного белка, может привести к торможению роста и размножения клетки.
Белки LptD грамотрицательных бактерий имеют схожую структуру и функции. О существенной роли белков LptD для их жизнедеятельности может свидетельствовать эффективность пептидомиметических антибиотиков, которые связываясь с LptD ингибируют транспорт ЛПС, что приводит к гибели клетки (Werneburg M., Zerbe K., Juhas M., Bigler L., Stalder U., Kaech A., Ziegler U., Obrecht D., Eberl L., Robinson J.A. / Inhibition of lipopolysaccharide transport to the outer membrane in Pseudomonas aeruginosa by peptidomimetic antibiotics. // Chembiochem. – 2012. -V.13(12). - P.1767-75. DOI: 10.1002/cbic.201200276). На данный момент такой препарат под названием Murepavadin, или POL7080, проходит 3 фазу клинических испытаний для лечения инфекций, вызванных Pseudomonas aeruginosa (Javed A., Slingerland C.J., Wood T.M., Martin N.I., Broere F., Weingarth M.H., Veldhuizen E.J.A. / Chimeric Peptidomimetic Antibiotic Efficiently Neutralizes Lipopolysaccharides (LPS) and Bacteria-Induced Activation of RAW Macrophages. // ACS Infect Dis. – 2023. - V. 9(3). - P.518-526. DOI: 10.1021/acsinfecdis.2c00518).
Эффективность белка LptD в качестве протективного антигена была показана против инфекций, вызванных Salmonella typhimurium, Vibrio parahaemolyticus, Bordetella pertussis (Dorji D., Graham R. M., Singh A. K., Ramsay J. P. Price P., Lee S. / Immunogenicity and protective potential of Bordetella pertussis biofilm and its associated antigens in a murine model. // Cellular Immunology. – 2019. – V. 337. - P.42-47. DOI:10.1016/j.cellimm.2019.01.006). Например, иммунизация LptD обеспечила 100% защиту мышей от V. parahaemolyticus, а также выживаемость в течение 10 дней наблюдения, в то время как контрольные животные погибли в течение 5 часов (Zha Z., Li C., Li W., Ye Z., Pan J. / LptD is a promising vaccine antigen and potential immunotherapeutic target for protection against Vibrio species infection. // Sci Rep. – 2016. -V.6. - P.38577. DOI: 10.1038/srep38577). Иммунизация мышей рекомбинантным слитым белком, включающим сальмонеллезные белки SipD и LptD, обеспечила 90% и 70% защиту от 10LD50 и 100LD50 S. typhimurium (Aghaie S.M., Tabatabaei M., Nazarian S. / Bioinformatics design of recombinant chimeric protein containing SipD and LptD immunogens and evaluation of its immunogenicity against Salmonella Typhimurium. // Microb Pathog. -2023. - V.175. -P.105959. DOI: 10.1016/j.micpath.2022.105959).
Теоретическая эффективность белка для применения в вакцинологии неоднократно оценивалась с помощью биоинформатики (Zai X., Yin Y., Guo F. et al. / Screening of potential vaccine candidates against pathogenic Brucella spp. using compositive reverse vaccinology. // Vet Res. – 2021. – V.52. -P.75. https://doi.org/10.1186/s13567-021-00939-5. Vishnu U.S., Sankarasubramanian J., Gunasekaran P., Rajendhran J. / Novel Vaccine Candidates against Brucella melitensis Identified through Reverse Vaccinology Approach. // OMICS. -2015. – V.19(11). - P.722-9. DOI: 10.1089/omi.2015.0105. Chukwu-Osazuwa J., Cao T., Vasquez I., Gnanagobal H., Hossain A., Machimbirike V.I., Santander J. / Comparative Reverse Vaccinology of Piscirickettsia salmonis, Aeromonas salmonicida, Yersinia ruckeri, Vibrio anguillarum and Moritella viscosa, Frequent Pathogens of Atlantic Salmon and Lumpfish Aquaculture. // Vaccines. - 2022. - V.10 (3). - P.473. https://doi.org/10.3390/vaccines10030473). В нашей недавней работе, анализ геномов 10 штаммов Brucella аbortus методами обратной вакцинологии показал, что среди 45 вычисленных поверхностных бруцеллезных белков, именно LptD обладает лучшими прогностическими иммуногенными характеристиками (Дятлова В.И. / Применение методов обратной вакцинологии для разработки новых вакцин против бруцеллеза. // Бактериология. – 2021. - V. 6(4). - P.16-29. DOI: 10.20953/2500-1027-2021-4-16-29).
LptD образует с липопротеином LptE архитектуру по типу «бочонка и пробки», где LptE, выступает в качестве шаперона, необходимого для правильного сворачивания и поддержания конформации LptD (Qiao S., Luo Q., Zhao Y., et al. / Structural basis for lipopolysaccharide insertion in the bacterial outer membrane. // Nature. – 2014. - V.511. - P. 108–111. DOI: https://doi.org/10.1038/nature13484). Использование шаперона при производстве белка может обеспечить большую эффективность вакцинного препарата. Кроме того, LptD содержит дисульфидную связь, поэтому для его получения предпочтительно применение специальных экспрессионных штаммов, обеспечивающих дисульфидных связей формирование у рекомбинантных белков. Также белок содержит пептид, обладающий по данным биоинформатического анализа признаками токсичности. Замена одного кодона в гене белка, может обеспечить снижение его токсичности.
На данный момент не найдено публикаций о клонировании данного бруцеллезного белка и оценки его вакцинного потенциала.
Известен способ получения рекомбинантных антигенов для создания бруцеллезной вакцины на основе системы экспрессии Escherichia coli и оценки их вакцинного потенциала (Akbari R., Sekhavati M.H., Bahrami A., Majidzadeh Heravi R., Yousefi S. / Production of Brucella lumazine Synthase Recombinant Protein to Design a Subunit Vaccine against Undulant Fever. // Arch Razi Inst. -2019. -V.74(1). - P.1-6. DOI: 10.22092/ari.2019.117997. Abdollahi A., Mansouri S., Amani J., Fasihi-Ramandi M., Ranjbar R., et al. A Recombinant Chimera Protein as a Novel Brucella Subunit Vaccine: Protective Efficacy and Induced Immune Response in BALB/c Mice. // Jundishapur J Microbiol. -2018. - V.11(1). - Р.e12776. https://doi.org/10.5812/jjm.12776. Yousefi S., Abbassi-Daloii T., Sekhavati M.H., Tahmoorespur M. / Evaluation of immune responses induced by polymeric OMP25-BLS Brucella antigen. // Microb Pathog. – 2018. – V.115. - P.50-56. DOI: 10.1016/j.micpath.2017.12.045). Однако несмотря на многолетние исследования, до сих пор ни один из препаратов на основе рекомбинантных бруцеллезных белков не прошел клинические испытания.
Изобретение решает задачу создания способа получения рекомбинантного бруцеллезного белка rLptD. Поставленная задача решается путем создания способа получения рекомбинантного белка rLptD, включающего конструирование генов белков rLptD, 2310 п.о., и LptE, 567 п.н., без сигнальных последовательностей, включая замену кодона цистеина «tgc» на серин «tcg» в позиции 436 п.н. гена rLptD, рекомбинантной плазмиды pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag, 6835 п.н., несущей последовательности, кодирующие белки rLptD и LptE B.abortus, слитые с синтетическими последовательностями, кодирующими шесть гистидинов и S-тага, соответственно, трансформацию клеток E. coli Shuffle T7 экспрессионной плазмидной ДНК pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag, кодирующей 2 рекомбинантныx белка rLptD и LptE, культивирование полученного штамма E. coli Shuffle T7/ pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag при температуре 30 °С, и продукцию белка rLptD в E. coli в течение 24 часов при температуре 12 °С, получение цитоплазматической фракции бактерий-продуцентов обработкой клеток лизоцимом с последующим центрифугированием, очистку белка rLptD металл-хелатной хроматографией с получением гомогенного конечного препарата белка rLptD с выходом не менее 0,2 г белка rLptD с литра бактериальной культуры, обладающего 98% чистоты по данным электрофореза и денситометрии и содержащего бактериальный эндотоксин в количестве не более 5 IU/мг.
Техническим результатом изобретения является способ продукции и очистки из цитоплазмы бактерий гомогенного рекомбинантного белка rLptD с чистотой 98%, содержанием бактериального эндотоксина не более 5 IU/мг и выходом 0,2 г с литра бактериальной культуры, применимый для получения больших количеств данного белка, пригодного для использования в биотехнологии и фармакологии.
Технический результат изобретения достигается за счет получения последовательностей ДНК, определяющих синтез белков rLptD и LptE, при помощи ПЦР с геномной ДНК штамма B.abortus 544 с использованием специфических праймеров, кодирующих сайты расщепления эндонуклеазами рестрикции BamHI, SacI, NdeI, XhoI.
Технический результат изобретения достигается за счет получения последовательности ДНК, определяющих синтез белка rLptD без токсичного пептида, за счет замены 1 кодона при помощи СОЭ-ПЦР с использованием специфических праймеров.
Также технический результат изобретения достигается за счет конструирования векторной плазмиды pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag, содержащей промоторную последовательность ДНК бактериофага T7 и последовательности ДНК, кодирующие белки rLptD и LptE B. abortus, и синтетическую последовательность шести гистидинов для очистки белка металл-хелатной хроматографией.
Также технический результат изобретения достигается за счет получения штамма Shuffle T7/ pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag на основе штамма E.coli Shuffle T7, трансформированного плазмидной ДНК pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag, коэкспрессирующей белки rLptD и LptE.
Также технический результат изобретения достигается за счет продукции рекомбинантного белка rLptD в бактериях E. coli штамма Shuffle T7/ pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag в течение 24 часов при температуре 12 °C, что обеспечивает накопление рекомбинантного белка в цитоплазме бактерий преимущественно в растворенном состоянии.
Также технический результат изобретения достигается получением цитоплазматической фракции бактериальных белков за счет процедуры обработки бактерий лизоцимом, что приводит к разрушению клеточной стенки и разделению цитоплазмы и сферопластов бактерий.
Также технический результат изобретения достигается благодаря схеме очистки белка rLptD с помощью металл-хелатной хроматографии на колонке c иммобилизованным бивалентным металлом, позволяющей получить гомогенный белок, характеризующийся 98% чистотой по данным электрофореза и денситометрии и содержанием бактериального эндотоксина не более 5 IU/мг белка.
Отличием предлагаемого способа является высокий выход растворимого рекомбинантного белка rLptD (0,2 г с литра бактериальной культуры), достигаемый за счет особенностей конструирования продуцента Shuffle T7/ pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag и понижения температуры его культивации при синтезе белка rLptD.
В предлагаемом техническом решении белок rLptD синтезируется бактериями в растворимой форме c нативной дисульфидной связью и совместно с белком-шапероном LptE, что способствует корректному фолдингу белка и оказывается возможным благодаря направленному накоплению rLptD в цитоплазме бактерий E. coli.
Существенным достоинством предлагаемого способа получения рекомбинантного белка rLptD является низкий уровень содержания бактериального эндотоксина в конечном препарате (5 IU/мг белка), допустимый для применения в инъекциях как по российским, так и по международным стандартам (XII издание Государственной фармакопеи Российской Федерации; Международная фармакопея ВОЗ, документ QAS/11.452 FINAL, июль 2012 г.).
Изобретение иллюстрируют следующие графические материалы:
фиг. 1. Схема организации рекомбинантной плазмиды pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag, где: LptD, LptE – клонированные фрагменты, включающие гены белков rLptD и LptE; BamHI, SacI, NdeI, XhoI - уникальные сайты эндонуклеаз рестрикции; T7 – промотор, присутствующий в рекомбинантной плазмиде; lacI – репрессор лактозного оперона, Cmr-ген устойчивости к хлорамфениколу, 6xHis - полигистидиновый таг, включающий 6 гистидинов, S-tag - аффинная метка из панкреатической рибонуклеазы А;
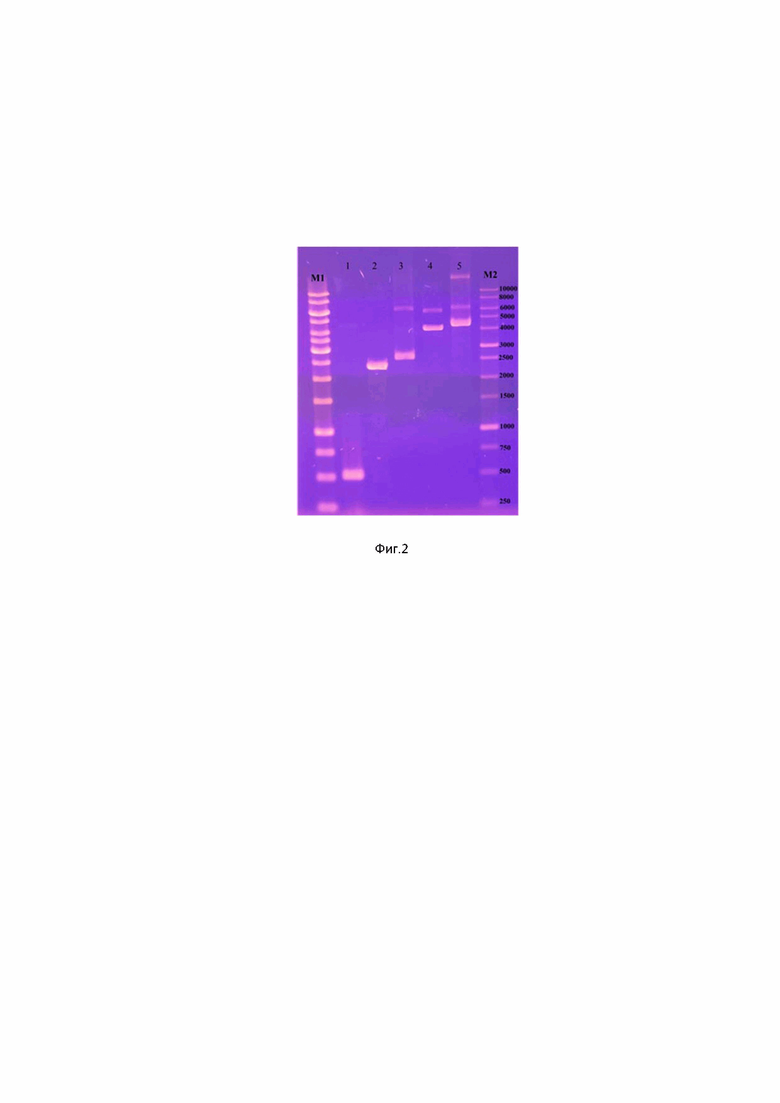
фиг. 2. Электрофоретический анализ фрагментов ДНК, используемых в работе, где маркер SM1163 - Thermo Scientific™ O'GeneRuler™ 1 kb DNA Ladder, 1 - плазмида pACYCDuet-1, 2 - pACYCDuet-1sdWP_002966739.1(437cg)-His, 3 - pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag, 4 - ген LptD, 5 - ген белка LptE (bab1_1814);
фиг. 3. Электрофоретический анализ экспрессии белка rLptD, где: маркер молекулярной массы белка PageRuler™ Plus Prestained Protein Ladder (указаны размеры белков маркера в кДа), 0 ч - образец из осадка клеток до индукции, 2-24 ч - образец осадка клеток через 24 часов индукции 1мМ ИПТГ при 12°С;
фиг. 4. Иммуноблот белков, где: SM1811 – маркер молекулярной массы белка PageRuler™ Plus Prestained Protein Ladder или Prestained Protein Marker II G2058, 1- экстракция белков через 4 часа индукции 1мМ ИПТГ c Mouse Anti-S-Tag-HRP (SBSTAGa) (Southernbiotech, США) и HRP Anti-6X His tag® antibody (ab1187) (Abcam, США), 2- c HRP Anti-6X His tag® antibody (ab1187) (Abcam, США).
Для лучшего понимания сущности изобретения ниже следуют подробные примеры его конкретного выполнения со ссылками на прилагаемые таблицы и фигуры.
Пример 1
Создание нуклеотидных последовательностей генов белков rLptD и LptE
С помощью BLAST (Basic Local Alignment Search Tool - базовый инструмент поиска местного выравнивания) (https://blast.ncbi.nlm.nih.gov/Blast.cgi) проводят анализ нуклеотидных последовательностей геномов 20 штаммов бруцелл, находящихся в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск», и выявляют идентичность нуклеотидных последовательностей генов белков LptD и LptE во всех штаммах. С помощью программы SignalP-6.0. (https://services.healthtech.dtu.dk/service.php?SignalP) устанавливают нуклеотидные последовательности лидерных пептидов в обоих генах белков. С помощью программы ToxinPred (https://webs.iiitd.edu.in/raghava/toxinpred/algo.php) определяют наличие токсичного пептида в составе нативного белка, устанавливают подходящий кодон для замены в составе нуклеотидной последовательности, кодирующей токсичный пептид. На основании вышеуказанных данных составляют нуклеотидные последовательности генов 2 белков без участков, кодирующих лидерный пептиды, с заменой определенного кодона в гене токсичного белка. Схема организации генов белка rLptD и LptE представлена в таблице 1, аминокислотные последовательности белков указаны в таблице 2.
Таблица 1
Схема организации генов белка rLptD и LptE
Условные обозначения: жирным выделены нуклеотиды «cg» – область замены, подчеркнуты нуклеотиды – область перекрытия 2 фрагментов гена rlptd при СОЭ-ПЦР, курсивом выделен участок полигистидинового тага и S-тага.
Пример 2
Конструирование плазмиды
Плазмиду pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag конструируют в результате следующих манипуляций:
амплификация гена lptd (Gene ID NCBI RefSeq: 3788468) без участка, кодирующего сигнальный пептид, 2310 п.о. обозначаемого в дальнейшем как rlptd, с заменой нуклеотидной последовательности в позиции 437 “gc” на “cg”, методом СOE-ПЦР с генома штамма Brucella аbortus 544 (ГКПМ-Оболенск, инв.№ 4464) с помощью праймеров:
амплификация гена белка LptE (bab1_1814, Gene ID NCBI RefSeq: 45125089) с помощью метода ПЦР, 567 п.о., соответственно, с двумя вариантами обратного праймера:
Рестрикции гена rlptd и плазмиды pACYCDuet-1 проводят эндонуклеазами BamHI и SacI, затем выполняют их лигирование. Проводят химическую транформацию штамма E. coli DH5α полученным лигатом. Рестрицированный ген белка LptE, эндонуклеазами NdeI и XhoI, лигируют в плазмиду pACYCDuet-1sdWP_002966739.1(437cg)-His. Полученной плазмидой pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag трансформируют химическим методом штамм E. coli DH5α, используемый для хранения и наращивания плазмид. Селекцию клеток, содержащих указанные плазмиды, проводят на среде LB с 34 мкг/мл хлорамфеникола. Контроль вставки целевой ДНК в плазмиде осуществляют с помощью ПЦР со специфическими праймерами, а также секвенированием по Сэнгеру рекомбинантной плазмиды со стандартными и специфическими праймерами. Схема организации плазмиды представлена на фиг. 1. Электрофоретический анализ генов и плазмид представлен на фиг. 2.
Пример 3
Секвенирование генов, аминокислотный состав белков
Для определения нуклеотидной последовательности генов белков rLptD и LptE, используют прямой метод секвенирования без предварительного клонирования геномных фрагментов ДНК. Определяют нуклеотидную последовательность гена rlptd. Секвенирование проводят на приборе ABI Applied Biosistems c использованием олигонуклеотидов, комплементарных последовательности нуклеотидов генов f1lptd (Forward primer), r2lptd (Reverse primer), а также flpte (Forward primer), rlpteS (Reverse primer). На основании полученного сиквенса определяют аминокислотную последовательность белка rLptD с помощью компьютерной программы Translate (https://www.bioinformatics.org/sms2/translate.html). Аминокислотный состав белков представлен в таблице 2.
Таблица 2
Аминокислотные последовательности белков
Пример 4
Получение штамма-продуцента белка rLptD
Штамм-продуцент полипептида rLptD конструируют на основе протеазо-дефицитного штамма E. coli Shuffle T7 [F´ lac, pro, lacIq / Δ(ara-leu)7697 araD139 fhuA2 lacZ::T7 gene1 Δ(phoA)PvuII phoR ahpC* galE (or U) galK λatt::pNEB3-r1-cDsbC (SpecR, lacIq) ΔtrxB rpsL150(StrR) Δgor Δ(malF)3], обладающего способностью правильного сворачивания в цитоплазме белков, имеющих в структуре несколько дисульфидных связей, за счет экспрессии оксидазы DsbC, также несущего ген Т7 РНК полимеразы под контролем изопропил-β-D-тиогалактопиранозид (ИПТГ) индуцибельного lacUV5 промотора (NEB, Великобритания). Штамм получают в результате следующих манипуляций:
амплификации 2 фрагментов гена rlptd методом ПЦР,
создание гена rlptd с помощью метода СОЭ-ПЦР,
клонирования гена rlptd в векторе pACYCDuet-1,
амплификации гена bab1_1814 методом ПЦР,
клонирования гена bab1_1814 в векторе pACYCDuet-1sdWP_002966739.1(437cg)-His,
трансформации клеток реципиентного штамма.
В качестве матрицы в ПЦР используют ДНК штамма B. аbortus 544 (ГКПМ-Оболенск, инв.№ 4464).
Клетки E. coli Shuffle T7 трансформируют рекомбинантной плазмидой pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag и отбирают клоны с фенотипом CmR на селективной среде с хлорамфениколом (34 мкг/мл). Штамм получил название E. coli Shuffle T7/ pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag (депонирован в ГКПМ-Оболенск с инв. № B-10623, свидетельство №107 от 6.03.2023)
Пример 5
Выделение и очистка белка rLptD
Культуру E. coli выращивают при температуре 30°C в жидкой или на агаризованной среде Luria-Bertani (LB) c 34 мкг/мл хлорамфеникола. Для выделения белка rLptD клетки E. coli Shuffle T7/ pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag выращивают при температуре 12°C в жидкой среде LB с антибиотиком и 1мМ ИПТГ в лабораторном ферментере New Brunsuik Scientific с рабочим объемом 1 л в течение 24 ч. Клеточную суспензию центрифугируют 2800g 15 мин, клетки ресуспендируют в буфере нанесения (50 мМ Трис-НСl, рН=8,0, 500 мМ NaCl, 10 мМ имидазол), вносят ФМСФ до 1 мМ, обрабатывали ДНКазой I (10000 ед./мл), лизоцимом (20 мг/мл) и озвучивают на дезинтеграторе UDM-10 («Techpan», Польша) при 44 кГц, 1,8 кВт, 10 раз по 30 с, при температуре 0 °С. Лизат клеток центрифугируют 37000 g 15 мин. Наличие белка в лизате культуры клеток подтверждали ДСН - электрофорезом в 12% ПААГ, а присутствие полигистидинового тага – в иммуноблоте. Электрофоретический анализ экспрессии и иммуноблот белка rLptD представлены на фиг. 3, 4. Супернатант после центрифугирования лизата клеток наносят на колонку с 5 мл иминодиуксусной сефарозы (Iminodiacetic acid Sepharose, Sigma-Aldridge, Германия), предварительно насыщенной ионами никеля и уравновешенной буфером нанесения. Колонку промывают 10 объемами буфера нанесения, 3 объемами буфера с 60 мМ имидазола (50 мМ Трис-НСl, рН=8,0, 500 мМ NaCl, 60 мМ имидазол), затем элюируют белок элюирующим буфером (50 мМ Трис-НСl, рН=8,0, 250 мМ имидазол, 500мМ NaCl). Белки диализуют против фосфатного буфера (137 мМ NaCl, 2,7 мМ KCl, 8 мМ Na2HPO4, 1,4 мМ KH2PO4, рН=7,4) с добавлением ФМСФ до 1мМ в течение 16 часов при комнатной температуре. Препарат белка хранят в аликвотах при температуре минус 70 °С.
Пример 6
Валидация препарата рекомбинантного белка rLptD
Измерение концентрации белка в полученном препарате проводят по методу Брэдфорд с использованием набора Quick Start™ Bradford Protein Assay (Bio-Rad, США). Выход рекомбинантного белка rLptD составляет 0,2 г с литра бактериальной культуры. Чистоту полученного белкового препарата анализируют электрофорезом в 10% денатурирующем ПААГ. После прохождения электрофореза гель окрашивают кумасси R-250 по стандартной методике и сканируют с помощью денситометра Typhoon FLA9500 (GE Healthcare, США). Чистота полученного препарата rLptD по данным денситометрии составляет 98%. Гомогенность препарата белка rLptD тестируют при помощи хроматографии высокого давления HPLC-SEC. HPLC-SEC проводят с использованием колонки Waters BioSuite High Resolution. 100 мкг белка наносят на колонку в буфере, содержащем 100 мМ фосфата натрия, рН 6.5. Единственный пик на хроматограмме свидетельствует о гомогенности препарата белка rLptD и отсутствии контаминаций. Содержание эндотоксина в конечном препарате белка rLptD определяют при помощи ЛАЛ-теста (Charles River Endosafe, США), оно составляет менее 5 IU/мг.
Таким образом, сконструирована генетическая конструкция, которая обеспечивает коэкспрессию белков rLptD и его шаперона LptE в экспрессионной системе E. coli. Проведены генетические манипуляции с геном целевого белка rLptD, обеспечивающие снижение его токсичности. Получен штамм-продуцент белка rLptD, обеспечивающий высокий выход белка в растворимой форме. Для получения белка использован штамм Shuffle T7, который за счет экспрессии изомеразы DsbC, участвующей в формировании дисульфидных связей, способствует правильному сворачиванию белка, что может обеспечить функциональную активность белка.
Проверка предложенного способа на соответствие его критерию "изобретательский уровень" показала, что ни в научной, ни в патентной литературе не выявлено совокупности признаков, указанной в формуле изобретения.



Изобретение относится к области биотехнологии. Описан способ получения рекомбинантного бруцеллезного белка rLptD. Способ включает конструирование гена белка rLptD с заменой нуклеотидов «gc» на «cg» в положении 437 п.н., создание рекомбинантной плазмиды, трансформацию клеток E. coli Shuffle T7 экспрессионной плазмидной ДНК, культивирование полученного штамма, получение цитоплазматической фракции бактерий-продуцентов обработкой клеток лизоцимом с последующим центрифугированием. Следом идёт очистка белка rLptD металл-хелатной хроматографией с получением гомогенного конечного препарата белка rLptD с выходом не менее 0,2 г белка с литра бактериальной культуры, обладающего 98% чистоты по данным электрофореза и денситометрии и содержащего бактериальный эндотоксин в количестве не более 5 IU/мг. Технический результат заключается в создании способа продукции и очистки из цитоплазмы бактерий гомогенного рекомбинантного белка rLptD с чистотой 98%, содержанием бактериального эндотоксина не более 5 IU/мг и выходом 0,2 г с литра бактериальной культуры, применимого для получения больших количеств данного белка, пригодного для использования в биотехнологии и фармакологии. 4 ил., 2 табл., 6 пр.
Способ получения рекомбинантного бруцеллезного белка rLptD, включающий конструирование гена белка rLptD с заменой нуклеотидов «gc» на «cg» в положении 437 п.н., создание рекомбинантной плазмиды pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag длиной 6835 п.н., несущей последовательности, кодирующие белки Brucella аbortus, rLptD и белок-шаперон LptE, слитые с синтетическими последовательностями, кодирующими шесть гистидинов и S-таг, соответственно, трансформацию клеток E. coli Shuffle T7 экспрессионной плазмидной ДНК pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag, кодирующей 2 рекомбинантных белка, rLptD и LptE, культивирование полученного штамма E. coli Shuffle T7/ pACYCDuet-1sdWP_002966739.1(437cg)-His-sdWP_002964883.1-S-tag при температуре 30 °С и продукцию белка rLptD в Escherichia coli при температуре 12 °С в течение 24 часов, получение цитоплазматической фракции бактерий-продуцентов, обработкой клеток лизоцимом с последующим центрифугированием, очистку белка rLptD металл-хелатной хроматографией с получением гомогенного конечного препарата белка rLptD с выходом не менее 0,2 г белка с литра бактериальной культуры, обладающего 98% чистоты по данным электрофореза и денситометрии и содержащего бактериальный эндотоксин в количестве не более 5 IU/мг.
| CN 104231061 A, 24.12.2014 | |||
| US 20110033492 A1, 10.02.2011 | |||
| МОЛЕКУЛЯРНАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ БРУЦЕЛЛЕЗА | 2003 |
|
RU2285538C2 |
| Дятлова В.И | |||
| Применение методов обратной вакцинологии для разработки новых вакцин против бруцеллеза | |||
| В.И | |||
| Дятлова | |||
| Бактериология | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| - Т | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| - С | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2024-03-11—Публикация
2023-06-16—Подача