Родственные заявки
[0001] По настоящей заявке испрашивается приоритет Предварительной заявки США No. 62/535354, поданной 21 июля 2017 г., полное содержание которой приведено в настоящем описании в качестве ссылки.
Область техники, к которой относится изобретение
[0002] Изобретение относится к получению мультиспецифических смесей антител, включающих подгруппу антител, выделенную из смеси двух или более моноспецифических антител и одного или нескольких биспецифических антител, где все антитела в подгруппе имеют одну и ту же общую тяжелую цепь. Изобретение также относится к способам выделения, очистки или получения иным образом такой подгруппы антител с использованием по меньшей мере одной стадии аффинной хроматографии. Изобретение также относится к способам применения такой подгруппы антител при множестве терапевтических показаний.
Уровень техники для изобретения
[0003] В течение последних двух десятилетий, моноклональные антитела (mAb) стали важным терапевтическим средством, обеспечивая значительные преимущества для пациентов при различных показаниях. Успех mAb частично обусловлен их высокой специфичностью для антигена-мишени и низкой свойственной им токсичностью. Эти свойства сильно ограничивают неспецифические побочные эффекты по сравнению с другими классами лекарственных средств. Подавляющее большинство одобренных терапевтических mAb представляют собой немодифицированные антитела изотипа IgG.
[0004] Однако, нацеливание на один белок, обеспечиваемое стандартными mAb, может не всегда являться достаточным для достижения значительного терапевтического эффекта (Fischer Expert Opin. Drug Discov. 2008 3(8):833-839).
[0005] Очевидным вариантом для увеличения эффективности является использование двух mAb в комбинации. Этот способ является клинически осуществимым, например, для антител, нацеленных на молекулы иммунных контрольных точек, таких как антитела против CTLA4 и против PD-1 (Larkin et al., N Engl J Med 2015; 373:23-34; Harris et al., Cancer Biol Med. 2016 13(2):171-93). Однако, значительные затраты и трудности разработки ассоциированы с разработкой комбинаций mAb. В частности, необходимо реализовать два отдельных производственных процесса, что приводит к значительному увеличению затрат (Rasmussen et al., Archives of Biochemistry and Biophysics 2012 526:39-145). Эти проблемы становятся даже более важными, если предусматривают нацеливание на три или более белков или антигенов.
[0006] Несколько способов для нацеливания на множество белков или антигенов использовали до настоящего времени. Использование двух mAb в комбинации является клинически осуществимым, но часто осложняется значительными затратами и трудностями разработки. Биспецифические антитела (BiAb) представляют собой быстро развивающуюся альтернативу для достижения мультиспецифического нацеливания, и более 60 форматов описано до настоящего времени (Spiess et al., Mol Immunol. 2015 67:95-106; Brinkmann and Kontermann mAbs 2017 9:182-212), и другим способом достижения нацеливания на два или даже больше белков является получение смесей антител или рекомбинантных поликлональных смесей. Однако, только немногие из этих мультиспецифических форматов одобрены для терапевтического использования.
[0007] Соответственно, существует необходимость в получении мультиспецифических смесей антител, способных к нацеливанию на множество белков, эпитопов и/или антигенов - мишеней.
Сущность изобретения
[0008] Настоящее изобретение относится к смесям антител, включающим подгруппу антител, выделенную из смеси двух или более моноспецифических антител и одного или нескольких биспецифических антител, где все антитела в подгруппе имеют одну и ту же общую тяжелую цепь. Эти смеси получают при совместной экспрессии множества легких цепей с общей тяжелой цепью в одной клетке. В некоторых вариантах осуществления, очищенные подгруппы включают только антитела, содержащие по меньшей мере легкую цепь каппа. В некоторых вариантах осуществления, очищенные подгруппы включают только антитела, содержащие по меньшей мере легкую цепь лямбда. В некоторых вариантах осуществления, очищенные подгруппы включают только антитела, содержащие легкую цепь каппа и легкую цепь лямбда.
[0009] Настоящее изобретение относится также к способам выделения, очистки или получения иным образом подгруппы антител, выделенной из смеси двух или более моноспецифических антител и одного или нескольких биспецифических антител, где все антитела в подгруппе имеют одну и ту же общую тяжелую цепь, с использованием по меньшей мере одной стадии аффинной хроматографии. В некоторых вариантах осуществления, стадию очистки проводят с использованием специфических для константного домена или вариабельного домена каппа сред для аффинной хроматографии. В некоторых вариантах осуществления, стадию очистки проводят с использованием специфических для константного домена или вариабельного домена лямбда сред для аффинной хроматографии. В некоторых вариантах осуществления, стадию очистки проводят с использованием двухстадийного способа аффинной хроматографии. В некоторых вариантах осуществления, первую стадию очистки проводят с использованием специфических для константного домена или вариабельного домена каппа сред для аффинной хроматографии, и вторую стадию очистки - с использованием специфических для константного домена лямбда сред для аффинной хроматографии. В некоторых вариантах осуществления, первую стадию очистки проводят с использованием специфических для константного домена лямбда сред для аффинной хроматографии и вторую стадию очистки - с использованием специфических для константного домена или вариабельного домена каппа сред для аффинной хроматографии.
[0010] Настоящее изобретение относится к мультиспецифическим смесям антител и к способам, которые можно использовать при любом из множества терапевтических, диагностических и/или профилактических показаний. Например, мультиспецифические смеси антител можно использовать для лечения, предотвращения и/или замедления прогрессирования, или облегчения симптома злокачественной опухоли, или другого неопластического состояния посредством введения смеси антител субъекту, для которого такое лечение или предотвращение является желательным. В некоторых вариантах осуществления, мультиспецифические смеси антител, описанные в настоящем описании, можно использовать для лечения гематологических злокачественных новообразований и/или солидных опухолей. Например, мультиспецифические смеси антител, описанные в настоящем описании, можно использовать для лечения CD47+ опухолей, мезотелин+ опухолей и их комбинаций. В качестве неограничивающего примера, мультиспецифические смеси антител, описанные в настоящем описании, можно использовать для лечения неходжскинской лимфомы (NHL), острого лимфоцитарного лейкоза (ALL), острого миелоидного лейкоза (AML), хронического лимфоцитарного лейкоза (CLL), хронического миелогенного лейкоза (CML), множественной миеломы (MM), рака молочной железы, рака яичника, рака головы и шеи, рака мочевого пузыря, меланомы, мезотелиомы, колоректального рака, холангиокарциномы, рака поджелудочной железы, включая аденокарциному поджелудочной железы, рака легкого, включая аденокарциному легкого, лейомиомы, лейомиосаркомы, рака почки, глиомы, глиобластомы, рака эндометрия, рака пищевода, рака желчных протоков и желудка, и рака предстательной железы. Солидные опухоли включают, например, опухоли молочной железы, опухоли яичника, опухоли легкого, опухоли поджелудочной железы, опухоли предстательной железы, опухоли меланомы, колоректальные опухоли, опухоли легкого, опухоли головы и шеи, опухоли мочевого пузыря, опухоли пищевода, опухоли печени и опухоли почки.
[0011] В некоторых вариантах осуществления, мультиспецифические смеси антител можно использовать для лечения, предотвращения и/или замедления прогрессирования, или облегчения симптома аутоиммунного заболевания, и/или воспалительного нарушения посредством введения смеси антител субъекту, для которого такое лечение или предотвращение является желательным. Аутоиммунные заболевания включают, например, синдром приобретенного иммунодефицита (СПИД, представляющий собой вирусное заболевание с аутоиммунным компонентом), очаговую алопецию, анкилозирующий спондилит, антифосфолипидный синдром, аутоиммунную болезнь Аддисона, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунное заболевание внутреннего уха (AIED), аутоиммунный лимфопролиферативный синдром (ALPS), аутоиммунную тромбоцитопеническую пурпуру (ATP), болезнь Бехчета, кардиомиопатию, брюшные афты-герпетиформный дерматит; синдром хронической усталости и иммунной дисфункции (CFIDS), хроническую воспалительную демиелинизирующую полиневропатию (CIPD), рубцовый пемфигоид, холодовую агглютининовую болезнь, синдром crest, болезнь Крона, болезнь Дегоса, ювенильный дерматомиозит, дискоидную волчанку, первичную криоглобулинемию смешанного типа, фибромиалгию-фибромиозит, болезнь Грэйвса, синдром Гийена-Барре, тиреоидит Хашимото, идиопатический пульмонарный фиброз, идиопатическую тромбоцитопеническую пурпуру (ITP), IgA-нефропатию, инсулин-зависимый сахарный диабет, ювенильный хронический артрит (болезнь Стилла), ювенильный ревматоидный артрит, болезнь Меньера, смешанное заболевание соединительной ткани, рассеянный склероз, миастению, пернициозную анемию, узелковый полиартериит, полихондрит, полигландулярные синдромы, ревматическую полимиалгию, полимиозит и дерматомиозит, первичную агаммаглобулинемию, первичный биллиарный цирроз, псориаз, псориатический артрит, феномен Рейно, синдром Рейтера, ревматический приступ, ревматоидный артрит, саркоидоз, склеродермию (прогрессирующую системную склеродермию (PSS), также известную как системная склеродермия (SS)), синдром Шегрена, синдром мышечной скованности, системную красную волчанку, артериит Такаясу, височный артериит/гигантоклеточный артериит, язвенный колит, увеит, витилиго и гранулематоз Вегенера.
[0012] Воспалительные нарушения включают, например, хронические и острые воспалительные нарушения. Примеры воспалительных нарушений включают болезнь Альцгеймера, астму, хроническое обструктивное заболевание легких, атопическую аллергию, аллергию, атеросклероз, бронхиальную астму, экзему, гломерулонефрит, реакцию трансплантат против хозяина, гемолитические анемии, остеоартрит, сепсис, инсульт, трансплантацию тканей и органов, васкулит, диабетическую ретинопатию и индуцированное искусственной вентиляцией повреждение легких.
[0013] В некоторых вариантах осуществления, мультиспецифические смеси антител можно использовать для перенацеливания T-клеток.
[0014] Фармацевтические композиции по изобретению могут включать мультиспецифическую смесь антител по изобретению и носитель. Эти фармацевтические композиции можно включать в наборы, например, такие как терапевтические наборы и/или диагностические наборы.
Краткое описание чертежей
[0015] Фигуры 1A, 1B и 1C представляют собой серии схематических представлений различных способов получения смесей рекомбинантных антител. На фигуре 1A изображены способы смешивания моноклональных антител (mAb), которые были экспрессированы и очищены независимо, для получения смеси mAb. На фигуре 1B изображены способы смешивания линий клеток, также обозначенных как поликлональный банк клеток, для получения смеси только mAb в одном реакторе для ферментации. На фигуре 1C изображены способы совместной экспрессии множества цепей антител в одной линии клеток для получения смеси mAb и биспецифических антител (BiAb).
[0016] Фигуры 2A, 2B, и 2C представляют собой серии схематических представлений способов совместной экспрессии множества легких цепей вместе с одной, общей тяжелой цепью и полученных в результате смесей антител. На фигуре 2A изображено, каким образом совместная экспрессия двух легких цепей антител вместе с одной тяжелой цепью приводит в результате к секреции трех различных антител: двух mAb, каждое из которых включает одинаковые легкие цепи в каждом Fab, и одного BiAb, включающего отличную легкую цепь в каждом Fab. На фигуре 2B изображено, каким образом совместная экспрессия трех легких цепей антител вместе с одной тяжелой цепью приводит в результате к секреции шести различных антител: трех mAb, каждое из которых включает одинаковые легкие цепи в каждом Fab, и трех BiAb, включающих отличную легкую цепь в каждом Fab. На фигуре 2C изображено, каким образом совместная экспрессия четырех легких цепей антител с одной тяжелой цепью приводит в результате к секреции десяти различных антител: четырех mAb, каждое из которых включает одинаковые легкие цепи в каждом Fab, и шести BiAb, включающих отличную легкую цепь в каждом Fab.
[0017] Фигура 3 представляет собой схематическое представление способов совместной экспрессии двух легких цепей лямбда, одной легкой цепи каппа, и одной общей тяжелой цепи в одной клетке, что приводит к секреции смеси двух mAb IgGλλ, одного mAb IgGκκ, двух BiAb IgGκλ и одного BiAb IgGλλ (смеси 1). Из смеси 1, различные подсмеси можно выделять с использованием различных стадий аффинной хроматографии, как указано.
[0018] Фигура 4 представляет собой схематическое представление способов совместной экспрессии двух легких цепей лямбда, двух легких цепей каппа и одной общей тяжелой цепи в одной клетке, что приводит к секреции двух mAb IgGλλ, двух mAb IgGκκ, четырех BiAb IgGκλ, одного BiAb IgGλλ и одного BiAb IgGκκ (смеси 1). Из смеси 1, различные подсмеси можно выделять с использованием различных стадий аффинной хроматографии, как указано.
[0019] Фигура 5 представляет собой схематическое представление способов совместной экспрессии трех легких цепей лямбда, одной легкой цепи каппа и одной общей тяжелой цепи в одной клетке, что приводит к секреции смеси трех mAb IgGλλ, одного mAb IgGκκ, трех BiAb IgGκλ, трех BiAb IgGλλ и одного IgGκκ BiAb (смеси 1). Из смеси 1, различные подсмеси можно выделять с использованием различных стадий аффинной хроматографии, как указано.
[0020] Фигура 6 представляет собой общее схематическое представление способов по настоящему описанию.
[0021] Фигура 7A представляет собой схематическое представление двух биспецифических антител, нацеленных на CD47 и два эпитопа опухолеассоциированного антигена (TAA).
[0022] Фигура 7B представляет собой схематическое представление способа очистки подгруппы, содержащей два BiAb (CD47 x TAA, эпитоп 1, и CD47 x TAA, эпитоп 2), посредством двухстадийной аффинной хроматографии с использованием специфических для каппа аффинных сред, за которыми следуют специфические для лямбда аффинные среды, или наоборот.
[0023] Фигура 8A представляет собой схематическое представление первого биспецифического антитела, нацеленного на CD47 и первый опухолеассоциированный антиген (TAA 1), и второго биспецифического антитела, нацеленного на CD47 и второй опухолеассоциированный антиген (TAA 2).
[0024] Фигура 8B представляет собой схематическое представление способа очистки подгруппы, содержащей два BiAb (CD47 x TAA 1 и CD47 x TAA 2), посредством двухстадийной аффинной хроматографии с использованием специфических для каппа аффинных сред, за которыми следуют специфические для лямбда аффинные среды, или наоборот.
[0025] Фигура 9A представляет собой схематическое представление биспецифических антител, нацеленных на множество опухолеассоциированных антигенов (TAA 1, TAA 2 и т.д.) и/или на множество эпитопов на TAA.
[0026] Фигура 9B представляет собой схематическое представление способа очистки подгруппы, содержащей 4 различных BiAb (CD47 x TAA 1; CD47 x TAA 2; PD-L1 x TAA 1; PD-L1 x TAA 2), посредством двухстадийной аффинной хроматографии с использованием специфических для каппа аффинных сред, за которыми следуют специфические для лямбда аффинные среды, или наоборот.
[0027] Фигура 10A представляет собой схематическое представление биспецифических антител для перенацеливания T-клеток на множество опухолеассоциированных антигенов (TAA 1, TAA 2 и т.д.) и/или на множество эпитопов на TAA.
[0028] Фигура 10B представляет собой схематическое представление способа очистки подгруппы, содержащей 2 различных BiAb (CD3 x TAA 1; CD3 x TAA 2), посредством двухстадийной аффинной хроматографии с использованием специфических для каппа аффинных сред, за которыми следуют специфические для лямбда аффинные среды, или наоборот.
[0029] Фигура 11A представляет собой схематическое представление смеси mAb, нацеленного на первый TAA, в комбинации с BiAb, нацеленным на первый и второй TAA, для которого следует избегать двухвалентного нацеливания.
[0030] Фигура 11B представляет собой схематическое представление способа очистки подгруппы, содержащей BiAb (TAA 1 x TAA 2) и mAb против TAA1 посредством двухстадийной аффинной хроматографии с использованием специфических для каппа аффинных сред, за которыми следуют специфические для лямбда аффинные среды, или наоборот.
[0031] На фигуре 12A, 12B и 12C изображена серия графиков, изображающих уровень антителозависимого клеточного фагоцитоза (ADCP), показанный как показатель фагоцитоза, наблюдаемый в линии клеток аденокарциномы поджелудочной железы HPAC в присутствии увеличивающихся концентраций различных биспецифических антител и/или моноклональных антител, так же как комбинаций биспецифических антител.
[0032] На фигуре 13A, 13B и 13C изображена серия графиков, изображающих уровень ADCP, показанный как показатель фагоцитоза, наблюдаемый в линии клеток аденокарциномы яичника в присутствии увеличивающихся концентраций различных биспецифических антител и/или моноклональных антител, так же как комбинаций биспецифических антител.
[0033] На фигурах 14A, 14B и 14C изображена серия графиков, изображающих уровень ADCP, показанный как показатель фагоцитоза, наблюдаемый в линии клеток карциномы желудка NCI-N87 в присутствии увеличивающихся концентраций различных биспецифических антител и/или моноклональных антител, так же как комбинаций биспецифических антител.
[0034] Фигура 15 представляет собой график, изображающий уровень ADCP, показанный как показатель фагоцитоза, наблюдаемый в линии клеток карциномы желудка NCI-N87 в присутствии увеличивающихся концентраций различных биспецифических антител, так же как комбинаций с использованием различных соотношений биспецифических антител.
[0035] Фигура 16A представляет собой изображение геля после изоэлектрического фокусирования, в котором образец смеси IgG, получен посредством совместной экспрессии одной тяжелой цепи и трех различных легких цепей, и очистки из супернатанта посредством хроматографии с белком A (дорожка 1). Подсмесь K2O25O30, состоящая из двух биспецифических антител, загружена на дорожку 2.
[0036] Фигура 16B представляет собой хроматограмму, полученную после хроматографии гидрофобного взаимодействия подсмеси K2O25O30. Время элюции и характеристики пиков указаны во вложенной таблице.
[0037] Фигура 17 представляет собой график, изображающий уровень ADCP, показанный как показатель фагоцитоза, наблюдаемый в линии клеток карциномы желудка NCI-N87 в присутствии увеличивающихся концентраций подсмеси K2O25O30 и эквимолярной комбинации K2O25 и K2O30.
[0038] На фигуре 18A показана противоопухолевая активность 2 антител κλ CD47xMSLN (K2O38 и K2O41) и их комбинации (K2O38+K2O41) в модели рака печени на мышах на основе трансфицированных MSLN HepG2. На фигуре 18B показаны площади под кривыми и статистический анализ. Фигура 18C представляет собой график, показывающий ингибирование роста опухоли, наблюдаемое в различных группах обработки.
Подробное описание
[0039] Мультиспецифические смеси антител и способы, представленные в настоящем описании, преодолевают ограничения, наблюдаемые для других форматов антител и/или смесей антител. В настоящее время, большинство одобренных форматов моноклональных антител представляют собой немодифицированные антитела изотипа IgG1. Однако, нацеливание на один антиген не всегда является достаточным для достижения желательных терапевтических эффектов (Fischer Expert Opin. Drug Discov. 2008 3(8):833-839). Два mAb в комбинации использовали для увеличения эффективности. Этот способ является клинически осуществимым, например, для антител, нацеленных на молекулы иммунных контрольных точек, таких как антитела против CTLA4 и против PD-1 (Larkin et al., N Engl J Med 2015; 373:23-34; Harris et al., Cancer Biol Med. 2016 13(2):171-93). Однако, значительные затраты и трудности разработки ассоциированы с разработкой комбинаций mAb. В частности, необходимо реализовать два отдельных производственных процесса, что приводит к значительному увеличению затрат (Rasmussen et al., Archives of Biochemistry and Biophysics 2012 526:39-145). Эти проблемы становятся даже более важными, если предусматривают нацеливание на три или более белков или антигенов.
[0040] Биспецифические антитела (BiAb) разработаны в качестве альтернативных средств для достижения мультиспецифического нацеливания, и более 60 форматов описано до настоящего времени (Spiess et al., Mol Immunol. 2015 67:95-106; Brinkmann and Kontermann mAbs 2017 9:182-212). Поскольку два участка связывания включены в одну и ту же молекулу, уникальные механизмы действия, не поддерживаемые mAb или комбинациями mAb, становятся возможными с использованием BiAb (Fischer and Léger Pathobiology. 2007 74(1):3-14). Примерами таких уникальных механизмов действия являются перенацеливание T-клеток или клеток NK на клетки опухолей, доставка BiAb в центральную нервную систему посредством увеличенного транспорта через гематоэнцефалический барьер, активность миметика фактора свертывания VIII, избирательное нацеливание на рецепторы, экспрессированные на множестве типов клеток.
[0041] Другим способом обеспечения нацеливания на два или даже большее количество белков является получение смесей антител или рекомбинантных поликлональных смесей. В отличие от комбинации двух mAb, описанной выше, в которой каждое mAb продуцировано отдельно, антитела в смеси продуцируют вместе в форме смеси. Описаны различные способы получения смесей (см., например, Raju and Strohl Expert Opin. Biol. Ther. 2013 13(10):1347-1352; Wang et al., 2013 Current Opinion in Chemical Engineering 2013 2:1-11). Основной проблемой для продукции рекомбинантной поликлональной смеси является достижение однородности между партиями, так чтобы каждый компонент смесей оставался постоянным, и таким образом, общий состав и биологическая активность смеси оставались постоянными.
[0042] В одном способе, различные стабильные линии клеток, каждая из которых экспрессирует одно моноклональное антитело, смешивают для получения поликлонального банка клеток, который используют для продукции в одном биореакторе. В этом случае, различные антитела секретируются различными линиями клеток в среду, и все антитела очищают вместе для получения конечной рекомбинантной смеси антител (Rasmussen et al., Archives of Biochemistry and Biophysics 2012 526:39-145). В этом случае, воспроизводимые характеристики роста и производительности индивидуальных линий клеток в ходе ферментации необходимо необычайно хорошо контролировать для обеспечения однородности между партиями рекомбинантной поликлональной смеси. Более быстрый рост или увеличенная производительность одной линии клеток оказывает непосредственное влияние на состав смеси. Достижение такого уровня контроля не является простым и представляет собой значительное препятствие для этого способа. Тем не менее, очень сложные смеси из вплоть до 25 независимых антител разработаны с использованием поликлональных линий клеток и оценены в клинических исследованиях (Hjelmström et al., Blood 2008 112:1987).
[0043] Другим способом является совместная экспрессия множества тяжелых и/или легких цепей антител в одной клетке. В этом случае, различные тяжелые и легкие цепи могут образовывать пары и, таким образом, можно получать смесь. Сложность полученной смеси зависит от количества различных цепей, которые экспрессируют совместно. В этом способе, обеспечение того, чтобы различные возможные варианты образования пар воспроизводили функциональный антигенсвязывающий участок, является критическим, чтобы избегать продукции нефункциональных молекул. Эту проблему образования пар можно преодолевать посредством использования общей тяжелой или общей легкой цепи, или посредством конструирования поверхностей контакта белков для предпочтительного образования желательных пар (См., например, Fischer et al., Nat. Comms 20156:6113 doi: 10.1038/ncomms7113). В отличие от предшествующего способа, основанного на смешивании независимых линий клеток, этот способ приводит к образованию как mAb, так и BiAb. Значительным преимуществом является то, что после идентификации линии клеток, экспрессирующей различные цепи антител стабильным образом, ферментация и продукция упрощается, поскольку является сходным со стандартным способом mAb. Однако, если допустимы все варианты образования пар, сложность компонентов смеси (mAb и BiAb) может являться довольно значительной и таким образом, антитела на основе общей тяжелой или легкой цепи, являются предпочтительными.
[0044] Различные способы получения смесей рекомбинантных антител, их преимущества и ограничения перечислены в таблице 1 и проиллюстрированы на фигурах 1A-1C.
Таблица 1. Смеси рекомбинантных антител
[0045] Несколько смесей разработаны с использованием некоторых из способов, описанных выше, и достигли клинической стадии, что показывает, что этот вариант терапии представляет практический интерес. Смеси обеспечивают уникальные механизмы действия, которые невозможно обеспечить с использованием отдельного антитела.
[0046] Например, нацеливание на рецепторы семейства HER/ErbB активно исследовали с использованием смесей антител. Это семейства рецепторов тирозинкиназ включает рецепторы факторов роста EGFR/ErbB1, HER-2/ErbB2, HER-3/ErbB3 и HER-4/ErbB4. Несколько моноклональных антител, нацеленных на EGFR и HER2, одобрены для использования в клинике. Опубликованы исследования, что смечи антител, нацеленные на множество эпитопов, и таким образом, способные одновременно привлекать эти мишени, приводят к увеличенному ингибированию роста клеток злокачественных опухолей в экспериментах in vitro и in vivo. Это привело к разработке нескольких смесей антител, нацеленных против членов семейства HER/ErbB. Одним примером является Sym004, смесь двух mAb против EGFR, для которой показана значительно превосходящая активность в доклинических моделях, по сравнению с одобренным антителом против EGFR mAb цетуксимабом (Koefoed et al., mAbs 2011 3:6, 584-595). MM-151 представляет собой другую смесь, состоящую из трех mAb человека, нацеленных на отдельные, не перекрывающиеся эпитопы на EGFR (Arena et al., Science Translational Medicine 2016 8(324), 324ra14). Эта смесь обеспечивает более эффективное блокирование рецептора и ограничивает возникновение устойчивости, по сравнению с монотерапией mAb. Более сложная смесь, Sym013, состоящая из 6 mAb, нацеленных на EGFR, HER2 и HER3 (по два mAb нацелены против неперекрывающихся эпитопов на каждой мишени), также достигла стадии клинических исследований. В общем превосходную активность, наблюдаемую для смесей против этого семейства рецепторов, можно объяснить несколькими факторами, такими как более полное выключение этих частично избыточных путей передачи сигналов, увеличенная интернализация и деградация посредством опосредованного антителами перекрестного связывания рецепторов, увеличение опосредованного Fc уничтожения клеток.
[0047] Другой областью терапии, в которой для смесей антител показано необычайное превосходство, является лечение инфекционных заболеваний (Oleksiewicz et al., Archives of Biochemistry and Biophysics 2012 526:124-131; Pohl et al., Infection and Immunity 2013 81(6):1880-1888). Например, мультиэпитопное нацеливание на растворимые токсины, такие как ботулинический токсин A, увеличивает не только нейтрализацию токсина, но также его выведение из кровотока. В общем, для способов mAb не доказана очень большая эффективность для лечения инфекций, в отличие от других областей терапии. Это может отражать то, что ответ поликлональных антител, сходный с ответом естественной иммунной системы, является необходимым для эффективной защиты против сложных организмов, таких как патогены.
[0048] Розролимупаб является удивительным примером возможностей сложных смесей антител. Эта смесь из 25 mAb против антигена резуса D получена с использованием способа поликлонального банка клеток, проиллюстрированного на фигуре 1B, и разработана для лечения иммунной тромбоцитопенической пурпуры (ITP). Преимуществом этой сложной смеси является то, что она обеспечивает эффективный охват множества вариантов резуса D, присутствующих в популяции (Robak et al., Blood. 2012 120(18): 3670-76).
[0049] Эти примеры подчеркивают преимущества механизмов, которые смеси могут обеспечивать, по сравнению с монотерапией mAb. Эти механизмы включают, но без ограничения: увеличение интернализации и деградации рецепторов, быстрое и превосходное выведение растворимых мишеней, усиление зависимых от Fc эффекторных функций, синергический эффект нацеливания на множество эпитопов на одной мишени или на множество мишеней и путей, лучший охват вариантов мишени и предотвращение мутаций для ускользания.
[0050] Настоящее изобретение относится к способу получения определенной смеси антител из либо i) только биспецифических антител (BiAb), либо ii) моноклональных антител (mAb) и BiAb. Способ основан на совместной экспрессии одной тяжелой цепи антитела, которая является общей для всех областей Fv антител в смеси, и нескольких легких цепей из семейств либо каппа, либо лямбда. Эта совместная экспрессия и случайное включение в молекулы IgG приводит к секреции из одной клетки смеси моноспецифических mAb или BiAb, которые все содержат одну и ту же тяжелую цепь. Полную смесь можно затем очищать с использованием, например, аффинного реагента, связывающего область Fc IgG, такого как белок A, как описано ранее в US20140179547. Изобретение улучшает другие предшествующие способы, поскольку оно позволяет избирательную очистку различных подгрупп из секретированной смеси. В частности, оно позволяет простое и экономически эффективное получение смесей BiAb. Это обеспечивает возможность использования смесей BiAb для механизмов действия, невозможных с использованием отдельного mAb или смесей mAb. Настоящее изобретение объединяет преимущество использования одной линии клеток для продукции и возможности контроля состава конечных очищенных смесей для максимизации желательной биологической активности.
[0051] В зависимости от количества легких цепей, совместно экспрессированных с общей тяжелой цепью, можно получать различные типы смесей антител. Этот способ можно обобщить следующим образом:
Если
n=количество различных легких цепей, экспрессированных с общей тяжелой цепью
Тогда
Количество различных mAb=n
Количество различных BiAb = (n2-n)/2
Общее количество различных антител=n+(n2-n)/2
[0052] В таблице 2 перечислены эти количества для совместной экспрессии 2-10 различных легких цепей, и 3 примера дополнительно подробно описаны ниже:
1- Если две легкие цепи антител совместно экспрессируют с одной тяжелой цепью, секретируются три различных антитела: два mAb, каждое из которых включает одинаковые легкие цепи в каждом Fab, и одно BiAb, включающее отличную легкую цепь в каждом Fab (см. фигуру 2A). Однако, распространенность трех форм зависит от относительной экспрессии и сборки двух легких цепей. При условии, что экспрессия и сборка являются эквивалентными, теоретическое распределение представляет собой 25% каждого mAb и 50% BiAb.
2- Если три легкие цепи антител совместно экспрессируют с одной тяжелой цепью, секретируются 6 различных антител: три mAb, каждое из которых включает одинаковые легкие цепи в каждом Fab, и три BiAb, включающих отличную легкую цепь в каждом Fab (см. фигуру 2B). При условии, что экспрессия и сборка являются эквивалентными, теоретическое распределение представляет собой 11,1% для каждого mAb и 22,2% для каждого из BiAb.
3- Если четыре легкие цепи антител совместно экспрессируют с одной тяжелой цепью, секретируются 10 различных антител: четыре mAb, каждое из которых включает одинаковые легкие цепи в каждом Fab, и шесть BiAb, включающих отличную легкую цепь в каждом Fab (см. фигуру 2C). При условии, что экспрессия и сборка являются эквивалентными, теоретическое распределение представляет собой 6,25% для каждого mAb и 12,5% для каждого из BiAb.
Таблица 2. Обобщение смесей антител
[0053] В зависимости от того, принадлежат ли различные легкие цепи, экспрессированные совместно, к типу каппа или к типу лямбда, распределение mAb и BiAb, содержащих легкие цепи каппа или лямбда, может меняться, таким образом, внося дополнительное разнообразие в типы смесей, которые можно получать этим способом. Например, если две легкие цепи лямбда и одну легкую цепь каппа совместно экспрессируют с общей тяжелой цепью, продуцируются два mAb IgGλλ, одно mAb IgGκκ, два BiAb IgGκλ и одно BiAb IgGλλ, как показано на фигуре 3. Если четыре легких цепи совместно экспрессируют, распределение молекул может меняться, если используют две легких цепи каппа и две легких цепи лямбда (фигура 4) или если используют три легких цепи лямбда и одну легкую цепь каппа (фигура 5).
[0054] Полученное количество форм антител, образованных в данной мультиспецифической смеси, можно обобщить следующим образом:
Если
n=количество легких цепей каппа
m=количество легких цепей лямбд
Тогда
Количество mAb IgGκκ = n
Количество mAb IgGλλ = m
Количество BiAb IgGκλ = n x m
Количество BiAb IgGκκ = (n2-n)/2
Количество BiAb IgGλλ = (m2-m)/2
[0055] При условии, что экспрессия и сборка различных легких цепей являются идентичными, полученное теоретическое распределение каждой формы можно обобщить следующим образом:
Если
n=количество легких цепей каппа
m=количество легких цепей лямбда
Тогда
Доля mAb IgGκκ = n/(n x m)
Доля mAb IgGλλ = m/(n x m)
Доля BiAb IgGκλ = (n x m)x2/(n x m)
Доля BiAb IgGκκ = (n2-n)/(n x m)
Доля BiAb IgGλλ = (m2-m)/(n x m)
[0056] Настоящее изобретение относится к способу очистки хорошо определенной подгруппы из либо i) только BiAb, либо ii) mAb и BiAb из широкого множества различных смесей, которые можно получать посредством совместной экспрессии различных количеств легких цепей каппа и или легких цепей лямбда, как описано выше. Изобретение основано на многостадийной аффинной хроматографии с использованием смол, специфически связывающих фрагмент Fc и смол, специфически связывающих константную область каппа или константную область лямбда. Этим способом, подгруппы форм антител, составляющие эти сложные смеси, можно легко выделять, и настраивать их состав, в зависимости от того, какой тип смол используют, и от желательного механизма действия.
[0057] Например, при совместной экспрессии двух легких цепей лямбда и одной легкой цепи каппа с общей тяжелой цепью получают смесь, состоящую из двух mAb IgGλλ, одного mAb IgGκκ, двух BiAb IgGκλ и одного BiAb IgGλλ (фигура 3). Все эти формы антител содержат фрагмент Fc и могут быть легко и эффективно очищены с использованием, например, хроматографии с белком A. Из этой смеси (смеси 1, указанной на фигуре 3), различные определенные подгруппы антител могут быть легко выделены с использованием сред для аффинной хроматографии, специфически связывающих либо цепь каппа, либо цепь лямбда, таким образом, обеспечивающих связывание всех форм антител, содержащих по меньшей мере одну цепь каппа или лямбда, соответственно (см. фигуру 3, подсмеси 2 и 3, соответственно). Подсмесь 2 содержит одно mAb IgGκκ и два BiAb IgGκλ. Подсмесь 3 содержит два mAb IgGλλ, два BiAb IgGκλ и одно BiAb IgGλλ. Подсмесь, содержащую два BiAb IgGκλ (без mAb), можно выделять посредством двух последовательных стадий аффинной хроматографии с использованием сред, специфически связывающих цепь каппа и цепь лямбда (фигура 3, подсмесь 4).
[0058] Если четыре различные легкие цепи совместно экспрессируют, полученные смеси являются более сложными и зависят от соотношения легких цепей каппа и лямбда, которые совместно экспрессируют. На фигурах 4 и 5 описаны два примера, в которых две легких цепи лямбда и две легких цепи каппа, или три легких цепи лямбда и одну легкую цепь каппа совместно экспрессируют, соответственно.
[0059] При совместной экспрессии двух легких цепей лямбда и двух легких цепей каппа с общей тяжелой цепью получают смесь (смесь 1, фигура 4), состоящую из двух mAb IgGλλ, двух mAb IgGκκ, четырех BiAb IgGκλ, одного BiAb IgGλλ и одного BiAb IgGκκ. Все эти формы антител содержат фрагмент Fc и могут быть эффективно очищены с использованием например, хроматографии с белком A. Как описано выше, различные определенные подгруппы антител могут быть легко выделены из этой исходной смеси 1 с использованием сред для аффинной хроматографии специфически связывающих либо цепь каппа, либо цепь лямбда, и таким образом, обеспечивающих связывание всех форм антител, содержащих по меньшей мере одну цепь каппа или лямбда, соответственно (фигура 4, подсмесь 2 и 3, соответственно). Подсмесь 2 содержит два mAb IgGκκ, четыре BiAb IgGκλ и одно BiAb IgGκκ. Подсмесь 3 содержит два mAb IgGλλ, четыре BiAb IgGκλ и одно BiAb IgGλλ. Наконец, смесь, содержащую четыре BiAb IgGκλ (без mAb или BiAb, содержащих только цепи лямбда или только цепи каппа), можно выделять посредством двух последовательных стадий аффинной хроматографии с использованием сред, специфически связывающих цепь каппа и цепь лямбда (фигура 4, подсмесь 4).
[0060] В ситуации, в которой 3 легкие цепи лямбда и одну легкую цепь каппа совместно экспрессируют с общей тяжелой цепью, получают смесь (смесь 1, фигура 5), состоящую из трех mAb IgGλλ, одного mAb IgGκκ, трех BiAb IgGκλ, трех BiAb IgGλλ и одного BiAb IgGκκ. Все эти формы антител содержат фрагмент Fc и могут быть эффективно очищены с использованием например, хроматографии с белком A. Как описано выше, различные определенные подгруппы антител могут быть легко выделены из этой исходной смеси 1 (фигура 5) с использованием сред для аффинной хроматографии, специфически связывающих константные домены либо легкой цепи каппа, либо легкой цепи лямбда, таких как аффинные матриксы CaptureSelect Fab Kappa и CaptureSelect Fab Lambda (GE Healthcare), и таким образом обеспечивающих связывание всех форм антител, содержащих по меньшей мере одну цепь каппа или лямбда, соответственно (фигура 5, подсмеси 2 и 3, соответственно). Подсмесь 2 содержит одно mAb IgGκκ и три BiAb IgGκλ. Подсмесь 3 содержит три mAb IgGλλ, три BiAb IgGκλ и три BiAb IgGλλ. Наконец, подсмесь, содержащую три IgGκλ BiAb (без mAb или BiAb, содержащих только цепи лямбда или только цепи каппа) можно выделять посредством двух последовательных стадий аффинной хроматографии с использованием сред, специфически связывающих цепь каппа и цепь лямбда (фигура 5, подсмесь 4).
[0061] Две ситуации, описанные выше, подчеркивают, что, хотя в каждом случае четыре легких цепи совместно экспрессируют, характер экспрессированных цепей (т.е., две легких цепи каппа и две легких цепи лямбда или 3 легких цепи лямбда и одна легкая цепь каппа) приводит к получению и очистке очень различных подгрупп смесей, которые можно легко и эффективно выделять с использованием способа по изобретению. Эти ситуации представляют только избранные примеры и не ограничивают использование изобретения в других ситуациях.
[0062] Является очевидным, что изобретение можно в основном использовать для выделения подгрупп mAb и/или BiAb из сложных смесей, на основании их соответствующего содержания легких цепей каппа и легких цепей лямбда. В любой ситуации, это является возможным с использованием сред для аффинной хроматографии, специфически связывающих константный или вариабельный домен легких цепей антител либо каппа, либо лямбда, для очистки трех типов подгрупп смесей:
1. Все молекулы антител, содержащие по меньшей мере одну легкую цепь каппа, включая как mAb, так и BiAb
2. Все молекулы антител содержащие по меньшей мере одну легкую цепь лямбда, включая как mAb, так и BiAb
3. Все молекулы BiAb, содержащие одну легкую цепь каппа и одну легкую цепь лямбда
[0063] Изобретение может также дополнительно относиться к очистке подгрупп антител из смесей антител, содержащих гибридные легкие цепи, как описано в Патенте US20140179547. Эти гибридные цепи состоят из либо:
1. Вариабельного домена каппа, слитого с константным доменом лямбда, либо
2. Вариабельного домена лямбда, слитого с константным доменом каппа
[0064] Подобно полноразмерным легким цепям лямбда или каппа, эти гибридные молекулы можно избирательно выделять на основании состава их вариабельного и константного домена с использованием сред для хроматографии, связывающих либо:
константные домены каппа (таких как аффинный матрикс CaptureSelect™ LC-kappa (Hu) (Life Technologies, Zug, Switzerland)
некоторые вариабельные домены каппа (таких как белок L)
константные домены лямбда (таких как аффинный матрикс CaptureSelect™ LC-lambda (Hu) (Life Technologies, Zug, Switzerland)
[0065] Общее применение изобретения описано на фигуре 6.
[0066] Мультиспецифические смеси антител по настоящему изобретению можно использовать при множестве показаний. Подгруппы смесей антител могут находить множество применений для разработки вариантов терапии на основе механизмов действия, которые невозможно обеспечивать посредством mAb, смесей mAb или BiAb.
[0067] В частности, изобретение обеспечивает прямое получение смесей полностью человеческих BiAb с использованием одной линии клеток, что обеспечивает значительное преимущество. Действительно, как описано выше, комбинация двух индивидуальных mAb приводит к значительному увеличению затрат. Это ограничение является очевидно даже более значительным, если необходимо комбинировать два индивидуальных BiAb, поскольку получение BiAb является более сложным и более дорогостоящим, чем для стандартных mAb. Примеры представляющих потенциальный интерес BiAb, так же как то, каким образом эти смеси можно получать с использованием настоящего изобретения, более подробно описаны ниже.
[0068] Мультиэпитопное нацеливание на опухолеассоциированный антиген (TAA) в комбинации с блокированием CD47: CD47 является повсеместно экспрессированным рецептором, который действует в качестве контрольной точки для врожденной иммунной системы, репрессируя фагоцитоз посредством взаимодействия с SIRPα (См., например, Oldenborg, P.A., CD47: A Cell Surface Glycoprotein Which Regulates Multiple Functions of Hematopoietic Cells in Health and Disease, ISRN Hematol. 2013; 2013:614619; Soto-Pantoja DR, et al., Therapeutic opportunities for targeting the ubiquitous cell surface receptor CD47 (2012), Expert Opin Ther Targets. 2013 Jan;17(1):89-103; Sick E, et al., CD47 Update: a multifaced actor in the tumor microenvironment of potential therapeutic interest, Br J Pharmacol. 2012 Dec;167(7):1415-30). Способ блокирования CD47 с использованием BiAb исключает токсичность, наблюдаемую для mAb, направленных против CD47. BiAb CD47xTAA позволяет ограниченное ингибирование CD47 только на экспрессирующих TAA клетках, таким образом, исключая токсичность и плохие фармакокинетические свойства. Смесь двух BiAb, нацеленных на два эпитопа на одном рецепторе, каждое из которых содержит плечо против TAA и плечи против CD47, может приводить к превосходному блокированию против CD47, увеличенному охвату Fc и в конечном счете, к лучшему уничтожению клеток опухоли (фигура 7A). Действительно, в такой ситуации, для каждой молекулы TAA, можно блокировать два рецептора CD47, и два Fc присутствуют на поверхности клетки-мишени, усиливая привлечение эффекторных клеток посредством взаимодействия с рецептором Fc-гамма.
[0069] Совместная экспрессия общей тяжелой цепи вместе с:
Первой легкой цепью лямбда, управляющей специфичностью против первого эпитопа на TAA
Второй легкой цепью лямбда, управляющей специфичностью против второго эпитопа на TAA
Легкой цепью каппа, управляющей специфичностью против CD47
[0070] Из полученной смеси, подгруппу, содержащую два BiAb (CD47xTAA, эпитоп 1, и CD47xTAA, эпитоп 2), можно очищать посредством двухстадийной аффинной хроматографии с использованием специфических для каппа аффинных сред, за которыми следуют специфические для лямбда аффинные среды, или наоборот (фигура 7B).
[0071] Нацеливание на множество TAA в комбинации с блокированием CD47: Пример выше можно использовать для двух TAA, экспрессированных клеткой злокачественной опухоли - мишенью. Смесь двух BiAb, нацеленных на два TAA, в каждом из которых скомбинированы плечо против TAA и плечо против CD47, также может приводить к превосходному блокированию против CD47, увеличенному охвату Fc, в дополнительной комбинации с эффектами, связанными с блокированием TAA, и в конечном счете, к лучшему уничтожению клеток опухоли (фигура 8A).
[0072] Совместная экспрессия общей тяжелой цепи вместе с:
Первой легкой цепью лямбда, управляющей специфичностью против первого TAA
Второй легкой цепью лямбда, управляющей специфичностью против второго TAA
Легкой цепью каппа, управляющей специфичностью против CD47
[0073] Из полученной смеси, подгруппу, содержащую два BiAb (CD47xTAA 1 и CD47xTAA 2), можно очищать посредством двухстадийной аффинной хроматографии с использованием специфических для каппа аффинных сред, за которыми следуют специфические для лямбда аффинные среды, или наоборот (фигура 8B).
[0074] Нацеливание на множество TAA или эпитопов в комбинации с блокированием нескольких молекул контрольных точек: Способ, используемый в примерах выше, можно расширять до двух TAA (или двух эпитопов на одном и том же TAA), экспрессированных клеткой злокачественной опухоли - мишенью, в комбинации с плечами, блокирующими два рецептора контрольных точек, например, CD47 и PD-L1. Такая смесь может приводить к блокированию CD47, блокированию PD-L1, увеличенному охвату Fc, и в конечном счете, к лучшему уничтожению клеток опухоли, и потенциально, длительному ответу иммунной системы, в то же время с исключением токсичности, связанной с общим моноспецифическим блокированием иммунной контрольной точки (фигура 9A).
[0075] Совместная экспрессия общей тяжелой цепи вместе с:
Первой легкой цепью лямбда, управляющей специфичностью против первого TAA
Второй легкой цепью лямбда, управляющей специфичностью против второго TAA
Легкой цепью каппа, управляющей специфичностью против CD47
Легкой цепью каппа, управляющей специфичностью против PD-L1
[0076] Из полученной смеси, подгруппу, содержащую 4 различных BiAb (CD47xTAA 1; CD47xTAA 2; PD-L1xTAA 1; PD-L1xTAA 2) можно очищать посредством двухстадийной аффинной хроматографии с использованием специфических для каппа аффинных сред, за которыми следуют специфические для лямбда аффинные среды, или наоборот (фигура 9B).
[0077] Перенацеливание T-клеток на множество TAA: Перенацеливание T-клеток является клинически подтвержденным и широко осуществимым способом в онкологии (Chames and Baty MAbs. 2009 1(6):539-47). Смесь BiAb может обеспечивать перенацеливание T-клеток на два различных TAA (или эпитопа на одном и том же TAA), потенциально улучшая эффективность лечения (фигура 10A).
[0078] Совместная экспрессия общей тяжелой цепи вместе с:
Первой легкой цепью лямбда, управляющей специфичностью против первого TAA
Второй легкой цепью лямбда, управляющей специфичностью против второго TAA
Легкой цепью каппа, управляющей специфичностью против CD3
[0079] Из полученной смеси, подгруппу, содержащую 2 различных BiAb (CD3xTAA 1; CD3xTAA 2), можно очищать посредством двухстадийной аффинной хроматографии с использованием специфических для каппа аффинных сред, за которыми следуют специфические для лямбда аффинные среды, или наоборот (фигура 10B).
[0080] Примеры выше являются иллюстративными и не ограничивают возможного применения, которое можно осуществлять с использованием настоящего изобретения. Кроме того, является очевидным, что любую цепь каппа, представленную в любом примере, можно заменять цепью лямбда, и наоборот.
[0081] Другим важным типом применения настоящего изобретения является получение смесей mAb и BiAb, исключающих одну или несколько форм mAb. Этот признак является важным, поскольку для некоторых мишеней моноспецифическое, двухвалентное привлечение посредством mAb является неблагоприятным и может приводить к токсичности и другим нежелательным эффектам. Например, известно, что антитела против cMet вызывают нежелательную агонистическую активность, что привело к разработке моновалентных антител. Получение смеси, содержащей антитела против cMet, но исключающей mAb против c-Met, является прямым применением настоящего изобретения. Как описано выше, нацеливание на CD47 с использованием mAb приводит к значительной токсичности у человека. mAb против CD47 можно удалять из смесей mAb, нацеленных на другие рецепторы, и BiAb, нацеленных на CD47 в сочетании с другим рецептором. Подобным образом, моноклональные антитела против CD3 также необходимо исключать из смесей антител, содержащих связывающий CD3 компонент.
[0082] Комбинированное моновалентное и двухвалентное нацеливание на два опухолеассоциированных антигена: Например, смесь mAb, нацеленного на первый TAA, в комбинации с BiAb, нацеленным на первый и второй TAA, для которого следует избегать двухвалентного нацеливания. Этот способ можно использовать для таких TAA, как cMet и EGFR (фигура 11A).
[0083] Совместная экспрессия общей тяжелой цепи вместе с:
Легкой цепью лямбда, управляющей специфичностью против первого TAA 1
Легкой цепью каппа, управляющей специфичностью против второго TAA 2
[0084] Из полученной смеси, подгруппу, содержащую BiAb (TAA 1xTAA 2) и mAb против TAA1, можно очищать посредством аффинной хроматографии с использованием специфических для лямбда аффинных сред (фигура 11B).
[0085] И снова, другие применения подгруппы смесей антител можно рационализировать, и примеры выше не ограничивают объем изобретения.
[0086] Такой же принцип применим для любого изотипа антитела, так же как к антителам из не относящихся к человеку видов, при условии, что аффинные или другие хроматографические реагенты являются доступными для разделения различных подсмесей антител.
[0087] Кроме того, тот же принцип изобретения может являться применимым к форматам F(ab’)2, в которых одну VHCH1 совместно экспрессируют с двумя или более VκCκ или VλCλ, таким образом, получая секрецию смеси моноспецифических и биспецифических молекул F(ab’)2. Затем их можно разделять на хорошо определенные подсмеси, в соответствии со способом по изобретению, с использованием сред для аффинной хроматографии, связывающих фрагмент легких цепей каппа или лямбда. Подобным образом, гибридные VκCλ и VλCκ также можно использовать при осуществлении способа по изобретению.
Примеры
ПРИМЕР 1: Выбор антител-кандидатов для получения биспецифического антитела
[0088] Четыре антитела, нацеленные на различные эпитопы на hMSLN, и антитело против hCD19, все содержащие легкую цепь лямбда, так же как антитело против hCD47, содержащее легкую цепь каппа, отобраны для получения смесей антител. Все эти антитела, содержащие одну и ту же тяжелую цепь, описанные в Публикации PCT No. WO 2014/087248 и в одновременно находящаяся на рассмотрении Патентной заявке США No. 62/511669, поданной 26 мая 2017 г. и озаглавленной «Anti-CD47 x Anti-Mesothelin Antibodies and Methods of Use Thereof», являются пригодными для получения биспецифических антител на основании формата антитела κλ, как описано в Публикации патентной заявки No. US20140179547. Выбранные антитела перечислены в таблице 3, и последовательности показаны ниже.
Таблица 3.
[0089] Каждое из антител против hMSLN, против hCD19 и против hCD47 в таблице 3 включает общую тяжелую цепь (SEQ ID NO: 2) кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 1:
>ОБЩАЯ-HC-NT (SEQ ID NO: 1)
GAGGTGCAGCTGTTGGAGTCTGGGGGAGGCTTGGTACAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCTTTAGCAGCTATGCCATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGGTCTCAGCTATTAGTGGTAGTGGTGGTAGCACATACTACGCAGACTCCGTGAAGGGCCGGTTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCCGTATATTACTGTGCGAAAAGTTATGGTGCTTTTGACTACTGGGGCCAGGGAACCCTGGTCACAGTCTCGAGCGCCTCCACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACAGTCTCGTGGAACTCAGGAGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACTGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTATACCCTGCCCCCATCTCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACTTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGTCCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTTAA
>ОБЩАЯ-HC-AA (SEQ ID NO: 2)
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSAISGSGGSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSYGAFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG
[0090] Каждое из антител против hMSLN, против hCD19 и против hCD47 в таблице 3 включает общий вариабельный домен тяжелой цепи (SEQ ID NO: 4), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 3:
>ОБЩАЯ-VH-NT (SEQ ID NO: 3)
GAGGTGCAGCTGTTGGAGTCTGGGGGAGGCTTGGTACAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCTTTAGCAGCTATGCCATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGGTCTCAGCTATTAGTGGTAGTGGTGGTAGCACATACTACGCAGACTCCGTGAAGGGCCGGTTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCCGTATATTACTGTGCGAAAAGTTATGGTGCTTTTGACTACTGGGGCCAGGGAACCCTGGTCACAGTCTCGAGC
>ОБЩАЯ-VH-AA (SEQ ID NO: 4)
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSAISGSGGSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKSYGAFDYWGQGTLVTVSS
[0091] Антитело O25 включает общую тяжелую цепь (SEQ ID NO: 2), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 1, и включает легкую цепь лямбда (SEQ ID NO: 6), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 5. Вариабельная область легкой цепи лямбда указана жирным шрифтом в аминокислотной последовательности ниже.
>O25-LC-NT (SEQ ID NO: 5)
CAGCCTGTGCTGACTCAGCCGGCTTCCCTCTCTGCATCTCCTGGAGCATCAGCCAGTCTCACCTGCACCTTGCACAGTGGCATCTCTGTTAAGGATTACAGGATATACTGGTACCAGCAGAAGCCAGGGCGTCCTCCCCAGTATCTCCTGAGGTACAAGTCTAATTCAGATATGCAGCAGGGATCTGGAGTCCCCAGCCGCTTCTCTGGGTCCAAAGATGCTTCGGCCAATGCAGGGATTTTACTCATCTCTGGGCTCCAGTCTGAGGATGAGGCTGACTATTACTGTATGATTTGGCACCATGGCCATGGGACTAGTCTTGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCTTGGAAAGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCATAA
>O25-LC-AA (SEQ ID NO: 6)
QPVLTQPASLSASPGASASLTCTLHSGISVKDYRIYWYQQKPGRPPQYLLRYKSNSDMQQGSGVPSRFSGSKDASANAGILLISGLQSEDEADYYCMIWHHGHGTSLVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
[0092] Антитело O25 включает общий вариабельный домен тяжелой цепи (SEQ ID NO: 4), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 3, и включает вариабельный домен легкой цепи лямбда (SEQ ID NO: 8), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 7.
>O25-VH-NT (SEQ ID NO: 7)
CAGCCTGTGCTGACTCAGCCGGCTTCCCTCTCTGCATCTCCTGGAGCATCAGCCAGTCTCACCTGCACCTTGCACAGTGGCATCTCTGTTAAGGATTACAGGATATACTGGTACCAGCAGAAGCCAGGGCGTCCTCCCCAGTATCTCCTGAGGTACAAGTCTAATTCAGATATGCAGCAGGGATCTGGAGTCCCCAGCCGCTTCTCTGGGTCCAAAGATGCTTCGGCCAATGCAGGGATTTTACTCATCTCTGGGCTCCAGTCTGAGGATGAGGCTGACTATTACTGTATGATTTGGCACCATGGCCATGGGACTAGTCTTGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTA
>O25-VH-AA (SEQ ID NO: 8)
QPVLTQPASLSASPGASASLTCTLHSGISVKDYRIYWYQQKPGRPPQYLLRYKSNSDMQQGSGVPSRFSGSKDASANAGILLISGLQSEDEADYYCMIWHHGHGTSLVFGGGTKLTVL
[0093] Антитело O30 включает общую тяжелую цепь (SEQ ID NO: 2), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 1, и включает легкую цепь лямбда (SEQ ID NO: 10), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 9. Вариабельная область легкой цепи лямбда указана жирным шрифтом в аминокислотной последовательности ниже.
>O30-LC-NT (SEQ ID NO: 9)
CAGTCTGTGCTGACTCAGCCACCCTCAGCGTCTGGGACCCCCGGGCAGAGGGTCACCATCTCTTGTTCTGGAAGCAGCTCCAACATCGCGCATGGGCCTGTAAACTGGTACCAGCAGCTCCCAGGAACGGCCCCCAAACTCCTCATCTATGCTACTAATCATCGGCCCTCAGGGGTCCCTGACCGATTTTCTGGCTCCAAGTCTGGCACCACAGCCTCCCTGACCATCAGTGGGCTCCAGTCTGAGGATGAGGCTGATTATTACTGTGCTGCATATGATCTTACGGGCTGGTTTGCGTATGCTGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCTTGGAAAGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCATAA
>O30-LC-AA (SEQ ID NO: 10)
QSVLTQPPSASGTPGQRVTISCSGSSSNIAHGPVNWYQQLPGTAPKLLIYATNHRPSGVPDRFSGSKSGTTASLTISGLQSEDEADYYCAAYDLTGWFAYAVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
[0094] Антитело O30 включает общий вариабельный домен тяжелой цепи (SEQ ID NO: 4), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 3, и включает вариабельный домен легкой цепи лямбда (SEQ ID NO: 12), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 11.
>O30-VL-NT (SEQ ID NO: 11)
CAGTCTGTGCTGACTCAGCCACCCTCAGCGTCTGGGACCCCCGGGCAGAGGGTCACCATCTCTTGTTCTGGAAGCAGCTCCAACATCGCGCATGGGCCTGTAAACTGGTACCAGCAGCTCCCAGGAACGGCCCCCAAACTCCTCATCTATGCTACTAATCATCGGCCCTCAGGGGTCCCTGACCGATTTTCTGGCTCCAAGTCTGGCACCACAGCCTCCCTGACCATCAGTGGGCTCCAGTCTGAGGATGAGGCTGATTATTACTGTGCTGCATATGATCTTACGGGCTGGTTTGCGTATGCTGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTA
>O30-VL-AA (SEQ ID NO: 12)
QSVLTQPPSASGTPGQRVTISCSGSSSNIAHGPVNWYQQLPGTAPKLLIYATNHRPSGVPDRFSGSKSGTTASLTISGLQSEDEADYYCAAYDLTGWFAYAVFGGGTKLTVL
[0095] Антитело O35 включает общую тяжелую цепь (SEQ ID NO: 2), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 1, и включает легкую цепь лямбда (SEQ ID NO: 14), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 13. Вариабельная область легкой цепи лямбда указана жирным шрифтом в аминокислотной последовательности ниже.
>O35-LC-NT (SEQ ID NO: 13)
CAGCCTGTGCTGACTCAGCCGGTTTCCCTCTCTGCATCTCCTGGAGCATCAGTCAGTCTCACCTGCACCTTGCGCAGTGACATCAGGGTTAGAGATTACAGGATATTCTGGTACCAGCAGAAGCCAGGGAGTCCTCCCCAGTATCTCCTGAGGTACAAAACCGACTCAGATAAGCAGCAGGGCTCTGGAGTCCCCAGCCGCTTCTCTGGGTCCAAAGATGCTTCGGCCAATGCAGGGATTTTACTCATCTCTGGGCTCCAGTCTGAGGATGAGGCTGACTATTACTGTATGATTTGGCACCGCACCACGGGCACTAGTCTTGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCTTGGAAAGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCATAA
>O35-LC-AA (SEQ ID NO: 14)
QPVLTQPVSLSASPGASVSLTCTLRSDIRVRDYRIFWYQQKPGSPPQYLLRYKTDSDKQQGSGVPSRFSGSKDASANAGILLISGLQSEDEADYYCMIWHRTTGTSLVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
[0096] Антитело O35 включает общий вариабельный домен тяжелой цепи (SEQ ID NO: 4), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 3, и включает вариабельный домен легкой цепи лямбда (SEQ ID NO: 16), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 15.
>O35-VL-NT (SEQ ID NO: 15)
CAGCCTGTGCTGACTCAGCCGGTTTCCCTCTCTGCATCTCCTGGAGCATCAGTCAGTCTCACCTGCACCTTGCGCAGTGACATCAGGGTTAGAGATTACAGGATATTCTGGTACCAGCAGAAGCCAGGGAGTCCTCCCCAGTATCTCCTGAGGTACAAAACCGACTCAGATAAGCAGCAGGGCTCTGGAGTCCCCAGCCGCTTCTCTGGGTCCAAAGATGCTTCGGCCAATGCAGGGATTTTACTCATCTCTGGGCTCCAGTCTGAGGATGAGGCTGACTATTACTGTATGATTTGGCACCGCACCACGGGCACTAGTCTTGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTA
>O35-VL-AA (SEQ ID NO: 16)
QPVLTQPVSLSASPGASVSLTCTLRSDIRVRDYRIFWYQQKPGSPPQYLLRYKTDSDKQQGSGVPSRFSGSKDASANAGILLISGLQSEDEADYYCMIWHRTTGTSLVFGGGTKLTVL
[0097] Антитело O38 включает общую тяжелую цепь (SEQ ID NO: 2), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO:1, и включает легкую цепь лямбда (SEQ ID NO: 29), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 30
>O38-LC-NT (SEQ ID NO: 29)
CAGCCTGTGCTGACTCAGCCGGCTTCCCTCTCTGCATCTCCTGGGGCATCAGCCAGTCTCACCTGCACCTTGCGCAGTGGCATCAACGTTAGAGATTACAGGATATTCTGGTACCAGCAGAAGCCAGGGAGTCCTCCCCAGTATCTCCTGAGGTACAAAAGCGCATCAGATAAGCAGCAGGGCTCTGGAGTCCCCAGCCGCTTCTCTGGGTCCAAAGATGCTTCGGCCAATGCAGGGATTTTACTCATCTCTGGGCTCCAGTCTGAGGATGAGGCTGACTATTACTGTATGATTTGGCACCACGATTCGGAGGGGCATGCTTTTGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCTTGGAAAGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCATAA
>O38 -LC-AA (SEQ ID NO: 30)
QPVLTQPASLSASPGASASLTCTLRSGINVRDYRIFWYQQKPGSPPQYLLRYKSASDKQQGSGVPSRFSGSKDASANAGILLISGLQSEDEADYYCMIWHHDSEGHAFVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
[0098] Антитело O38 включает общий вариабельный домен тяжелой цепи (SEQ ID NO: 4), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 3, и включает вариабельный домен легкой цепи лямбда (SEQ ID NO: 31), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 32.
>O38-VL-NT (SEQ ID NO: 31)
CAGCCTGTGCTGACTCAGCCGGCTTCCCTCTCTGCATCTCCTGGGGCATCAGCCAGTCTC
ACCTGCACCTTGCGCAGTGGCATCAACGTTAGAGATTACAGGATATTCTGGTACCAGCAG
AAGCCAGGGAGTCCTCCCCAGTATCTCCTGAGGTACAAAAGCGCATCAGATAAGCAGCAG
GGCTCTGGAGTCCCCAGCCGCTTCTCTGGGTCCAAAGATGCTTCGGCCAATGCAGGGATT
TTACTCATCTCTGGGCTCCAGTCTGAGGATGAGGCTGACTATTACTGTATGATTTGGCAC
CACGATTCGGAGGGGCATGCTTTTGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTA
>O38-VL-AA (SEQ ID NO: 32)
QPVLTQPASLSASPGASASLTCTLRSGINVRDYRIFWYQQKPGSPPQYLLRYKSASDKQQGSGVPSRFSGSKDASANAGILLISGLQSEDEADYYCMIWHHDSEGHAFVFGGGTKLTVL
[0099] Антитело O41 включает общую тяжелую цепь (SEQ ID NO: 2), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 1, и включает легкую цепь лямбда (SEQ ID NO: 18), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 17. Вариабельная область легкой цепи лямбда указана жирным шрифтом в аминокислотной последовательности ниже.
>O41-LC-NT (SEQ ID NO: 17)
TCCTATGTGCTGACTCAGCCACCCTCAGTGTCAGTGGCCCCAGGAAAGACGGCCAGGATTACCTGTGGGGGAAACAAAATTGGACACCGCGCCGTGCACTGGTACCAGCAGAAGCCAGGCCAGGCCCCTGTGCTGGTCATCTATTATACCTATGAGCGGCCCTCAGGGATTCCTGAGCGATTCTCTGGCTCCAACTCTGGGAACACGGCCACCCTGACCATCAGCAGGGTCGAAGCCGGGGATGAGGCCGACTATTACTGTCAGGTGTGGGATTGGTACAGCGAGGGGGGGGTTGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCTTGGAAAGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCATAA
>O41-LC-AA (SEQ ID NO: 18)
SYVLTQPPSVSVAPGKTARITCGGNKIGHRAVHWYQQKPGQAPVLVIYYTYERPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDWYSEGGVVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
[00100] Антитело O41 включает общий вариабельный домен тяжелой цепи (SEQ ID NO: 4), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 3, и включает вариабельный домен легкой цепи лямбда (SEQ ID NO: 20), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 19.
>O41-VL-NT (SEQ ID NO: 19)
TCCTATGTGCTGACTCAGCCACCCTCAGTGTCAGTGGCCCCAGGAAAGACGGCCAGGATTACCTGTGGGGGAAACAAAATTGGACACCGCGCCGTGCACTGGTACCAGCAGAAGCCAGGCCAGGCCCCTGTGCTGGTCATCTATTATACCTATGAGCGGCCCTCAGGGATTCCTGAGCGATTCTCTGGCTCCAACTCTGGGAACACGGCCACCCTGACCATCAGCAGGGTCGAAGCCGGGGATGAGGCCGACTATTACTGTCAGGTGTGGGATTGGTACAGCGAGGGGGGGGTTGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTA
>O41-VL-AA (SEQ ID NO: 20)
SYVLTQPPSVSVAPGKTARITCGGNKIGHRAVHWYQQKPGQAPVLVIYYTYERPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDWYSEGGVVFGGGTKLTVL
[00101] Антитело L7-2 включает общую тяжелую цепь (SEQ ID NO: 2), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 1, и включает легкую цепь лямбда (SEQ ID NO: 22), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 21.
>L7-2-VL-NT (SEQ ID NO: 21)
AATTTTATGCTGACTCAGCCCCACTCTGTGTCGGAGTCTCCGGGGAAGACGGTAACCATCTCCTGCACCCGCAGCAGTGGCTCTATCGAAGATAAGTATGTGCAGTGGTACCAGCAGCGCCCGGGCAGTTCCCCCACCATTGTGATCTATTATGATAACGAAAGACCCTCTGGGGTCCCTGATCGGTTCTCTGGCTCCATCGACAGCTCCTCCAACTCTGCCTCCCTCACCATCTCTGGACTGAAGACTGAGGACGAGGCTGACTACTACTGTCAGACCTACGACCAGAGCCTGTATGGTTGGGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTAGGTCAGCCCAAGGCTGCCCCCTCGGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTTCAAGCCAACAAGGCCACACTGGTGTGTCTCATAAGTGACTTCTACCCGGGAGCCGTGACAGTGGCTTGGAAAGCAGATAGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCACACCCTCCAAACAAAGCAACAACAAGTACGCGGCCAGCAGCTATCTGAGCCTGACGCCTGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCATAA
>L7-2-LC-AA (SEQ ID NO: 22)
NFMLTQPHSVSESPGKTVTISCTRSSGSIEDKYVQWYQQRPGSSPTIVIYYDNERPSGVPDRFSGSIDSSSNSASLTISGLKTEDEADYYCQTYDQSLYGWVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
[00102] Антитело C2 включает общий вариабельный домен тяжелой цепи (SEQ ID NO: 114), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 113, и включает вариабельный домен легкой цепи лямбда (SEQ ID NO: 24), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 23.
>L7-2-VL-NT (SEQ ID NO: 23)
AATTTTATGCTGACTCAGCCCCACTCTGTGTCGGAGTCTCCGGGGAAGACGGTAACCATCTCCTGCACCCGCAGCAGTGGCTCTATCGAAGATAAGTATGTGCAGTGGTACCAGCAGCGCCCGGGCAGTTCCCCCACCATTGTGATCTATTATGATAACGAAAGACCCTCTGGGGTCCCTGATCGGTTCTCTGGCTCCATCGACAGCTCCTCCAACTCTGCCTCCCTCACCATCTCTGGACTGAAGACTGAGGACGAGGCTGACTACTACTGTCAGACCTACGACCAGAGCCTGTATGGTTGGGTGTTCGGCGGAGGGACCAAGCTGACCGTCCTA
>L7-2-VL-AA (SEQ ID NO: 24)
NFMLTQPHSVSESPGKTVTISCTRSSGSIEDKYVQWYQQRPGSSPTIVIYYDNERPSGVPDRFSGSIDSSSNSASLTISGLKTEDEADYYCQTYDQSLYGWVFGGGTKLTVL
[00103] Антитело K2 включает общую тяжелую цепь (SEQ ID NO: 2), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 1, и включает легкую цепь каппа (SEQ ID NO: 26), кодированную последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 25.
>K2-LC-NT (SEQ ID NO: 25)
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagagcattagcagctatttaaattggtatcagcagaaaccagggaaagcccctaagctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcagcagatgcacccgcgcgccccgaagaccttcggccaagggaccaaggtggaaatcaaaCGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGTTAA
>K2-LC-AA (SEQ ID NO: 26)
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQMHPRAPKTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
[00104] Антитело K2 включает общий вариабельный домен тяжелой цепи (SEQ ID NO: 4), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 3, и включает вариабельный домен легкой цепи каппа (SEQ ID NO: 28), кодированный последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 27.
>K2-VL-NT (SEQ ID NO: 27)
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcacCatcacttgccgggcaagtcagagcattagcagctatttaaattggtatcagcagaaaccagggaaagcccctaagctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcagcagatgcacccgcgcgccccgaagaccttcggCcaagggaccaaggtggaaatcaaa
>K2-VL-AA (SEQ ID NO: 28)
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQMHPRAPKTFGQGTKVEIK
ПРИМЕР 2: Экспрессия и очистка биспецифических антител, несущих легкую цепь лямбда и каппа.
[00105] Одновременная экспрессия одной тяжелой цепи и двух легких цепей в одной и той же клетке может приводить к сборке трех различных антител. Одновременную экспрессию можно осуществлять различными способами, такими как трансфекция множеством векторов, экспрессирующих одну из цепей, предназначенных для совместной экспрессии, или с использованием векторов, управляющих экспрессией множества генов. Вектор pNoviκHλ получен ранее для обеспечения совместной экспрессии одной тяжелой цепи, одной легкой цепи каппа и одной легкой цепи лямбда, как описано в US 2012/0184716 и WO 2012/023053, полное содержание каждого из которых, таким образом, приведено в качестве ссылки. Экспрессией трех генов управляют промоторы цитомегаловируса человека (hCMV), и вектор содержит также ген глутаминсинтетазы (GS), позволяющий отбор и получение стабильных линий клеток. Гены VL IgGλ против hMSLN, IgGλ против hCD19 или IgGκ против hCD47 клонировали в вектор pNoviκHλ, для временной экспрессии в клетках млекопитающих. Клетки Peak размножали и разделяли по флаконам T175 в концентрации 8×106 клеток на флакон в 45 мл культуральной среды, содержащей эмбриональную бычью сыворотку. 30 мкг плазмидной ДНК трансфицировали в клетки посредством трансфекции с использованием реагента липофектамина 2000, согласно инструкциям производителя. Концентрацию антител в содержащем сыворотку супернатанте трансфицированных клеток измеряли в нескольких временных точках в ходе продукции с использованием технологии интерферометрии биослоя (BLI). Устройство OctetRED96 и биосенсоры с белком A использовали для количественной оценки (Pall, Basel, Switzerland). 200 мкл супернатанта использовали для определения концентрации IgG; биосенсоры подвергали предварительной подготовке и регенерации с использованием 10 мМ глицина pH 1,7, и калибраторы IgG, разведенные в кондиционированной среде для клеток PEAK, подготавливали для получения стандартной кривой. Концентрации определяли с использованием 5PL взвешенного по Y уравнения стандартной кривой зависимости ответа от дозы и начального угла наклона уравнения скорости связывания. В соответствии с концентрацией антител, супернатанты собирали через 7-10 суток после трансфекции и осветляли посредством центрифугирования при 1300 g в течение 10 мин. Способ очистки состоял из трех аффинных стадий. Во-первых, аффинный матрикс CaptureSelect™ IgG-CH1 (Thermo Fisher Scientific, Waltham, MA) промывали с использованием PBS и затем добавляли к осветленному супернатанту. После инкубации в течение ночи при +4°C, супернатанты центрифугировали при 1000 g в течение 10 мин, проскок сохраняли, и смолу промывали дважды с использованием PBS. Затем, смолу переносили в колонки для центрифугирования, и раствор, содержащий 50 мМ глицин при pH 3,0, использовали для элюции. Несколько фракций после элюции получали, пулировали и подвергали обессоливанию против 25 мМ гистидина/125 мМ NaCl pH 6,0 с использованием установок для фильтрации ультрацентрифугированием 50 кДа Amicon® (Merck KGaA, Darmstadt, Germany). Конечный продукт, содержащий тотальные IgG человека из супернатанта, оценивали количественно с использованием спектрофотометра Nanodrop (NanoDrop Technologies, Wilmington, DE) и инкубировали в течение 30 мин при RT и 20 об./мин с соответствующим объемом аффинного матрикса CaptureSelect™ LC-kappa (Hu) (Thermo Fisher Scientific, Waltham, MA). Стадии инкубации, восстановления смолы, элюции и обессоливания проводили, как описано ранее. Последнюю стадию аффинной очистки проводили с использованием аффинного матрикса CaptureSelect™ LC-lambda (Hu) (Thermo Fisher Scientific, Waltham, MA), используя такой же способ, как для двух предшествующих очисток. Конечный продукт оценивали количественно с использованием Nanodrop. Очищенные биспецифические антитела анализировали посредством электрофореза в денатурирующих и восстанавливающих условиях. Использовали биоанализатор Agilent 2100 с набором для анализа белка Protein 80, как описано производителем (Agilent Technologies, Santa Clara, CA, USA). 4 мкл очищенных образцов смешивали с буфером для образцов, дополненным дитиотреитолом (DTT; Sigma Aldrich, St. Louis, MO). Образцы нагревали при 95°C в течение 5 мин и затем наносили на чип. Аликвоту после первой стадии очистки (содержащую биспецифическое антитело и оба моноспецифических mAb) и аликвоту конечного продукта наносили в гель для изоэлектрического фокусирования (IEF) для оценки чистоты конечного очищенного биспецифического антитела (отсутствия контаминации mAb). Уровень агрегатов определяли посредством SEC-HPLC. Наконец, связывание биспецифических антител с обеими мишенями оценивали с использованием OctetRED96. Кратко, биотинилированные мишени (hMSLN, hCD19, hCD47 и не имеющую отношения к делу мишень) нагружали на биосенсор со стрептавидином. Затем этот биосенсор погружали в раствор, содержащий биспецифическое антитело, и связывание мониторировали в реальном времени. Все образцы тестировали по контаминации эндотоксином с использованием теста с лизатом амебоцитов мечехвоста (LAL; Charles River Laboratories, Wilmington, MA). Следующие биспецифические антитела были экспрессированы и очищены:
Таблица 4.
ПРИМЕР 3: Активность в анализах фагоцитоза индивидуальных биспецифических антител, нацеленных на hMSLN и hCD47, и комбинаций биспецифических антител
[00106] Биспецифические антитела, нацеленные на белок или антиген, экспрессированный на поверхности клетки опухоли, и способные совместно привлекать CD47 на той же самой клетке опухоли, могут опосредовать увеличение фагоцитарной активности макрофага посредством предотвращения передачи ингибирующего сигнала, опосредованной взаимодействием CD47 с SIRPα. Этот принцип описан в Публикации PCT No. WO 2014/087248 и в одновременно находящейся на рассмотрении Патентной заявке США No. 62/511669, поданной 26 мая 2017 г. и озаглавленной «Anti-CD47 x Anti-Mesothelin Antibodies and Methods of Use Thereof». В этом случае авторы настоящего изобретения тестировали гипотезу мультиэпитопного нацеливания на опухолеассоциированный антиген (TAA), в этом случае, hMSLN, в комбинации с блокированием CD47, как проиллюстрировано на фигуре 7. Для оценки преимущества наличия более высокой плотности Fc и более сильного блокирования CD47 на молекулу MSLN, авторы настоящего изобретения сравнивали фагоцитарную активность, опосредованную либо индивидуальными биспецифическими антителами hCD47/hMSLN, либо попарными комбинациями биспецифических антител. Биспецифическое антитело hCD47/hCD19 K2L7-2 использовали в качестве моновалентного контроля против hCD47, поскольку hCD19 не присутствовал в анализе. Тестировали три линии клеток опухолей, экспрессирующие различные уровни hCD47 и hMSLN: NCI-N87, HPAC и Caov-3. Уровни экспрессии на поверхности клеток CD47 и мезотелина для клеток NCI-N87 составляли 43000 и 27000, соответственно. Уровни экспрессии на поверхности клеток CD47 и мезотелина для клеток HPAC составляли 105000 и 13000, соответственно. Уровни экспрессии на поверхности клеток CD47 и мезотелина для клеток Caov-3 составляли 220000 и 38000, соответственно.
[00107] Проводили анализ с использованием макрофагов человека, дифференцированных из моноцитов периферической крови и NCI-N87, HPAC или CaOV3 в качестве клетки-мишени. Макрофаги инкубировали совместно с меченными кальцеином AM клетками-мишенями (соотношение эффектор:мишень 1:1) в течение 2,5 часов при 37°C в присутствии увеличивающихся концентраций биспецифического или моновалентного антитела. В конце периода инкубации, супернатанты заменяли на полную культуральную среду. Планшеты подвергали визуализации с использованием платформы CX5 Imaging, и по 1500 макрофагов получали и анализировали для каждых условий. Доказательства фагоцитоза получали по дважды-положительным событиям, и показатели фагоцитоза рассчитывали посредством программного обеспечения.
[00108] Эти эксперименты по зависимости ответа от дозы показывают, что фагоцитарная активность, опосредованная комбинацией K2O30+K2O41, превосходила активность либо K2O30, либо K2O41, для всех трех типов клеток (фигура 12A, 13A и 14A). Подобным образом, фагоцитарная активность, опосредованная комбинацией K2O35+K2O41, превосходила активность либо K2O35, либо K2O41, для всех трех типов клеток (фигура 12B, 13B и 14B). Кроме того, фагоцитарная активность, опосредованная комбинацией K2O38+K2O41, превосходила активность либо K2O38, либо K2O41, для клеток NCI-N87 и HPAC (фигура 12C и 14C). Комбинация K2O30 +K2O25 превосходила по активности либо K2O30, либо K2O25, для клеток NCI-N87 (фигура 15). Во всех случаях, являющееся отрицательным контролем IgG (обозначенное как NI-0801, описанное в Публикации PCT No. WO2008/106200) или контроль моновалентного антитела против hCD47 индуцировал только минимальную или не индуцировал фагоцитарной активности. Во всех этих примерах, два биспецифических антитела добавляли в равных количествах (т.е., в соотношении 50:50). Для оценки того, могут ли небольшие изменения этого эквимолярного соотношения влиять на активность, K2O30 и K2O25 смешивали в соотношениях 40:60 и 60:40, и тестировали. Для всех соотношений получили сходные результаты, показывающие, что небольшие различия соотношения между двумя биспецифическими антителами не вносят значительного вклада в увеличение фагоцитарной активности комбинации (фигура 15A).
ПРИМЕР 4: Экспрессия четырех цепей антитела с одного вектора
[00109] Вектор pNoviκHλ модифицировали, чтобы позволять экспрессию дополнительной легкой цепи. Новый вектор, pNoviH3L, содержит четыре промотора, управляющие экспрессией одной тяжелой цепи и трех легких цепей. Легкую цепь каппа антитела против CD47 K2, и две легкие цепи лямбда антител против hMSLN O30 и O25 клонировали в этот один вектор. Все кодирующие последовательности и стыки клонирования подтверждали секвенированием. Этот вектор использовали для временной трансфекции, как описано в примере 2, для подтверждения его функциональности, т.е., того, что возможна продукция биспецифических антител. Затем вектор линеаризовали для электропорации в клетки яичника китайского хомяка (CHO).
ПРИМЕР 5: Экспрессия смесей антител, содержащих биспецифические и моноспецифические антитела.
[00110] В исследованиях, представленных в настоящем описании, стабильные линии CHO трансфицировали и выращивали с использованием химически определенного, свободного от компонентов животного происхождения (CDACF) производственного процесса. После трансфекции посредством электропорации и отбора с использованием MSX, проводили скрининг посредством FACS. Пулы с наивысшей продукцией отбирали для продукции в условиях периодической культуры с подпиткой. Общую производительность по IgG оценивали для различных пулов с использованием технологии Octet. Аффинную очистку проводили, как описано в примере 2. Материал после стадии хроматографии с белком A, таким образом, содержащий все формы IgG, анализировали по содержанию полипептидов с использованием биоанализатора Agilent, посредством изоэлектрического фокусирования в геле (IEF) и определения уровня агрегатов посредством SEC-HPLC. Наконец, связывание биспецифических антител с обеими мишенями оценивали с использованием OctetRED96. Кратко, биотинилированные мишени (hMSLN, hCD47 и не имеющую отношения к делу мишень) нагружали на биосенсор со стрептавидином. Затем этот биосенсор погружали в раствор, содержащий биспецифическое антитело, и связывание мониторировали в реальном времени. Все образцы тестировали по контаминации эндотоксином с использованием теста с лизатом амебоцитов мечехвоста (LAL; Charles River Laboratories, Wilmington, MA).
ПРИМЕР 6: Очистка подсмеси, содержащей два биспецифических антитела
[00111] Смесь всех форм IgG (биспецифических и моноспецифических IgG), которую экспрессировали и очищали в примере 5, дополнительно подвергали двум стадиям хроматографии с использованием сред, специфически взаимодействующих с константными доменами легкой цепи каппа или лямбда, таких как аффинные матриксы CaptureSelect Fab Kappa и CaptureSelect Fab Lambda (GE Healthcare). Эти две стадии позволяли выделять все формы IgG, содержащие как легкую цепь каппа, так и легкую цепь лямбда, как показано на фигуре 6 и 7B. Затем тотальные IgG наносили на колонку, содержащую аффинный матрикс CaptureSelect Fab kappa (GE Healthcare), уравновешенную десятью объемами PBS. Затем колонку промывали с использованием 5-10 объемов колонки PBS. Все молекулы иммуноглобулинов, несущие легкую цепь каппа, элюировали с колонки посредством введения 5 объемов колонки 0,1 M глицина, pH 3,0, и собирали фракции. Фракции, содержащие антитело, пулировали перед заменой буфера на колонке для замены буфера Amicon (Merck), уравновешенной PBS. Затем антитело наносили на вторую колонку, содержащую аффинный матрикс CaptureSelect Fab lambda, уравновешенную десятью объемами PBS. Затем колонку промывали с использованием 5-10 объемов колонки PBS. Все молекулы иммуноглобулинов, несущие только легкую цепь каппа, не связывались с колонкой и обнаружены в проскоке. Антитела, несущие легкую цепь лямбда, элюировали с колонки посредством введения 5 объемов колонки 0,1 M глицина, pH 3,0 и собирали фракции. Фракции, содержащие биспецифические антитела, пулировали перед заменой буфера на колонке для замены буфера Amicon (Merck) , уравновешенной PBS. Фракции проскока и элюции с каждой стадии очистки анализировали посредством SDS-PAGE и показали, что антитела, несущие легкие цепи лямбда, обнаружены в проскоке аффинного матрикса CaptureSelect Fab kappa и, наоборот, что антитела, несущие легкие цепи каппа, обнаружены в проскоке аффинного матрикса CaptureSelect Fab lambda.
[00112] Смесь всех форм IgG, после получения со стадии с белком A, и подсмесь K2O25O30, содержащую две биспецифические формы антитела, которые очищали, как описано выше, анализировали посредством IEF (фигура 16A). Как ожидали, 6 полос, соответствующих различным формам моно- и биспецифических антител, являлись видимыми для смеси, полученной после белка A. После трех стадий аффинной очистки, две полосы, соответствующие двум биспецифическим формам, содержащим легкую цепь каппа и лямбда являлись видимыми. Очищенную подсмесь K2O25O30 далее анализировали посредством хроматографии гидрофобного взаимодействия (HIC) для определения относительного содержания двух форм биспецифических антител. Интегрирование двух отдельных пиков выявило, что K2O25O30 содержит 69% K2O25 и 31% K2O30 (фигура 16B).
ПРИМЕР 7: Активность в анализе фагоцитоза подсмеси, содержащей два биспецифических антитела, нацеленных на hMSLN и hCD47, и комбинации таких же двух биспецифических антител
[00113] Затем активность подсмеси K2O25O30, выделенной в примере 6, сравнивали с эквимолярной комбинацией K2O25 и K2O30 в анализе фагоцитоза in vitro с использованием клеток NCI-N87, как описано в примере 3. Активность K2O25O30 и эквимолярной комбинации K2O25 и K2O30 являлась идентичной (фигура 17), показывая, что подсмесь воспроизводит увеличение активности комбинации, по сравнению с активностью индивидуальных биспецифических антител, как описано в примере 3.
ПРИМЕР 8: Противоопухолевая активность in vivo комбинаций биспецифических антител
[00114] Противоопухолевую активность 2 антител κλ против CD47xMSLN (K2O38 и K2O41) и одной комбинации антител κλ против CD47xMSLN (K2O38+K2O41) оценивали в модели рака печени на основе трансфицированных MSLN HepG2. 3,106 клеток HepG2-MSLN имплантировали подкожно мышам NOD/SCID. Объемы опухолей измеряли 2-3 раза в неделю (с использованием следующей формулы: (длина x ширина2)/2). Обработку начинали, когда опухоль достигала между 150 и 200 мм3. Мышей случайным образом распределяли на 8 групп (6-7 мышей на группу). В этом эксперименте сравнивали эффект комбинаций антител κλ против CD47xMSLN с эффектом антител κλ против CD47xMSLN отдельно и Mab против MSLN аматуксимаба. Антитело инъецировали i.v. один раз в неделю до конца эксперимента (d28). Все антитела вводили при 60 мг/кг на инъекцию. Измерение объема опухоли использовали для расчета площади под кривой (AUC) для каждой индивидуальной мыши. Для статистических анализов, проводили однофакторный ANOVA с последующим тестом множественного сравнения (теста множественного сравнения Тьюки), с использованием GraphPad Prism. p< 0,05 считали статистически значимым. Процент ингибирования роста опухоли (TGI), по сравнению с группой контроля изотипа, также определяли на основании объемов опухолей, с использованием формулы: %TGI={1- [(Tt-T0)/(Vt-V0)]} x 100; где Tt=медианный объем опухоли для обработки на время t; T0=медианный объем опухоли для обработки на время 0; Vt=медианный объем опухоли для контроля на время t и V0=медианный объем опухоли для контроля на время 0.
[00115] Как показано на фигуре 18, обработка с использованием 2 антител κλ CD47xMSLN значимо уменьшала рост опухоли по сравнению с контролем hIgG1, с TGI 21% для K2O41 и 46% для K2O38. Для комбинации показан превосходящий эффект на рост опухоли, по сравнению со способом с использованием отдельных антител, с TGI 80% для K2O41+K2O38. Наконец, как для отдельных антител κλ CD47xMSLN, так и для их комбинации, показан превосходящий противоопухолевый эффект, по сравнению с аматуксимабом, нейтрализующим mAb, узнающим MSLN, в настоящее время проходящим клиническое исследование.
Другие варианты осуществления
[00116] В то время как настоящее изобретение описано в сочетании с его подробным описанием, предшествующее описание предназначено для иллюстрации, а не для ограничения объема изобретения, который определен объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации включены в объем следующей формулы изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> НОВИММУН СА
<120> ПОЛУЧЕНИЕ МУЛЬТИСПЕЦИФИЧЕСКИХ СМЕСЕЙ АНТИТЕЛ И СПОСОБЫ ИХ
ПРИМЕНЕНИЯ
<130> NOVI-045/001WO 322145-2716
<140> US 16/042889
<141> 2018-07-23
<150> US 62/535354
<151> 2017-07-21
<160> 32
<170> PatentIn версии 3.5
<210> 1
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 1
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc
60
tcctgtgcag cctctggatt cacctttagc agctatgcca tgagctgggt ccgccaggct
120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac
180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat
240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaaagttat
300
ggtgcttttg actactgggg ccagggaacc ctggtcacag tctcgagcgc ctccaccaag
360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc
420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cagtctcgtg gaactcagga
480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc
540
ctcagcagcg tggtgactgt gccctccagc agcttgggca cccagaccta catctgcaac
600
gtgaatcaca agcccagcaa caccaaggtg gacaagagag ttgagcccaa atcttgtgac
660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc
720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc
780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc
840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt
900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc
960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg
1020
cagccccgag aaccacaggt gtataccctg cccccatctc gggaggagat gaccaagaac
1080
caggtcagcc tgacttgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg
1140
gagagcaacg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac
1200
ggctccttct tcctctatag caagctcacc gtggacaagt ccaggtggca gcaggggaac
1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc
1320
tccctgtctc cgggttaa
1338
<210> 2
<211> 445
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 2
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ser Tyr Gly Ala Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 3
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 3
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc
60
tcctgtgcag cctctggatt cacctttagc agctatgcca tgagctgggt ccgccaggct
120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac
180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat
240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaaagttat
300
ggtgcttttg actactgggg ccagggaacc ctggtcacag tctcgagc
348
<210> 4
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 4
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ser Tyr Gly Ala Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 5
<211> 675
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 5
cagcctgtgc tgactcagcc ggcttccctc tctgcatctc ctggagcatc agccagtctc
60
acctgcacct tgcacagtgg catctctgtt aaggattaca ggatatactg gtaccagcag
120
aagccagggc gtcctcccca gtatctcctg aggtacaagt ctaattcaga tatgcagcag
180
ggatctggag tccccagccg cttctctggg tccaaagatg cttcggccaa tgcagggatt
240
ttactcatct ctgggctcca gtctgaggat gaggctgact attactgtat gatttggcac
300
catggccatg ggactagtct tgtgttcggc ggagggacca agctgaccgt cctaggtcag
360
cccaaggctg ccccctcggt cactctgttc ccgccctcct ctgaggagct tcaagccaac
420
aaggccacac tggtgtgtct cataagtgac ttctacccgg gagccgtgac agtggcttgg
480
aaagcagata gcagccccgt caaggcggga gtggagacca ccacaccctc caaacaaagc
540
aacaacaagt acgcggccag cagctatctg agcctgacgc ctgagcagtg gaagtcccac
600
agaagctaca gctgccaggt cacgcatgaa gggagcaccg tggagaagac agtggcccct
660
acagaatgtt cataa
675
<210> 6
<211> 224
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 6
Gln Pro Val Leu Thr Gln Pro Ala Ser Leu Ser Ala Ser Pro Gly Ala
1 5 10 15
Ser Ala Ser Leu Thr Cys Thr Leu His Ser Gly Ile Ser Val Lys Asp
20 25 30
Tyr Arg Ile Tyr Trp Tyr Gln Gln Lys Pro Gly Arg Pro Pro Gln Tyr
35 40 45
Leu Leu Arg Tyr Lys Ser Asn Ser Asp Met Gln Gln Gly Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Lys Asp Ala Ser Ala Asn Ala Gly Ile
65 70 75 80
Leu Leu Ile Ser Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys
85 90 95
Met Ile Trp His His Gly His Gly Thr Ser Leu Val Phe Gly Gly Gly
100 105 110
Thr Lys Leu Thr Val Leu Gly Gln Pro Lys Ala Ala Pro Ser Val Thr
115 120 125
Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu
130 135 140
Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly Ala Val Thr Val Ala Trp
145 150 155 160
Lys Ala Asp Ser Ser Pro Val Lys Ala Gly Val Glu Thr Thr Thr Pro
165 170 175
Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu
180 185 190
Thr Pro Glu Gln Trp Lys Ser His Arg Ser Tyr Ser Cys Gln Val Thr
195 200 205
His Glu Gly Ser Thr Val Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
210 215 220
<210> 7
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 7
cagcctgtgc tgactcagcc ggcttccctc tctgcatctc ctggagcatc agccagtctc
60
acctgcacct tgcacagtgg catctctgtt aaggattaca ggatatactg gtaccagcag
120
aagccagggc gtcctcccca gtatctcctg aggtacaagt ctaattcaga tatgcagcag
180
ggatctggag tccccagccg cttctctggg tccaaagatg cttcggccaa tgcagggatt
240
ttactcatct ctgggctcca gtctgaggat gaggctgact attactgtat gatttggcac
300
catggccatg ggactagtct tgtgttcggc ggagggacca agctgaccgt ccta
354
<210> 8
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 8
Gln Pro Val Leu Thr Gln Pro Ala Ser Leu Ser Ala Ser Pro Gly Ala
1 5 10 15
Ser Ala Ser Leu Thr Cys Thr Leu His Ser Gly Ile Ser Val Lys Asp
20 25 30
Tyr Arg Ile Tyr Trp Tyr Gln Gln Lys Pro Gly Arg Pro Pro Gln Tyr
35 40 45
Leu Leu Arg Tyr Lys Ser Asn Ser Asp Met Gln Gln Gly Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Lys Asp Ala Ser Ala Asn Ala Gly Ile
65 70 75 80
Leu Leu Ile Ser Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys
85 90 95
Met Ile Trp His His Gly His Gly Thr Ser Leu Val Phe Gly Gly Gly
100 105 110
Thr Lys Leu Thr Val Leu
115
<210> 9
<211> 657
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 9
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc
60
tcttgttctg gaagcagctc caacatcgcg catgggcctg taaactggta ccagcagctc
120
ccaggaacgg cccccaaact cctcatctat gctactaatc atcggccctc aggggtccct
180
gaccgatttt ctggctccaa gtctggcacc acagcctccc tgaccatcag tgggctccag
240
tctgaggatg aggctgatta ttactgtgct gcatatgatc ttacgggctg gtttgcgtat
300
gctgtgttcg gcggagggac caagctgacc gtcctaggtc agcccaaggc tgccccctcg
360
gtcactctgt tcccgccctc ctctgaggag cttcaagcca acaaggccac actggtgtgt
420
ctcataagtg acttctaccc gggagccgtg acagtggctt ggaaagcaga tagcagcccc
480
gtcaaggcgg gagtggagac caccacaccc tccaaacaaa gcaacaacaa gtacgcggcc
540
agcagctatc tgagcctgac gcctgagcag tggaagtccc acagaagcta cagctgccag
600
gtcacgcatg aagggagcac cgtggagaag acagtggccc ctacagaatg ttcataa
657
<210> 10
<211> 218
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 10
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Ala His Gly
20 25 30
Pro Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ala Thr Asn His Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Thr Ala Ser Leu Thr Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Tyr Asp Leu Thr Gly
85 90 95
Trp Phe Ala Tyr Ala Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser
115 120 125
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
130 135 140
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro
145 150 155 160
Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn
165 170 175
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
180 185 190
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
195 200 205
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 11
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 11
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc
60
tcttgttctg gaagcagctc caacatcgcg catgggcctg taaactggta ccagcagctc
120
ccaggaacgg cccccaaact cctcatctat gctactaatc atcggccctc aggggtccct
180
gaccgatttt ctggctccaa gtctggcacc acagcctccc tgaccatcag tgggctccag
240
tctgaggatg aggctgatta ttactgtgct gcatatgatc ttacgggctg gtttgcgtat
300
gctgtgttcg gcggagggac caagctgacc gtccta
336
<210> 12
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 12
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Ala His Gly
20 25 30
Pro Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ala Thr Asn His Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Thr Ala Ser Leu Thr Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Tyr Asp Leu Thr Gly
85 90 95
Trp Phe Ala Tyr Ala Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 13
<211> 675
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 13
cagcctgtgc tgactcagcc ggtttccctc tctgcatctc ctggagcatc agtcagtctc
60
acctgcacct tgcgcagtga catcagggtt agagattaca ggatattctg gtaccagcag
120
aagccaggga gtcctcccca gtatctcctg aggtacaaaa ccgactcaga taagcagcag
180
ggctctggag tccccagccg cttctctggg tccaaagatg cttcggccaa tgcagggatt
240
ttactcatct ctgggctcca gtctgaggat gaggctgact attactgtat gatttggcac
300
cgcaccacgg gcactagtct tgtgttcggc ggagggacca agctgaccgt cctaggtcag
360
cccaaggctg ccccctcggt cactctgttc ccgccctcct ctgaggagct tcaagccaac
420
aaggccacac tggtgtgtct cataagtgac ttctacccgg gagccgtgac agtggcttgg
480
aaagcagata gcagccccgt caaggcggga gtggagacca ccacaccctc caaacaaagc
540
aacaacaagt acgcggccag cagctatctg agcctgacgc ctgagcagtg gaagtcccac
600
agaagctaca gctgccaggt cacgcatgaa gggagcaccg tggagaagac agtggcccct
660
acagaatgtt cataa
675
<210> 14
<211> 224
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 14
Gln Pro Val Leu Thr Gln Pro Val Ser Leu Ser Ala Ser Pro Gly Ala
1 5 10 15
Ser Val Ser Leu Thr Cys Thr Leu Arg Ser Asp Ile Arg Val Arg Asp
20 25 30
Tyr Arg Ile Phe Trp Tyr Gln Gln Lys Pro Gly Ser Pro Pro Gln Tyr
35 40 45
Leu Leu Arg Tyr Lys Thr Asp Ser Asp Lys Gln Gln Gly Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Lys Asp Ala Ser Ala Asn Ala Gly Ile
65 70 75 80
Leu Leu Ile Ser Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys
85 90 95
Met Ile Trp His Arg Thr Thr Gly Thr Ser Leu Val Phe Gly Gly Gly
100 105 110
Thr Lys Leu Thr Val Leu Gly Gln Pro Lys Ala Ala Pro Ser Val Thr
115 120 125
Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu
130 135 140
Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly Ala Val Thr Val Ala Trp
145 150 155 160
Lys Ala Asp Ser Ser Pro Val Lys Ala Gly Val Glu Thr Thr Thr Pro
165 170 175
Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu
180 185 190
Thr Pro Glu Gln Trp Lys Ser His Arg Ser Tyr Ser Cys Gln Val Thr
195 200 205
His Glu Gly Ser Thr Val Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
210 215 220
<210> 15
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 15
cagcctgtgc tgactcagcc ggtttccctc tctgcatctc ctggagcatc agtcagtctc
60
acctgcacct tgcgcagtga catcagggtt agagattaca ggatattctg gtaccagcag
120
aagccaggga gtcctcccca gtatctcctg aggtacaaaa ccgactcaga taagcagcag
180
ggctctggag tccccagccg cttctctggg tccaaagatg cttcggccaa tgcagggatt
240
ttactcatct ctgggctcca gtctgaggat gaggctgact attactgtat gatttggcac
300
cgcaccacgg gcactagtct tgtgttcggc ggagggacca agctgaccgt ccta
354
<210> 16
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 16
Gln Pro Val Leu Thr Gln Pro Val Ser Leu Ser Ala Ser Pro Gly Ala
1 5 10 15
Ser Val Ser Leu Thr Cys Thr Leu Arg Ser Asp Ile Arg Val Arg Asp
20 25 30
Tyr Arg Ile Phe Trp Tyr Gln Gln Lys Pro Gly Ser Pro Pro Gln Tyr
35 40 45
Leu Leu Arg Tyr Lys Thr Asp Ser Asp Lys Gln Gln Gly Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Lys Asp Ala Ser Ala Asn Ala Gly Ile
65 70 75 80
Leu Leu Ile Ser Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys
85 90 95
Met Ile Trp His Arg Thr Thr Gly Thr Ser Leu Val Phe Gly Gly Gly
100 105 110
Thr Lys Leu Thr Val Leu
115
<210> 17
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 17
tcctatgtgc tgactcagcc accctcagtg tcagtggccc caggaaagac ggccaggatt
60
acctgtgggg gaaacaaaat tggacaccgc gccgtgcact ggtaccagca gaagccaggc
120
caggcccctg tgctggtcat ctattatacc tatgagcggc cctcagggat tcctgagcga
180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg
240
gatgaggccg actattactg tcaggtgtgg gattggtaca gcgagggggg ggttgtgttc
300
ggcggaggga ccaagctgac cgtcctaggt cagcccaagg ctgccccctc ggtcactctg
360
ttcccgccct cctctgagga gcttcaagcc aacaaggcca cactggtgtg tctcataagt
420
gacttctacc cgggagccgt gacagtggct tggaaagcag atagcagccc cgtcaaggcg
480
ggagtggaga ccaccacacc ctccaaacaa agcaacaaca agtacgcggc cagcagctat
540
ctgagcctga cgcctgagca gtggaagtcc cacagaagct acagctgcca ggtcacgcat
600
gaagggagca ccgtggagaa gacagtggcc cctacagaat gttcataa
648
<210> 18
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 18
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Lys Ile Gly His Arg Ala Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Thr Tyr Glu Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Trp Tyr Ser Glu Gly
85 90 95
Gly Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro
100 105 110
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
115 120 125
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
130 135 140
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala
145 150 155 160
Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
165 170 175
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
180 185 190
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
195 200 205
Val Ala Pro Thr Glu Cys Ser
210 215
<210> 19
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 19
tcctatgtgc tgactcagcc accctcagtg tcagtggccc caggaaagac ggccaggatt
60
acctgtgggg gaaacaaaat tggacaccgc gccgtgcact ggtaccagca gaagccaggc
120
caggcccctg tgctggtcat ctattatacc tatgagcggc cctcagggat tcctgagcga
180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg
240
gatgaggccg actattactg tcaggtgtgg gattggtaca gcgagggggg ggttgtgttc
300
ggcggaggga ccaagctgac cgtccta
327
<210> 20
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 20
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Lys Ile Gly His Arg Ala Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Thr Tyr Glu Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Trp Tyr Ser Glu Gly
85 90 95
Gly Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 21
<211> 657
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 21
aattttatgc tgactcagcc ccactctgtg tcggagtctc cggggaagac ggtaaccatc
60
tcctgcaccc gcagcagtgg ctctatcgaa gataagtatg tgcagtggta ccagcagcgc
120
ccgggcagtt cccccaccat tgtgatctat tatgataacg aaagaccctc tggggtccct
180
gatcggttct ctggctccat cgacagctcc tccaactctg cctccctcac catctctgga
240
ctgaagactg aggacgaggc tgactactac tgtcagacct acgaccagag cctgtatggt
300
tgggtgttcg gcggagggac caagctgacc gtcctaggtc agcccaaggc tgccccctcg
360
gtcactctgt tcccgccctc ctctgaggag cttcaagcca acaaggccac actggtgtgt
420
ctcataagtg acttctaccc gggagccgtg acagtggctt ggaaagcaga tagcagcccc
480
gtcaaggcgg gagtggagac caccacaccc tccaaacaaa gcaacaacaa gtacgcggcc
540
agcagctatc tgagcctgac gcctgagcag tggaagtccc acagaagcta cagctgccag
600
gtcacgcatg aagggagcac cgtggagaag acagtggccc ctacagaatg ttcataa
657
<210> 22
<211> 218
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 22
Asn Phe Met Leu Thr Gln Pro His Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Ser Ile Glu Asp Lys
20 25 30
Tyr Val Gln Trp Tyr Gln Gln Arg Pro Gly Ser Ser Pro Thr Ile Val
35 40 45
Ile Tyr Tyr Asp Asn Glu Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Lys Thr Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Thr Tyr Asp Gln
85 90 95
Ser Leu Tyr Gly Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser
115 120 125
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
130 135 140
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro
145 150 155 160
Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn
165 170 175
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
180 185 190
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
195 200 205
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 23
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 23
aattttatgc tgactcagcc ccactctgtg tcggagtctc cggggaagac ggtaaccatc
60
tcctgcaccc gcagcagtgg ctctatcgaa gataagtatg tgcagtggta ccagcagcgc
120
ccgggcagtt cccccaccat tgtgatctat tatgataacg aaagaccctc tggggtccct
180
gatcggttct ctggctccat cgacagctcc tccaactctg cctccctcac catctctgga
240
ctgaagactg aggacgaggc tgactactac tgtcagacct acgaccagag cctgtatggt
300
tgggtgttcg gcggagggac caagctgacc gtccta
336
<210> 24
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 24
Asn Phe Met Leu Thr Gln Pro His Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Ser Ile Glu Asp Lys
20 25 30
Tyr Val Gln Trp Tyr Gln Gln Arg Pro Gly Ser Ser Pro Thr Ile Val
35 40 45
Ile Tyr Tyr Asp Asn Glu Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Lys Thr Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Thr Tyr Asp Gln
85 90 95
Ser Leu Tyr Gly Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 25
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 25
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgcc gggcaagtca gagcattagc agctatttaa attggtatca gcagaaacca
120
gggaaagccc ctaagctcct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca
180
aggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag tctgcaacct
240
gaagattttg caacttacta ctgtcagcag atgcacccgc gcgccccgaa gaccttcggc
300
caagggacca aggtggaaat caaacgtacg gtggctgcac catctgtctt catcttcccg
360
ccatctgatg agcagttgaa atctggaact gcctctgttg tgtgcctgct gaataacttc
420
tatcccagag aggccaaagt acagtggaag gtggataacg ccctccaatc gggtaactcc
480
caggagagtg tcacagagca ggacagcaag gacagcacct acagcctcag cagcaccctg
540
acgctgagca aagcagacta cgagaaacac aaagtctacg cctgcgaagt cacccatcag
600
ggcctgagct cgcccgtcac aaagagcttc aacaggggag agtgttaa
648
<210> 26
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Met His Pro Arg Ala Pro
85 90 95
Lys Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 27
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 27
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgcc gggcaagtca gagcattagc agctatttaa attggtatca gcagaaacca
120
gggaaagccc ctaagctcct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca
180
aggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag tctgcaacct
240
gaagattttg caacttacta ctgtcagcag atgcacccgc gcgccccgaa gaccttcggc
300
caagggacca aggtggaaat caaa
324
<210> 28
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 28
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Met His Pro Arg Ala Pro
85 90 95
Lys Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 29
<211> 678
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 29
cagcctgtgc tgactcagcc ggcttccctc tctgcatctc ctggggcatc agccagtctc
60
acctgcacct tgcgcagtgg catcaacgtt agagattaca ggatattctg gtaccagcag
120
aagccaggga gtcctcccca gtatctcctg aggtacaaaa gcgcatcaga taagcagcag
180
ggctctggag tccccagccg cttctctggg tccaaagatg cttcggccaa tgcagggatt
240
ttactcatct ctgggctcca gtctgaggat gaggctgact attactgtat gatttggcac
300
cacgattcgg aggggcatgc ttttgtgttc ggcggaggga ccaagctgac cgtcctaggt
360
cagcccaagg ctgccccctc ggtcactctg ttcccgccct cctctgagga gcttcaagcc
420
aacaaggcca cactggtgtg tctcataagt gacttctacc cgggagccgt gacagtggct
480
tggaaagcag atagcagccc cgtcaaggcg ggagtggaga ccaccacacc ctccaaacaa
540
agcaacaaca agtacgcggc cagcagctat ctgagcctga cgcctgagca gtggaagtcc
600
cacagaagct acagctgcca ggtcacgcat gaagggagca ccgtggagaa gacagtggcc
660
cctacagaat gttcataa
678
<210> 30
<211> 225
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 30
Gln Pro Val Leu Thr Gln Pro Ala Ser Leu Ser Ala Ser Pro Gly Ala
1 5 10 15
Ser Ala Ser Leu Thr Cys Thr Leu Arg Ser Gly Ile Asn Val Arg Asp
20 25 30
Tyr Arg Ile Phe Trp Tyr Gln Gln Lys Pro Gly Ser Pro Pro Gln Tyr
35 40 45
Leu Leu Arg Tyr Lys Ser Ala Ser Asp Lys Gln Gln Gly Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Lys Asp Ala Ser Ala Asn Ala Gly Ile
65 70 75 80
Leu Leu Ile Ser Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys
85 90 95
Met Ile Trp His His Asp Ser Glu Gly His Ala Phe Val Phe Gly Gly
100 105 110
Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys Ala Ala Pro Ser Val
115 120 125
Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln Ala Asn Lys Ala Thr
130 135 140
Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly Ala Val Thr Val Ala
145 150 155 160
Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly Val Glu Thr Thr Thr
165 170 175
Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala Ser Ser Tyr Leu Ser
180 185 190
Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser Tyr Ser Cys Gln Val
195 200 205
Thr His Glu Gly Ser Thr Val Glu Lys Thr Val Ala Pro Thr Glu Cys
210 215 220
Ser
225
<210> 31
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 31
cagcctgtgc tgactcagcc ggcttccctc tctgcatctc ctggggcatc agccagtctc
60
acctgcacct tgcgcagtgg catcaacgtt agagattaca ggatattctg gtaccagcag
120
aagccaggga gtcctcccca gtatctcctg aggtacaaaa gcgcatcaga taagcagcag
180
ggctctggag tccccagccg cttctctggg tccaaagatg cttcggccaa tgcagggatt
240
ttactcatct ctgggctcca gtctgaggat gaggctgact attactgtat gatttggcac
300
cacgattcgg aggggcatgc ttttgtgttc ggcggaggga ccaagctgac cgtccta
357
<210> 32
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 32
Gln Pro Val Leu Thr Gln Pro Ala Ser Leu Ser Ala Ser Pro Gly Ala
1 5 10 15
Ser Ala Ser Leu Thr Cys Thr Leu Arg Ser Gly Ile Asn Val Arg Asp
20 25 30
Tyr Arg Ile Phe Trp Tyr Gln Gln Lys Pro Gly Ser Pro Pro Gln Tyr
35 40 45
Leu Leu Arg Tyr Lys Ser Ala Ser Asp Lys Gln Gln Gly Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Lys Asp Ala Ser Ala Asn Ala Gly Ile
65 70 75 80
Leu Leu Ile Ser Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys
85 90 95
Met Ile Trp His His Asp Ser Glu Gly His Ala Phe Val Phe Gly Gly
100 105 110
Gly Thr Lys Leu Thr Val Leu
115
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА ПРОТИВ CEACAM5 И CD3 | 2020 |
|
RU2827106C1 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ИНТЕРЛЕЙКИНУ-31 ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ | 2019 |
|
RU2795411C2 |
| УСТОЙЧИВЫЕ МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2018 |
|
RU2779602C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2020 |
|
RU2818588C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ ADAM9, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2783619C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ, БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ТАКИХ АНТИТЕЛ | 2018 |
|
RU2795240C2 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| АНТИТЕЛА К СОБАЧЬЕМУ АЛЬФА-РЕЦЕПТОРУ ИНТЕРЛЕЙКИНА-4 | 2020 |
|
RU2840044C1 |
| АНТИТЕЛА К СОБАЧЬЕМУ АЛЬФА-РЕЦЕПТОРУ ИНТЕРЛЕЙКИНА-4 | 2020 |
|
RU2838943C1 |
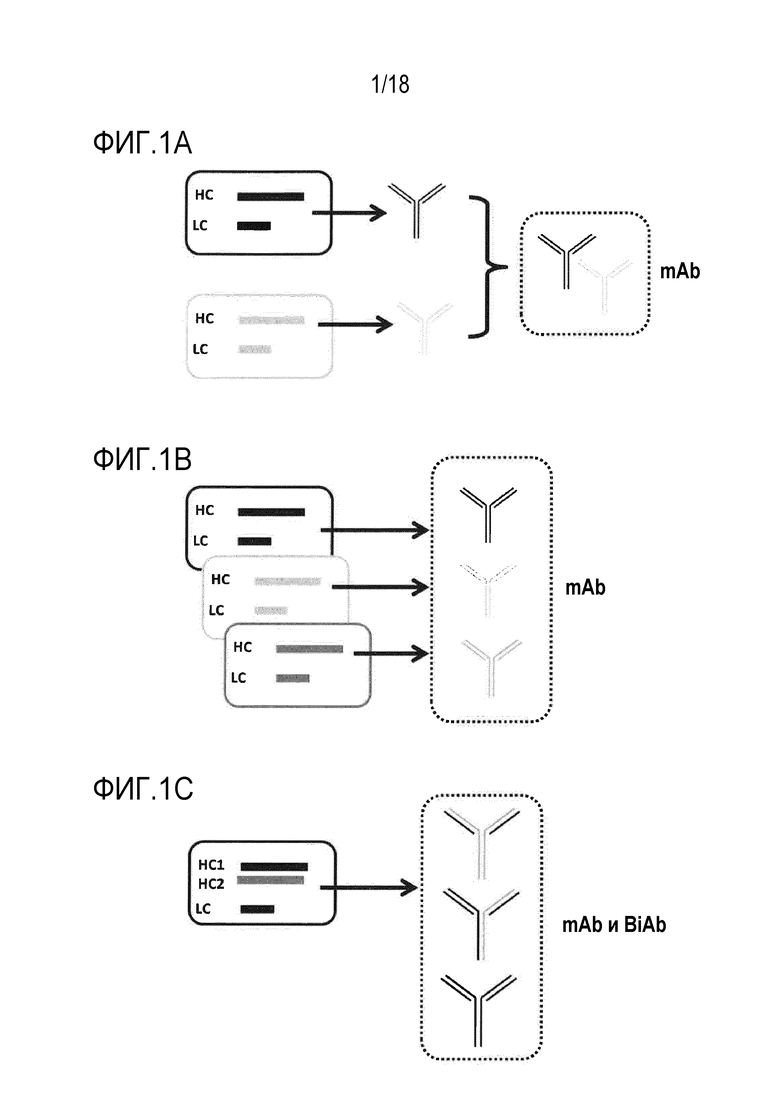
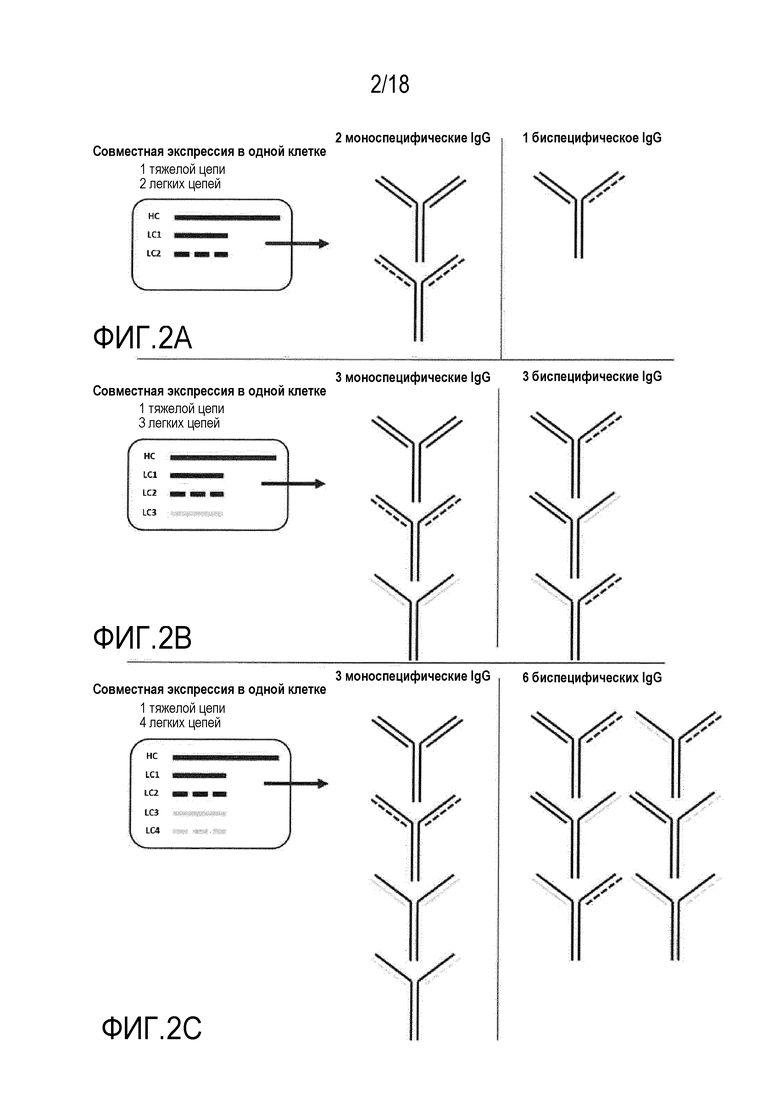
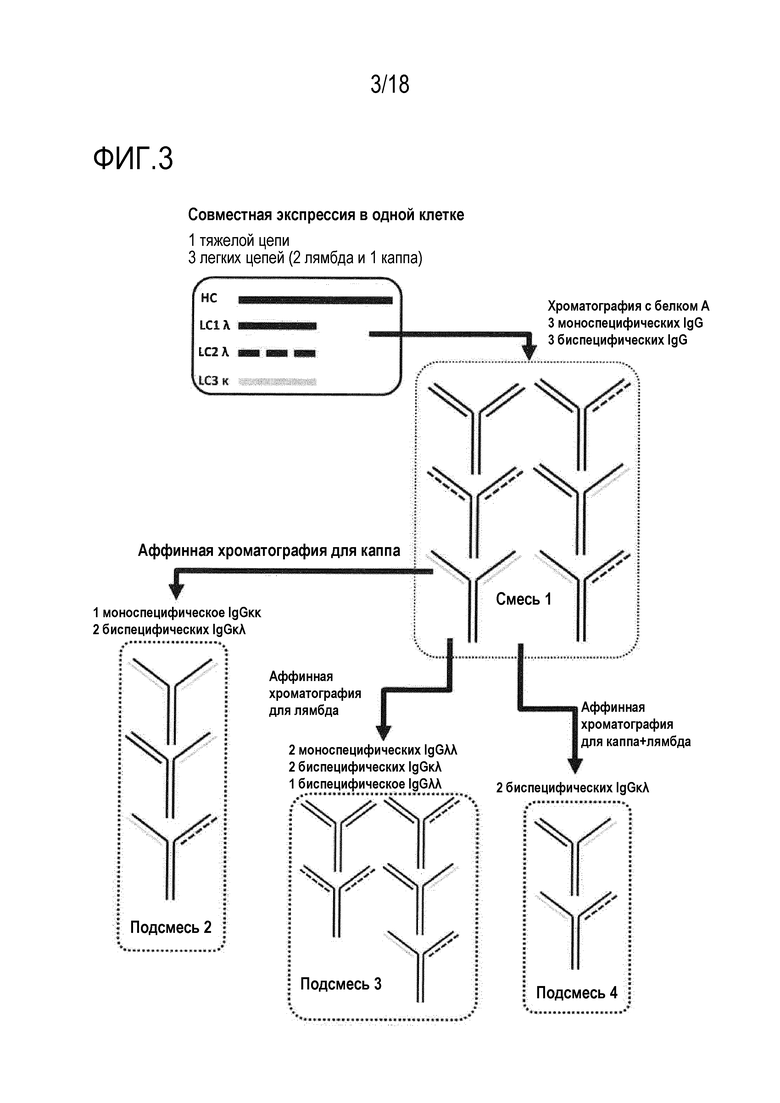
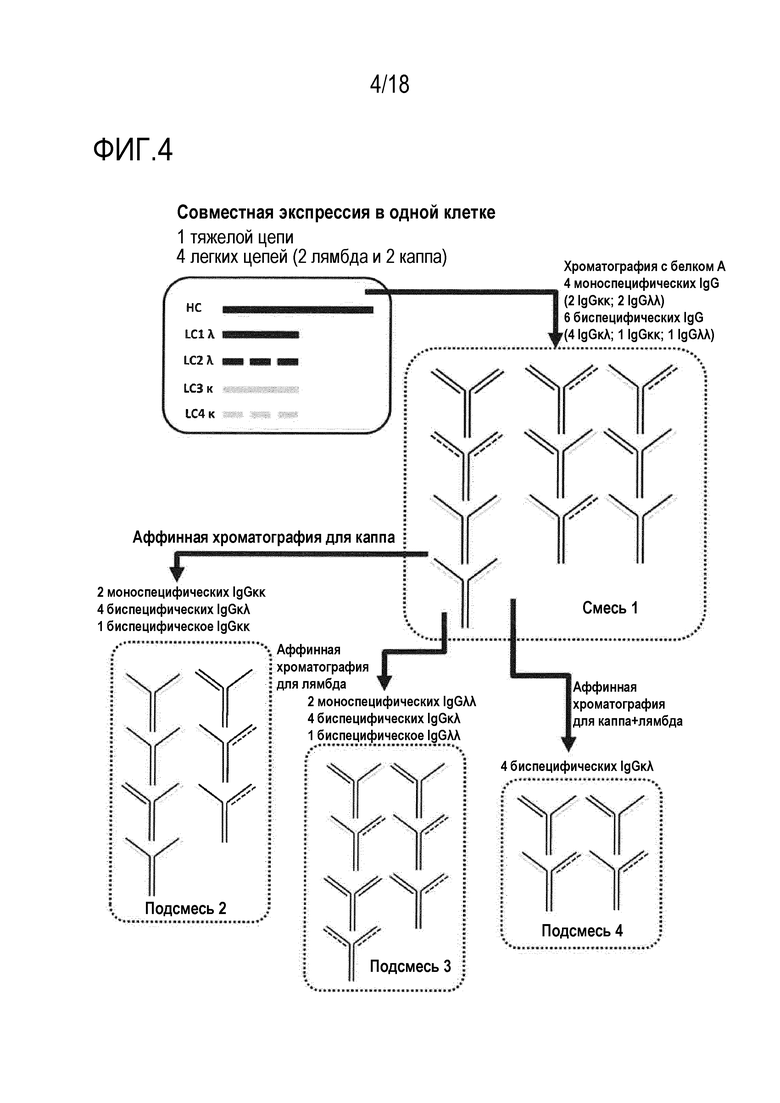
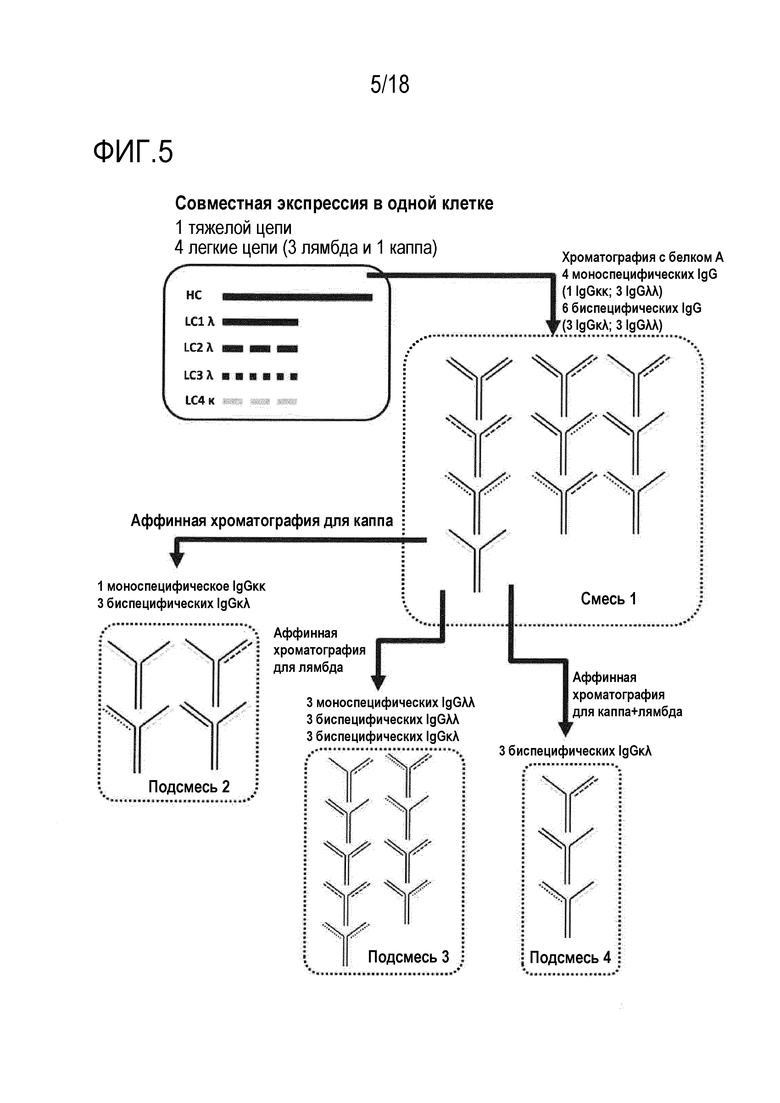
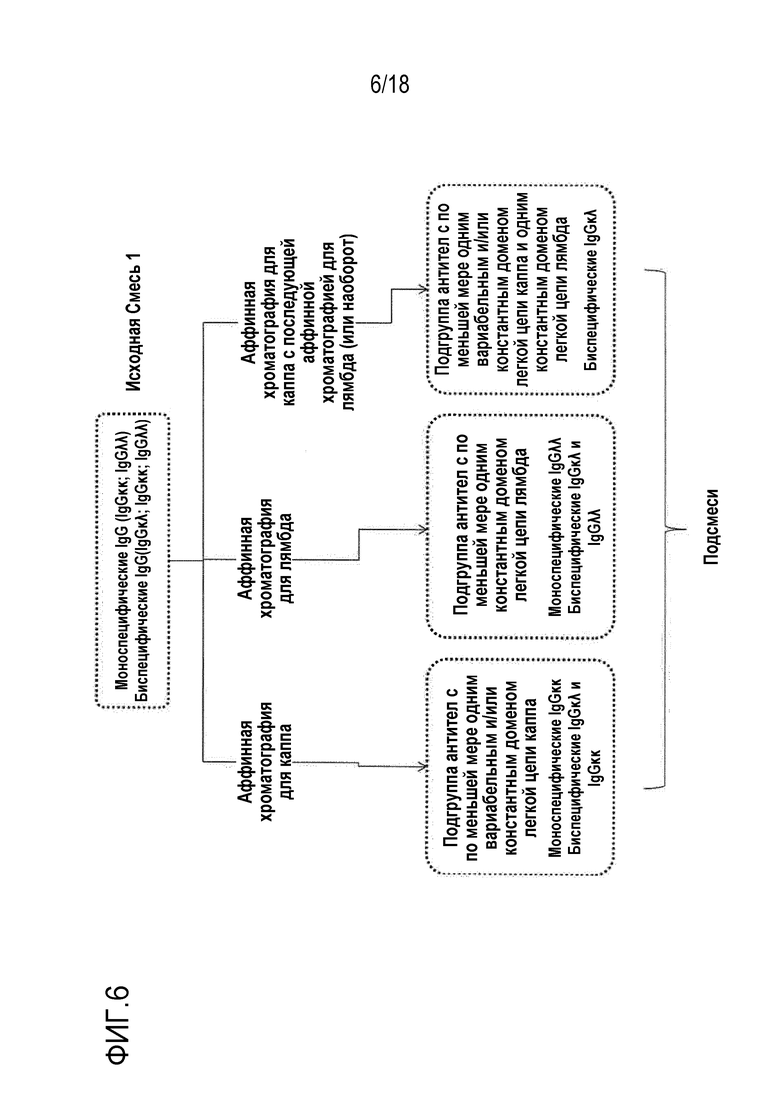
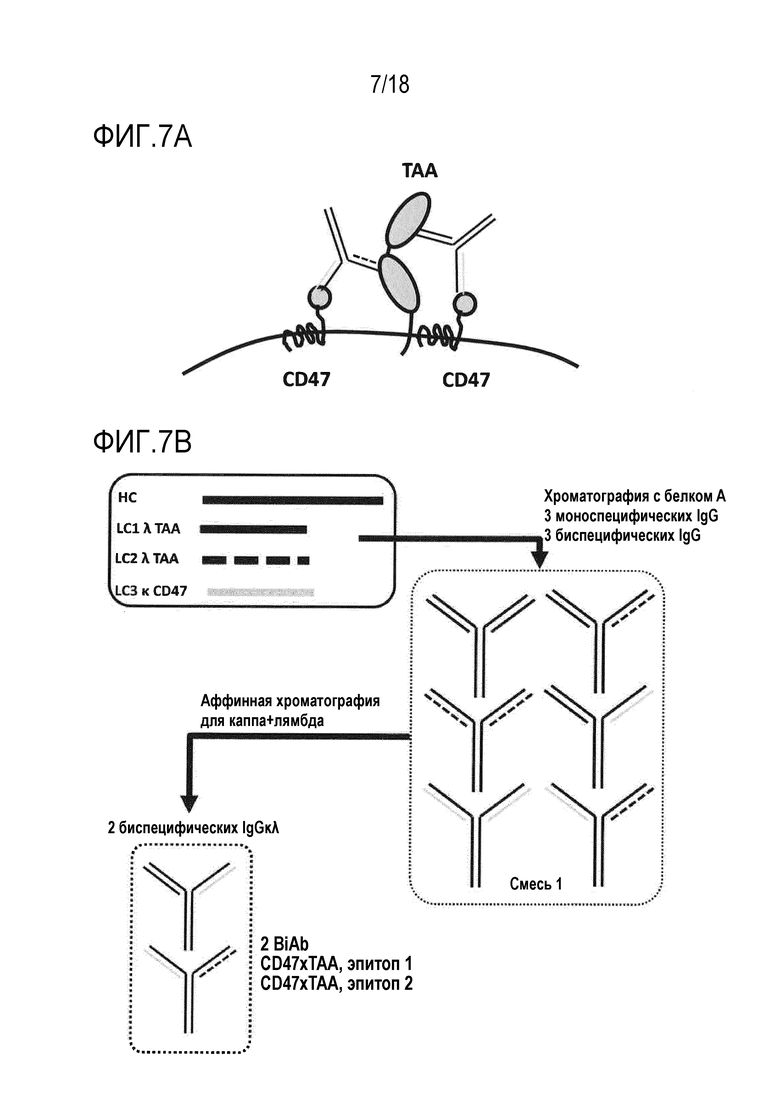
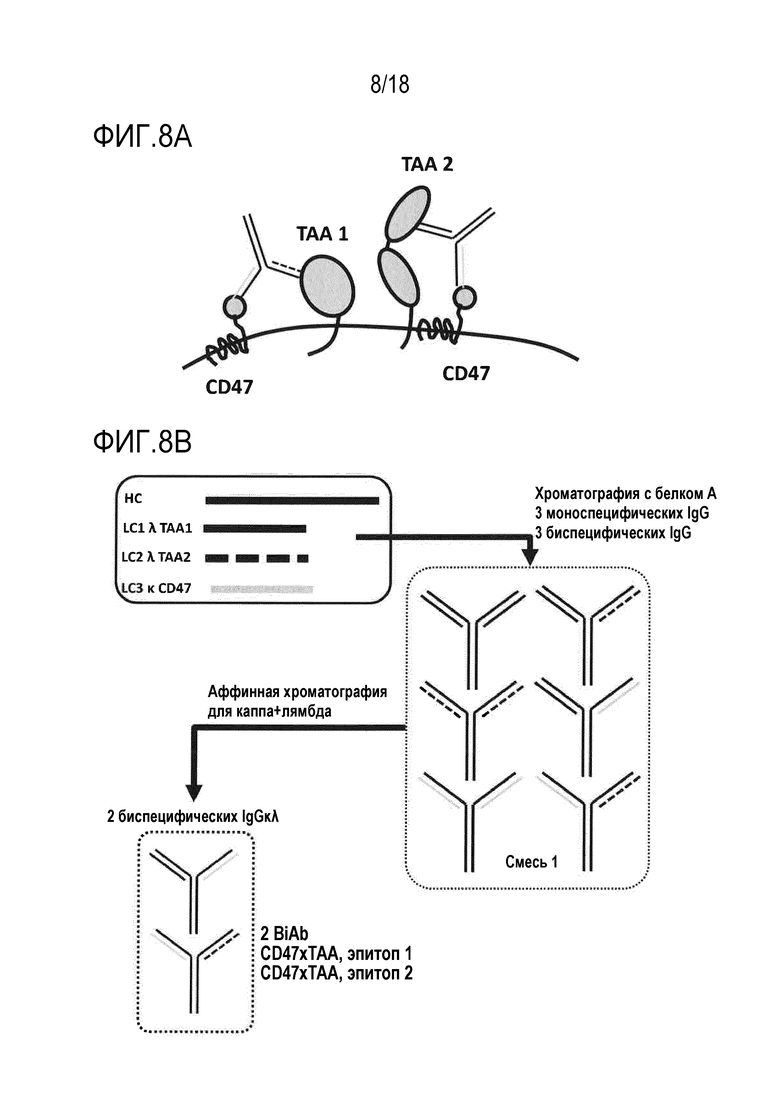
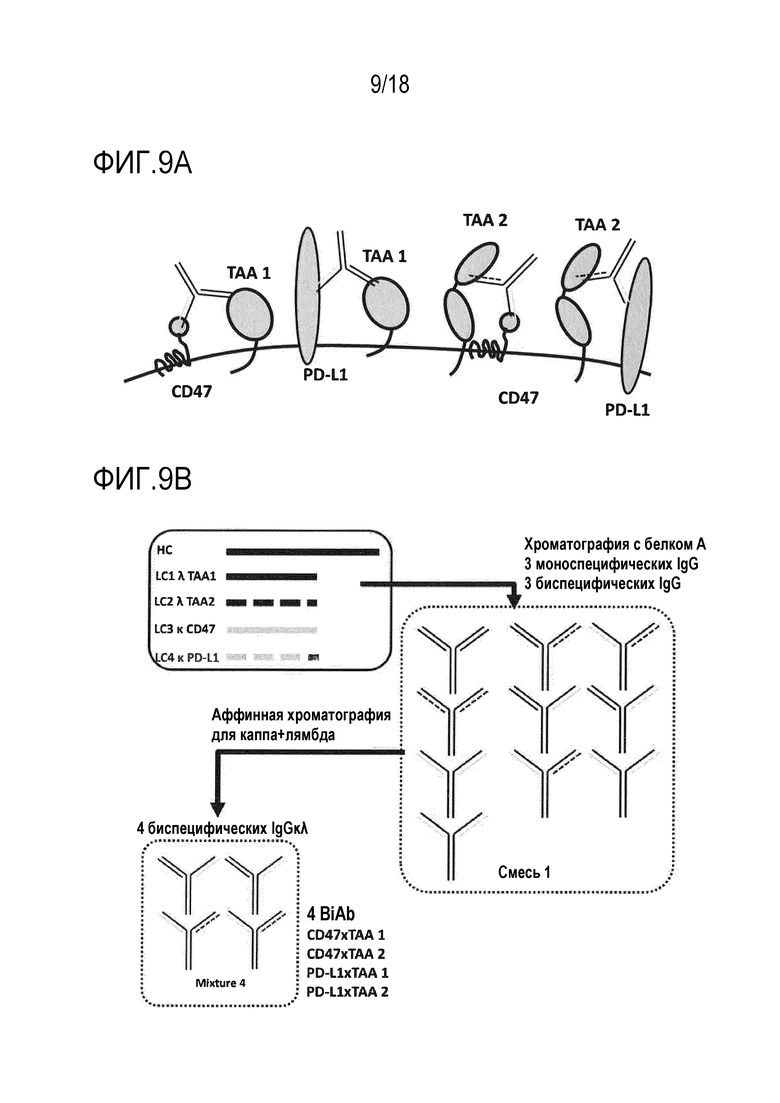
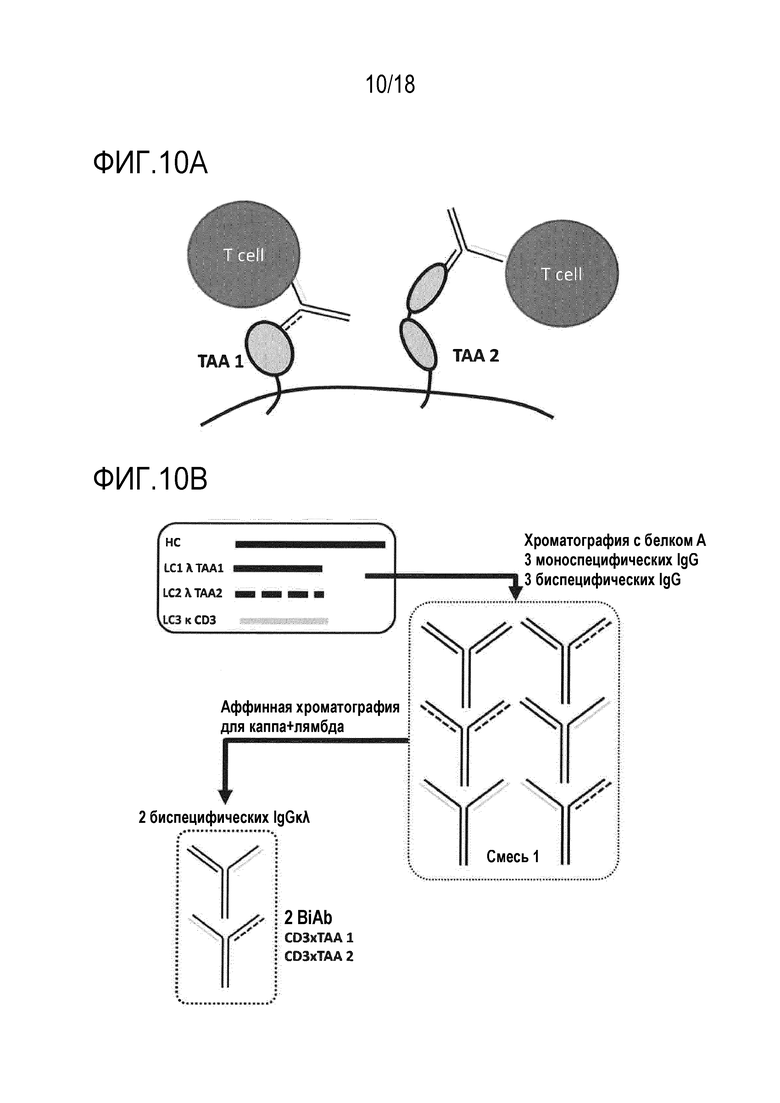
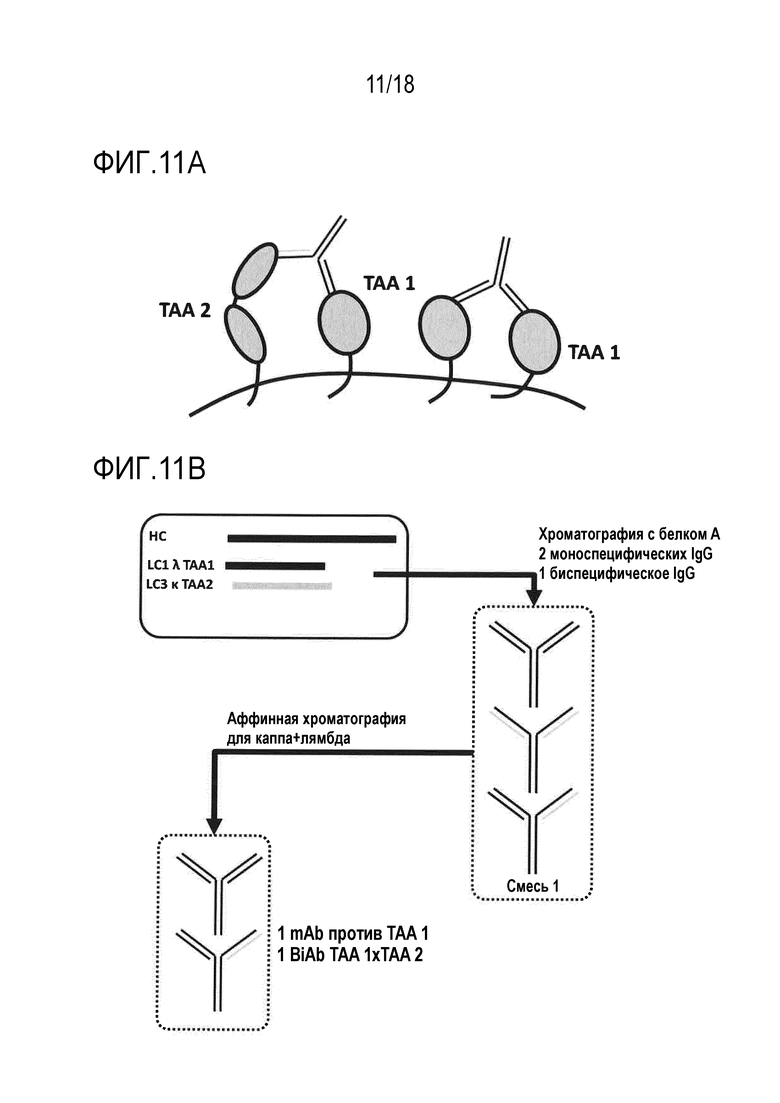
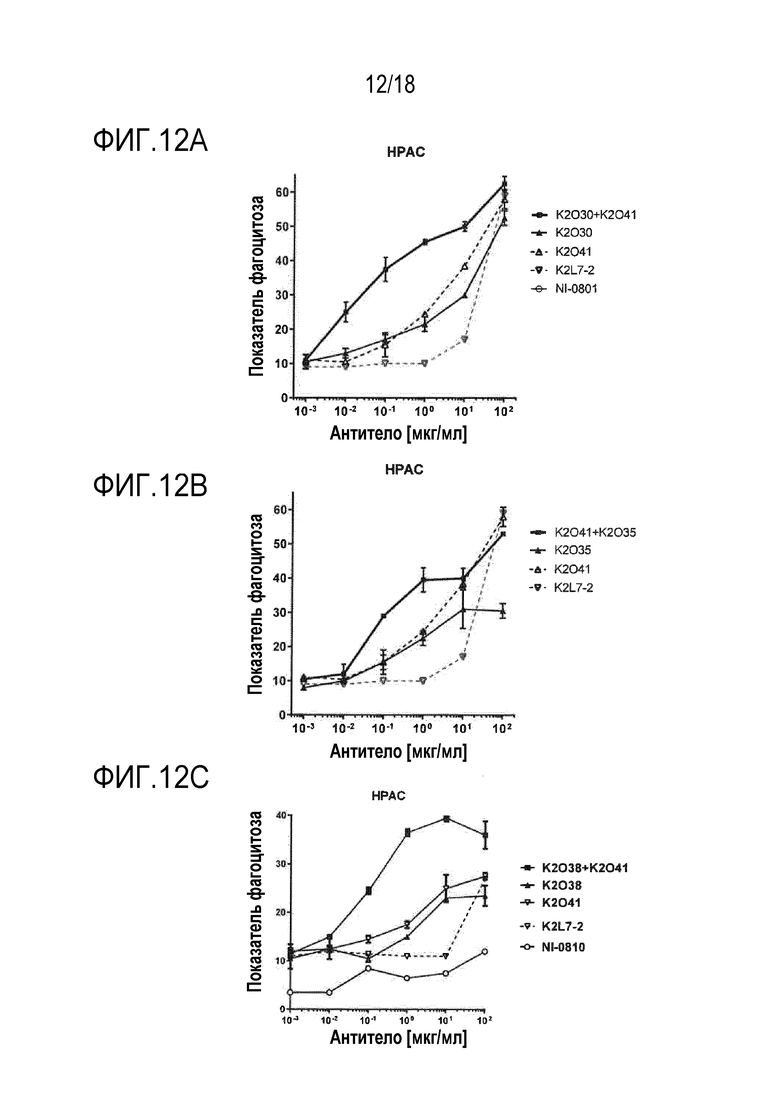
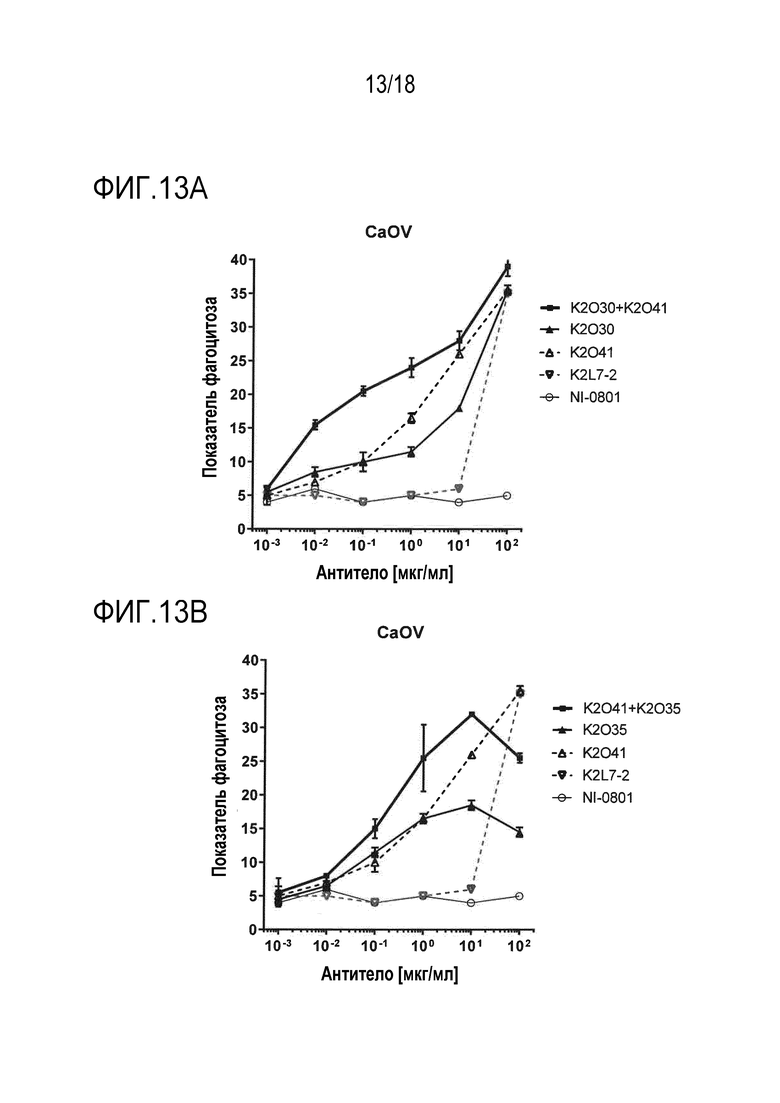
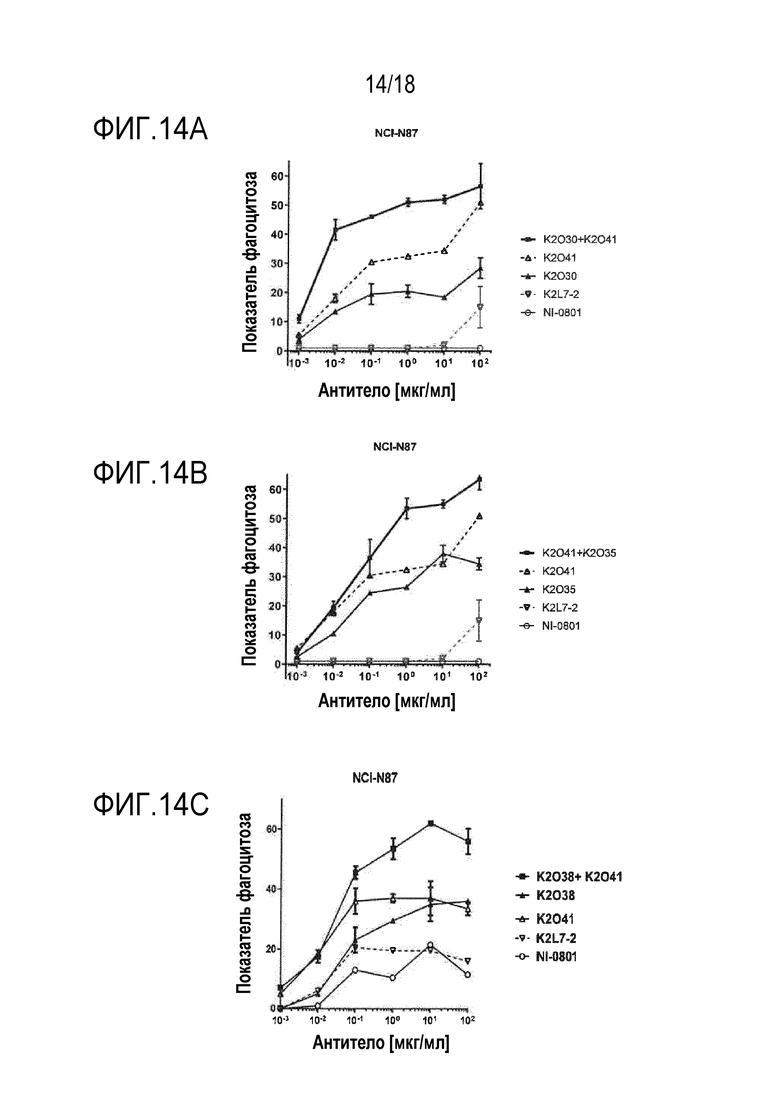
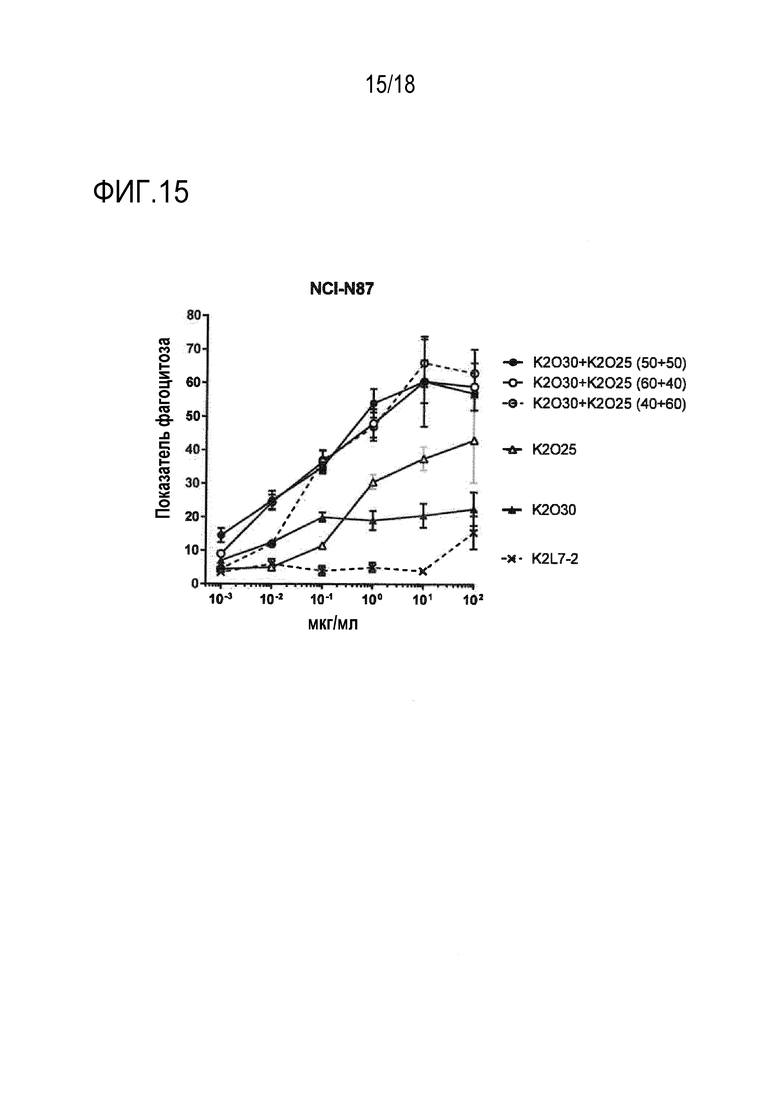
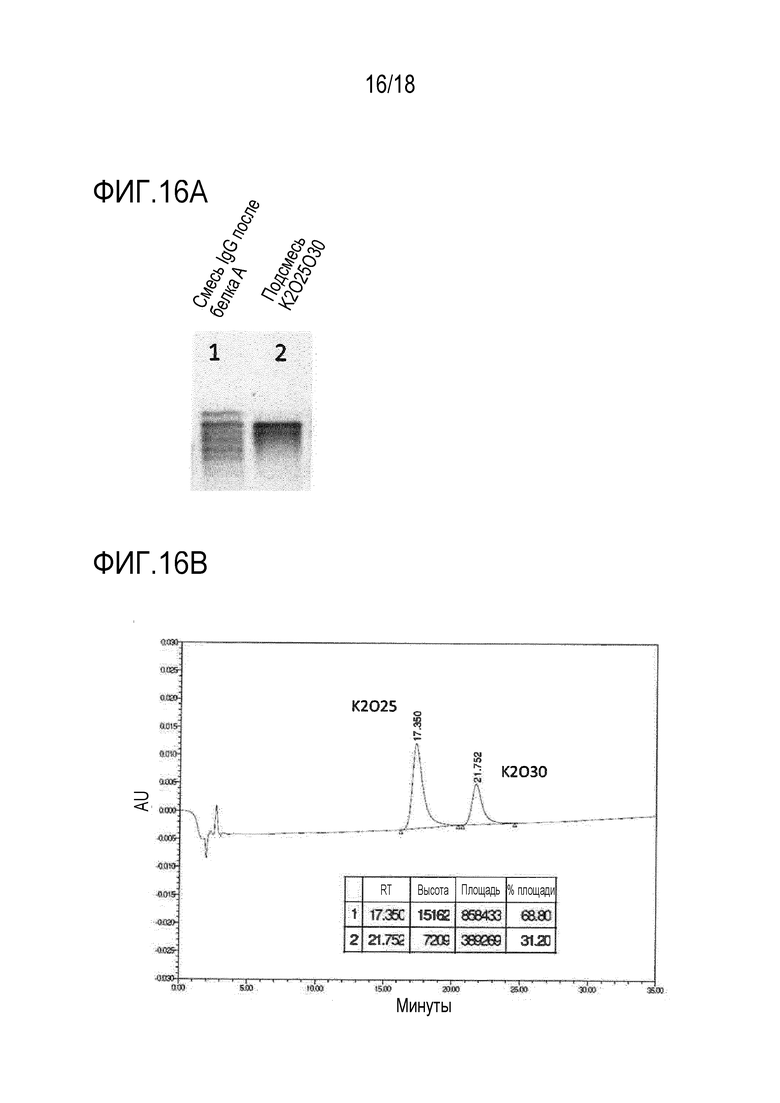
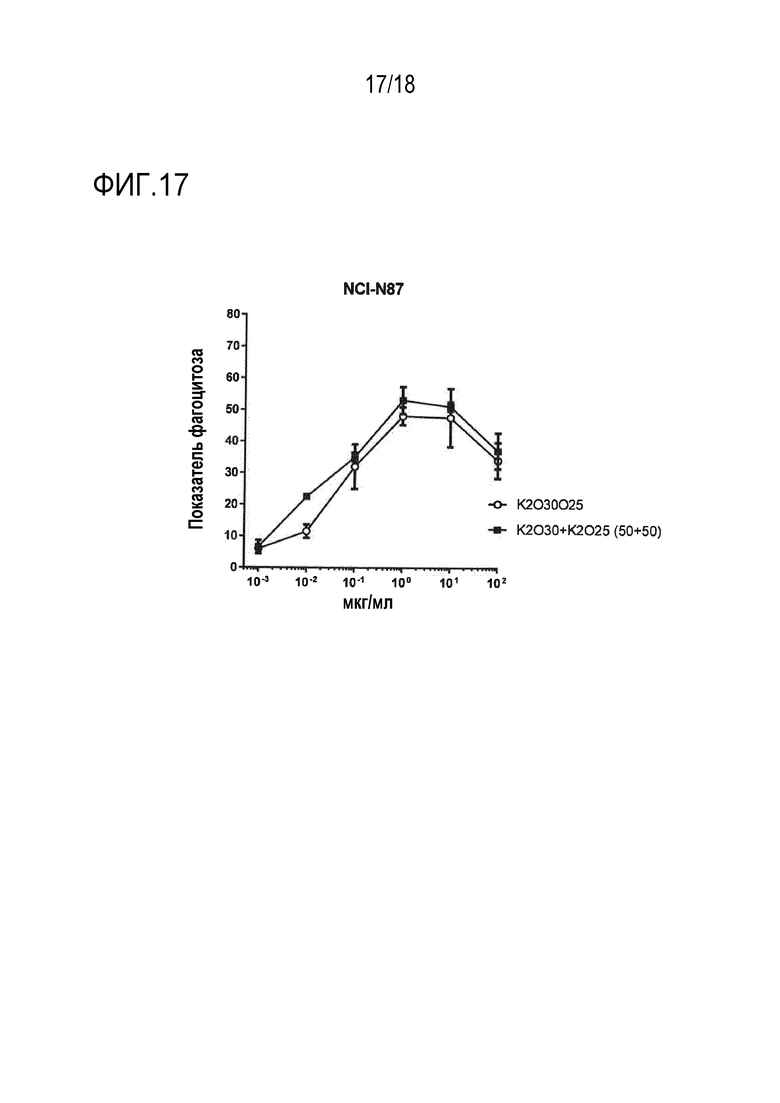
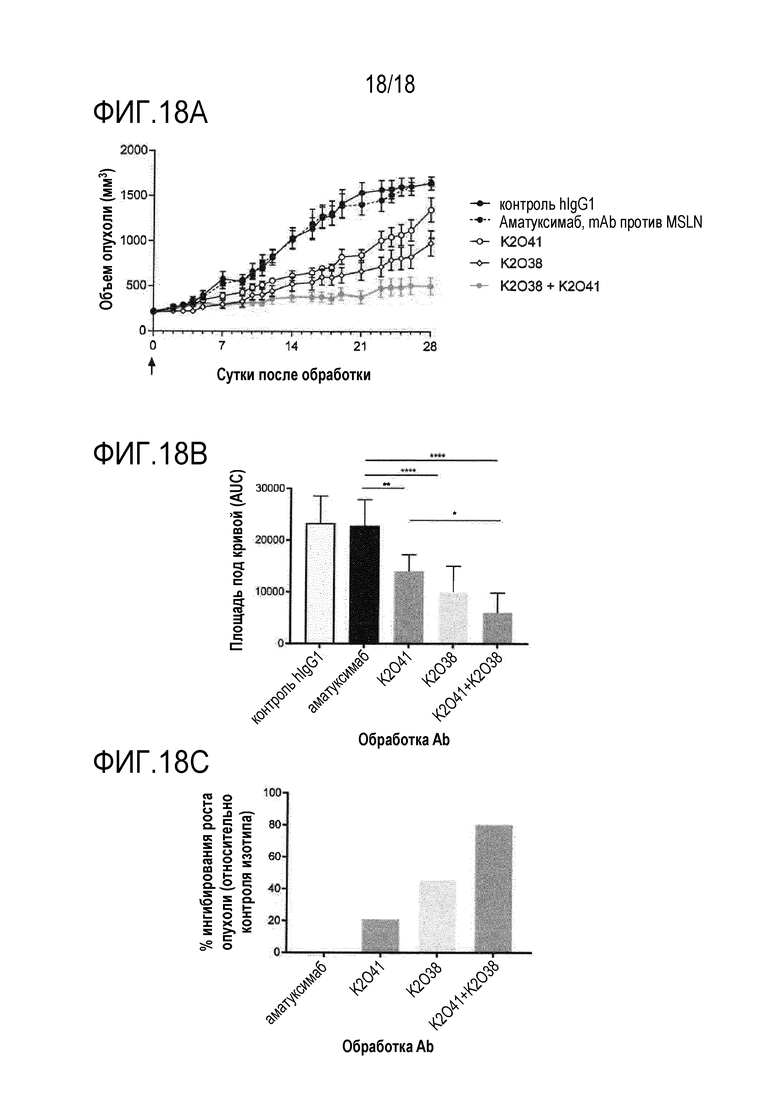
Изобретение относится к области биохимии, в частности к способу выделения подгруппы антител. Изобретение позволяет эффективно получать подгруппу антител. 2 з.п. ф-лы, 8 пр., 4 табл., 18 ил.
1. Способ выделения подгруппы антител:
а) культивирование единственной клеточной линии, способной к экспрессии:
i) одной тяжелой цепи иммуноглобулина; и
ii) трех легких цепей иммуноглобулина, где по меньшей мере одна легкая цепь является легкой цепью каппа и по меньшей мере одна легкая цепь является легкой цепью лямбда,
для получения смеси антител из трех или более моноспецифических антител и трех или более биспецифических антител;
b) очистка подгруппы антител из смеси антител с помощью по меньшей мере двух стадий аффинной хроматографии, где по меньшей мере две стадии аффинной очистки включают стадию очистки с использованием среды для аффинной хроматографии белка А, за которой следует:
i) среда для аффинной хроматографии, специфичная для константного домена каппа; или
ii) среда для аффинной хроматографии, специфичная для константного домена лямбда, или
iii) комбинация сред аффинной хроматографии (i) и (ii), в которой среды аффинной хроматографии (i) и (ii) используют в любом порядке, тем самым выделяя подгруппу антител,
1) где, если единственная клеточная линия экспрессирует:
а) легкую цепь иммуноглобулина, содержащую по меньшей мере часть легкой цепи каппа, и две легкие цепи иммуноглобулина, содержащие по меньшей мере часть легкой цепи лямбда; или
b) легкую цепь иммуноглобулина, содержащую по меньшей мере часть легкой цепи лямбда, и две легкие цепи иммуноглобулина, содержащие по меньшей мере часть легкой цепи каппа,
то очистку подгруппы антител из смеси антител проводят с использованием:
I) среды для аффинной хроматографии, специфичной для константного домена каппа, где очищенная подгруппа антител состоит из:
i) одного моноспецифического антитела и двух биспецифических антител; или
ii) двух моноспецифических антител и трех биспецифических антител;
все содержат по меньшей мере часть легкой цепи каппа; или
II) среды для аффинной хроматографии, специфичной для константного домена лямбда, где очищенная подгруппа антител состоит из:
i) одного моноспецифического антитела и двух биспецифических антител; или
ii) двух моноспецифических антител и трех биспецифических антител; все содержат по меньшей мере часть легкой цепи лямбда; или
III) среды для аффинной хроматографии, специфичной для константного домена каппа, и среды для аффинной хроматографии, специфичной для константного домена лямбда, где очищенная подгруппа антител состоит из двух биспецифических антител, каждое из которых содержит по меньшей мере часть легкой цепи каппа и по меньшей мере часть легкой цепи лямбда; или
2) где, если единственная клеточная линия экспрессирует:
а) легкую цепь иммуноглобулина, содержащую по меньшей мере часть легкой цепи каппа, и три легкие цепи иммуноглобулина, содержащие по меньшей мере часть легкой цепи лямбда; или
b) легкую цепь иммуноглобулина, содержащую по меньшей мере часть легкой цепи лямбда, и три легкие цепи иммуноглобулина, содержащие по меньшей мере часть легкой каппа-цепи; или
c) две легкие цепи иммуноглобулина, содержащие по меньшей мере часть легкой цепи каппа, и две легкие цепи иммуноглобулина, содержащие по меньшей мере часть легкой цепи лямбда;
то очистку подгруппы антител проводят с использованием:
I) среды для аффинной хроматографии, специфичной для константного домена каппа, где очищенная подгруппа антител состоит из:
i) одного моноспецифического антитела и трех биспецифических антител; или
ii) трех моноспецифических антител и шести биспецифических антител; или
iii) двух моноспецифических антител и пяти биспецифических антител;
все содержат по меньшей мере часть легкой каппа-цепи; или
II) среды для аффинной хроматографии, специфичной для константного домена лямбды, где очищенная подгруппа антител состоит из:
i) одного моноспецифического антитела и трех биспецифических антител; или же
ii) трех моноспецифических антител и шести биспецифических антител; или
iii) двух моноспецифических антител и пяти биспецифических антител;
все содержат по меньшей мере часть легкой цепи лямбда; или
III) среды для аффинной хроматографии, специфичной для константного домена каппа, и среды для аффинной хроматографии, специфичной для константного домена лямбда, где очищенная подгруппа антител состоит из трех или четырех биспецифических антител, каждое из которых содержит по меньшей мере часть легкой цепи каппа и по меньшей мере часть легкой цепи лямбда.
2. Способ по п.1, где подгруппа антител содержит моноспецифические и биспецифические антитела.
3. Способ по п.1, где подгруппа антител содержит антитело, которое связывается с другим эпитопом того же антигена.
| WO 2015024896 A1, 26.02.2015 | |||
| US 2016264685 A1, 15.09.2016 | |||
| АНТИТЕЛА И ДРУГИЕ МОЛЕКУЛЫ, КОТОРЫЕ СВЯЗЫВАЮТ В7-Н1 И PD-1 | 2012 |
|
RU2625034C2 |
Авторы
Даты
2024-03-22—Публикация
2018-07-23—Подача