ОБЛАСТЬ ТЕХНИКИ
В настоящем документе описана кристаллическая форма гидрохлорида LNP023 и способ ее получения. Также в настоящем документе описана фармацевтическая композиция, содержащая кристаллическую форму гидрохлорида LNP023 и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
Фармацевтическая композиция, описанная в настоящем документе, может быть использована для лечения заболевания или расстройства, опосредованного активацией комплемента.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
LNP023 относится к классу ингибиторов фактора В пути комплемента и действует посредством ингибирования или подавления амплификации системы комплемента, вызванной активацией С3, независимо от первоначального механизма активации. В настоящее время он разрабатывается для лечения или профилактики пароксизмальной ночной гемоглобинурии (PNH), С3-гломерулопатии (C3G), иммуноглобулиновой А нефропатии (IgAN) и мембранозной нефропатии (MN). Гидрохлорид LNP023 химически обозначается как гидрохлорид 4-((2S,4S)-(4-этокси-1-((5-метокси-7-метил-1H-индол-4-ил)метил)пиперидин-2-ил))бензойной кислоты и может быть представлен следующей химической структурой в соответствии с формулой (А),
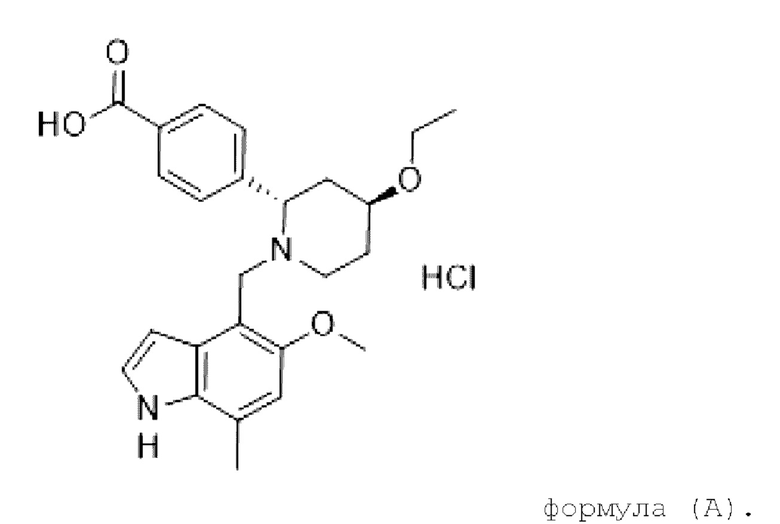
Гидрохлорид LNH023 и способы его получения раскрыты в W0 2015/009616, который включен в настоящий документ посредством ссылки во всей своей полноте. В примере 26d из WO 2015/009616 гидрохлорид LNP023 получают в виде кристаллического твердого вещества посредством перекристаллизации полученного аморфного материала и характеризуют с помощью рентгеновской порошковой дифракции. Эта кристаллическая форма обозначена в настоящем документе как форма А.
Различные твердые формы активного фармацевтического ингредиента часто имеют различные свойства. Различия в физико-химических свойствах твердых форм могут играть решающую роль для улучшения фармацевтических композиций, например,
фармацевтические композиции с улучшенным профилем растворения, или с улучшенной стабильностью, или сроком хранения могут стать доступными благодаря улучшенной твердой форме активного фармацевтического ингредиента. Кроме того, можно улучшить обработку или обращение с активным фармацевтическим ингредиентом в процессе разработки рецептуры и производства. Таким образом, новые твердые формы активного фармацевтического ингредиента могут иметь требуемые свойства при обработке. Они могут быть проще в обращении, лучше подходят для хранения или обеспечивают лучшую очистку по сравнению с ранее известными твердыми формами.
Кристаллическая «форма А» LNP023 HCl из WO 2015/009616 имеет определенные свойства, которые делают ее менее подходящей для крупномасштабного производственного процесса. В связи с этим требуется более стабильная форма LNP023 HCl.
Таким образом, существует необходимость в предоставлении твердой формы гидрохлорида LNP023, которая имеет физико-химические свойства, позволяющие надежно производить безопасный и эффективный лекарственный продукт, содержащий гидрохлорид LNP023.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Раскрытие предоставляет кристаллическую гидратную форму гидрохлорида LNP023, которая далее также упоминается как «форма НВ». «Форма НВ» гидрохлорида LNP02 3 имеет благоприятные физико-химические свойства для лекарственного вещества, предназначенного для использования в твердой дозированной форме для перорального применения.
Преимущественные свойства формы НВ препарата LNP023 включают химическую стабильность, физическую стабильность, гигроскопичность, растворимость, растворение, морфологию, кристалличность, текучесть, уплотняемость и смачиваемость. В результате эти свойства делают форму НВ пригодной для крупномасштабных производственных процессов.
В одном из вариантов осуществления форма НВ представляет собой фазово чистую высококристаллическую форму гидрохлорида LNP023, физически и химически стабильную во время фармацевтической обработки и хранения. Форма НВ является термодинамически более стабильной формой, и потенциальное превращение в другие формы может быть сведено к минимуму. Форма А при определенных условиях может превращаться в форму НВ. Использование термодинамически стабильной формы соединения высоко ценится, поскольку превращения, например, из формы А в форму НВ или полиморфные превращения, которые могут происходить в процессе производства и хранения лекарственного вещества, могут быть исключены, если используется наиболее стабильная форма. Это обеспечивает надежную биодоступность и, следовательно, постоянную эффективность лекарственного продукта.
Сокращения
PXRD порошковая рентгеновская дифракция
SXRD единичная кристаллическая рентгеновская дифракция
FTIR инфракрасное преобразование Фурье
ATR ослабленное полное отражение
DSC дифференциальная сканирующая калориметрия
DVS динамическая сорбция паров
TGA термогравиметрический анализ
MS масс-спектрометрия
NMR ядерный магнитный резонанс
GC газовая хроматография
KF Карл-Фишер
RH относительная влажность
к. т. комнатная температура
вес. % весовые проценты
об. % объемные проценты.
Определения
В контексте раскрытия следующие определения имеют указанные значения, если прямо не указано иное:
Используемый в настоящем документе термин «комнатная температура» относится к температуре в диапазоне от 20 до 30°С.
Используемый в настоящем документе термин «измеренный при температуре в диапазоне от 20 до 30°С» относится к измерению в стандартных условиях. Обычно под стандартными условиями подразумевается температура в диапазоне от 20 до 30°С, т.е. при комнатной температуре. Стандартные условия могут означать температуру приблизительно 22°С.
Используемый в настоящем документе термин «форма НВ», когда описывает твердую форму гидрохлорида LNP023, относится к конкретной кристаллической гидратной форме гидрохлорида LNP023, например моногидратной форме. Эта форма дополнительно определена в настоящем документе и формуле изобретения.
Используемый в настоящем документе термин «форма А», когда описывает твердую форму гидрохлорида LNP023, относится к конкретной кристаллической форме гидрохлорида LNP023, как раскрыто в W0 2015/009616. Форма А гидрохлорида LNP023 может характеризоваться порошковой рентгеновской дифрактограммой, содержащей пики при значениях угла 2-тета (11,6±0,1)°, (15,3±0.1)°, (16,5±0,1)°, (20,1±0,1)° и (23,3±0,1)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
Форма А получена согласно WO 2015/009616 следующим образом (см. пример 26d):
К раствору 4-((2S,4S)-(4-этокси-1-((5-метокси-7-метил-1H-индол-4-ил)метил) пиперидин-2-ил))бензойной кислоты (620 мг, 1, 467 ммоль) в H2O/CH3CN (10/3 мл) добавляли 5 М водн. HCl (500 мкл, 2,500 ммоль). Реакционную смесь затем лиофилизировали с получением аморфного соединения, которое затем суспендировали в iPrOH (300 мл). Суспензию нагревали до 70°С. Суспензия превращалась в раствор после 1,5 ч. Раствор затем охлаждали до комнатной температуры при перемешивании в течение прибл. 5 ч с получением твердого вещества. Полученное твердое вещество собирали фильтрованием и сушили при высоком вакууме при 5 0°С с получением указанного в заголовке соединения в виде кристаллического твердого вещества. 1Н ЯМР (HCl соль, 400 МГц, CD3OD) δ 10,73 (br. s., 1Н), 8,23 (d, J=8,44 Гц, 2Н), 7,74 (d, J=8,44 Гц, 2Н), 7,31-7,36 (m, 1Н), 6,77 (s, 1Н), 6.37 (dd, J=1,77, 3,12 Гц, 1Н), 4,33 (d, J=12,72 Гц, 1Н), 4,25 (d, J=12,72 Гц, 1Н), 3,79-3,85 (m, 1Н), 3,76 (s, 3Н), 3,51-3,67 (m, 4Н), 3,37-3,44 (m, 1Н), 2,51 (s, 3Н), 2,21-2,29 (m, 2Н), 1,90-2,15 (m, 2Н), 1,31 (t, J=6,97 Гц, 3Н).
Рентгеновская порошковая дифрактограмма описана ниже в таблице 1.


Термин «отражение» применительно к порошковой рентгеновской дифракции, используемый в настоящем документе, означает пики на рентгеновской дифрактограмме, которые возникают при определенных углах дифракции (углах Брэгга) в результате конструктивной интерференции от рентгеновских лучей, рассеянных параллельными плоскостями атомов в твердом материале, которые распределены в упорядоченной и повторяющейся схеме в дальнем позиционном порядке. Такой твердый материал классифицируется как кристаллический материал, тогда как аморфный материал определяется как твердый материал, в котором отсутствует дальний порядок, а проявляется только ближний порядок, что приводит к широкому рассеянию. Согласно литературным данным дальний порядок, например, распространяется приблизительно на 100-1000 атомов, тогда как ближний порядок распространяется только на несколько атомов (см. «Fundamentals of Powder Diffraction and Structural Characterization of Materials» by Vitalij K. Pecharsky and Peter Y. Zavalij, Kluwer Academic Publishers, 2003, page 3).
Термин «по существу такой же» относительно порошковой рентгеновской дифракции означает, что необходимо учитывать вариации в положениях пиков и относительной интенсивности пиков. Например, типичная точность значений 2-тета находится в диапазоне ±0,2° 2-тета, например, в диапазоне ±0,1° 2-тета. Таким образом, пик, который обычно появляется при 9,2° 2-тета, например, может появиться между (9,2-0,2)° и (9,2±0,2)° 2-тета, например, между (9,2-0,1)° и (9,2±0,1)° 2-тета на большинстве рентгеновских дифрактометров при стандартных условиях. Кроме того, специалисты в данной области техники оценят, что относительная интенсивность пиков будет отличаться в зависимости от аппарата, а также в зависимости от степени кристалличности, предпочтительной ориентации, размера частиц, подготовки образца и других факторов, известных специалистам в данной области техники, и должна рассматриваться только как качественная мера.
Термин «по существу такой же» относительно инфракрасной спектрометрии означает, что необходимо учитывать вариации в положениях пиков и относительной интенсивности пиков. Например, типичная точность значений волнового числа находится в диапазоне ±4 см-1, например, в диапазоне ±2 см-1. Таким образом, пик при 1692 см-1, например, может появиться между (1692-4) и (1692±4) см-1, например, между (1692-2) и (1692±2) см-1 на большинстве инфракрасных спектрометров при стандартных условиях.
Интенсивность пиков может быть получена из соответствующих рисунков, но специалист в данной области техники оценит, что различия в интенсивности пиков, обусловленные степенью кристалличности, подготовкой образца, способом измерения и другими факторами, также могут иметь место в инфракрасной спектроскопии. Поэтому интенсивность пиков следует воспринимать только как качественный показатель.
Форма НВ гидрохлорида LNP023, описанная в настоящем документе, может быть упомянута в настоящем документе как характеризующаяся графическими данными, «как показано на» фигуре. Такие данные включают, например, порошковую рентгеновскую дифракцию и FTIR. Специалист в данной области техники понимает, что такие факторы, как изменения типа прибора, отклик и изменения направленности пробы, концентрация пробы и чистота пробы, могут привести к небольшим изменениям таких данных, если они представлены в графической форме, например, изменениям, относящимся к точному положению и интенсивности пиков. Однако сравнение графических данных на фигурах в данном документе с графическими данными, полученными для другой или неизвестной твердой формы, и подтверждение того, что два набора графических данных относятся к одной и той же кристаллической форме, являются общеизвестными специалисту в данной области техники.
Используемые в настоящем документе термины «твердая форма» или «твердое состояние» взаимозаменяемо относятся к любой кристаллической или аморфной фазе соединения.
Используемый в настоящем документе термин «аморфный» относится к твердой форме соединения, которое не является кристаллическим. Аморфное соединение не имеет дальнего порядка и не демонстрирует определенную картину рентгеновской дифракции с пиками.
В настоящем документе термин «полиморф» относится к кристаллическим формам, имеющим одинаковый химический состав, но различное пространственное расположение молекул, атомов или ионов, образующих кристалл.
Термин «сокристалл», используемый в настоящем документе, относится к кристаллическому материалу, содержащему два или более различных молекулярных или ионных соединений в одной кристаллической решетке, которые связаны неионными и нековалентными связями, где по меньшей мере два из отдельных молекулярных или ионных соединений являются твердыми при комнатной температуре.
Термин «гидрат», используемый в настоящем документе, относится к твердому кристаллическому веществу, в котором вода либо взаимодействует с кристаллической структурой, либо заполняет ее, например, является частью кристаллической структуры или заключена в кристалл (водные включения). Таким образом, вода может присутствовать в стехиометрическом или нестехиометрическом количестве. Если вода присутствует в стехиометрическом количестве, гидрат может обозначаться добавлением греческих числовых префиксов. Например, гидрат может называться полугидратом или моногидратом, в зависимости от стехиометрии воды/соединения. Содержание воды можно измерить, например, с помощью кулонометрии по Карлу Фишеру.
Используемые в настоящем документе термины «дегидратировать» или «дегидратация» описывают по меньшей мере частичное удаление воды из кристаллической структуры молекулы хозяина.
Термин «сольват», используемый в настоящем документе, относится к кристаллическому твердому телу, в котором один или несколько органических растворителей взаимодействуют или размещаются в кристаллической структуре, например, являются частью кристаллической структуры или включены в кристалл (включения растворителя). Таким образом, один или несколько органических растворителей могут присутствовать в стехиометрическом или нестехиометрическом количестве. Если один или несколько органических растворителей присутствуют в стехиометрическом количестве, сольват может обозначаться добавлением греческих цифровых префиксов. Например, сольват может называться гемисольватом или моносольватом, в зависимости от стехиометрии растворителя(растворителей) / соединения.
Содержание растворителя может быть измерено, например, с помощью GC, NMR, SXRD или TGA/MS.
Термин «изоструктурный сольват», используемый в настоящем документе, относится к сольватам, имеющим ту же пространственную группу с небольшими искажениями размеров элементарной ячейки и тот же тип молекулярной сети молекулы-хозяина. Изоструктурные сольваты, как определено в настоящем документе, отличаются типом органического растворителя (растворителей), присутствующего в качестве гостевой молекулы (молекул).
Используемые в настоящем документе термины «десольватировать» или «десольватация» описывают по меньшей мере частичное удаление органического растворителя из кристаллической структуры молекулы хозяина.
Используемые в настоящем документе термины «безводная форма» или «безводный» относятся к кристаллическому твердому веществу, в котором вода не взаимодействует с кристаллической структурой или не вмещается в нее. Безводные формы могут по-прежнему содержать остаточную воду, которая не является частью кристаллической структуры, но может адсорбироваться на поверхности или абсорбироваться в неупорядоченных участках кристалла. Как правило, безводная форма не содержит более 3,0 вес. %, например, не более 1,0 вес. % воды, в пересчете на вес кристаллической формы.
Термин «несольватированный», используемый в настоящем документе, когда речь идет о кристаллическом твердом веществе, означает, что никакой органический растворитель не взаимодействует с кристаллической структурой или не вмещается в нее. Несольватированные формы все еще могут содержать остаточные органические растворители, которые не являются частью кристаллической структуры, но могут адсорбироваться на поверхности или абсорбироваться в неупорядоченных участках кристалла. В одном варианте осуществления несольватированная форма содержит не более 3,0 вес. %, например, не более 1,0 вес. %. В одном из вариантов осуществления несольватированная форма не содержит более 0,5 вес. % органических растворителей в пересчете на вес кристаллической формы.
Используемый в данном документе термин «маточный раствор» относится к раствору, остающемуся после кристаллизации твердого вещества из указанного раствора.
Используемый в настоящем документе термин «антирастворитель» относится к жидкостям, которые уменьшают растворимость гидрохлорида LNP023 в растворителе.
«Заранее определенное количество», используемое в настоящем документе в отношении гидрохлорида LNP023, относится к исходному количеству гидрохлорида LNP023, используемому для получения фармацевтической композиции с требуемой дозировкой гидрохлорида LNP023.
Термин «терапевтически эффективное количество», используемый в настоящем документе в отношении гидрохлорида LNP023, охватывает количество гидрохлорида LNP023, которое вызывает требуемый терапевтический или профилактический эффект.
Используемый в настоящем документе термин «негигроскопичный» относится к увеличению массы (за счет поглощения воды) менее чем на 0,2% при 80% RH при 25°С в пересчете на вес соединения.
Термин «равносторонний», используемый в настоящем документе в отношении формы кристаллов, относится к равноразмерным кристаллам, таким как кубы или сферы.
Термины «пластина» или «пластиноподобный», используемые в настоящем документе в отношении формы кристаллов, относятся к плоским таблитчатым кристаллам, имеющим сходную ширину и толщину больше, чем у хлопьев.
Термины «хлопья» или «хлопьеподобный», используемые в настоящем документе в отношении формы кристаллов, относятся к тонким плоским кристаллам, имеющим сходные ширину и толщину меньше, чем у пластин.
Термины «игольчатый» или «иглоподобный», используемые в настоящем документе в отношении формы кристаллов, относятся к остроконечным тонким и сильно вытянутым кристаллам, имеющим сходную толщину и ширину.
Термин «столбики» или «столбчатый», используемый в настоящем документе взаимозаменяемо в отношении формы кристаллов, относится к вытянутым призматическим кристаллам, имеющим большую ширину и толщину, чем иглы.
Такие определения габитусов кристалла соответствуют тем, которые обычно используются в данной области техники, например, см. «Polymorphism in the Pharmaceutical Industry» edited by Rolf Hilfiker (Wiley-VCH, 2006); Chapter 7, Light Microscopy (Gary Nichols).
Используемый в настоящем документе термин «приблизительно» означает приблизительно, в районе, примерно или около. Когда термин «приблизительно» используется в сочетании с числовым интервалом, он изменяет этот интервал, расширяя границы выше и ниже приведенных числовых значений. В общем, термин «приблизительно» используется в настоящем документе для изменения числового значения выше и ниже заявленного значения с отклонением на 10%.
Используемый в настоящем документе термин «по существу свободный от любой другой твердой формы» применительно к композиции, содержащей конкретную твердую форму гидрохлорида LNP023, означает, что композиция включает не более 20 вес. % (весовых процентов), не более 15 вес. %, не более 10 вес. %, не более 9 вес. %, не более 8 вес. %, не более 7 вес. %, не более 6 вес. %, не более 5 вес. %, не более 4 вес. %, не более 3 вес. %, не более 2 вес. %, не более 1 вес. %, не более 0,5 вес. %, или максимум 0,1 вес. %, или любой весовой процент от 80 до 100 вес. % любой другой твердой формы гидрохлорида LNP023 в пересчете на вес композиции.
Используемый в настоящем документе «практически чистый», когда используется в отношении формы, означает соединение, имеющее чистоту более 90 вес. %, включая более 90, 91, 92, 93, 94, 95, 96, 97, 98 и 99 вес. %, а также включая равную приблизительно 100 вес. % конкретной твердой формы гидрохлорида LNP023 в пересчете на вес соединения. Оставшийся материал содержит другую форму(-ы) соединения, или примеси реакции, или примеси обработки, возникающие при его получении. Например, кристаллическая форма гидрохлорида LNP023 может считаться по существу чистой, если она имеет чистоту более 90 вес. %, как измерено способами, которые в настоящее время известны и общеприняты в данной области техники, где оставшиеся менее 10 вес. % материала содержат другую форму(-ы) гидрохлорида LNP023, примеси реакции или примеси обработки.
Используемый в настоящем документе термин «субъект» подразумевает человека. В качестве примера субъекты человека включают пациента (далее - пациент), страдающего расстройством, например, расстройством, описанным в настоящем документе, или нормального субъекта.
Термин «физически стабильный», используемый в настоящем документе, означает, что конкретное свободное основание или солевая форма не переходит в одну или несколько различных физических форм {например, различные твердые формы, измеренные с помощью XRPD, DSC и т.д.) при воздействии определенных условий, например, комнатной температуры, влажности окружающей среды или 40°С/75% относительной влажности, в течение определенного периода времени, например, 1 дня, 2 дней, 3 дней, 1 недели, 2 недель, 1 месяца, 2 месяцев, 3 месяцев, 6 месяцев, 12 месяцев, 18 месяцев, 24 месяцев или дольше. В некоторых вариантах осуществления менее 25% формы соединения переходит в одну или несколько различных физических форм при воздействии заданных условий. В некоторых вариантах осуществления менее чем приблизительно 20%, менее чем приблизительно 15%, менее чем приблизительно 10%, менее чем приблизительно 5%, менее чем приблизительно 3%, менее чем приблизительно 1%, менее чем приблизительно 0,5% формы конкретного соединения изменяется в одну или более различных физических форм этого конкретного соединения при воздействии заданных условий. В некоторых вариантах осуществления не обнаруживаемое количество конкретной формы соединения переходит в одну или несколько различных физических форм соединения.
Термин «химически стабильный», используемый в настоящем документе, означает, что химическая структура конкретного соединения не изменяется в другое соединение (например, разлагается) при воздействии определенных условий, например, комнатной температуры, влажности окружающей среды или 40°С/75% относительной влажности, в течение определенного периода времени, например, 1 дня, 2 дней, 3 дней, 1 недели, 2 недель, 1 месяца, 2 месяцев, 3 месяцев, 6 месяцев, 12 месяцев, 18 месяцев, 24 месяцев или дольше. В некоторых вариантах осуществления менее 25% формы конкретного соединения переходит в одно или более других соединений при воздействии заданных условий. В некоторых вариантах осуществления менее чем приблизительно 20%, менее чем приблизительно 15%, менее чем приблизительно 10%, менее чем приблизительно 5%, менее чем приблизительно 3%, менее чем приблизительно 1%, менее чем приблизительно 0,5% формы конкретного соединения изменяется в одно или более других соединений при воздействии заданных условий. В некоторых вариантах осуществления не обнаруживаемое количество формы конкретного соединения переходит в одну или более различных физических форм этого конкретного соединения.
Используемый в настоящем документе термин «фармацевтически приемлемое вспомогательное вещество» относится к веществам, которые не проявляют значительную фармакологическую активность при введенной дозе и которые добавляются в фармацевтическую композицию в дополнение к активному фармацевтическому ингредиенту. Вспомогательные вещества могут выполнять, среди прочего, функцию носителя, разбавителя, разделительного средства, разрыхлителя, модифицирующего средства, способствующего растворению, усилителя абсорбции, стабилизатора или технологической добавки. Вспомогательные вещества могут включать наполнители (разбавители), связующие, разрыхлители, смазывающие вещества и вещества, способствующие скольжению.
Используемые в данном документе термины «наполнитель» или «разбавитель» относятся к веществам, которые используются для разбавления активного фармацевтического ингредиента перед доставкой. Разбавители и наполнители также могут служить стабилизаторами.
Используемый в настоящем документе, термин «связующее» относится к веществам, которые связывают активный фармацевтический ингредиент и фармацевтически приемлемое вспомогательное вещество вместе для поддержания связности и дискретности порций.
Термины «разрыхлитель» или «разрыхляющее вещество», используемые в настоящем документе, относятся к веществам, которые при добавлении к твердой фармацевтической композиции облегчают ее разрушение или распадаемость после введения и позволяют высвободить активный фармацевтический ингредиент как можно эффективнее, чтобы обеспечить его быстрое растворение.
Термин «смазывающее вещество», используемый в настоящем документе, относится к веществам, которые добавляются в порошковую смесь для предотвращения прилипания уплотненной порошковой массы к оборудованию во время процесса таблетирования или инкапсулирования. Они способствуют извлечению таблетки из матрицы и могут улучшать текучесть порошка.
Термин «вещество, способствующее скольжению», используемый в настоящем документе, относится к веществам, которые используются в составах таблеток и капсул для улучшения текучести при сжатии таблеток и для получения эффекта, препятствующего слеживанию.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 иллюстрирует репрезентативную PXRD формы НВ гидрохлорида LNP023, описанного в настоящем документе. Ось х показывает угол рассеяния в °2-тета, ось у показывает интенсивность рассеянного рентгеновского пучка в отсчетах детектированных фотонов в секунду.
Фиг. 2 иллюстрирует сравнение репрезентативной PXRD формы НВ гидрохлорида LNP023, описанного в настоящем документе (внизу), и репрезентативной PXRD формы А гидрохлорида LNP023 из WO 2015/009616 (вверху). Ось х показывает угол рассеяния в °2-тета. Порошковая рентгеновская дифрактограмма формы А была смещена вдоль оси у, чтобы разделить дифрактограммы для наглядности. Поэтому ось у является произвольной и не была обозначена.
Фиг. 3 иллюстрирует репрезентативный FTIR спектр формы НВ гидрохлорида LNP023, описанного в настоящем документе. По оси х показаны номера волн в см-1, по оси у - относительная интенсивность в процентах пропускания.
Фиг. 4 иллюстрирует репрезентативную кривую DSC формы НВ гидрохлорида LNP023, описанного в настоящем документе. По оси х показана температура в градусах Цельсия (°С), по оси у показана скорость теплового потока в ваттах на грамм (Вт/г) с восходящими эндотермическими пиками.
Фиг. 5 иллюстрирует репрезентативную кривую TGA формы НВ гидрохлорида LNP023, описанного в настоящем документе. По оси х показана температура в градусах Цельсия (°С), по оси у отложена масса (потеря) образца в весовых процентах (вес. %).
Фиг. 6 иллюстрирует репрезентативные изотермы DVS формы НВ гидрохлорида LNP023, описанного в настоящем документе, в диапазоне от 0 до 95% относительной влажности. По оси х показана относительная влажность в процентах (%), измеренная при температуре (25,0±1,0)°С, по оси у - изменение равновесной массы в процентах веса (вес. %) по отношению к весу образца при RH 0%. Цикл сорбции отмечен треугольниками, при этом цикл десорбции отмечен квадратами.
Фиг. 7а и 7b иллюстрируют сканирующие электронные микроскопические изображения формы НВ гидрохлорида LNP023, описанного в настоящем документе, при получении в соответствии с примером 3 (масштабная линейка в целом: 50 микрометров).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Кристаллическая форма
Примеры вариантов осуществления:
В одном варианте осуществления изобретение относится к кристаллической гидратной форме гидрохлорида LNP023, в настоящем документе также называемой «формой НВ».
Гидрохлорид LNP023 может быть представлен следующей химической структурой в соответствии с формулой (А)
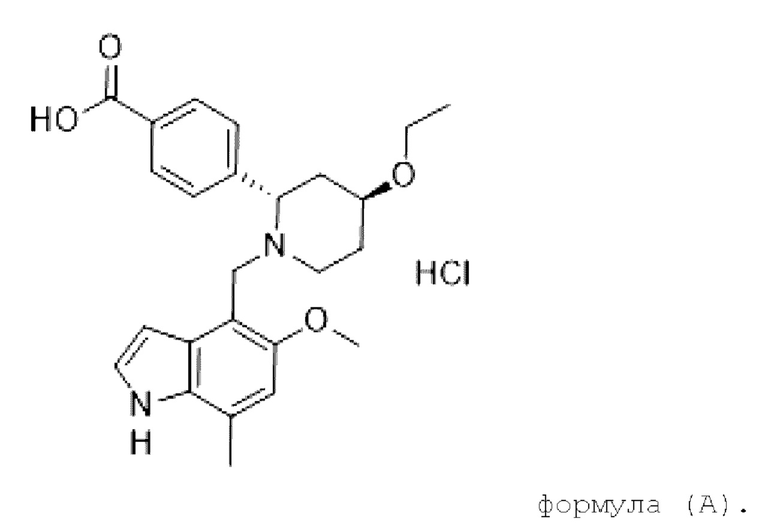
Форма НВ гидрохлорида LNP023, описанная в настоящем документе, может быть охарактеризована аналитическими способами, хорошо известными в фармацевтической промышленности для определения характеристик твердых веществ. Такие способы включают без ограничения PXRD, SXRD, FTIR, DSC, DVS, TGA и SEM. Их можно охарактеризовать одним из вышеупомянутых аналитических способов или объединением двух или более из них. В частности, форма НВ гидрохлорида LNP023, описанная в настоящем документе, может характеризоваться любым одним из следующих вариантов осуществления или объединением двух или более из следующих вариантов осуществления.
Примеры вариантов осуществления PXRD:
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (9,2±0,2)° и (19,1±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)° и (19,1±0,2)0 при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (19,1±0,2)° и (24,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (12,2±0,2)°, (19,1±0,2)° и (24,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (12,2±0,2)°, (19,1±0,2)°, (21,3±0,2)° и (24,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (16,6±0,2)°, (19,1±0,2)°, (21,3±0,2)° и (24,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (16,6±0,2)°, (19,1±0,2)°, (21,3±0,2)° и (24,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (16,6±0,2)°, (19,1±0,2)°, (21,3±0,2)° и (24,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся тем, что кристаллическая форма гидрохлорида LNP023 (форма НВ) может быть охарактеризована пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (19,1±0,2)°, (21,3±0,2)° и (24,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Kalpha1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (19,1±0,2)°, (21,3±0,2)° и (24,6±0,2) при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (19,1±0,2)°, (20,7±0,2)°, (21,3±0,2)° и (24,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (19,1±0,2)°, (20,7±0,2)°, (21,3±0,2)°, (24,0±0,2)° и (24,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (19,1±0,2)°, (20,7±0,2)°, (21,3±0,2)°, (22,2±0,2)°, (24,0±0,2)° и (24,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (19,1±0,2)°, (20,7±0,2)°, (21,3±0,2)°, (22,2±0,2)°, (24,0±0,2)°, (24,6±0,2)° и (28,0±0,2) при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (12,2±0,2)°, (19,1±0,2)° и (24,6±0,2)°, и по меньшей мере одним или более пиком, выбранным из группы, состоящей из (10,0±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (20,7±0,2)°, (21,3±0,2)°, (22,2±0,2)°, (24,0±0,2)° и (28,0±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В другом варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета, такими как:
(4,6±0,1)°, (9,2±0,1)° и (19,1±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)° и (19,1±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (19,1±0,1)° и (24,6±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (12,2±0,1)°, (19,1±0,1)° и (24,6±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (12,2±0,1)°, (19,1±0,1)°, (21,3±0,1)° и (24,6±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (12,2±0,1)°, (12,6±0,1)°, (16,6±0,1)°, (19,1±0,1)°, (21,3±0,1)° и (24,6±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (10,0±0,1)°, (12,2±0,1)°, (12,6±0,1)°, (16,6±0,1)°, (19,1±0,1)°, (21,3±0,1)° и (24,6±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (10,0±0,1)°, (12,2±0,1)°, (12,6±0,1)°, (16,6±0,1)°, (19,1±0,1)°, (21,3±0,1)° и (24,6±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (10,0±0,1)°, (12,2±0,1)°, (12,6±0,1)°, (15,3±0,1)°, (16,6±0,1)°, (19,1±0,1)°, (21,3±0,1)° и (24,6±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (10,0±0,1)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (19,1±0,2)°, (21,3±0,2)° и (24,6±0,2)°; или
(4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (19,1±0,2)°, (20,7±0,2)°, (21,3±0,2)° и (24,6±0,2)°; или
(4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (19,1±0,2)°, (20,7±0,2)°, (21,3±0,2)°, (24,0±0,2)° и (24,6±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (10,0±0,1)°, (12,2±0,1)°, (12,6±0,1)°, (15,3±0,1)°, (16,6±0,1)°, (17,2±0,1)°, (19,1±0,1)°, (20,7±0,1)°, (21,3±0,1)°, (22,2±0,1)°, (24,0±0,1)° и (24,6±0,1)°; или
(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (10,0±0,1)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,1)°, (16,6±0,1)°, (17,2±0,1)°, (19,1±0,1)°, (20,7±0,1)°, (21,3±0,1)°, (22,2±0,1)°, (24,0±0,1)°, (24,6±0,1)° и (28,0±0,1)° при
измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся пиками PXRD, идентифицированными при значениях угла 2-тета (4(4,6±0,1)°, (6,8±0,1)°, (9,2±0,1)°, (12,2±0,1)°, (19,1±0,1)° и (24,6±0,1)°, и по меньшей мере одним или более пиком, выбранным из группы, состоящей из (10,0±0,1)°, (12,6±0,1)°, (15,3±0,1)°, (16,6±0,1)°, (17,2±0,1)°, (20,7±0,1)°, (21,3±0,1)°, (22,2±0,1)°, (24,0±0,1)° и (28,0±0,1)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
PXRD формы НВ, описанной в настоящем документе, можно четко отличить от PXRD формы А из WO 2015/009616 (см. также наложение PXRD, показанное на фиг. 2, описанное в настоящем документе). Например, форма НВ показывает характерные пики при (4,6±0,1) и (9,2±0,1)° 2-тета, тогда как форма А не показывает пиков в тех же диапазонах. Согласно странице 176 WO 2015/009616 среди четырех наиболее характерных пиков формы А один является пиком при 11,6° 2-тета. В отличие от этого форма НВ, описанная в настоящем документе, не показывает пика в том же диапазоне.
В другом варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), которая может характеризоваться PXRD, как описано в одном из вариантов осуществления выше, но не включает пик под углом 2-тета (11,6±0,2)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Kalpha1;2 с длиной волны 0,15419 нм.
В одном из вариантов осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), которая может характеризоваться PXRD, как описано выше, но не включает пиков при значениях угла 2-тета (11,6±0,1)° 2-тета при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Kalpha1;2 с длиной волны 0,15419 нм.
В другом варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся по существу такой же PXRD, как показано на фиг. 1, описанной в настоящем документе при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Kalpha1,2 с длиной волны 0,15419 нм.
Относительная интенсивность пиков, например, как показано на фиг. 1 и приведено в таблице 2, может быть в определенной степени изменена вследствие морфологии частиц формы НВ. В целом морфология многих кристаллических частиц имеет тенденцию давать образец, который демонстрирует некоторую степень
предпочтительной ориентации в держателе образца. Это особенно очевидно для игольчатых или пластинчатых кристаллов, когда уменьшение размера позволяет получить более тонкие иглы или пластинки. Предпочтительная ориентация в образце влияет на интенсивность различных пиков, так что некоторые из них более интенсивны, а другие - менее интенсивны по сравнению с тем, что можно было бы ожидать от совершенно случайного образца.
Примеры вариантов осуществления FTIR:
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах
(34 52±4) см-1, (2875±4) см-1 и (1692±4) см-1.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах
(3452±4) см-1, (2875±4) см-1, (1692±4) см-1 и (1439±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки ATR.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (1692±4) см-1, (1439±4) см-1 и (12 4 3±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (1692±4) см-1, (1439±4) см-1, (1243±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах
(3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1692±4) см-1, (1439±4) см-1, (1243±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах
(3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1439±4) см-1, (1243±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах
(3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1439±4) см-1, (1243±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1439±4) см-1, (1243±4) см-1 и (767±4) см-1.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см~1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1439±4) см-1, (1243±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1497±4) см-1, (1439±4) см-1, (1243±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1497±4) см-1, (1461±4) см-1, (1439±4) см-1, (1243±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1497±4) см-1, (1461±4) см-1, (1439±4) см-1, (1425±4) см-1, (1243±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1497±4) см-1, (1461±4) см-1, (1439±4) см-1, (1425±4) см-1, (1384±4) см-1, (1243±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1497±4) см-1, (1461±4) см-1, (1439±4) см-1, (1425±4) см-1, (1384±4) см-1, (1243±4) см-1, (1184±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1497±4) см-1, (1461±4) см-1, (1439±4) см-1, (1425±4) см-1, (1384±4) см-1, (1243±4) см-1, (1184±4) см-1, (1069±4) см-1 и (767±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1497±4) см-1, (1461±4) см-1, (1439±4) см-1, (1425±4) см-1, (1384±4) см-1, (1243±4) см-1, (1184±4) см-1, (1069±4) см-1, (767±4) см-1 и (739±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (3274±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1497±4) см-1, (1461±4) см-1, (1439±4) см-1, (1425±4) см-1, (1384±4) см-1, (1243±4) см-1, (1184±4) см-1, (1069±4) см-1, (767±4) см-1 и (739±4) см-1 при измерении при температуре в диапазоне от 2 0 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (3274±4) см-1, (2933±4) см-1, (2875±4) см-1, (2732±4) см-1, (1709±4) см-1, (1692±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1497±4) см-1, (1461±4) см-1, (1439±4) см-1, (1425±4) см-1, (1384±4) см-1, (1243±4) см-1, (1184±4) см-1, (1069±4) см-1, (767±4) см-1 и (739±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±4) см-1, (2875±4) см-1, (2732±4) см-1, (1692±4) см-1, (1439±4) см-1, (1243±4) см-1 и (767±4) см-1 и по меньшей мере один пик, выбранный из группы, состоящей из (3274±4) см-1, (2933±4) см-1, (1709±4) см-1, (1658±4) см-1, (1615±4) см-1, (1601±4) см-1, (1515±4) см-1, (1497±4) см-1, (1461±4) см-1, (1425±4) см-1, (1384±4) см-1, (1184±4) см-1, (1069±4) см-1 и (739±4) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В другом варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах
(34 52±2) см-1, (2875±2) см-1 и (1692±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (1692±2) см-1 и (1439±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (1692±2) см-1, (1439±2) см-1 и (12 4 3±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (1692±2) см-1, (1439±2) см-1, (1243±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1692±2) см-1, (1439±2) см-1, (1243±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см-1, (1658±2) см-1, (1439±2) см-1, (1243±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см~1, (1658±2) см-1, (1615±2) см-1, (1439±2) см-1, (1243±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см-1, (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1439±2) см-1, (1243±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см-1, (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1439±2) см-1, (1243±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см -1, (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1497±2) см-1, (1439±2) см-1, (1243±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см-1, (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1497±2) см-1, (1461±2) см-1, (1439±2) см-1, (1243±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см-1, (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1497±2) см-1, (1461±2) см-1, (1439±2) см-1, (1425±2) см-1, (1243±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см-!., (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1497±2) см-1, (1461±2) см-1, (1439±2) см-1, (1425±2) см-1, (1384±2) см-1, (1243±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см-!., (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1497±2) см-1, (1461±2) см-1, (1439±2) см-1, (1425±2) см-1, (1384±2) см-1, (1243±2) см-1, (1184±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см-1, (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1497±2) см-1, (1461±2) см-1, (1439±2) см-1, (1425±2) см-1, (1384±2) см-1, (1243±2) см-1, (1184±2) см-1, (1069±2) см-1 и (767±2) см-1; или
(3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см-1, (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1497±2) см-1, (1461±2) см-1, (1439±2) см-1, (1425±2) см-1, (1384±2) см-1, (1243±2) см-1, (1184±2) см-1, (1069±2) см-1, (767±2) см-1 и (739±2) см-1; или
(3452±2) см-1, (3274±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см~1, (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1497±2) см-1, (1461±2) см-1, (1439±2) см-1, (1425±2) см-1, (1384±2) см-1, (1243±2) см-1, (1184±2) см-1, (1069±2) см-1, (767±2) см-1 и (739±2) см-1; или
(3452±2) см-1, (3274±2) см-1, (2933±2) см-1, (2875±2) см-1, (2732±2) см-1, (1709±2) см-1, (1692±2) см-1, (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1497±2) см-1, (1461±2) см-1, (1439±2) см-1, (1425±2) см-1, (1384±2) см-1, (1243±2) см-1, (1184±2) см-1, (1069±2) см-1, (767±2) см-1 и (739±2) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием FTIR спектра, включающего пики при волновых числах (3452±2) см-1, (2875±2) см-1, (2732±2) см-1, (1692±2) см-1, (1439±2) см-1, (1243±2) см-1 и (767±2) см-1 и по меньшей мере один пик, выбранный из группы, состоящей из (3274±2) см-1, (2933±2) см-1, (1709±2) см-1, (1658±2) см-1, (1615±2) см-1, (1601±2) см-1, (1515±2) см-1, (1497±2) см-1, (1461±2) см-1, (1425±2) см-1, (1384±2) см-1, (1184±2) см-1, (1069±2) см-1 и (739±2) см-1 при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки АТР.
В еще одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся по существу таким же FTIR-спектром, как показано на фиг. 3, описанной в настоящем документе при измерении при температуре в диапазоне от 20 до 30°С с помощью алмазной ячейки ATR.
Иллюстративные примеры вариантов осуществления DSC:
В одном варианте осуществления гидрохлорид LNP023 (форма НВ) характеризуется наличием по существу такого же профиля DSC, как показано на фиг. 4. В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием кривой DSC, показывающей широкое эндотермическое событие, которое заканчивается при температуре приблизительно 170°С, с последующим экзотермическим разложением при температуре приблизительно 200°С при измерении со скоростью нагрева 10 К/мин. В одном варианте осуществления широкое эндотермическое событие, которое заканчивается при температуре приблизительно 170°С, представляет собой эндотермическое событие в диапазоне от 35°С до 170°С при измерении при скорости нагрева 10 К/мин.
Иллюстративные примеры вариантов осуществления TGA:
В одном варианте осуществления гидрохлорид LNP023 (форма НВ) характеризуется с помощью по существу такого же термогравиметрического анализа (TGA), как показано на фиг. 5. В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся наличием кривой TGA, демонстрирующей потерю массы при температуре приблизительно 220°С, например, при температуре от 200 до 220°С, вследствие потери воды и остаточных растворителей не более 4,5 вес. %, например, не более 4,3 вес. %, например, не более 4,0 вес. %, например, не более 3,8 вес. %, например, не более 3,4 вес. %, в пересчете на вес кристаллической формы кристаллической формы, при нагревании от 30 до 300°С со скоростью 20 К/мин.
Иллюстративные примеры вариантов осуществления DVS: В одном варианте осуществления гидрохлорид LNP023 (форма НВ) характеризуется по существу таким же DVS, как показано на фиг. 6. В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся изменением массы не более чем на 4,5 вес. %, например, не более чем на 4,0 вес. %, например, не более чем на 3,0 вес. %, например, не более 2,0 вес. %, например, не более 1,8 вес. %, 1,6 вес. %, 1,5 вес. % или 1,4 вес. %, в пересчете на вес кристаллической формы при измерении с помощью DVS при относительной влажности в диапазоне от 0 до 95% и температуре (25±1,0)°С.
Иллюстративные примеры дополнительных вариантов осуществления:
В другом варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся как несольватированная форма. В одном варианте осуществления кристаллическая форма гидрохлорида LNP023 находится в гидратированной форме, например, в форме моногидрата.
Примеры морфологии
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), характеризующейся столбчатой или равносторонней морфологией.
В одном варианте осуществления изобретение относится к кристаллической форме гидрохлорида LNP023 (форма НВ), имеющей габитус кристалла, который является по существу равносторонним или столбчатым, например, по существу равносторонним. Это приводит к предпочтительным свойствам сыпучести и текучести по сравнению с мелкими кристаллами ацикулярной (игольчатой) или реечной (лопастной) формы. Такие предпочтительные формы кристаллов могут быть получены при осуществлении способа, как изложено в настоящем документе, например, при осуществлении методики кристаллизации, включающей температурный цикл с последующим измельчением, приводящим к уменьшению размера частиц.
Полученные частицы характеризуются подходящим соотношением сторон. Соотношение сторон ψА (0<ψА≤1) определяется соотношением минимального и максимального диаметра Ферета ψA=xFeret min/xFeret max. Она дает представление об удлинении частицы, т.е. чем меньше значение, тем более удлиненной является частица. Поэтому в дополнительных вариантах осуществления изобретения равносторонние частицы кристаллической формы гидрохлорида LNP023 (форма НВ) имеют соотношение сторон (а50) выше приблизительно 0,4, например, выше приблизительно 0,45. В других вариантах осуществления равносторонние частицы формы НВ имеют соотношение сторон от приблизительно 0,4 до приблизительно 0,7, например, от приблизительно 0,45 до 0,6.
В дополнительных вариантах осуществления гранулометрический состав Хд0 равносторонних частиц кристаллической формы гидрохлорида LNP023 (форма НВ) составляет менее приблизительно 300 мкм, например, менее приблизительно 200 мкм, например, менее приблизительно 150 мкм. В дополнительных вариантах осуществления изобретения гранулометрический состав Х90 составляет от приблизительно 30 до приблизительно 150 мкм, например, от приблизительно 35 до приблизительно 130 мкм, например, от приблизительно 4 0 до приблизительно 105 мкм.
В дополнительных вариантах осуществления, гранулометрический состав Х50 равносторонних частиц формы НВ составляет от приблизительно 5 до приблизительно 100 мкм, например, от приблизительно 10 до приблизительно 70 мкм, например, от приблизительно 15 до приблизительно 55 мкм.
Еще в одном варианте осуществления изобретения гранулометрический состав Х10 равносторонних частиц формы НВ составляет от приблизительно 0,1 до приблизительно 50 мкм, например, от приблизительно 1 до приблизительно 30 мкм, например, от приблизительно 2 до приблизительно 20 мкм.
В дополнительном варианте осуществления равносторонние частицы формы НВ имеют консолидированную (15 кПа) насыпную плотность менее приблизительно 0,8 г/мл, например, менее приблизительно 0,7 г/мл. В других вариантах осуществления равносторонние частицы формы НВ имеют консолидированную (15 кПа) насыпную плотность от приблизительно 0,4 до приблизительно 0,7 г/мл, например, от приблизительно 0,50 до приблизительно 0,65 г/мл, например, от приблизительно 0,55 до приблизительно 0,60 г/мл.
Композиция
Примеры вариантов осуществления:
В другом аспекте изобретение относится к композиции, содержащей форму НВ гидрохлорида LNP023, описанную в настоящем документе, как определено в любом из вариантов осуществления, описанных выше, причем упомянутая композиция по существу не содержит никакой другой твердой формы гидрохлорида LNP023. Например, композиция, содержащая форму НВ гидрохлорида LNP023, описанную в настоящем документе, содержит не более 20 вес. %, например, не более 10 вес. %, например, не более 5, 4, 3, 2 или 1 вес. %, любой другой твердой формы гидрохлорида LNP023 в пересчете на вес композиции. В одном из вариантов осуществления любая другая твердая форма гидрохлорида LNP023 представляет собой форму А из WO 2015/009616 или аморфную форму. Форма А гидрохлорида LNP023 демонстрирует PXRD, включающую, среди прочего, характерный пик при угле 2-тета (11,6±0,1)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм. Таким образом, отсутствие этого пика при угле 2-тета (11,6±0,1)° в PXRD подтверждает отсутствие формы А гидрохлорида LNP023 в композиции.
В одном варианте осуществления изобретение относится к композиции, содержащей форму НВ гидрохлорида LNP023, описанную в настоящем документе, как определено в любом из вариантов осуществления, описанных выше, причем упомянутая композиция имеет PXRD, не содержащую пика при угле 2-тета (11,6±0,1)° при измерении при температуре в диапазоне от 20 до 30°С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм.
В одном из вариантов осуществления изобретение относится к композиции, содержащей по меньшей мере 90 вес. %, включая по меньшей мере 90, 91, 92, 93, 94, 95, 96, 97, 98 и 99 вес. %, и также включая равное приблизительно 100 вес. % количество кристаллической формы НВ гидрохлорида LNP023, определенной в любом из описанных выше вариантов осуществления, по общему весу композиции. Оставшийся материал может содержать другую твердую форму(-ы) гидрохлорида LNP023, или реакционные примеси, или технологические примеси, возникающие при получении композиции.
Способ
Примеры вариантов осуществления:
В другом аспекте изобретение относится к способу получения формы НВ гидрохлорида LNP023, описанного в настоящем документе, или композиции, содержащей его, как определено в любом из аспектов и их соответствующих вариантах осуществления, описанных выше, включающему:
(i) предоставление гидрохлорида LNP023 в твердой форме;
(ii) суспендирование гидрохлорида LNP023, предоставленного на стадии (i), в первом растворителе, содержащем ацетон и воду, и нагревание с растворением твердого вещества с получением раствора;
(iii) охлаждение раствора, полученного на стадии (ii), и добавление второго растворителя, содержащего ацетон, или этилацетат, или их комбинацию, с получением кристаллов в маточном растворе;
(iv) отделение по меньшей мере части кристаллов, полученных на стадии (iii), от маточного раствора;
(v) необязательно промывание выделенных кристаллов, полученных на стадии (iv); и
(vi) высушивание кристаллов, полученных на стадии (iv) или
(v).
Пример описания способа:
Твердый исходный материал гидрохлорид LNP023 может быть получен в соответствии с методикой, раскрытой в примере 26d из WO 2015/009616.
Твердый исходный материал, полученный на стадии (i), может быть суспендирован в первом растворителе, содержащем ацетон и воду. Первый растворитель может содержать дополнительные органические растворители. В одном варианте осуществления ацетон и вода могут быть единственными растворителями, присутствующими в суспензии. Концентрация гидрохлорида LNP023 в суспензии находится, например, в диапазоне от приблизительно 0,07 до 0,30 г/г, например, от приблизительно 0,10 до 0,2 5 г/г, например, от приблизительно 0,15 до 0,20 г/г, например, концентрация составляет приблизительно 0,20 г/г. В одном варианте осуществления соотношение ацетона и воды (г/г) составляет, например, от 60:40 до 90:10, например, от 65:45 до 85:15, например, от 75:25 до 80:20. В одном варианте осуществления нагревание на стадии (ii) может осуществляться при повышенной температуре, например, при температуре в диапазоне от приблизительно 30 до 56°С, например, от приблизительно 45 до 55°С. Нагревание может сопровождаться любым видом движения твердого материала, суспендированного в растворителе, включая, без ограничения, например, размешивание, перемешивание, смешивание, встряхивание, вибрацию, сонификацию, мокрый помол и тому подобное. После растворения твердого материала раствор можно охладить до температуры в диапазоне от приблизительно 20 до 50°С, например, от приблизительно 35 до 45°С, и добавить второй растворитель, содержащий ацетон, этилацетат или их комбинацию. Второй растворитель может содержать дополнительные органические растворители или воду. В одном варианте осуществления ацетон и этилацетат могут быть единственными растворителями, добавленными на стадии (iii). Если в качестве второго растворителя используют ацетон и этилацетат, они могут быть добавлены в виде смеси растворителей ацетона и этилацетата или могут быть добавлены последовательно. В одном варианте осуществления при последовательном добавлении сначала добавляют ацетон, а затем этилацетат. Концентрация гидрохлорида LNP023 находится, например, в диапазоне от приблизительно 0,04 до 0,15 г/г, например, от приблизительно 0,05 до 0,10 г/г, и, например, от приблизительно 0,05 до 0,07 г/г, например, концентрация составляет приблизительно 0,06 г/г. Соотношение ацетона и этилацетата (г/г) составляет, например, от 0,5:3 до 1:1, например, 1:2. В одном варианте осуществления суспензия может быть дополнительно охлаждена до температуры в диапазоне от 0 до 25°С, например, от приблизительно 5 до 15°С, например, 10°С, для завершения кристаллизации. После получения формы НВ в практически чистом виде по меньшей мере часть кристаллов может быть отделена от маточного раствора. В одном варианте осуществления кристаллы могут быть отделены от маточного раствора любым обычным способом, таким как фильтрование, центрифугирование, упаривание растворителя или декантация, например, посредством фильтрования или центрифугирования. В одном варианте осуществления кристаллы могут быть отделены от маточного раствора посредством фильтрования.
Необязательно на следующей стадии выделенные кристаллы могут быть промыты подходящим растворителем, например, органическим растворителем или водой. Подходящие органические растворители содержат, без ограничения, ацетон и этилацетат.
Затем полученные кристаллы можно высушить. Высушивание можно проводить при температуре приблизительно 70°С или менее, например, приблизительно 60°С или менее, например, приблизительно 50°С. Высушивание можно также проводить при комнатной температуре. Высушивание можно проводить в течение периода времени в диапазоне от приблизительно 2 до 24 часов, например, от приблизительно 4 до 16 часов, например, от приблизительно 6 до 10 часов. В одном варианте осуществления высушивание можно проводить в течение периода от приблизительно 6 до 8 часов. Высушивание можно проводить при атмосферном давлении или при пониженном давлении. В одном варианте осуществления высушивание проводят при давлении приблизительно 200 мбар или менее, например, приблизительно 150 мбар или менее. В одном варианте осуществления высушивание проводят при давлении приблизительно 80 мбар или менее. В одном варианте осуществления высушивание проводят, например, в вакууме приблизительно 50 мбар или менее.
В одном варианте осуществления определенные способы кристаллизации могут быть применены в способе для получения кристаллов формы НВ с улучшенной технологичностью продукта. Способы включают, без ограничения, температурный цикл или добавление второго растворителя в течение длительного периода времени, например, в течение 12-36 ч, например, может быть температурный цикл. Температурный цикл может быть проведен следующим образом: На стадии (iii) перед добавлением второго растворителя раствор может быть охлажден до температуры в диапазоне от приблизительно 0 до 25°С, например, от приблизительно 5 до 15°С, например, 10°С, и затем нагрет до температуры в диапазоне от приблизительно 30 до 45°С, например, от 30 до приблизительно 4 0°С, например, 35°С.Этот температурный цикл может быть проведен по меньшей мере 3 раза, например, по меньшей мере 6 раз, например, по меньшей мере 8 раз, например, от 6 до 12 раз. После температурного цикла можно добавить второй растворитель. В одном варианте осуществления второй растворитель может представлять собой этилацетат.
Форма НВ после обработки, т.е. после применения определенных способов кристаллизации, как описано выше, состоит из кристаллов с четко определенной морфологией, эта морфология приводит к отличным свойствам порошка и технологичности, позволяющим составлять лекарственный продукт, содержащий форму НВ, с помощью стандартных производственных процессов и оборудования. В одном варианте осуществления, в отличие от формы А, которая не может быть разработана таким образом, форма НВ не является хрупкой, поэтому проблемы с измельчением и широким гранулометрическим составом могут быть сведены к минимуму. Кроме того, текучесть формы НВ выше, чем у формы А. Таким образом, форма НВ, особенно при разработке, сочетает в себе высокую физико-химическую стабильность и отличные свойства порошка. Поэтому она превосходит форму А и является идеальной твердой формой гидрохлорида LNP023 для стандартного производства улучшенной фармацевтической композиции.
В одном варианте осуществления изобретение относится к способу получения формы НВ гидрохлорида LNP023, описанной в настоящем документе, или композиции, содержащей ее, как определено в любом из аспектов и их соответствующих вариантов осуществления, описанных выше, включающему в качестве стадии (iii) описанной выше процедуры
a) охлаждение раствора, полученного на стадии (ii), с последующим повторным нагреванием раствора;
b) повторение стадии (а) по меньшей мере 3 раза и
c) добавление второго растворителя, содержащего ацетон, этилацетат или их комбинацию.
Пример измельчения
Перед тем, как частицы формы НВ гидрохлорида LNP023, описанной в настоящем документе, заполняются в капсулы или подвергаются другой дальнейшей обработке, они, например, измельчаются. Измельчение может проводиться для того, чтобы обеспечить легкое заполнение частиц непосредственно в капсулы, в частности, без необходимости использования дополнительных вспомогательных веществ.
В одном варианте осуществления размер частиц формы НВ гидрохлорида LNP023 уменьшается с помощью роторного ударного измельчения. Роторное ударное измельчение можно проводить с использованием различных статических и вращающихся элементов оснастки, например, роторного крыльчатого битера со статическим ситом, роторного крыльчатого битера со статическим ситом и ударным элементом, роторного штифтового диска со статическим штифтовым диском или роторного штифтового диска с вращающимся штифтовым диском. Форма НВ гидрохлорида LNP023, подлежащая измельчению, транспортируется в роторную ударную мельницу с помощью соответствующих систем транспортировки порошка, например, вибропитателя или двухшнекового питателя, для адекватного контроля соответствующей скорости подачи порошка. Далее порошок транспортируется к элементам ударной оснастки с помощью газового потока, создаваемого либо вращающимися элементами роторной ударной мельницы, либо воздуходувкой, соединенной с роторной ударной мельницей. Уменьшение размера частиц формы НВ частиц гидрохлорида LNP023 происходит путем удара на вращающихся элементах, удара на статических элементах или удара между сталкивающимися частицами формы НВ. Адекватные параметры способа, такие как скорость вращения ротора и скорость подачи материала для получения индивидуальной формы НВ гидрохлорида LNP023, связаны с конкретными параметрами оборудования роторной ударной мельницы. Измельченный продукт с заданными физическими свойствами собирают в контейнере для продукта после отделения от транспортного газа с помощью, например, фильтров, циклонов. Измельченный продукт может быть окончательно смешан с помощью соответствующих методик, например, диффузионного смесителя, с получением соответствующей физической однородности изготовленной партии.
Роторное ударное измельчение может быть проведено, например, посредством роторного ударного измельчения с использованием вращающегося штифтового диска со статической штифтовой дисковой оснасткой, часто описываемой в данной области техники как штифтовая мельница. Не зависимые от масштаба параметры скорости вращения ротора и скорости подачи могут быть описаны скоростью вершины ротора и удельной скоростью подачи. Скорость ротора конкретного масштаба оборудования в принципе связана с диаметром штифтового диска соответствующего масштаба оборудования по параметру скорость наконечника ротора для независимого от масштаба параметра. Скорость подачи конкретного масштаба оборудования в принципе связана с площадью поверхности штифта соответствующего масштаба оборудования параметром удельной скорости подачи для независимого от масштаба параметра. Форма НВ продукта гидрохлорида LNP023 с заданными физическими свойствами может быть получена роторным ударным измельчением со следующими независимыми от масштаба параметрами измельчения: скорость наконечника ротора от 10 до 60 м/с, при этом диаметр внешних вращающихся штифтов учитывается для нормирования, или удельная скорость подачи не более приблизительно 4000 кг/(ч⋅м2), при этом площадь цилиндрической поверхности вращающихся штифтов учитывается для нормирования.
В зависящем от масштаба примере форма НВ гидрохлорида LNP023 может быть измельчена с помощью роторной ударной мельницы, такой как модель 100UPZ, Hosokawa Alpine AG, Аугсбург/Германия, и вращающегося штифтового диска со статической оснасткой штифтового диска, часто описываемого в открытых источниках как штифтовая мельница. Продукт с заданными физическими свойствами может быть получен, проводя процесс при скорости вращения ротора от 1800 до 10500 об./мин., например, от 4000 до 8500 об./мин., например, при скорости вращения ротора 6000 об./мин. Скорость подачи составляет, например, от 1 до 22 кг/ч, например, от 6 до 18 кг/ч, например, при скорости подачи 15 кг/ч.
Фармацевтические композиции и применение
Примеры вариантов осуществления:
В дополнительном аспекте изобретение относится к использованию формы НВ гидрохлорида LNP023, описанной в настоящем документе, или композиции, содержащей форму НВ гидрохлорида LNP023, как определено в любом из аспектов и их соответствующих вариантах осуществления, описанных выше, для получения фармацевтической композиции.
В дополнительном аспекте изобретение относится к фармацевтической композиции, содержащей форму НВ гидрохлорида LNP023 или композицию, содержащую форму НВ гидрохлорида LNP023, как определено в любом из аспектов и их соответствующих вариантов осуществления, описанных выше, например, в заранее определенном или терапевтически эффективном количестве, и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
В одном варианте осуществления фармацевтическая композиция, содержащая форму НВ гидрохлорида LNP023, как определено в любом из аспектов и их соответствующих вариантах осуществления, описанных выше, содержит гидрохлорид LNP023 в дозе не более приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления фармацевтическая композиция содержит гидрохлорид LNP023 в дозе от приблизительно 10 мг до приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления фармацевтическая композиция содержит гидрохлорид LNP023 в дозе приблизительно 10 мг, приблизительно 25 мг, приблизительно 50 мг, приблизительно 100 мг или приблизительно 200 мг, каждая из которых представлена в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления фармацевтическая композиция содержит гидрохлорид LNP023 в дозе 10 мг, 25 мг, 50 мг, 100 мг или 200 мг, каждая из которых представлена в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления терапевтически эффективное количество формы НВ гидрохлорида LNP023 выбрано из группы, состоящей из 1, 5, 10, 25, 50, 100 и 200 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления терапевтически эффективное количество формы НВ гидрохлорида LNP023 составляет 100 или 200 мг. В одном варианте осуществления терапевтически эффективное количество формы НВ гидрохлорида LNP023 составляет 50 мг. В одном варианте осуществления терапевтически эффективное количество формы НВ гидрохлорида LNP023 составляет 10 мг.
По меньшей мере одно фармацевтически приемлемое вспомогательное вещество, которое может входить в фармацевтическую композицию, описанную в настоящем документе, например, выбрано из группы, состоящей из носителей, наполнителей, разбавителей, связующих, разрыхлителей, смазывающих веществ, веществ, способствующих скольжению, и их комбинаций. Подходящими носителями являются, например, диспергирующая жидкость или капсула. В одном предпочтительном варианте осуществления фармацевтическая композиция содержит одно фармацевтически приемлемое вспомогательное вещество, например, носитель.
В предпочтительном варианте осуществления фармацевтическая композиция, содержащая форму НВ гидрохлорида LNP023, или композиция, содержащая форму НВ гидрохлорида LNP023, как определено в любом из аспектов и их соответствующих вариантах осуществления, описанных выше, представляет собой твердую дозированную форму для перорального применения. В одном варианте осуществления твердая дозированная форма для перорального применения выбрана из группы, состоящей из таблеток и капсул. В одном варианте осуществления дозированная форма для перорального применения находится в форме таблетки. В одном варианте осуществления дозированная форма для перорального применения представляет собой капсулу. В одном варианте осуществления капсула имеет размер 0.
Таблетка может быть получена посредством смешивания формы НВ гидрохлорида LNP023 или композиции, содержащей форму НВ гидрохлорида LNP023, как определено в любом из аспектов и их соответствующих вариантах осуществления, описанных выше, с по меньшей мере одним вспомогательным веществом, таким как наполнители, разбавители, связующие, разрыхлители, смазывающие вещества, вещества, способствующие скольжению, или их комбинации. Необязательно перед сжатием выполняется стадия гранулирования, например, сухое или влажное гранулирование.
Капсула может быть получена посредством смешивания формы НВ гидрохлорида LNP023 или композиции, содержащей форму НВ гидрохлорида LNP023, как определено в любом из аспектов и их соответствующих вариантах осуществления, описанных выше, с по меньшей мере одним вспомогательным веществом, таким как наполнители, разбавители, связующие, разрыхлители, смазывающие вещества, вещества, способствующие скольжению, или их комбинации, и заполнения смесью в капсулы, которая используется в качестве носителя. Альтернативно формой НВ гидрохлорида LNP023 аккуратно наполняют капсулу, которая используется в качестве носителя. Оболочка капсулы может быть желатиновой или оболочкой из гидроксипропилметилцеллюлозы (НРМС).
В одном варианте осуществления изобретение относится к фармацевтической композиции, содержащей форму НВ частиц гидрохлорида LNP023 в капсуле, например, капсуле размера 0. В одном варианте осуществления частицы формы НВ в капсуле имеют соотношение сторон от 0,4 до приблизительно 0,7, например, от 0,45 до 0,6. В одном варианте осуществления частицы формы НВ в капсуле имеют гранулометрический состав Х50 от приблизительно 5 до приблизительно 100 мкм, например, от приблизительно 10 до приблизительно 70 мкм, например, от приблизительно 15 до приблизительно 55 мкм. В одном варианте осуществления частицы формы НВ в капсуле имеют консолидированную (15 кПа) насыпную плотность от приблизительно 0,4 до приблизительно 0,7 г/мл, например, от приблизительно 0,50 до приблизительно 0,65 г/мл, например, от приблизительно 0,55 до приблизительно 0,60 г/мл.
В дополнительном аспекте изобретение относится к форме НВ гидрохлорида LNP023, или композиции, содержащей форму НВ гидрохлорида LNP023, или фармацевтической композиции, содержащей то же, что определено в любом из вышеописанных аспектов и их соответствующих вариантах осуществления, для применения в лечении описанных в настоящем документе заболеваний и расстройств.
В еще одном аспекте изобретение относится к форме НВ гидрохлорида LNP023, или композиции, содержащей форму НВ гидрохлорида LNP023, или фармацевтической композиции, содержащей то же, что определено в любом из вышеописанных аспектов и их вариантах осуществления, для применения в лечении или профилактике показаний, раскрытых в WO 2015/009616 и WO 2019/043609, в частности, для лечения или профилактики пароксизмальной ночной гемоглобинурии (PNH), заболеваний почек, вызванных комплементом, C3G (С3 гломерулопатии), IgAN (иммуноглобулиновой А нефропатии) и других нефропатий с признаками гломерулярного отложения С3, таких как MN (мембранозная нефропатия) и HUS (гемолитико-уремический синдром, вызванный E.coli), а также атипичный гемолитико-уремический синдром (aHUS).
В другом аспекте изобретение относится к способу лечения заболеваний и расстройств, раскрытых в WO 2015/009616 и WO 2 019/043609, каждый из которых включен в настоящий документ посредством ссылки во всей своей полноте, у субъекта, нуждающегося в этом. В одном варианте осуществления заболевание или расстройство выбрано из пароксизмальной ночной гемоглобинурии (PNH), заболеваний почек, вызванных комплементом, C3G (С3 гломерулопатии), IgAN (иммуноглобулиновой А нефропатии) и других нефропатий с признаками гломерулярного отложения С3, таких как MN (мембранозная нефропатия) и HUS (гемолитико-уремический синдром, вызванный E.coli), а также атипичный гемолитико-уремический синдром (aHUS). В одном варианте осуществления способ включает введение субъекту терапевтически эффективного количества формы НВ гидрохлорида LNP023, как описано в настоящем документе.
В другом аспекте изобретение относится к способу лечения пароксизмальной ночной гемоглобинурии (PNH) у нуждающегося в этом субъекта, способ включает введение субъекту терапевтически эффективного количества формы НВ LNP023 для лечения субъекта.
В одном варианте осуществления способ лечения PNH у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе не более приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе не более приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способ лечения PNH у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе от приблизительно 20 мг до приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе от приблизительно 10 мг до приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способ лечения PNH у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе приблизительно 20 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг или приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 10 мг, приблизительно 25 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способа лечения PNH форму НВ LNP023 вводят субъекту в общей суточной дозе около 20 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 10 мг.
В одном варианте осуществления способа лечения PNH форму НВ LNP023 вводят субъекту в общей суточной дозе около 50 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 25 мг.
В одном варианте осуществления способа лечения PNH форму НВ LNP023 вводят субъекту в общей суточной дозе около 100 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 50 мг.
В одном варианте осуществления способа лечения PNH форму НВ LNP023 вводят субъекту в общей суточной дозе около 200 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 100 мг.
В одном варианте осуществления способа лечения PNH форму НВ LNP023 вводят субъекту в общей суточной дозе около 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 200 мг.
В одном варианте осуществления способа лечения PNH форму НВ LNP023 вводят субъекту перорально дважды в день (b.i.d.), например, приблизительно каждые 12 часов.
В одном варианте осуществления способа лечения PNH форму НВ LNP023 вводят перорально дважды в день (b.i.d.), например, приблизительно каждые 12 часов, субъекту в дозе 200 мг, в пересчете на безводное свободное основание LNP023.
В другом аспекте изобретение относится к способу лечения вызванного комплементом заболевания почек C3G (С3 гломерулопатии) у нуждающегося в этом субъекта, при этом способ включает введение субъекту терапевтически эффективного количества формы НВ LNP023 для лечения субъекта.
В одном варианте осуществления способ лечения C3G у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе не более приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе не более приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способ лечения C3G у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе от приблизительно 20 мг до приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе от приблизительно 10 мг до приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способ лечения C3G у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе приблизительно 20 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг или приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 10 мг, приблизительно 25 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способа лечения C3G форму НВ LNP023 вводят субъекту в общей суточной дозе около 20 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 10 мг.
В одном варианте осуществления способа лечения C3G форму НВ LNP023 вводят субъекту в общей суточной дозе около 50 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 25 мг.
В одном варианте осуществления способа лечения C3G форму НВ LNP023 вводят субъекту в общей суточной дозе около 100 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 50 мг.
В одном варианте осуществления способа лечения C3G форму НВ LNP023 вводят субъекту в общей суточной дозе около 200 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 100 мг.
В одном варианте осуществления способа лечения C3G форму НВ LNP023 вводят субъекту в общей суточной дозе около 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 200 мг.
В одном варианте осуществления способа лечения C3G форму НВ LNP023 вводят субъекту перорально дважды в день (b.i.d.), например, приблизительно каждые 12 часов.
В одном варианте осуществления способа лечения C3G форму НВ LNP023 вводят перорально дважды в день (b.i.d.), например, приблизительно каждые 12 часов, субъекту в дозе 200 мг, в пересчете на безводное свободное основание LNP023.
В другом аспекте изобретение относится к способу лечения IgAN (иммуноглобулиновой А нефропатии) у нуждающегося в этом субъекта, при этом способ включает введение субъекту терапевтически эффективного количества формы НВ LNP023 для лечения субъекта.
В одном варианте осуществления способ лечения IgAN у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе не более приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе не более приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способ лечения IgAN у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе от приблизительно 20 мг до приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе от приблизительно 10 мг до приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способ лечения IgAN у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе приблизительно 20 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг или приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 10 мг, приблизительно 25 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способа лечения IgAN форму НВ LNP023 вводят субъекту в общей суточной дозе около 20 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 10 мг.
В одном варианте осуществления способа лечения IgAN форму НВ LNP023 вводят субъекту в общей суточной дозе около 50 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 25 мг.
В одном варианте осуществления способа лечения IgAN форму НВ LNP023 вводят субъекту в общей суточной дозе около 100 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 50 мг.
В одном варианте осуществления способа лечения IgAN форму НВ LNP023 вводят субъекту в общей суточной дозе около 200 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 100 мг.
В одном варианте осуществления способа лечения IgAN форму НВ LNP023 вводят субъекту в общей суточной дозе около 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 200 мг.
В одном варианте осуществления способа лечения IgAN форму НВ LNP023 вводят субъекту перорально дважды в день (b.i.d.), например, приблизительно каждые 12 часов.
В одном варианте осуществления способа лечения IgAN форму НВ LNP023 вводят перорально дважды в день (b.i.d.), например, приблизительно каждые 12 часов, субъекту в дозе 200 мг, в пересчете на безводное свободное основание LNP023.
В другом аспекте изобретение относится к способу лечения MN (мембранозной нефропатии), например, идиопатической MN (iMN), у нуждающегося в этом субъекта, при этом способ включает введение субъекту терапевтически эффективного количества формы НВ LNP023 для лечения субъекта.
В одном варианте осуществления способ лечения MN, например, iMN, у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе не более приблизительно 4 00 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе не более приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способ лечения MN, например, iMN, у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе от приблизительно 20 мг до приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе от приблизительно 10 мг до приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способ лечения MN, например, iMN, у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе приблизительно 20 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг или приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 10 мг, приблизительно 25 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способа лечения MN форму НВ LNP023 вводят субъекту в общей суточной дозе около 20 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 10 мг.
В одном варианте осуществления способа лечения MN форму НВ LNP023 вводят субъекту в общей суточной дозе около 50 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 25 мг.
В одном варианте осуществления способа лечения MN форму НВ LNP023 вводят субъекту в общей суточной дозе около 100 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 50 мг.
В одном варианте осуществления способа лечения MN форму НВ LNP023 вводят субъекту в общей суточной дозе около 200 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 100 мг.
В одном варианте осуществления способа лечения MN форму НВ LNP023 вводят субъекту в общей суточной дозе около 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 200 мг.
В одном варианте осуществления способа лечения MN форму НВ LNP023 вводят субъекту перорально дважды в день (b.i.d.), например, приблизительно каждые 12 часов.
В одном варианте осуществления способа лечения MN форму НВ LNP023 вводят перорально дважды в день (b.i.d.), например, приблизительно каждые 12 часов, субъекту в дозе 200 мг, в пересчете на безводное свободное основание LNP023.
В другом аспекте изобретение относится к способу лечения атипичного гемолитико-уремического синдрома (aHUS) у нуждающегося в этом субъекта, при этом способ включает введение субъекту терапевтически эффективного количества формы НВ LNP023 для лечения субъекта.
В одном варианте осуществления способ лечения aHUS у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе не более приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе не более приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способ лечения aHUS у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе от приблизительно 20 мг до приблизительно 400 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе от приблизительно 10 мг до приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способ лечения aHUS у субъекта включает введение субъекту формы НВ LNP023 в суточной дозе приблизительно 20 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг или приблизительно 4 00 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 10 мг, приблизительно 25 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг, в пересчете на безводное свободное основание LNP023.
В одном варианте осуществления способа лечения aHUS форму НВ LNP023 вводят субъекту в общей суточной дозе около 20 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 10 мг.
В одном варианте осуществления способа лечения aHUS форму НВ LNP023 вводят субъекту в общей суточной дозе около 50 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 25 мг.
В одном варианте осуществления способа лечения aHUS форму НВ LNP023 вводят субъекту в общей суточной дозе около 100 мг, в пересчете на безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 50 мг.
В одном варианте осуществления способа лечения aHUS форму НВ LNP023 вводят субъекту в общей суточной дозе около 200 мг, рассчитанной как безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 100 мг.
В одном варианте осуществления способа лечения aHUS форму НВ LNP023 вводят субъекту в общей суточной дозе около 400 мг, рассчитанной как безводное свободное основание LNP023. В одном варианте осуществления введение осуществляют дважды в день (b.i.d.), например, приблизительно каждые 12 часов, в дозе приблизительно 200 мг.
В одном варианте осуществления способа лечения aHUS форму НВ LNP023 вводят субъекту перорально дважды в день (b.i.d.), например, приблизительно каждые 12 часов.
В одном варианте осуществления способа лечения aHUS форму НВ LNP023 вводят перорально дважды в день (b.i.d.), например, приблизительно каждые 12 часов, субъекту в дозе 200 мг, в пересчете на безводное свободное основание LNP023.
Все вышеупомянутые варианты осуществления, относящиеся к способам лечения определенных заболеваний в определенных дозах, в равной степени применимы к
форме НВ препарата LNP023 для применения в лечении определенных заболеваний в определенных дозах в соответствии с настоящим изобретением;
применению формы НВ LNP023 в производстве лекарственного средства для лечения определенных заболеваний в определенных дозах в соответствии с настоящим изобретением;
применению формы НВ LNP023 для лечения определенных заболеваний в определенных дозах в соответствии с настоящим изобретением; и
фармацевтической композиции, содержащей форму НВ LNP023 и один или более фармацевтически приемлемых носителей, для применения в лечении определенных заболеваний в определенных дозах в соответствии с настоящим изобретением.
Способы испытания морфологических свойств
Соотношение сторон: Соотношение сторон означает соотношение максимальной длины кристалла к его минимальной ширине. При соотношении сторон, равном 1, кристалл имеет изометрический габитус кристалла. При уменьшении соотношения сторон ниже 1 габитус кристалла становится все более и более пластинообразным. Напротив, когда соотношение сторон увеличивается все больше и больше выше 1, кристалл приближается к игольчатому габитусу кристалла. В соответствии с раскрытием равносторонние частицы формы НВ имеют соотношение сторон а50, например, от приблизительно 0,4 до приблизительно 0,7.
Соотношение сторон определяется способом динамического анализа изображений (DIA) с помощью анализатора динамических изображений QICPIC компании Sympatec GmbH, Clausthal-Zellerfeld, Германия.
Гранулометрический состав: Гранулометрический состав измеряется способом лазерной дифракции света (LLD) с помощью прибора Helos компании Sympatec GmbH, Clausthal-Zellerfeld, Германия.
Консолидированная насыпная плотность: Консолидированная (15 кПа) насыпная плотность измеряется с помощью порошкового реометра FT4 (Freeman Technology).
ПРИМЕРЫ
Следующие неограничивающие примеры являются иллюстративными для раскрытия и не должны быть истолкованы как каким-либо образом ограничивающие.
Пример 1. Получение формы НВ гидрохлорида LNP023
Соль LNP023-HCl формы А получали, как описано в примере 26d из WO 2015/009616. Суспендировали 9,3 г гидрохлорида формы А LNP023 в 48,1 г смеси ацетона и воды (ацетон : вода = 78:22 м:м) и растворяли при температуре приблизительно 50°С.Раствор охлаждали до 4 0°С и добавляли 136 г смеси ацетона и этилацетата (ацетон : этилацетат = 1:2 м : м) в течение 24 часов. Суспензию охлаждали до 10°С для завершения кристаллизации. Продукт выделяли посредством фильтрования и высушивали в вакууме при 50°С с получением 7,7 г кристаллического моногидрата соли LNP023-HCl (форма НВ).
Пример 2. Получение формы НВ гидрохлорида LNP023 с использованием затравочных кристаллов
Соль LNP023-HCl формы А получали, как описано в примере 26d из WO 2015/009616. Суспендировали 42 г формы А гидрохлорида LNP023 в 212 г смеси ацетона и воды (ацетон : вода = 80:20 м : м) и растворяли при температуре приблизительно 50°С. Раствор охлаждали до 25°С и добавляли 0,4 г затравочных кристаллов моногидрата кристаллической соли LNP023-HCl (форма НВ), полученного в соответствии с примером 1, для инициирования роста кристаллов. Затем в течение 3 часов добавляли 207 г ацетона, затем 414 г этилацетата в течение 6 часов. Продукт выделяли посредством фильтрования и высушивали в вакууме при 50°С с получением 36 г кристаллического моногидрата соли LNP023-HCl (форма НВ).
Пример 3. Получение разработанной формы НВ гидрохлорида LNP023 с использованием температурных циклов Соль LNP023-HCl формы А получали, как описано в примере 26d из WO 2015/009616. Суспендировали 80 г формы А гидрохлорида LNP023 в 409 г смеси ацетона и воды (ацетон : вода = 78:22 м : м) и растворяли при температуре приблизительно 50°С.Раствор охлаждали до 4 0°С и добавляли 0,32 г затравочных кристаллов моногидрата кристаллической соли LNP023-HCl (форма НВ), полученного в соответствии с примером 1, для инициирования роста кристаллов. Затем проводили температурное циклирование посредством охлаждения до 10°С и нагревания до 35°С в течение 9 раз. Затем в течение 12 часов добавляли 1090 г этилацетата с последующим охлаждением до 5°С. Продукт выделяли посредством фильтрования и высушивали в вакууме при 50°С с получением 66 г кристаллического моногидрата соли LNP023-HCl (форма НВ) со столбчатыми частицами.
Пример 4. Характеристика формы НВ гидрохлорида LNP023
Указанное в заголовке соединение имеет тот же спектр 1Н NMR, что и пример 26d WO 2015/009616.
Примеры анализов и интерпретации результатов:
Порошковая рентгеновская дифракция
PXRD проводили на дифрактометре Bruker D8 Advance с геометрией Брэгга-Брентано, излучением Cu-Кальфа1,2 (длина волны 0,15419 нм) с фокусирующим зеркалом и твердотельным детектором PIXcel. Дифрактограмму записывали при напряжении на трубке от 30 до 40 кВ и токе трубки 40 мА с шагом 0, 015-0, 020° 2-тета с приблизительным временем шага не менее 40 с в угловом диапазоне от 2° до 40° 2-тета в условиях окружающей среды. Типичная точность значений 2-тета находится в диапазоне ± 0,2° 2-тета, например, ± 0,1° 2-тета. Таким образом, дифракционный пик формы НВ гидрохлорида LNP023, который появляется, например, при 9,2° 2-тета, может появляться в диапазоне от (9,2-0,2)° до (9,2±0,2)° 2-тета, например, от (9,2-0,1)° до (9,2±0,1)° 2-тета на большинстве рентгеновских дифрактометров при стандартных условиях.
Репрезентативная дифрактограмма формы НВ гидрохлорида LNP023 представлена на фиг. 1 в настоящем документе. Соответствующий список пиков предоставлен в Таблице 2 ниже.
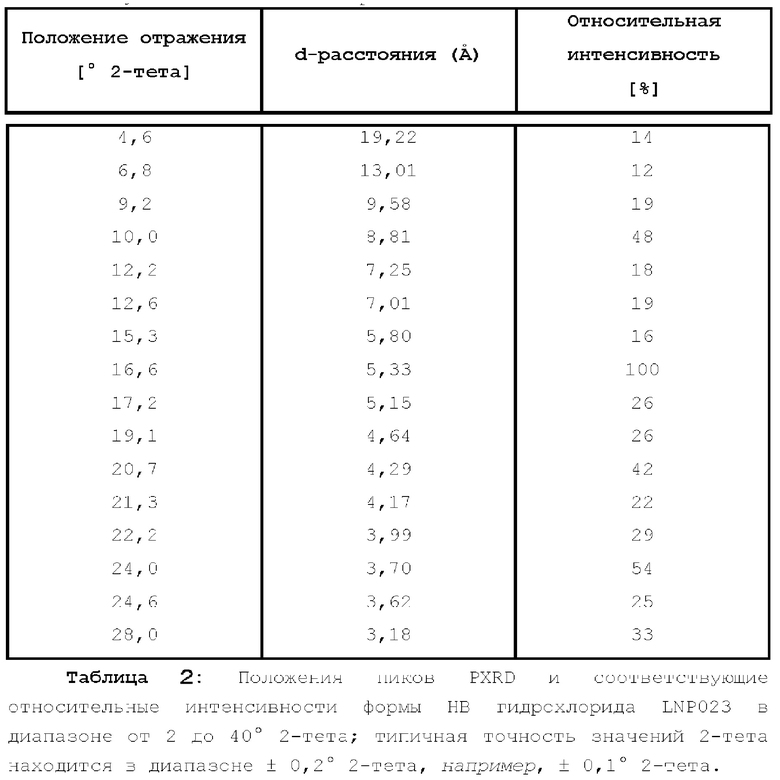
Относительная интенсивность, как показано в таблице 2, может быть в определенной степени изменена вследствие морфологии частиц формы НВ.
Инфракрасная спектроскопия с преобразованием Фурье
Спектр FTIR регистрировали с помощью методики ослабленного полного отражения (ATR) на спектрометре Nicolet 6700 с разрешением 4 см-1 при комнатной температуре. Число сканирований составило 64, и диапазон составил от 650 до 4000 волновых чисел (см-1).
Для регистрации спектра на поверхность алмаза в виде порошка наносили кончиком шпателя образец. Затем образец прижимали к алмазу с помощью сапфировой наковальни и записывали спектр. В качестве фонового спектра использовался спектр чистого алмаза. Типичная точность значений волнового числа находится в диапазоне приблизительно ±2 см-1. Таким образом, инфракрасный пик формы НВ гидрохлорида LNP023, описанного в настоящем документе, при 3452 см-1 может появляться между (3452-2) и (3452±2) см-1 на большинстве инфракрасных спектрометров при стандартных условиях.
Репрезентативный спектр FTIR кристаллической формы НВ, описанной в настоящем документе, представлен на фиг. 3, и соответствующий список пиков приведен ниже с типичной точностью волновых чисел в диапазоне ±2 см-1.
3452, 3274, 2933, 2875, 2732, 1709, 1692, 1658, 1615, 1601, 1515, 1497, 1461, 1439, 1425, 1384, 1243, 1184, 1069, 767, 739 см-1.
Дифференциальная сканирующая калориметрия
DSC проводили на приборе ТА Discovery DSC 2500. Образец (2,7 мг) нагревали в алюминиевом тигле Tzero с перфорированной алюминиевой крышкой от 30 до 300°С со скоростью 10° К/мин. В качестве продувочного газа использовали азот (скорость продувки 50 мл/мин).
Репрезентативная кривая ДСК представлена на фиг. 4 далее и показывает широкое эндотермическое явление, которое заканчивается при температуре приблизительно 170°С, за которым следует экзотермическое разложение при температуре приблизительно 200°С при измерении при скорости нагрева 10 К/мин. Точнее, эндотермическое явление находится в диапазоне от 35°С до 170°С.
Термогравиметрический анализ
TGA проводили на приборе Mettler Toledo DSC/TGA 1. Образец (от 10 до 20 мг) нагревали в алюминиевом тигле объемом а100 мкл, закрытом алюминиевой крышкой, от 30 до 300°С со скоростью 20 К/мин. Крышка автоматически прокалывалась в начале измерения. В качестве продувочного газа использовали азот (скорость продувки 50 мл/мин).
Репрезентативная кривая TGA представлена на фиг. 5 далее и показывает стадию от приблизительно 30 до 220°С, что связано с потерей воды (дегидратацией) и остаточных растворителей. Масса в течение стадии была определена как приблизительно 4,1%. Содержание воды в образце 3,7% определяли кулонометрическим титрованием по Карлу-Фишеру, что соответствует 0,98 моль воды на моль LNP023 HCl. Определение воды проводили на кулонометре Metrohin 831 KF, подключенном к процессору обработки образцов 774 Oven, который для измерения нагревали до 160°С.
Динамическая сорбция паров
Динамические изотермы сорбции паров регистрировали с помощью прибора DVS Advantage. Цикл измерений начинали при относительной влажности окружающей среды (RH) 4 0%. Затем RH снижали до 0% с шагом 10%. Затем RH увеличивали от 0% до 90% с шагом 10% и от 90% до 95% с шагом 5% в цикле сорбции, а затем уменьшали до 0% в цикле десорбции с шагом 10% или 5%. Наконец, RH воздуха увеличивали до относительной влажности окружающей среды 4 0% с шагом 10%. Время одного шага устанавливали на минимум 3 часа и максимум 6 часов. Если равновесное состояние с постоянным изменением массы 0,002%/мин в течение минимум 5 мин было достигнуто до максимального времени для всех исследованных образцов, то последовательная стадия увлажнения применялась до максимального времени 6 часов. Если равновесие не было достигнуто, то после максимального времени в 6 часов применялась следующая стадия увлажнения. Температура составляла 25±1,0°С.
На фиг. 6 показано изменение равновесной массы (дельта m в весовых% - контрольный вес при RH 0% по оси у) формы НВ гидрохлорида LNP023 во время цикла сорбции (отмечено треугольниками) от 0% до 95% RH, а также во время цикла десорбции (отмечено квадратами) от 95 до 0% RH (по оси х). Может наблюдаться разница в молекулярной массе между 40 и 95% RH менее 0,2 вес. % и отсутствие значительного гистерезиса между кривой сорбции и десорбции. Поэтому форма НВ гидрохлорида LNP023, описанная в настоящем документе, может считаться негигроскопичной. PXRD формы НВ гидрохлорида LNP023 остается неизменной после эксперимента.
Электронная микроскопия
Электронно-микроскопические изображения получали с помощью микроскопа Gemini SE 300 (Zeiss) с использованием SE-детектора. Как видно на фиг. 7а и 7b, форма НВ гидрохлорида LNP023, полученная с помощью методик инженерной кристаллизации, например, как показано в примере 3, содержит частицы столбчатой и равносторонней формы, что объясняет превосходные текучие свойства порошка.
Пример 5. Получение фармацевтической композиции
Частицы формы НВ, полученные в примере 3, переносят на штифтовую мельницу 100UPZ фирмы Hosokawa Alpine AG, Аугсбург/Германия. Частицы измельчают при скорости вращения ротора 6000 об./мин. и скорости подачи 15 кг/ч.
Полученными равносторонними частицами в количестве 50, 100 или 2 00 мг каждая наполняют твердые желатиновые капсулы размера 0.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЧАСТИЦЫ РЕЗИНАТА ФЕНИЛЭФРИНА | 2014 |
|
RU2675788C2 |
| ЧАСТИЦЫ ФЕНИЛЭФРИНА С ПОКРЫТИЕМ И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКИХ СОСТАВАХ | 2014 |
|
RU2681312C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 3-(2,6-ДИХЛОР-3,5-ДИМЕТОКСИФЕНИЛ)-1-{ 6-[4-(4-ЭТИЛПИПЕРАЗИН-1-ИЛ)-ФЕНИЛАМИНО]-ПИРИМИДИН-4-ИЛ} -1-МЕТИЛМОЧЕВИНЫ И ЕЕ ДОЛЕЙ | 2010 |
|
RU2572848C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ, СОЛИ И ПОЛИМОРФЫ ТРАНСНОРСЕРТРАЛИНА И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2578956C2 |
| ПОЛИМОРФНЫЕ ФОРМЫ ИКОТИНИБА МАЛЕАТА И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2708079C2 |
| ПОЛИМОРФНЫЕ ФОРМЫ ИКОТИНИБА И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2710013C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ИНГИБИТОРА TLR7/TLR8 | 2019 |
|
RU2792005C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ИНГИБИТОРА LTA4H | 2019 |
|
RU2808992C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ СОЕДИНЕНИЯ ТРИАЗОЛОПИРИМИДИНА | 2017 |
|
RU2754856C2 |
| СОЛИ И КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ИНДУЦИРУЮЩЕГО АПОПТОЗ АГЕНТА | 2011 |
|
RU2628560C2 |


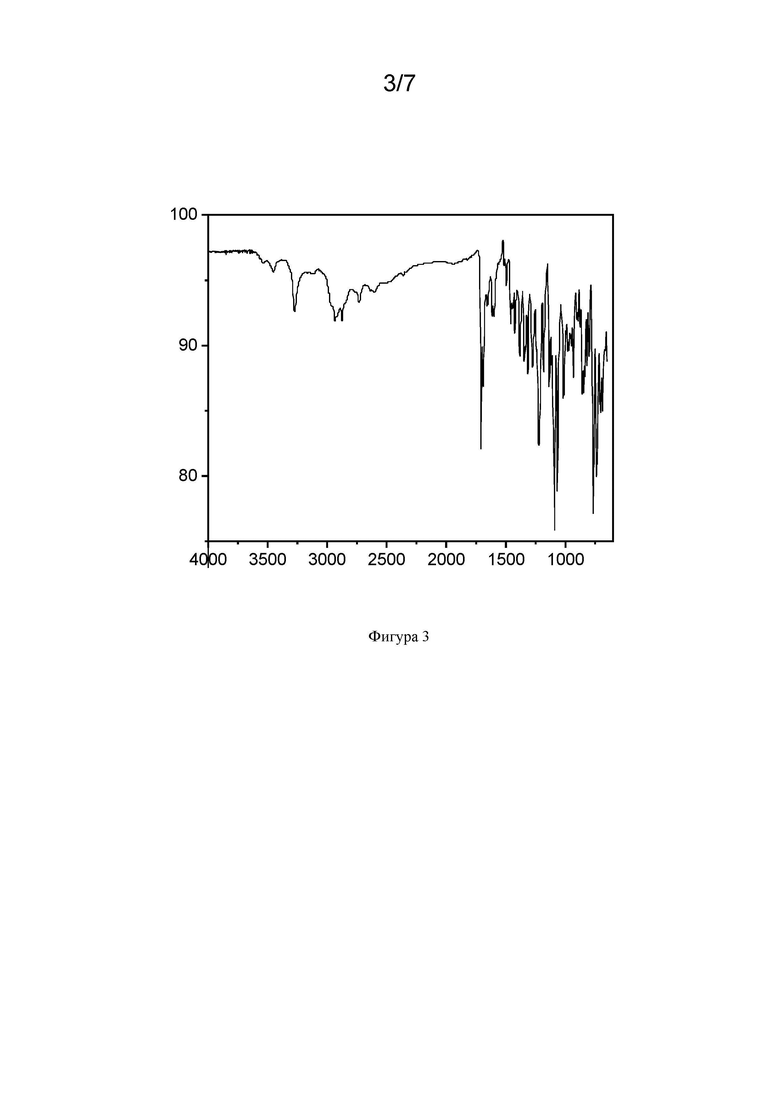
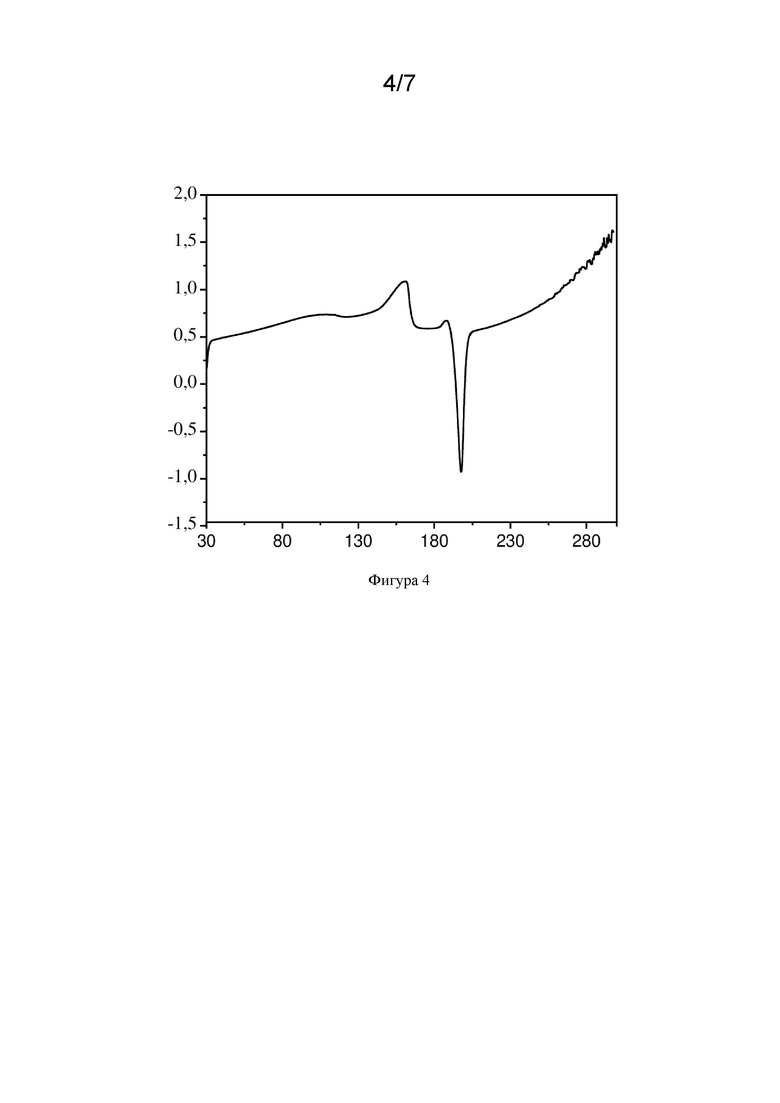



Изобретение относится к способу получения кристаллической гидратной формы гидрохлорида LNP023 (форма НВ), имеющей формулу (А), характеризующуюся порошковой рентгеновской дифрактограммой, содержащей по меньшей мере пять пиков при углах 2-тета, выбранных из (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (19,1±0,2)°, (20,7±0,2)°, (21,3±0,2)°, (22,2±0,2)°, (24,0±0,2)°, (24,6±0,2)° и (28,0±0,2) при измерении при температуре в диапазоне от 20 до 30 °С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм. Способ включает стадии (i) предоставления гидрохлорида LNP023 в твердой форме; (ii) суспендирования гидрохлорида LNP023, предоставленного на стадии (i), в первом растворителе, содержащем ацетон и воду, в массовом соотношении ацетона к воде от 60:40 до 90:10, и нагревания до температуры в диапазоне от 30 до 56 °С для растворения твердого вещества для получения раствора; (iii) охлаждения раствора, полученного на стадии (ii), и добавления второго растворителя, содержащего ацетон и этилацетат в массовом соотношении ацетона к этилацетату от 0,5:3 до 1:1, с дальнейшим охлаждением до температуры в диапазоне от около 0 до 25 °С для выделения кристаллов в маточном растворе; (iv) отделения по меньшей мере части кристаллов, полученных на стадии (iii), от маточного раствора; (v) необязательно промывания выделенных кристаллов, полученных на стадии (iv), подходящим растворителем; и (vi) сушку кристаллов, полученных на стадии (iv) или (v). На этапе (v) подходящий органический растворитель выбран из ацетона и этилацетата. Технический результат – получение кристаллической гидратной формы гидрохлорида LNP023 (форма НВ), обладающей благоприятными физико-химическими свойствами. 6 з.п. ф-лы, 8 ил., 2 табл., 5 пр.
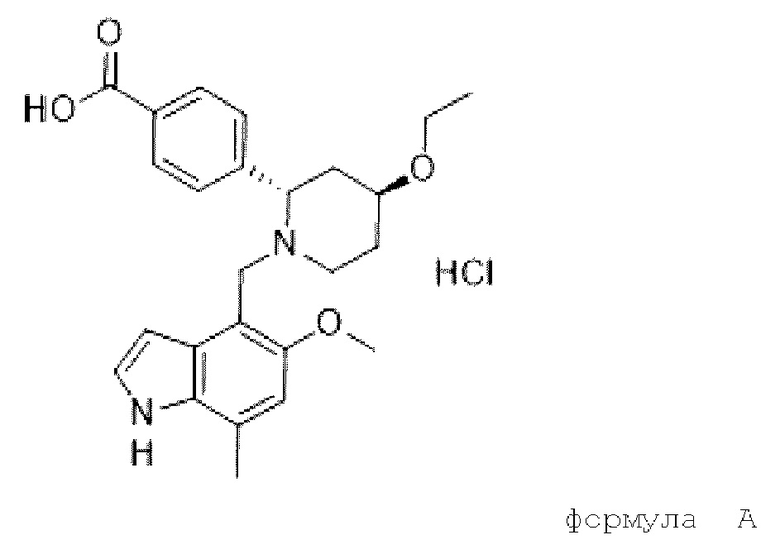
1. Способ получения кристаллической гидратной формы гидрохлорида LNP023 (форма НВ), имеющей следующую формулу (А)

характеризующуюся порошковой рентгеновской дифрактограммой, содержащей по меньшей мере пять пиков при углах 2-тета, выбранных из (4,6±0,2)°, (6,8±0,2)°, (9,2±0,2)°, (10,0±0,2)°, (12,2±0,2)°, (12,6±0,2)°, (15,3±0,2)°, (16,6±0,2)°, (17,2±0,2)°, (19,1±0,2)°, (20,7±0,2)°, (21,3±0,2)°, (22,2±0,2)°, (24,0±0,2)°, (24,6±0,2)° и (28,0±0,2) при измерении при температуре в диапазоне от 20 до 30 °С с использованием излучения Cu-Кальфа1,2 с длиной волны 0,15419 нм, где способ включает следующие стадии:
(i) предоставление гидрохлорида LNP023 в твердой форме;
(ii) суспендирование гидрохлорида LNP023, предоставленного на стадии (i), в первом растворителе, содержащем ацетон и воду, в массовом соотношении ацетона к воде от 60:40 до 90:10, и нагревание до температуры в диапазоне от 30 до 56 °С для растворения твердого вещества для получения раствора;
(iii) охлаждение раствора, полученного на стадии (ii), и добавление второго растворителя, содержащего ацетон и этилацетат в массовом соотношении ацетона к этилацетату от 0,5:3 до 1:1, с дальнейшим охлаждением до температуры в диапазоне от около 0 до 25 °С для выделения кристаллов в маточном растворе;
(iv) отделение по меньшей мере части кристаллов, полученных на стадии (iii), от маточного раствора;
(v) необязательно промывание выделенных кристаллов, полученных на стадии (iv), подходящим растворителем; и
(vi) сушка кристаллов, полученных на стадии (iv) или (v).
2. Способ по п. 1, включающий в качестве стадии (iii)
(a) охлаждение раствора, полученного на стадии (ii), добавление затравочных кристаллов моногидрата кристаллической соли LNP023-HCl (форма НВ) с последующим повторным нагреванием раствора;
(b) повторение стадии (а) по меньшей мере 3 раза.
3. Способ по п. 1 или 2, в котором добавление второго растворителя на этапе (iii) осуществляют в течение от 12 до 36 часов.
4. Способ по любому из пп. 1-3, в котором на этапе (v) подходящий растворитель выбирают из органического растворителя и воды.
5. Способ по п. 4, в котором органический растворитель выбран из ацетона и этилацетата.
6. Способ по любому из пп. 1-5, в котором на этапе (vi) сушку кристаллов выполняют при температуре 70 °С или менее.
7. Способ по любому из пп. 1-6, в котором на этапе (vi) сушку кристаллов выполняют при давлении окружающей среды или пониженном давлении.
| Устройство для использования отработавшего пара высокого давления паровозной машины | 1928 |
|
SU31030A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Mainolfi, N., Ehara, T | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Journal of Medicinal Chemistry, | |||
Авторы
Даты
2024-05-03—Публикация
2021-05-17—Подача