Данная заявка испрашивает приоритет по Международной заявке № PCT/CN2019/081919, поданной 9 апреля 2019 г., полное содержание которой включено в данный документ.
УРОВЕНЬ ТЕХНИКИ
Белковый гомеостаз или протеостаз означает способность клеток должным образом регулировать синтез, сворачивание, транспортировку и деградацию клеточных белков. Должным образом регулируемая деградация белка необходима для нормального функционирования клеток, включая их пролиферацию, дифференцировку и гибель, и часто бывает нарушена при раке и других заболеваниях.
Убиквитин-протеасомная система (UPS, англ. «ubiquitin-proteasome system») является одним из основных путей в клетках, который опосредует утилизацию и метаболическую переработку белков (Yu and Matouschek, Annu Rev Biophys, 2017, 46:149-173; Navon and Ciechanover, J Biol Chem, 2009, 284:33713-33718). Убиквитин представляет собой повсеместно экспрессируемый белок из 76 аминокислотных остатков. В случае деградации белков UPS процесс убиквитинирования происходит, когда убиквитин присоединяется к аминокислотному остатку лизина в белке-субстрате, что включает серию ферментативных этапов. Сначала убиквитин переносится на активирующий убиквитин фермент E1. Во-вторых, активированный убиквитин переносится с E1 к конъюгирующему убиквитин ферменту E2. И в-третьих, один из нескольких сотен разных ферментов убиквитинлигаз Е3 связывает убиквитин с остатком лизина в белке-субстрате. Повторение этого ферментативного процесса приводит к мечению белков-субстратов цепями полиубиквитина, которые затем доставляются к протеасоме, крупному комплексу из многих субъединиц, который разрушает белки, меченные убиквитином. Способность некоторых белков-шаперонов клетки и шаперонных комплексов направлять белки к UPS облегчается их прямым взаимодействием с убиквитинлигазами E3 (Amm et al., Biochim Biophys Acta, 2014, 1843:182-196; Taipale et al., Cell, 2012,150:987-1001). Помимо деградации белков, убиквитинирование белков также может регулировать другие процессы, такие как субклеточная локализация, активность и белок-белковые взаимодействия субстратов.
Химически индуцированная направленная деградация белков стала новым способом разработки низкомолекулярных лекарственных препаратов. В качестве способа лечения заболевания малую молекулу можно использовать для стимуляции взаимодействия целевого белка или белков с компонентом различных клеточных путей деградации белка, индуцируя таким образом деградацию целевого белка или белков.
В частности, направленные на протеолиз химеры (PROTAC) являются примером таких малых молекул, которые целенаправленно индуцируют деградацию определенных белков путем кооптации UPS (Burslem and Crews, Cell, 2020, 181:102-114; Pettersson and Crews, Drug Discov Today Technol, 2019, 31:15-27). Молекулы PROTAC представляют собой бифункциональные малые молекулы, которые одновременно связываются с целевым белком или белками и убиквитинлигазой E3. Эта индуцированная близость целевого(ых) белка(ов) и лигазы E3 вызывает убиквитинирование и последующую деградацию целевого(ых) белка(ов) протеасомой. Хотя PROTAC, которые содержат компоненты, связывающие целевые белки, которые случайным образом связываются с разными белками, часто могут вызывать деградацию разных белков, в некоторых случаях отталкивание зарядов и стерическое столкновение между отдельными мишенями и лигазой E3 могут повысить наблюдаемую селективность деградации (Pettersson and Crews, Drug Discov Today Technol, 2019, 31:15-27; Bondeson et al, Cell Chem Biol, 2018, 25:78-87; Gadd et al., Nat Chem Biol, 2017, 13:514-521; Zengerle et al., ACS Chem Biol, 2015, 10:1770-1777).
Технология AUTAC следует аналогичному принципу индуцированной близости, но направлена на деградацию белков посредством аутофагии (Daiki et al., Mol Cell, 2019, 76:797-810).
Однако имеющимся на сегодня технологиям направленной деградации белков присущи некоторые недостатки. Они включают случайную деградацию целевого белка во многих тканях и органах, а не только в ткани и органе, в которых целевой белок участвует в болезненном процессе, что, как ожидается, приведет к нежелательным побочным эффектам лечения. Кроме того, за счет мутаций в компонентах UPS, таких как лигазы E3, может развиваться резистентность к PROTAC (Ottis et al., ACS Chem Biol, 2019, 14:2215-2223; Zhang et al., Mol Cancer Ther, 2019, 18:1302-1311), приводя к потере терапевтической эффективности. Таким образом, существует потребность в улучшенных/альтернативных способах и композициях для направленной деградации белка.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены химеры для направленной на опухоль деградации белка (T-PEACH), содержащие первый фрагмент, который способен связываться с целевым белком (например, BRD4) или белками, и второй фрагмент, который способен связывать белок-шаперон или белковый компонент шаперонного комплекса. Такие соединения T-PEACH включают имеющие формулу I:
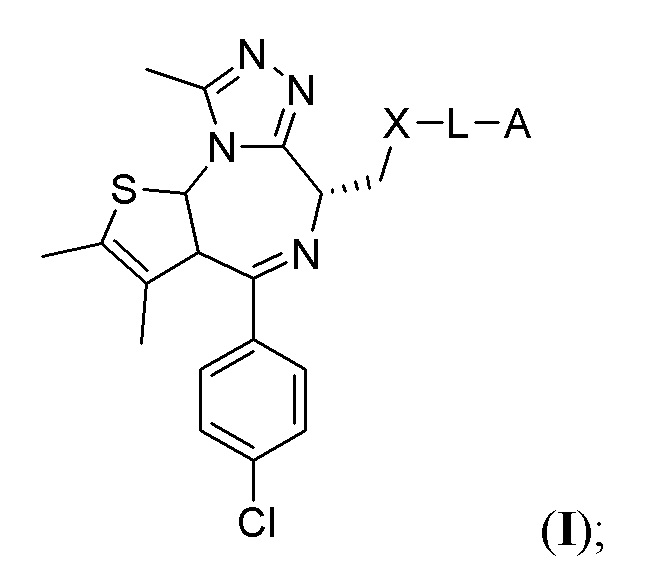
и их фармацевтически приемлемые соли, где X, L и A соответствуют определению в данном документе.
Также предложены композиции, содержащие описанные соединения формулы I, а также способы их производства. В одном аспекте описанные соединения индуцируют направленную деградацию онкогенных белков селективным в отношении опухоли образом и применимы в лечении рака и связанных с ним патологических состояний.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 приведен вестерн-блот деградации BRD4, индуцированной соединением 074.
На Фиг. 2 приведен вестерн-блот BRD4 после обработки соединением 074 и/или ингибитором протеасом бортезомибом.
На Фиг. 3a проиллюстрирован средний объем опухолей в модели с ксенотрансплантатом ОМЛ MV4-11 у мышей, обработанных соединением 074.
На Фиг. 3b проиллюстрирована средняя масса тела в модели с ксенотрансплантатом ОМЛ MV4-11 у мышей, обработанных соединением 074.
На Фиг. 4a проиллюстрирован средний объем опухолей в модели с ксенотрансплантатом ДВКЛ SU-DHL-4 у мышей, обработанных соединениями 074 и 078.
На Фиг. 4b проиллюстрирована средняя масса тела в модели с ксенотрансплантатом ДВКЛ SU-DHL-4 у мышей, обработанных соединениями 074 и 078.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
1.Общее описание соединений
В данном документе предложены соединения T-PEACH, имеющие формулу I:
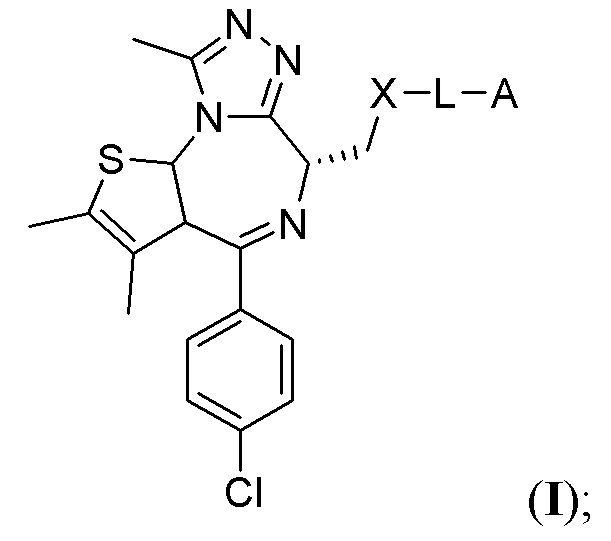
или их фармацевтически приемлемая соль, где
X представляет собой C(O) или (C1-C4)алкилен;
A представляет собой 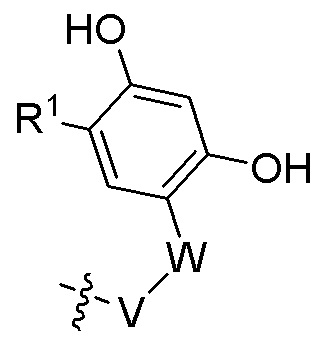 ;
;
W представляет собой 5- или 6-членный гетероарил, необязательно замещенный 1-3 группами, выбранными из R2;
V представляет собой фенил или 5-9-членный гетероарил, необязательно замещенный 1-3 группами, выбранными из R3;
R1 представляет собой галоген, (C1-C4)алкил, галоген(C1-C4)алкил, (C1-C4)алкокси или галоген(C1-C4)алкокси;
R2 представляет собой (C1-C4)алкил, галоген(C1-C4)алкил, (C2-C6)алкенил, галоген(C2-C6)алкенил, (C2-C6)алкинил, галоген(C2-C6)алкинил, CN, -C1-4алкилORa, -ORa, -C(O)Ra, -C(O)ORa, -C(O)NRaRb, -C(O)NRa(C1-4алкилен)ORa, -C(O)NRa(C1-4алкилен)NRaRb, -C(O)NRa(C1-4алкилен)OR, -NRaRb, -O(C1-4алкилен)NRaRb, -C1-4алкилNRaRb, -SRa, -S(O)Ra, -S(O)2Ra, -S(O)NRaRb, -SO2NRaRb, -NRa(C1-4алкил)ORa, -NRa(C1-4алкил)NRaRb, -C1-6алкилC(O)NRaRb, фенил или 5-7-членный гетероарил, где каждый из указанных фенила или 5-7-членного гетероарила необязательно и независимо замещен 1-3 группами, выбранными из R4;
каждый из Ra и Rb независимо выбран из водорода и (C1-C4)алкила, где указанный (C1-C4)алкил необязательно замещен одним или более галогеном или 3-7-членным гетероциклилом, или ими обоими;
каждый из R3 и R4 независимо представляет собой галоген, -NRaRb, (C1-C4)алкил, галоген(C1-C4)алкил, (C1-C4)алкокси или галоген(C1-C4)алкокси; и
L представляет собой линкер.
2.Определения
В контексте данного документа форма единственного числа относится к одному или более чем одному, например по меньшей мере к одному, грамматическому объекту. Употребление формы единственного числа в сочетании с термином «содержащий» может означать в данном документе «один», но также соответствует значению «один или более» «по меньшей мере один» и «один или более чем один».
В контексте данного документа термины «около» и «приблизительно» в общем случае означают приемлемую степень погрешности для измеряемой величины с учетом типа или точности измерений. Примеры степени погрешности находятся в пределах 20 процентов (%), как правило, в пределах 10% и, чаще, в пределах 5% от заданного диапазона значений. Термин «по существу» означает более 50%, предпочтительно более 80% и наиболее предпочтительно более 90% или 95%.
В контексте данного документа термин «содержащий» или «содержит» употребляется в отношении композиций, способов и их соответствующего(их) компонент(ов), которые присутствуют в заданном варианте осуществления, но допускает включение не указанных элементов.
В контексте данного документа термин «состоящий преимущественно из» относится к тем элементам, которые необходимы для заданного варианта осуществления. Этот термин допускает наличие дополнительных элементов, которые не оказывают существенного влияния на основные и новые или функциональные характеристики этого варианта осуществления изобретения.
Термин «состоящий из» относится к композициям, способам и их соответствующим компонентам, описанным в данном документе, которые исключают любой элемент, не перечисленный в этом описании варианта осуществления.
В контексте данного документа термин «алкил» означает насыщенный нециклический углеводород с прямой или разветвленной цепью, содержащий, если не указано иное, от 1 до 10 атомов углерода, например, (C1-C6)алкил или (C1-C4)алкил. Репрезентативные алкилы с прямой цепью включают метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил и н-децил; тогда как насыщенные разветвленные алкилы включают изопропил, втор-бутил, изобутил, трет-бутил, изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил, 2,3-диметилпентил, 2,4-диметилпентил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилпентил, 2,2-диметилгексил, 3,3-диметилпентил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилпентил, 3-этилпентил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, 2-метил-4-этилпентил, 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2-метил-4-этилгексил, 2,2-диэтилпентил, 3,3-диэтилгексил, 2,2-диэтилгексил, 3,3-диэтилгексил и т. п.
В контексте данного документа термин «алкенил» означает насыщенный нециклический углеводород с прямой или разветвленной цепью, содержащий, если не указано иное, от 2 до 10 атомов углерода (например, (C2-C6)алкенил или (C2-C4)алкенил) и содержащий по крайней мере одну углерод-углеродную двойную связь. Репрезентативные (C2-C10)алкенилы с прямой или разветвленной цепью включают винил, аллил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил-2-бутенил, 2,3-диметил-2-бутенил, 1-гексенил, 2-гексенил, 3-гексенил, 1-гептенил, 2-гептенил, 3-гептенил, 1-октенил, 2-октенил, 3-октенил, 1-ноненил, 2-ноненил, 3-ноненил, 1-деценил, 2-деценил, 3-деценил и т. п.
В контексте данного документа термин «алкинил» означает насыщенный нециклический углеводород с прямой или разветвленной цепью, содержащий, если не указано иное, от 2 до 10 атомов углерода (например, (C2-C6)алкинил или (C2-C4)алкинил) и содержащий по крайней мере одну углерод-углеродную тройную связь. Репрезентативные алкинилы с прямой или разветвленной цепью включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-бутинил, 4-пентинил, 1-гексинил, 2-гексинил, 5-гексинил, 1-гептинил, 2-гептинил, 6-гептинил, 1-октинил, 2-октинил, 7-октинил, 1-нонинил, 2-нонинил, 8-нонинил, 1-децинил, 2-децинил, 9-децинил и т. п.
В контексте данного документа «4-6-членный циклоалкил» означает насыщенный моноциклический алкильный радикал, содержащий от 4 до 6 атомов углерода. Репрезентативные циклоалкилы включают циклопропил, циклобутил, циклопентил и циклогексил.
В контексте данного документа термин «галогеналкил» означает алкильную группу, в которой один или более (в том числе все) водородных радикалов замещены группой галогена, причем каждая группа галогена независимо выбрана из -F, -Cl, -Br и -I. Репрезентативные галогеналкильные группы включают трифторметил, бромметил, 1,2-дихлорэтил, 4-иодбутил, 2-фторпентил и т.п.
В контексте данного документа «алкокси» представляет собой алкильную группу, которая присоединена к другому фрагменту посредством кислородного линкера.
В контексте данного документа «галогеналкокси» представляет собой галогеналкильную группу, которая присоединена к другому фрагменту посредством кислородного линкера.
В контексте данного документа термин «алкилен» относится к алкильной группе, которая имеет две точки присоединения. Предпочтительными являются алкиленовые группы с прямой цепью. Неограничивающие примеры алкиленовых групп включают метиленэтилен, н-пропилен, изопропилен и т. п. Алкиленовые группы необязательно могут быть замещены одним или более заместителями.
В контексте данного документа термин «гетероциклил» означает моноциклическую гетероциклическую кольцевую систему, которая представляет собой насыщенное кольцо или ненасыщенное неароматическое кольцо, содержащее, насколько позволяют размер и валентность, до 5 гетероатомов, независимо выбранных из азота, кислорода и серы. Гетероцикл может быть присоединен посредством любого гетероатома или атома углерода. Репрезентативные гетероциклы включают морфолинил, тиоморфолинил, пирролидинонил, пирролидинил, пиперидинил, пиперазинил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропириндинил, тетрагидропиримидинил и т. п.
В контексте данного документа термин «гетероароматический», «гетероарил» или подобные термины означают, насколько позволяет определенный размер, моноциклическое или полициклическое гетероароматическое кольцо, содержащее атомы углерода в кольце и один или более гетероатомов кольца, выбранных из азота, кислорода и серы. Репрезентативные гетероарильные группы включают пиридил, фуранил, тиенил, пирролил, оксазолил, имидазолил, тиазолил, изоксазолил, хинолинил, пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, триазолил, тиадиазолил, изохинолинил, индазолил, бензоксазолил, бензофурил, индолизинил, имидазопиридил, тетразолил, бензимидазолил, бензотиазолил, бензотиадиазолил, бензоксадиазолил, индолил, тетрагидроиндолил, азаиндолил, имидазопиридил, хиназолинил, пуринил, бензотиенил и т. п. Точка присоединения гетероароматического или гетероарильного кольца к другой группе может находиться у атома углерода или у гетероатома гетероароматических или гетероарильных колец.
В контексте данного документа термин «галоген» или «гало» означает F, Cl, Br или I.
Когда гетероциклильная или гетероарильная группа содержит атом азота, она может быть замещенной или незамещенной, насколько позволяет валентность.
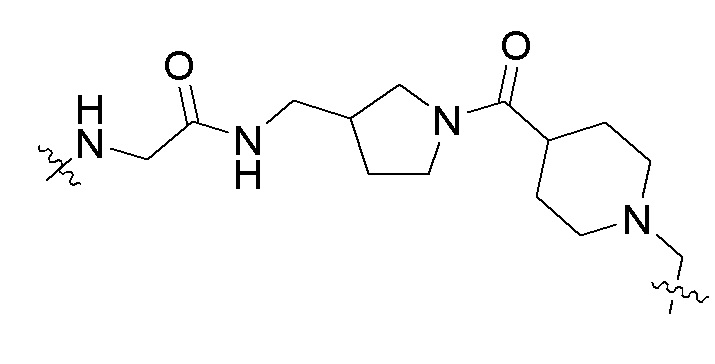
Термины «линкер» или «связывающий фрагмент», употребляемые взаимозаменяемо, относятся к химическому фрагменту, который соединяет два других фрагмента (например, первый связывающий фрагмент и второй связывающий фрагмент). Линкер может ковалентно присоединяться к первому связывающему фрагменту и второму связывающему фрагменту. В одном аспекте линкер не расщепляется in vivo. В одном аспекте линкер содержит одну или более циклических кольцевых систем. В другом аспекте линкер содержит алкильную цепь, необязательно замещенную и/или перемежаемую одной или более химическими группами. В одном аспекте линкер обладает оптимальными пространственными и химическими свойствами для обеспечения оптимальной терапевтической активности. В одном аспекте линкер не влияет на способность первого связывающего фрагмента и второго связывающего фрагмента связывать их соответствующие мишени, например, HSP90 и BRD4.
При употреблении в связи с описанием химической группы, которая может иметь несколько точек присоединения, дефис (-) обозначает точку присоединения данной группы к переменной, для которой она определена. Например, -NRaRb и -C(O)NRa(C1-4алкилен)NRaR означают, что точки присоединения этих групп находятся на атоме азота и атоме углерода, соответственно.
Пунктирная клиновидная связь, как в « », представляет точку, в которой изображенная группа присоединена к определенной переменной.
», представляет точку, в которой изображенная группа присоединена к определенной переменной.
Когда стереохимия описанного соединения указана или изображена структурой, указанный или изображенный стереоизомер является чистым по меньшей мере на 60%, 70%, 80%, 90%, 99% или 99,9% по массе относительно всех других стереоизомеров. Массовый процент чистоты относительно всех других стереоизомеров представляет собой отношение массы одного стереоизомера к массе других стереоизомеров. Например, когда один энантиомер указан или изображен структурой, изображенный или указанный энантиомер является оптически чистым по меньшей мере на 60%, 70%, 80%, 90%, 99% или 99,9% по массе. Процент оптической чистоты по массе представляет собой отношение массы энантиомера к сумме массы данного энантиомера и массы его оптического изомера.
Для применения в лекарственных средствах фармацевтически приемлемые соли описанных соединений относятся к нетоксичным «фармацевтически приемлемым солям». Формы фармацевтически приемлемых солей включают фармацевтически приемлемые кислотные/анионные или основные/катионные соли. Подходящие фармацевтически приемлемые кислотно-аддитивные соли описанных в данном документе соединений включают, например, соли неорганических кислот (таких как хлористоводородная кислота, бромистоводородная, фосфорная, азотная и серная кислоты) и органических кислот (таких как уксусная кислота, бензолсульфоновая, бензойная, метансульфоновая и п-толуолсульфоновая кислоты). Соединения по настоящему изобретению с кислотными группами, такими как карбоновые кислоты, могут образовывать фармацевтически приемлемые соли с фармацевтически приемлемым(и) основанием(ями). Подходящие фармацевтически приемлемые основные соли включают, например, соли аммония, соли щелочных металлов (такие как соли натрия и калия) и соли щелочноземельных металлов (такие как соли магния и кальция). Соединения с четвертичной аммониевой группой также содержат противоанион, такой как хлорид, бромид, йодид, ацетат, перхлорат и т. п. Другие примеры таких солей включают гидрохлориды, гидробромиды, сульфаты, метансульфонаты, нитраты, бензоаты и соли с аминокислотами, такими как глутаминовая кислота.
Термин «фармацевтически приемлемый носитель» относится к нетоксичному носителю, адъюванту или несущей среде, которые не нарушают фармакологическую активность соединения, с которым они составлены. Фармацевтически приемлемые носители, адъюванты или несущие среды, которые можно использовать в описанных в данном документе композициях, включают, но не ограничиваются этим, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлозу натрия, полиакрилаты, воски, блок-полимеры полиэтилен-полиоксипропилен, полиэтиленгликоль и шерстяной жир.
Любые композиции или способы, предложенные в настоящем документе, можно комбинировать с одной или более другими композициями и способами, предложенными в данном документе.
В контексте данного документа термин «субъект» относится к людям и отличным от человека животным, включая ветеринарных субъектов. Термин «отличное от человека животное» включает всех позвоночных, например млекопитающих и не млекопитающих, таких как отличные от человека приматы, мыши, кролики, овцы, собаки, кошки, лошади, коровы, куры, амфибии и рептилии. В предпочтительном варианте осуществления субъект представляет собой человека и может называться пациентом.
В контексте данного документа термины «лечить» или «лечение» относятся, предпочтительно, к действию для получения благоприятного или необходимого клинического результата, включая, но не ограничиваясь этим, облегчение или смягчение одного или более признаков или симптомов заболевания или патологического состояния, уменьшение степени заболевания, стабильность (т. е. отсутствие ухудшения) болезненного состояния, улучшение или смягчение болезненного состояния, уменьшение скорости или времени до прогрессирования и ремиссию (частичную или полную), как выявляемые, так и не выявляемые. «Лечение» также может означать продление выживаемости по сравнению с ожидаемой выживаемостью в отсутствие лечения. Лечение не обязательно должно приводить к излечению.
«Терапевтически эффективное количество» представляет собой количество, достаточное для лечения заболевания у субъекта. Терапевтически эффективное количество можно вводить за одно или более введений. В одном аспекте терапевтически эффективное количество относится к дозировке от около 0,01 до около 100 мг/кг массы тела/сутки.
Термины «вводить» или «введение» включают любой способ доставки фармацевтической композиции или агента в систему субъекта или в конкретный участок в организме субъекта или на его поверхности. В некоторых вариантах осуществления изобретения агент вводят внутривенно, внутримышечно, подкожно, внутрикожно, интраназально, перорально, чрескожно или через слизистые оболочки. В предпочтительном варианте осуществления агент вводят внутривенно. В другом предпочтительном варианте осуществления агент вводят перорально. Введение агента может выполняться несколькими людьми, работающими согласованно. Введение агента включает, например, назначение агента для введения субъекту и/или предоставление инструкций, напрямую или через другого человека, для приема конкретного агента, как путем самодоставки, например, путем пероральной доставки, подкожной доставки, внутривенной доставки через центральную линию и т. д .; так и путем доставки квалифицированным специалистом, например, внутривенной доставки, внутримышечной доставки, внутриопухолевой доставки и т. д.
3.Соединения
В первом варианте осуществления предложено соединение формулы I:
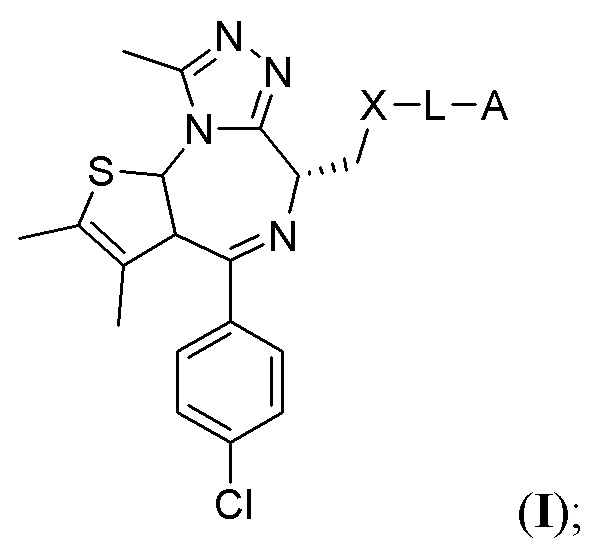
или его фармацевтически приемлемая соль, где переменные соответствуют описанным выше.
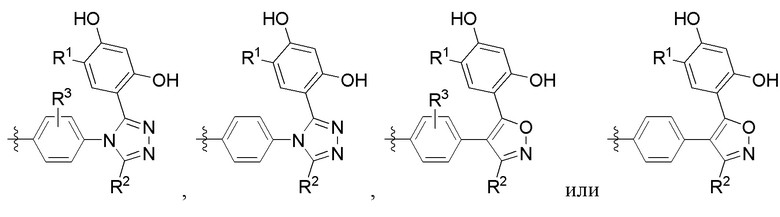
Во втором варианте осуществления A в соединении формулы I или его фармацевтически приемлемой соли представляет собой
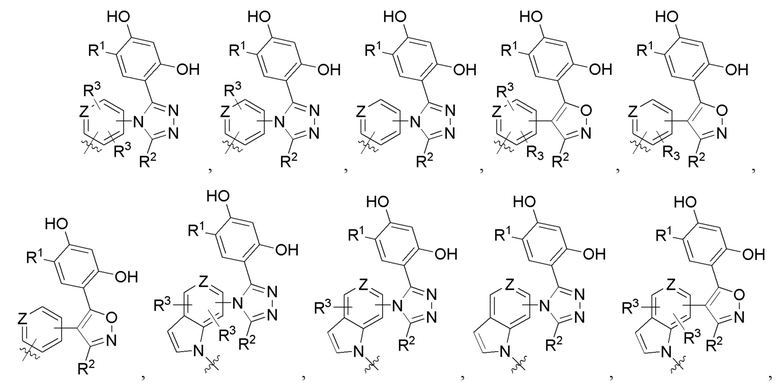
 а Z представляет собой N или CH, где оставшиеся переменные соответствуют описанным выше для формулы I. В альтернативном варианте в качестве части второго варианта осуществления A в соединении формулы I или его фармацевтически приемлемой соли соответствует определению выше, где Z представляет собой CH, а оставшиеся переменные соответствуют описанным выше для формулы I.
а Z представляет собой N или CH, где оставшиеся переменные соответствуют описанным выше для формулы I. В альтернативном варианте в качестве части второго варианта осуществления A в соединении формулы I или его фармацевтически приемлемой соли соответствует определению выше, где Z представляет собой CH, а оставшиеся переменные соответствуют описанным выше для формулы I.
В третьем варианте осуществления R3 в соединении формулы I или его фармацевтически приемлемой соли независимо представляет собой (C1-C4)алкил или галоген, где оставшиеся переменные соответствуют описанным выше для формулы I или второго варианта осуществления.
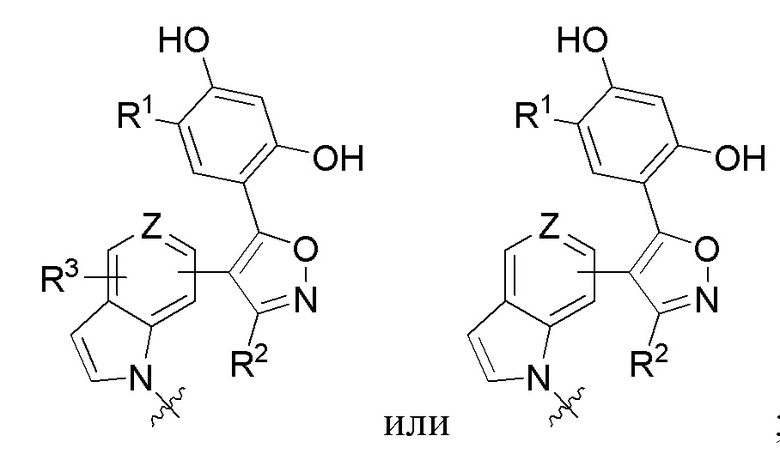
Во четвертом варианте осуществления A в соединении формулы I или его фармацевтически приемлемой соли представляет собой
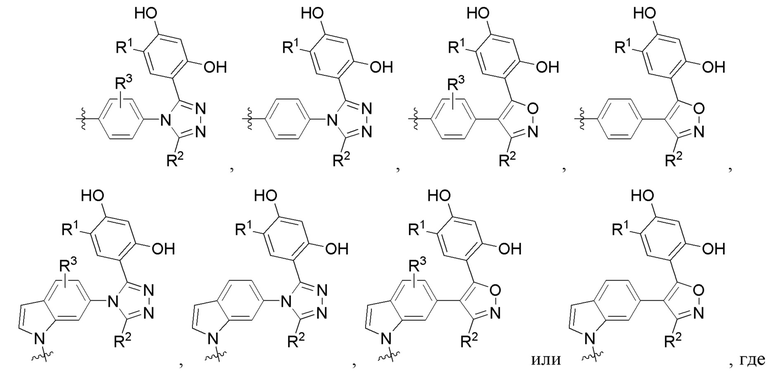 оставшиеся переменные соответствуют описанным выше для формулы I или второго или третьего варианта осуществления. В альтернативном варианте в качестве части четвертого варианта осуществления A в соединении формулы I или его фармацевтически приемлемой соли представляет собой
оставшиеся переменные соответствуют описанным выше для формулы I или второго или третьего варианта осуществления. В альтернативном варианте в качестве части четвертого варианта осуществления A в соединении формулы I или его фармацевтически приемлемой соли представляет собой
 , где оставшиеся переменные соответствуют описанным выше для формулы I или второго или третьего варианта осуществления. В другом альтернативном варианте в качестве части четвертого варианта осуществления A в соединении формулы I или его фармацевтически приемлемой соли представляет собой
, где оставшиеся переменные соответствуют описанным выше для формулы I или второго или третьего варианта осуществления. В другом альтернативном варианте в качестве части четвертого варианта осуществления A в соединении формулы I или его фармацевтически приемлемой соли представляет собой
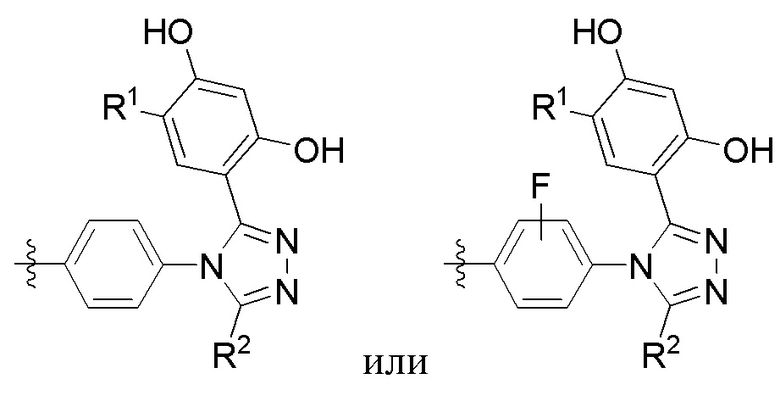 , где оставшиеся переменные соответствуют описанным выше для формулы I или второго или третьего варианта осуществления.
, где оставшиеся переменные соответствуют описанным выше для формулы I или второго или третьего варианта осуществления.
В пятом варианте осуществления L в соединении формулы I или его фармацевтически приемлемой соли представляет собой *Het1-X1-, *Het1-X1-Het2-X2-, *Het1-X1-(C1-C4)алкилен-Het2-X2-, *Het1-X1-Het2-X2(C1-C4)алкилен-, *-(CH2CH2O)o-(CH2)p-Het1-X1-Het2-(CH2CH2O)n, *-(CH2CH2O)n-(CH2)m-Het1-X1-Het2-X2, *Het1-X1-Phe-X2-NRc-X3-, *-(CH2CH2O)o-(CH2)p-Het1-X1-Phe-X2-NRc-(CH2CH2O)n-, *-(CH2CH2O)n-(CH2)m-NRc-Phe-X1-, *-(CH2CH2O)o-(CH2)p-NRc-Phe-(CH2CH2O)n-, *-(CH2CH2O)o-(CH2)p-NRc-(CH2CH2O)n-(CH2)m-, *(CH2CH2O)n-(CH2)m-NRc-(CH2CH2O)n-(CH2)m-C(O)-NRd-(CH2CH2O)o-(CH2)p-, *-(CH2CH2O)o-(CH2)p-NRc-(CH2CH2O)n-(CH2)m-Het1-X1-Het2-X2-, *-(CH2CH2O)o-(CH2)p-NRc-(CH2CH2O)n-(CH2)m-Het1-X1-Het2-X2-(CH2CH2O)o, *NRc-(CH2CH2O)n-(CH2)m-Phe-NH-X1-Het1-X2, *NRc-(CH2CH2O)n-(CH2)m-Phe-NH-X1-Het1-X2-(CH2CH2O)o, *-(CH2CH2O)o-(CH2)p-NRc-(CH2CH2O)n-(CH2)m-Phe-X1-NRc-(CH2CH2O)o-(CH2)p-, *-(CH2CH2O)o-(CH2)p-NRc-(CH2CH2O)n-(CH2)m-Het1-X1-, *-(CH2CH2O)o-(CH2)p-NRc-(CH2CH2O)n-(CH2)m-Het1-X1-(CH2CH2O)n-, *-(CH2CH2O)n-(CH2)m-NRc-(CH2)m-C(O)-NRd-Het1-X1-Het2-(CH2CH2O)o-(CH2)p или *NRc-(CH2)m-C(O)-NRd-(CH2)m-Het1-X1-Het2-X2;
* указывает точку присоединения к X;
каждый из Het1 и Het2 независимо представляет собой фенил, 4-6-членный гетероциклил, 5-7-членный гетероарил или 4-6-членный циклоалкил;
каждый из X1, X2 и X3, независимо представляет собой C(O) или (CH2)r;
каждый из Rc и Rd независимо представляет собой водород или (C1-C4)алкил; и
каждое из m, n, o, p, q и r независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5 и 6, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего или четвертого варианта осуществления.
В шестом варианте осуществления соединение формулы I представляет собой соединение формулы II:
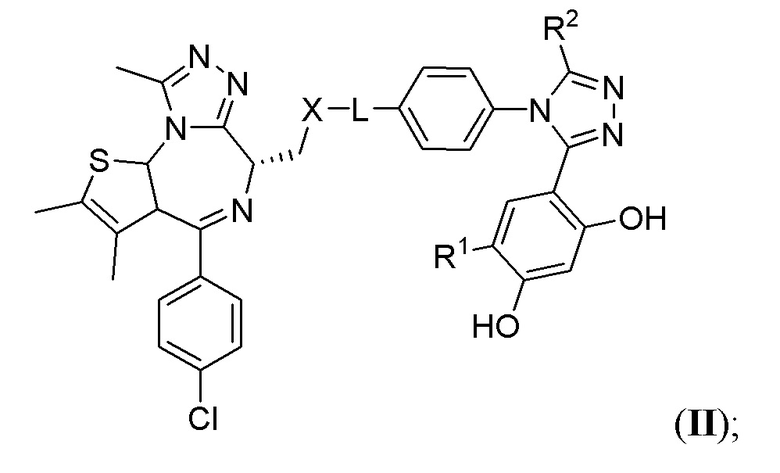
или его фармацевтически приемлемую соль, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого или пятого варианта осуществления.
В седьмом варианте осуществления R1 в соединении формулы I или II или их фармацевтически приемлемой соли представляет собой галоген или (C1-C4)алкил, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого или пятого варианта осуществления. В альтернативном варианте в качестве части седьмого варианта осуществления R1 в соединении формулы I или II или их фармацевтически приемлемой соли представляет собой хлор, изопропил, метил, пропил или этил, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого или пятого варианта осуществления. В другом альтернативном варианте в качестве части седьмого варианта осуществления R1 в соединении формулы I или II или их фармацевтически приемлемой соли представляет собой изопропил или этил, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого или пятого варианта осуществления.
В восьмом варианте осуществления R2 в соединении формулы I или II или их фармацевтически приемлемой соли представляет собой -ORa, -SRa, -C(O)NRaRb или -C(O)NRa(C1-4алкилен)NRaRb, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого, пятого или седьмого варианта осуществления.
В девятом варианте осуществления каждый из Ra и Rb в соединении формулы I или II или их фармацевтически приемлемой соли независимо выбран из водорода и (C1-C4)алкила, где указанный (C1-C4)алкил необязательно замещен 1-3 галогенами или 6-членным гетероциклилом, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого, пятого, седьмого или восьмого варианта осуществления.
В десятом варианте осуществления R2 в соединении формулы I или II или их фармацевтически приемлемой соли представляет собой OH, SH, -C(O)NHCH2CF3, -C(O)NHCH2CH3, -C(O)NH(CH2)2N(CH2CH3)2, -C(O)NHCH(CH3)2, C(O)NH2, -C(O)NH(CH2)2пиперидинил, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого, пятого, седьмого, восьмого или девятого варианта осуществления. В альтернативном варианте в качестве части десятого варианта осуществления R2 в соединении формулы I или II или их фармацевтически приемлемой соли представляет собой -C(O)NHCH2CF3 или OH, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого, пятого, седьмого, восьмого или девятого варианта осуществления.
В одиннадцатом варианте осуществления соединение формулы I представляет собой соединение формулы III:
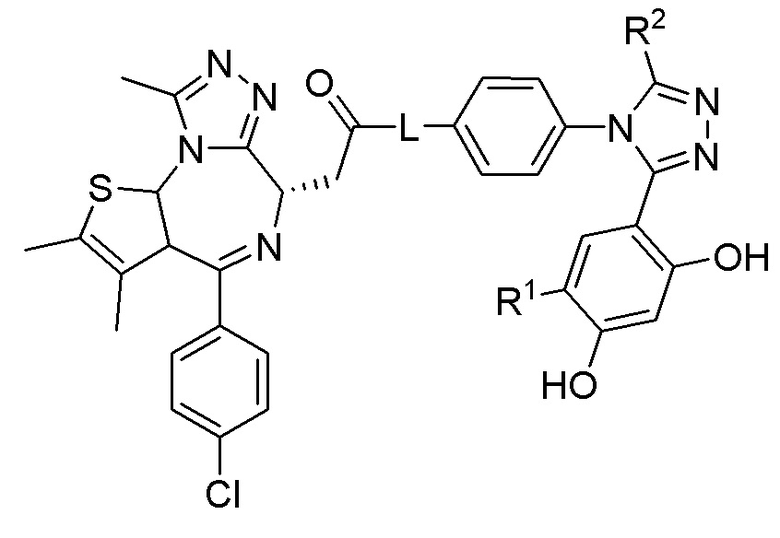 ;
;
или его фармацевтически приемлемую соль, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого, пятого, седьмого, восьмого, девятого или десятого варианта осуществления.
В двенадцатом варианте осуществления каждый из Het1 и Het2, определенных в пятом и последующих вариантах осуществления, независимо представляет собой 4-6-членный гетероциклил, где оставшиеся переменные соответствуют описанным выше для формулы I, II или III или второго, третьего, четвертого, пятого, седьмого, восьмого, девятого или десятого варианта осуществления.
В тринадцатом варианте осуществления L в соединении формулы I, II или III или их фармацевтически приемлемой соли представляет собой *Het1-X1-, *Het1-X1-Het2-X2-,*Het1-X1-Het2-(CH2CH2O)n-,*Het1-X1-Phe-X2-NRc-X3-,*Het1-X1-Phe-X2-NRc-(CH2CH2O)n-,*NRc-Phe-X1-,*NRc-Phe-(CH2CH2O)n-,*NRc-(CH2CH2O)n-(CH2)m-, *NRc-(CH2CH2O)n-(CH2)m-C(O)-NRd-(CH2CH2O)o-(CH2)p-,*NRc-(CH2CH2O)n-(CH2)m-Het1-X1-Het2-X2-,*NRc-(CH2CH2O)n-(CH2)m-Phe-NH-X1-Het1-X2-,*NRc-(CH2CH2O)n-(CH2)m-Phe-X1-Het1-X2-,*NRc-(CH2CH2O)n-(CH2)m-Phe-X1-NRc-(CH2CH2O)o-(CH2)p-,*NRc-(CH2CH2O)n-(CH2)m-Het1-X1-,*NRc-(CH2)m-C(O)-NRd-Het1-X1-Het2-(CH2CH2O)o-(CH2)p или *NRc-(CH2)m-C(O)-NRd-(CH2)m-Het1-X1-Het2-X2-, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого, пятого, седьмого, восьмого, девятого, десятого или двенадцатого варианта осуществления. В альтернативном варианте L в соединении формулы I, II или III или их фармацевтически приемлемой соли представляет собой *Het1-X1-(CH2)r, *Het1-X1-Het2-(CH2)r-, *Het1-(CH2)r-Phe-(CH2)r-NRc-(CH2)r-, *NRc-Phe-(CH2)r-, *NRc-(CH2CH2O)n-, *NRc-(CH2)m-, *NRc-(CH2)m-C(O)-NRd-(CH2)p-, *NRc-(CH2)m-C(O)-NRd-(CH2CH2O)o-, *NRc-(CH2)m-Het1-X1-Het2-(CH2)r-, *NRc-(CH2)m-Phe-(CH2)r-Het1-(CH2)r-, *NRc-Phe-NH-C(O)-Het1-(CH2)r-, *NRc-(CH2CH2O)n-(CH2)m-Phe-(CH2)r-NRc-(CH2)p- или *NRc-(CH2)m-C(O)-NRd-(CH2)m-Het1-X1-Het2-(CH2)r-, где оставшиеся переменные соответствуют описанным выше для формулы I или второго, третьего, четвертого, пятого, седьмого, восьмого, девятого, десятого или двенадцатого варианта осуществления.
В четырнадцатом варианте осуществления каждое из m, n, o, p, q и r, определенных в пятом и последующих вариантах осуществления, независимо представляет собой целое число, выбранное из 0, 1, 2 и 3, где оставшиеся переменные соответствуют описанным выше для формулы I, II или III или второго, третьего, четвертого, пятого, седьмого, восьмого, девятого, десятого, двенадцатого или тринадцатого варианта осуществления.
В пятнадцатом варианте осуществления каждый из Het1 и Het2, определенных в пятом и последующих вариантах осуществления, независимо представляет собой пиперидинил, пиперазинил, азетидинил или пирролидинил, где оставшиеся переменные соответствуют описанным выше для формулы I, II или III или второго, третьего, четвертого, пятого, седьмого, восьмого, девятого, десятого, двенадцатого, тринадцатого или четырнадцатого варианта осуществления.
В шестнадцатом варианте осуществления L в соединении формулы I, II или III или их фармацевтически приемлемой соли представляет собой

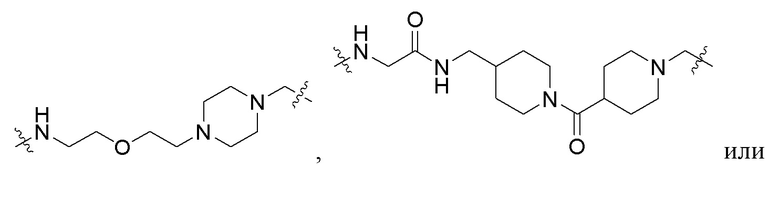
 , где оставшиеся переменные соответствуют описанным выше для формулы I, II или III или второго, третьего, четвертого, пятого, седьмого, восьмого, девятого, десятого, двенадцатого, тринадцатого, четырнадцатого или пятнадцатого варианта осуществления.
, где оставшиеся переменные соответствуют описанным выше для формулы I, II или III или второго, третьего, четвертого, пятого, седьмого, восьмого, девятого, десятого, двенадцатого, тринадцатого, четырнадцатого или пятнадцатого варианта осуществления.
В семнадцатом варианте осуществления соединение формулы I представляет собой соединение формулы IV:
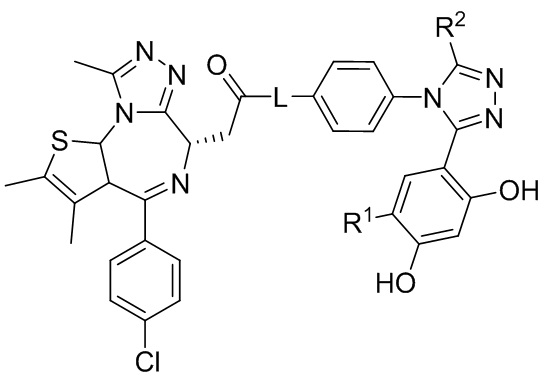 ;
;
или его фармацевтически приемлемую соль, где
R1 представляет собой (C1-C4)алкил;
R2 представляет собой - C(O)NRaRb или OH;
Ra представляет собой водород или (C1-C2)алкил;
Rb представляет собой (C1-C4)алкил, необязательно замещенный 1-3 галогенами; и
L представляет собой *Het1-X1-Het2-X2- или *Het1-X1-Phe-X2-NRc-X3, а оставшиеся переменные соответствуют описанным выше для формулы I.
В восемнадцатом варианте осуществления Ra в соединении формулы IV или его фармацевтически приемлемой соли представляет собой водород, где оставшиеся переменные соответствуют описанным выше для формулы I или семнадцатого варианта осуществления.
В девятнадцатом варианте осуществления Rb в соединении формулы IV или его фармацевтически приемлемой соли представляет собой (C1-C4)алкил, замещенный 1-3 галогенами, где оставшиеся переменные соответствуют описанным выше для формулы I или семнадцатого или восемнадцатого варианта осуществления.
В двадцатом варианте осуществления L в соединении формулы IV или его фармацевтически приемлемой соли представляет собой *Het1-(CH2)r-Het2-X2- или *Het1-(CH2)r-Phe-(CH2)r-NRc-(CH2)r, где оставшиеся переменные соответствуют описанным выше для формулы I или семнадцатого, восемнадцатого или девятнадцатого варианта осуществления. В альтернативном варианте в качестве части двадцатого варианта осуществления L в соединении формулы IV или его фармацевтически приемлемой соли представляет собой *Het1-(CH2)r-Het2-X2- или *Het1-(CH2)r-Phe-(CH2)r-NRc-(CH2)r; а каждое r независимо представляет собой целое число, выбранное из 1 и 2, и где оставшиеся переменные соответствуют описанным выше для формулы I или семнадцатого, восемнадцатого или девятнадцатого варианта осуществления.
В двадцать первом варианте осуществления каждый из Het1 и Het2 в соединении формулы IV или его фармацевтически приемлемой соли независимо представляет собой пиперидинил или пиперазинил, где оставшиеся переменные соответствуют описанным выше для формулы I или семнадцатого, восемнадцатого, девятнадцатого или двадцатого варианта осуществления.
Конкретные примеры соединений приведены в разделе «ПРИМЕРЫ» и включены в данный документ в качестве части двадцать второго варианта осуществления. Также включены фармацевтически приемлемые соли, а также нейтральные формы этих соединений.
Также в данном документе предложены фармацевтические композиции, содержащие описанное в данном документе соединение и фармацевтически приемлемый носитель.
4. Применения, составление и введение
Описанные в данном документе соединения и композиции в общем случае применимы в качестве противораковой терапии. В одном аспекте описанные соединения и композиции ведут себя как направленные на опухоль химеры деградации белка (T-PEACH), в которых одна часть соединений отвечает за связывание BRD4, а другая часть отвечает за связывание с HSP90 и/или HSP70. Их механизмы действия включают, но не ограничиваются этим, деградацию BRD4 и/или других членов семейства белков BET, что препятствует передаче последующих сигналов и приводит к гибели раковых клеток. В одном аспекте описанные соединения обуславливают деградацию BRD4.
Таким образом, в данном документе предложены способы лечения патологических состояний, которые восприимчивы к деградации BRD4, включающие введение нуждающемуся в этом субъекту терапевтически эффективного количества одного или более соединений или композиций, описанных в данном документе. Также предложено применение одного или более соединений или композиций, описанных в данном документе, в производстве лекарственного средства для лечения патологических состояний, которые восприимчивы к деградации BRD4. Дополнительно предложено применение соединения или композиции, описанных в данном документе, для лечения патологических состояний, которые восприимчивы к деградации BRD4.
В одном аспекте патологическое состояние, которое можно лечить представленными соединениями и композициями, представляет собой рак. Термины «рак» или «опухоль» хорошо известны в данной области техники и относятся к наличию, например у субъекта, клеток, обладающих характеристиками, типичными для клеток, вызывающих рак, такими как неконтролируемая пролиферация, бессмертие, метастатический потенциал, высокая скорость роста и пролиферации, сниженная гибель/ апоптоз клеток и некоторые характерные морфологические особенности. Раковые клетки часто приобретают форму солидной опухоли. Однако рак также включает несолидные опухоли, например опухоли крови, например лейкоз, в случае чего раковые клетки происходят из костного мозга. В контексте данного документа термин «рак» включает предзлокачественные, а также злокачественные опухоли. Раковые опухоли включают, но не ограничиваются этим, акустическую невриому, острый лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз (моноцитарный, миелобластный, аденокарциному, ангиосаркому, астроцитому, миеломоноцитарный и промиелоцитарный лейкоз), острый Т-клеточный лейкоз, базальноклеточную карциному, карциному желчного протока, рак мочевого пузыря, рак головного мозга, рак молочной железы, бронхогенную карциному, рак шейки матки, хондросаркому, хордому, хориокарциному, хронический лейкоз, хронический лимфоцитарный лейкоз, хронический миелоцитарный (гранулоцитарный) лейкоз, хронический миелоцитарный (гранулоцитарный) лейкоз, хронический миелогенный лейкоз, рак толстой кишки, колоректальный рак, краниофарингиому, цистаденокарциному, диффузную крупноклеточную B-лимфому, лимфому Беркитта, диспролиферативные изменения (дисплазии и метаплазии), эмбриональную карциному, рак эндометрия, эндотелиосаркому, эпендимому, эпителиальную карциному, эритролейкоз, рак пищевода, эстроген-рецептор-положительный рак молочной железы, эссенциальную тромбоцитемию, опухоль Юинга, фибросаркому, фолликулярную лимфому, рак из половых клеток яичек, глиому, болезнь тяжелых цепей, гемангиобластому, гепатому, гепатоцеллюлярный рак, нечувствительный к гормонам рак предстательной железы, лейомиосаркому, липосаркому, рак легкого, лимфагиоэндотелиосаркому, лимфангиосаркому, лимфобластный лейкоз, лимфому (ходжкинскую и неходжкинскую), злокачественные образования и гиперпролиферативные расстройства мочевого пузыря, молочной железы, толстой кишки, легкого, яичников, поджелудочной железы, предстательной железы, кожи и матки, лимфоидные злокачественные образования Т-клеточного или В-клеточного происхождения, лейкоз, лимфому, медуллярную карциному, медуллобластому, меланому, менингиому, мезотелиому, множественную миелому, миелогенный лейкоз, миелому, миксосаркому, нейробластому, немелкоклеточный рак легкого, олигодендроглиому, рак полости рта, остеогенную саркому, рак яичников, рак поджелудочной железы, папиллярные аденокарциномы, папиллярную карциному, пинеалому, истинную полицитемию, рак предстательной железы, рак прямой кишки, почечно-клеточную карциному, ретинобластому, рабдомиосаркому, саркому, карциному сальных желез, семиному, рак кожи, мелкоклеточную карциному легкого, солидные опухоли (карциномы и саркомы), мелкоклеточный рак легкого, рак желудка, плоскоклеточную карциному, синовиому, рак потовых желез, рак щитовидной железы, макроглобулинемию Вальденстрема, опухоли яичек, рак матки и опухоль Вильмса. Другие виды рака включают первичный рак, метастатический рак, рак ротоглотки, рак гортани, рак печени, рак желчного пузыря, рак желчных протоков, рак тонкой кишки, рак мочевыводящих путей, рак почек, рак уротелия, рак женских половых путей, рак матки, гестационную трофобластическую болезнь, рак мужских половых путей, рак семенных пузырьков, рак яичек, опухоли из половых клеток, опухоли эндокринных желез, рак щитовидной железы, рак надпочечников, рак гипофиза, гемангиому, саркому, возникающую из костей и мягких тканей, саркому Капоши, рак нервов, рак глаза, менингиальный рак, глиобластомы, нейромы, нейробластомы, шванномы, солидные опухоли, возникающие из гемопоэтических злокачественных образований, такие как лейкозы, метастатическую меланому, рецидивирующий или стойкий эпителиальный рак яичников, рак фаллопиевых труб, первичный рак брюшины, желудочно-кишечные стромальные опухоли, колоректальный рак, рак желудка, меланому, мультиформную глиобластому, неплоскоклеточный немелкоклеточный рак легкого, злокачественную глиому, эпителиальный рак яичников, первичный серозный рак брюшины, метастатический рак печени, нейроэндокринную карциному, рефрактерное злокачественное образование, трижды негативный рак молочной железы, рак молочной железы, усиленный HER2, рак носоглотки, рак полости рта, рак желчевыводящих путей, гепатоцеллюлярную карциному, плоскоклеточные карциномы головы и шеи (ПККГШ), немедуллярную карциному щитовидной железы, рецидивирующую мультиформную глиобластому, нейрофиброматоз 1 типа, рак ЦНС, липосаркому, лейомиосаркому, рак слюнных желез, меланому слизистых оболочек, акральную/лентигинозную меланому, параганглиому, феохромоцитому, распространенный метастатический рак, солидную опухоль, трижды негативный рак молочной железы, колоректальный рак, саркому, меланому, карциному почек, рак эндометрия, рак щитовидной железы, рабдомиосаркому, множественную миелому, рак яичников, глиобластому, стромальную желудочно-кишечную опухоль, мантийноклеточную лимфому и рефрактерное злокачественное образование.
В контексте данного документа под «солидной опухолью» подразумевается любая патогенная опухоль, которую можно пальпировать или обнаружить с использованием методов визуализации как аномальный рост, имеющий три измерения. Солидную опухоль дифференцируют от опухоли крови, такой как лейкоз. Однако клетки опухоли крови происходят из костного мозга; следовательно, ткань, вырабатывающая раковые клетки, представляет собой солидную ткань, которая может быть гипоксической.
Под «опухолевой тканью» подразумеваются клетки, внеклеточный матрикс и другие природные компоненты, связанные с солидной опухолью.
Конкретная дозировка и схема лечения для любого конкретного пациента будут зависеть от ряда факторов, включая активность конкретного применяемого соединения, возраст, массу тела, общее состояние здоровья, пол, рацион, время введения, скорость выведения, комбинацию лекарственных препаратов, а также мнение лечащего врача и тяжесть конкретного заболевания, лечение которого проводят. Количество описанного в данном документе соединения в композиции также будет зависеть от конкретного соединения в композиции.
ПРИМЕРЫ
Пример 1: Синтез соединения 039
Репрезентативная схема синтеза для соединения 039. Конкретные пути синтеза промежуточных соединений приведены ниже.
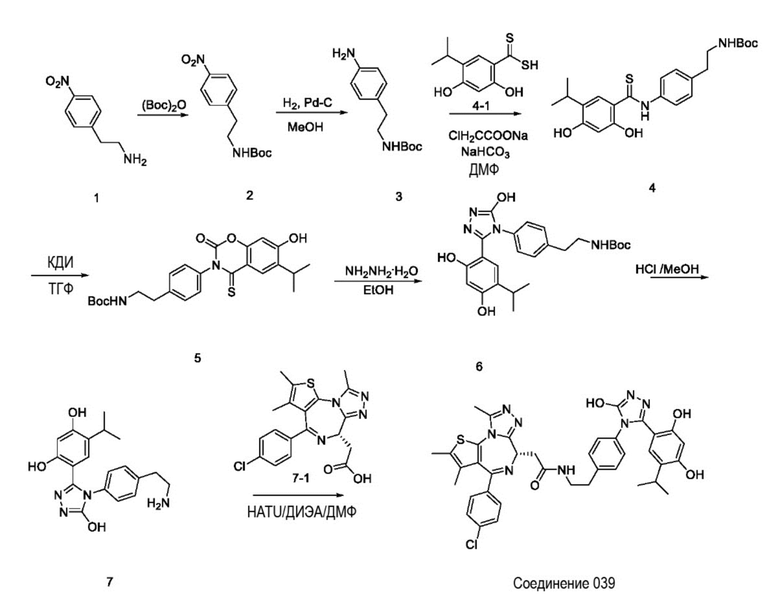
Промежуточное соединение 2:
трет-бутил 4-нитрофенэтилкарбамат
В раствор промежуточного соединения 1 (8,00 г, 39,5 ммоль) и (Boc)2O (8,60 г, 39,5 ммоль) в ТГФ (50 мл) и воде (50 мл) добавляли NaOH (3,1 г, 79,0 ммоль). Потом реакционный раствор перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор экстрагировали EtOAc (50 мл * 3). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и концентрировали с получением промежуточного соединения 2 (10,0 г, выход 79,3%) в виде масла.
Промежуточное соединение 3:
трет-бутил 4-аминофенэтилкарбамат
Раствор промежуточного соединения 2 (10,0 г, 33,1 ммоль) и Pd/C (10%, 1,5 г) в MeOH (150 мл) перемешивали в атмосфере H2 в течение ночи. Смесь фильтровали, а фильтрат концентрировали с получением промежуточного соединения 3 (8,8 г, выход 99%) в виде желтого твердого вещества.
Промежуточное соединение 4:
трет-бутил 4-(2,4-дигидрокси-5-изопропилфенилтиоамидо)фенэтилкарбамат
Раствор промежуточного соединения 4-1 (1,0 г, 4,38 ммоль), ClH2CCOONa (765 мг, 6,57 ммоль) и NaHCO3 (1,1 г, 13,14 ммоль) в ДМФ (10 мл) перемешивали при 30°C в течение 3 часов. В реакционную смесь добавляли промежуточное соединение 3 (1,03 г, 4,38 ммоль). После этого полученную смесь перемешивали при 80°C в течение 4 часов, вливали смесь в ледяную воду и экстрагировали ЭА (20 мл * 3). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и фильтровали. Фильтрат концентрировали и очищали посредством ИГХ с элюированием ПЭ:ЭА = 1:1 с получением промежуточного соединения 4 (1,50 г, выход 79,7%) в виде масла.
Промежуточное соединение 5:
трет-бутил 4-(7-гидрокси-6-изопропил-2-оксо-4-тиоксо-2H-бензо[e][1,3]оксазин-3(4H)-ил)фенэтилкарбамат
Раствор промежуточного соединения 4 (1,5 г, 3,2 ммоль) и КДИ (1,07 г, 6,57 ммоль) в ТГФ (3 мл) перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор вливали в солевой раствор (5 мл) и экстрагировали ЭА (5 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и концентрировали с получением промежуточного соединения 5 (2,5 г, неочищенное), которое использовали для следующей реакции без очистки.
Промежуточное соединение 6:
трет-бутил 4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)фенэтилкарбамат
В раствор промежуточного соединения 5 (2,5 г, неочищенное) в EtOH (5 мл) добавляли (NH2)2 (238 мг, 7,4 ммоль). Потом полученную смесь перемешивали в течение ночи при комнатной температуре. Осажденное твердое вещество фильтровали и сушили с получением промежуточного соединения 6 (500 мг, выход 20%) в виде белого твердого вещества.
Промежуточное соединение 7:
4-(4-(4-(2-аминоэтил)фенил)-5-гидрокси-4H-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол
Раствор промежуточного соединения 6 (500 мг,1,41 ммоль) в HCl-MeOH (3 Н, 10 мл) перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали с получением промежуточного соединения 7 (360 мг, выход 92%) в виде белого твердого вещества.
Соединение 039:
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)фенэтил)ацетамид
В раствор промежуточного соединения 7-1 (50 мг, 0,125 ммоль), HATU (71,3 мг, 0,188 ммоль) и ДИЭА (48,4 мг, 0,375 ммоль) в ДМФ (3 мл) добавляли промежуточное соединение 7 (48,8 мг, 0,125 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Смесь очищали посредством препаративной ВЭЖХ (Waters 2767/Qda, колонка: SunFire 19*250 мм 10 мкм, подвижная фаза A: 0,1% ТФУ/H2O, B: АЦН) с получением соединения 039, 15 мг, выход 16,3%) в виде белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ 11,91 (с, 1H), 9,58 (с, 1H), 9,39 (с, 1H), 8,36-8,30 (м, 1H), 7,45 (дд, J = 24,9, 8,6 Гц, 4H), 7,24 (д, J = 8,4 Гц, 2H), 7,10 (д, J = 8,3 Гц, 2H), 6,80 (с, 1H), 6,25 (с, 1H), 4,51 (т, J = 7,0 Гц, 1H), 3,32-3,27 (м, 2H), 3,23-3,20 (м, 2H), 2,97-2,95 (м, 1H), 2,75-2,70 (м, 2H), 2,59 (с, 3H), 2,41 (с, 3H), 1,62 (с, 3H), 0,97 (д, J = 6,9 Гц, 6H).
ЖХМС (ИЭР): RT = 1,524 мин, метод ЖХМС-004 (ЖХМС 2020-002): A70B30+-, (A: 0,1% МК/H2O B: 0,1 % МК/АЦН, кол. SunFire C18), масса, рассчитанная для C38H37ClN8O4S, 736,2, полученное m/z 737,6 [M+H+]).
Пример 2: Синтез соединения 074
Репрезентативная схема синтеза для соединения 074 приведена ниже. Также приведены конкретные пути синтеза промежуточных соединений.
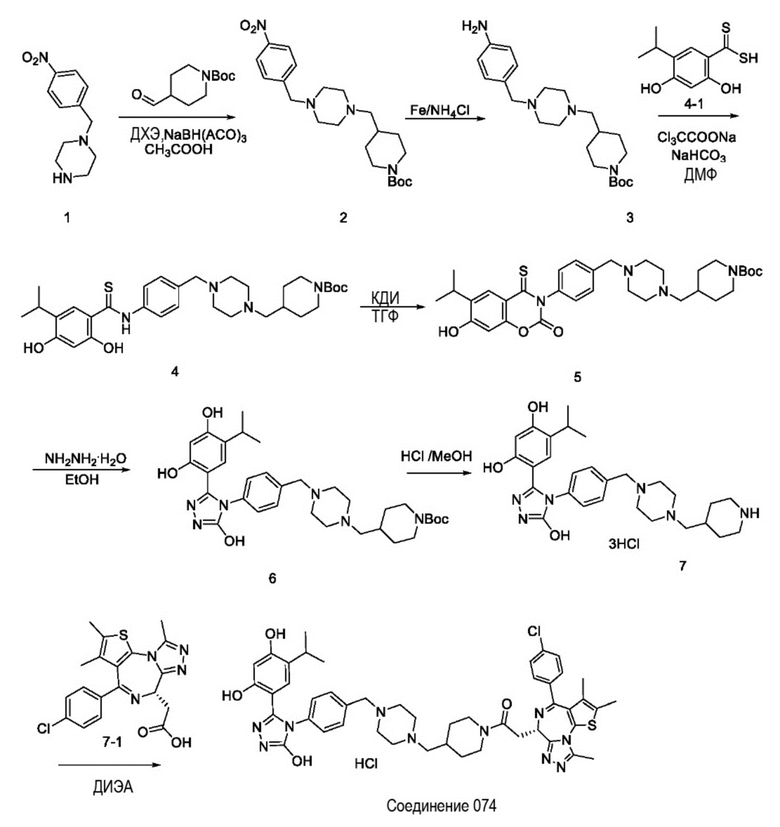
Промежуточное соединение 2:
трет-бутил 4-((4-(4-нитробензил)пиперазин-1-ил)метил)пиперидин-1-карбоксилат
В раствор 1-(4-нитробензил)пиперазина (промежуточное соединение 1) (96 г, 0,434 моль), трет-бутил 4-формилпиперидин-1-карбоксилата (92 г, 0,434 моль) и CH3COOH (26 г, 0,434 моль) в ДХЭ (1 л) добавляли NaBH(OAc)3 (138 г, 0,65 моль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор вливали в водн. раствор NaHCO3 и экстрагировали ДХМ (500 мл * 3). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и концентрировали с получением промежуточного соединения 2 (163 г, выход 90%) в виде белого твердого вещества.
Промежуточное соединение 3:
трет-бутил 4-((4-(4-аминобензил)пиперазин-1-ил)метил)пиперидин-1-карбоксилат
В раствор промежуточного соединения 2 (163 г, 0,39 моль) и NH4Cl (210 г, 3,9 моль) в EtOH (1 л) и H2O(100 мл) добавляли порошок Fe (109 г, 1,95 ммоль). Полученную смесь нагревали при 80°C в течение 3 часов. Ее охлаждали до комнатной температуры и фильтровали. Фильтрат вливали в водн. раствор NaHCO3 и экстрагировали EtOAc (1 л * 3). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и концентрировали. Остаток растирали с ПЭ: ЭА = 10:1 с получением промежуточного соединения 3 (120 г, выход 73%) в виде белого твердого вещества.
Промежуточное соединение 4:
трет-бутил 4-((4-(4-(2,4-дигидрокси-5-изопропилфенилтиоамидо)бензил) пиперазин-1-ил)метил)пиперидин-1-карбоксилат
Раствор промежуточного соединения 3 (77,5 г, 340 ммоль), ClCH2CO2Na (49,5 г, 424,5 ммоль) и NaHCO3 (90 г, 849 ммоль) в ДМФ (500 мл) перемешивали при 40°C в течение 3 часов. В реакционную смесь добавляли соединение 4 (110 г, 283 ммоль). После этого полученную смесь нагревали при 80°C в течение ночи. Реакционную смесь вливали в ледяную воду, осажденное твердое вещество собирали путем фильтрации с получением промежуточного соединения 4 (132 г, 80% выход) в виде желтого твердого вещества.
Промежуточное соединение 5:
трет-бутил 4-((4-(4-(7-гидрокси-6-изопропил-2-оксо-4-тиоксо-2H-бензо[e][1,3] оксазин-3(4H)-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-карбоксилат
Раствор промежуточного соединения 4 (132 г, 226 ммоль) и КДИ (73,4 г, 452 ммоль) в ТГФ (1 л) перемешивали в течение 2 часов при комнатной температуре. Реакционный раствор вливали в солевой раствор (1 л) и экстрагировали EtOAc (500 мл * 3). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и концентрировали с получением промежуточного соединения 5 (138 г, неочищенное), которое использовали для следующей реакции без очистки.
Промежуточное соединение 6:
трет-бутил 4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4- триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-карбоксилат
В раствор промежуточного соединения 5 (138 г, неочищенное) в EtOH (1 л) добавляли NH2NH2H2O (22,6 г, 452 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Осажденное твердое вещество фильтровали и сушили с получением промежуточного соединения 6 (62 г, 45% выход за 2 этапа) в виде белого твердого вещества.
Промежуточное соединение 7:
4-(5-гидрокси-4-(4-((4-(пиперидин-4-илметил)пиперазин-1-ил)метил)фенил)-4H-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол
Раствор промежуточного соединения 6 (62 г, 102 ммоль) в HCl-MeOH (3 Н, 300 мл) перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали с получением промежуточного соединения 7 (63 г, выход 100%) в виде белого твердого вещества.
Соединение 074:
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-она гидрохлорид
В раствор промежуточного соединения 7-1 (13 г, 32,5 ммоль), BOP (21,55 г, 48,75 ммоль) и ДИЭА (41,86 г, 325 ммоль) в ДМФ (130 мл) добавляли промежуточное соединение 7 (20 г, 32,5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли H2O и собирали осажденное твердое вещество путем фильтрации. Его сушили, потом очищали посредством силикагелевой хроматографии (градиент, ДХМ: MeOH = от 50:1 до 30:1 до 20:1) с получением 8 г белого твердого вещества. В раствор этого белого твердого вещества в MeOH (200 мл) добавляли HCl-MeOH (9 мл, 3 Н) и перемешивали. Его перемешивали при к. т. в течение 1 часа и концентрировали. Добавляли H2O (60 мл) и перемешивали в течение 10 мин. Смесь фильтровали, фильтрационный осадок промывали H2O (30 мл * 2). Его сушили в вакууме с получением соединения 074 (7,5 г) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ 11,95 (с, 1H), 10,68(м, 1H), 9,62 (с, 1H), 9,38 (с, 1H), 7,64-7,44 (м, 6H), 7,25 (д, J = 8,4 Гц, 2H), 6,93 (с, 1H), 6,31 (с, 1H), 4,63 (т, J = 6,7 Гц, 1H), 4,41-4,15 (м, 3H), 3,79-3,40 (м, 12H), 3,43-3,00 (м, 4H), 2,76-2,55 (м, 5H), 2,42 (с, 3H), 2,05-2,02 (м, 1H), 1,90-1,68 (м, 2H), 1,63 (с, 3H), 0,98 (д, J = 6,9 Гц, 6H).
ЖХМС (ИЭР): RT = 1,31 мин, метод ЖХМС-004 (ЖХМС 2020-002): A90B10+-, (A: 0,1% МК/H2O B: 0,1 % МК/АЦН, кол. SunFire C18), масса, рассч. для C47H54Cl2N10O4S, 924,34, полученное m/z 889,6 [M-HCl+H+]).
Пример 3: Синтез соединения 078
Репрезентативная схема синтеза для соединения 078 приведена ниже. Также приведены конкретные пути синтеза промежуточных соединений.
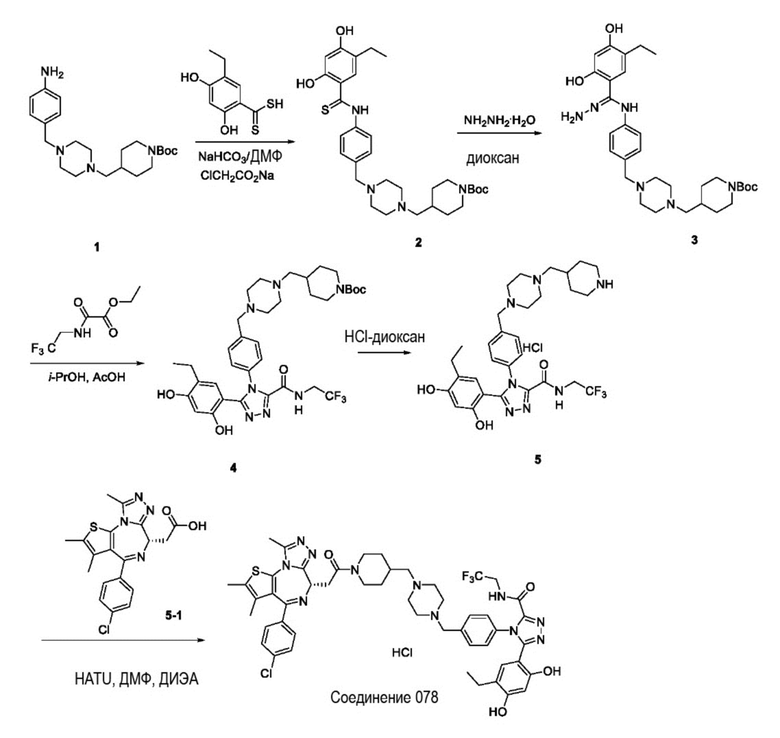
Промежуточное соединение 2:
трет-бутил 4-((4-(4-(5-этил-2,4-дигидроксифенилтиоамидо)бензил)пиперазин-1-ил) метил)пиперидин-1-карбоксилат
В смесь 5-этил-2,4-дигидроксибензодитионовой кислоты (3,00 г, 14,02 ммоль) и NaHCO3 (1,57 г, 18,70 ммоль) в ДМФ (30 мл) добавляли ClCH2CO2Na (1,20 г, 10,29 ммоль). После перемешивания при 40°C в течение 1,5 ч добавляли промежуточное соединение 1 (3,64 г, 9,35 ммоль) в ДМФ (30 мл) и перемешивали при 80°C в течение 2 ч. Смесь вливали в ледяную воду (50 мл). Осажденное твердое вещество собирали путем фильтрации и сушили в вакууме с получением промежуточного соединения 2 (5,0 г) в виде желтого твердого вещества.
Промежуточное соединение 3:
трет-бутил 4-((4-(4-(5-этил-2,4-дигидроксибензогидразонамидо)бензил)пиперазин -1-ил)метил)пиперидин-1-карбоксилат
В раствор промежуточного соединения 2 (5 г, 5,27 ммоль) в диоксане (70 мл) добавляли гидрид гидразина (1,6 г, 21,08 ммоль). Смесь перемешивали при к. т. в течение 3 ч и экстрагировали EtOAc (200 мл * 2). Объединенную органическую фазу промывали H2O и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 3 (5,4 г) в виде коричневого твердого вещества.
Промежуточное соединение 4:
трет-бутил 4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-((2,2,2-трифторэтил) карбамоил)-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-карбоксилат
В раствор промежуточного соединения 3 (5,4 г, 9,5 ммоль) в i-PrOH (55 мл) добавляли этил 2-оксо-2-((2,2,2-трифторэтил)амино)ацетат (3,8 г, 19,0 ммоль) и AcOH (0,15 мл). После перемешивания при 85°C в течение ночи смесь охлаждали до комнатной температуры. Осажденное твердое вещество собирали путем фильтрации и сушили в вакууме с получением промежуточного соединения 4 (2,5 г) в виде белого твердого вещества.
Промежуточное соединение 5:
5-(5-этил-2,4-дигидроксифенил)-4-(4-((4-(пиперидин-4-илметил)пиперазин-1-ил)метил)фенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид
Промежуточное соединение 4 (2,5 г, 3,56 ммоль) растворяли в HCl-диоксане (3 Н, 10 мл). Смесь перемешивали при к. т. в течение ночи и концентрировали в вакууме с получением указанного в заголовке промежуточного соединения 5 (3,0 г) в виде желтого твердого вещества.
Соединение 078:
4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамида гидрохлорид
В раствор промежуточного соединения 5-1 (300 мг, 0,8 ммоль) и промежуточного соединения 5 (530 мг, 0,8 ммоль) в ДМФ (15 мл) добавляли ДИЭА (4 мг, 3,8 ммоль) и HATU (290 мг, 0,8 ммоль) при к. т. После перемешивания при к. т. в течение ночи реакционную смесь разводили водой (10 мл) и экстрагировали EtOAc (10 мл * 3). Объединенную органическую фазу промывали H2O, солевым раствором, сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали посредством препаративной ВЭЖХ (Waters 2767/Qda, колонка: SunFire 19*250 мм 10 мкм, подвижная фаза A: 0,1% ТФУ/H2O, B: АЦН) с получением белого твердого вещества (211 мг). Добавляли насыщенный NaHCO3 (20 мл) и экстрагировали EtOAc (20 мл * 2). Объединенную органическую фазу промывали H2O и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. К остатку добавляли H2O (20 мл), а затем добавляли HCl (2 Н, 1 мл). Смесь лиофилизировали с получением соединения 078 в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): 9,75-9,66 (м, 2H), 7,61-7,37 (м, 8H), 6,75 (с, 1H), 6,34 (с, 1H), 4,60-4,57 (м, 1H), 4,37-4,34 (м, 2H), 4,21-4,16 (м, 2H), 3,99-3,95 (м, 2H), 3,66-3,30 (м, 11H), 3,18-3,12 (м, 3H), 2,67-2,57 (м, 4H), 2,44 (с, 3H), 2,33-2,29 (м, 2H), 1,76-1,60 (м, 4H), 1,63 (с, 3H), 1,24 (с, 1H), 0,95-0,91 (м, 4H).
ЖХМС (ИЭР): Shimadzu LCMS-017, RT = 1,415 мин, метод: A90B10, (A: 0,1% МК/H2O B: 0,1% МК/АЦН, кол. SunFire C18), масса, рассчит. для химической формулы C49H54Cl2F3N11O4S: 1019,34, полученное m/z 984,4 [M-HCl+H]+.
Пример 4: Синтез соединения 016
Репрезентативная схема синтеза для соединения 016 приведена ниже. Также приведены конкретные пути синтеза промежуточных соединений.
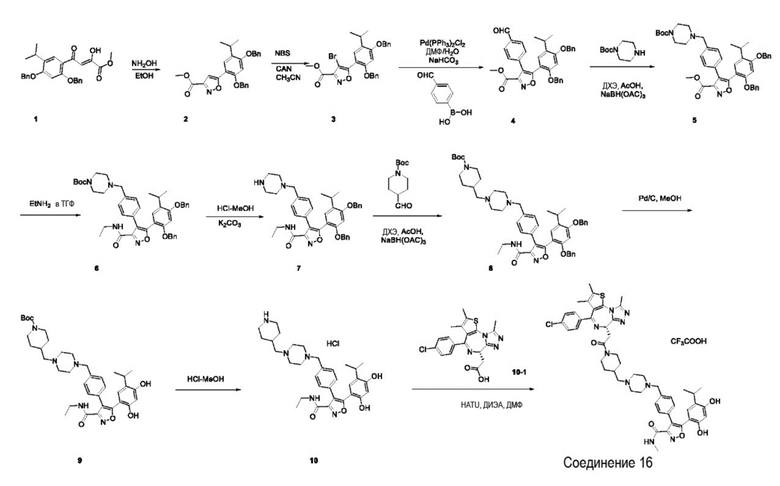
Промежуточное соединение 2
метил 5-(2,4-бис(бензилокси)-5-изопропилфенил)изоксазол-3-карбоксилат
Смесь промежуточного соединения 1 (15,5 г, 33,70 ммоль) и гидроксиламина гидрохлорида в EtOH (50 мл) перемешивали с обратным холодильником в течение 4 ч, затем охлаждали до к. т. и концентрировали. Добавляли H2O и экстрагировали смесь ДХМ (100 мл * 3). Объединенную органическую фазу сушили над Na2SO4, фильтровали и концентрировали. Остаток растирали с EtOH/H2O (200 мл/200 мл). Его собирали путем фильтрации с получением промежуточного соединения 2 (15 г, выход 97%) в виде желтого твердого вещества.
Промежуточное соединение 3
метил 5-(2,4-бис(бензилокси)-5-изопропилфенил)-4-бромизоксазол-3-карбоксилат
Смесь метильного промежуточного соединения 2 (15 г, 32,82 ммоль), NBS (6,43, 36,11 ммоль) и АЦН (9,0 г, 16,41 ммоль) в CH3CN (200 мл) перемешивали с обратным холодильником в течение 14 ч. После этого охлаждали до к. т. и концентрировали. Добавляли H2O и экстрагировали смесь ЭА (100 мл * 3). Объединенную органическую фазу промывали H2O, солевым раствором, сушили над Na2SO4 и концентрировали. Остаток очищали посредством силикагелевой хроматографии (ДХМ : MeOH = 20:1) с получением промежуточного соединения 3 (14,2 г, выход 81) в виде желтого твердого вещества.
Промежуточное соединение 4
метил 5-(2,4- бис(бензилокси)-5-изопропилфенил)-4-(4-формилфенил)изоксазол-3-карбоксилат
В раствор промежуточного соединения 3 (3 г, 5,6 ммоль) в ДМФ/ H2O (140 мл/28 мл) добавляли (4-формилфенил)бороновую кислоту (1,34 г, 8,4 ммоль), NaHCO3 (1,4 г, 16,8 ммоль) и Pd(PPh3)2Cl2 (0,4 г, 0,56 ммоль). Его перемешивали при 80°C в течение 3 часов в атмосфере Ar. полученную смесь вливали в H2O и экстрагировали EtOAc ( 100 мл * 3). Объединенную органическую фазу промывали водой, солевым раствором, сушили над Na2SO4 и концентрировали. Остаток очищали посредством силикагелевой хроматографии (ДХМ : MeOH = 20:1) с получением промежуточного соединения 4 (1,7 г, выход 54%) в виде желтого твердого вещества.
Промежуточное соединение 5
метил 5-(2,4-бис(бензилокси)-5-изопропилфенил)-4-(4-((4-(трет-бутоксикарбонил)пиперазин-1-ил)метил)фенил)изоксазол-3-карбоксилат
Смесь промежуточного соединения 4 (1,7 г, 3,03 ммоль), трет-бутил пиперазин-1-карбоксилата (0,56 г, 3,03 ммоль) в ДХЭ (15 мл) перемешивали при комнатной температуре в течение 1 ч. Добавляли NaBH(OAc)3 (1,4 г, 6,4 ммоль) и перемешивали в течение 2 ч. Полученную смесь разводили H2O и экстрагировали EtOAc (20 мл * 2). Объединенную органическую фазу промывали водой, солевым раствором, сушили над Na2SO4 и концентрировали с получением промежуточного соединения 5 (1,5 г, выход 68%) в виде желтого твердого вещества.
Промежуточное соединение 6
трет-бутил 4-(4-(5-(2,4-бис(бензилокси)-5-изопропилфенил)-3-(этилкарбамоил)изоксазол-4-ил)бензил)пиперазин-1-карбоксилат
Смесь промежуточного соединения 6 (1,5 г, 2,05 ммоль) в EtNH2-ТГФ (2 Н, 10 мл) перемешивали с обратным холодильником в течение 18 ч. Полученную смесь разводили водой и экстрагировали EtOAc (20 мл * 2). Объединенную органическую фазу промывали H2O, солевым раствором, сушили над Na2SO4 и фильтровали. Его концентрировали с получением промежуточного соединения 6 (1,5 г, выход 98%) в виде желтого твердого вещества.
Промежуточное соединение 7
5-(2,4-бис(бензилокси)-5-изопропилфенил)-N-этил-4-(4-(пиперазин-1-илметил)фенил)изоксазол-3-карбоксамид
Смесь промежуточного соединения 6 (1,5 г, 2,02 ммоль) в HCl-MeOH (3 Н, 10 мл) перемешивали при комнатной температуре в течение 3 часов. Полученную смесь концентрировали с получением промежуточного соединения 7 HCl (1,37 г) в виде белого твердого вещества. Его добавляли в H2O, потом добавляли K2CO3 до pH = 10-11. Его экстрагировали EtOAc (20 мл * 3). Объединенную органическую фазу промывали H2O, солевым раствором, сушили над Na2SO4 и концентрировали с получением промежуточного соединения 7 (1,28 г, 100%).
Промежуточное соединение 8
трет-бутил 4-((4-(4-(5-(2,4-бис(бензилокси)-5-изопропилфенил)-3-(этилкарбамоил)изоксазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-карбоксилат
Смесь промежуточного соединения 7 (1,28 г, 1,98 ммоль), трет-бутил 4-формилпиперидин-1-карбоксилата (0,42 г, 1,98 ммоль) и AcOH (1 мл) в ДХЭ (15 мл) перемешивали при комнатной температуре в течение 1 ч. Добавляли NaBH(OAc)3 (0,96 г, 4,34 ммоль) и перемешивали в течение 2 ч. Полученную смесь разводили водой и экстрагировали (20 мл * 2). Объединенную органическую фазу промывали H2O, солевым раствором, сушили над Na2SO4 и концентрировали с получением промежуточного соединения 8 (1,64 г, выход 98%) в виде желтого твердого вещества.
Промежуточное соединение 9
трет-бутил 4-((4-(4-(5-(2,4-дигидрокси-5-изопропилфенил)-3-(этилкарбамоил)изоксазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-карбоксилат
Раствор промежуточного соединения 8 (1,64 г, 4,51 ммоль) и Pd/C (10%, 600 мг) в MeOH (50 мл) перемешивали при комнатной температуре в течение ночи в атмосфере H2. Реакционный раствор фильтровали, а фильтрат концентрировали в вакууме с получением промежуточного соединения 9 (1,27 г, выход 100%) в виде белого твердого вещества.
Промежуточное соединение 10
5-(2,4-дигидрокси-5-изопропилфенил)-N-этил-4-(4-((4-(пиперидин-4-илметил)пиперазин-1-ил)метил)фенил)изоксазол-3-карбоксамид гидрохлорид
Смесь промежуточного соединения 9 (1,27 г) в HCl-MeOH (3 Н, 20 мл) перемешивали при комнатной температуре в течение 3 часов. Полученную смесь концентрировали с получением промежуточного соединения 10 (1,12 г, выход 98%) в виде белого твердого вещества.
Соединение 16
4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-этилизоксазол-3-карбоксамид, трифторуксусная кислота
Смесь промежуточного соединения 10 (50 мг, 0,084 ммоль), промежуточного соединения 10-1 (33,6 мг, 0,084 ммоль), HATU (48 мг, 0,126 ммоль) и ДИЭА (43 мг, 0,336 ммоль) в ДМФ (2 мл) перемешивали при комнатной температуре в течение 1 ч. Полученную смесь экстрагировали EtOAc (10 мл * 3). Объединенную органическую фазу промывали H2O, солевым раствором, сушили над Na2SO4. Ее фильтровали и концентрировали, затем очищали посредством препаративной ВЭЖХ (Waters 2767/Qda, колонка: SunFire 19*250 мм 10 мкм, подвижная фаза A: 0,1% ТФУ/H2O, B: АЦН) с получением соединения 016 (12,66 мг, выход 16%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ 9,79 (с, 1H), 9,67 (с, 1H), 8,87 (с, 1H), 7,55-7,19 (м, 9H), 6,76 (с, 1H), 6,44 (с, 1H), 4,57 (т, J = 6,7 Гц, 1H), 4,35 (д, J = 11,5 Гц, 2H), 4,15-4,13 (м, 2H), 3,64-3,59 (м, 7H), 3,39-3,33 (м, 3H), 3,26-3,20 (м, 3H), 3,13-3,10 (м, 4H), 3,02-2,95 (м, 3H), 2,60-2,58 (м, 4H), 2,42 (с, 3H), 1,77-1,66 (м, 2H), 1,63 (с, 3H), 1,09 (т, J = 7,2 Гц, 3H), 0,93 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): Shimadzu LCMS-009, RT = 1,486 мин, метод: A90B10+-, (A: 0,1% МК/H2O B: 0,1% МК/АЦН, кол. SunFire C18), масса, рассчит. для C51H58ClN9O5S, 943,40, полученное m/z 944,6 [M-CF3COOH+H]+.
Дополнительные соединения получали в соответствии с общей процедурой и схемой, приведенными в примерах 1-4, включая следующие:
Соединение 001
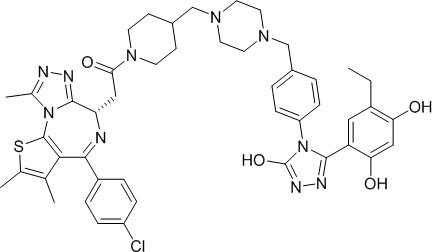
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,90 (с, 1H), 9,56 (с, 1H), 9,37 (с, 1H), 7,47 (м, 4H), 7,27 (д, J = 8,1 Гц, 2H), 7,11 (д, J = 8,2 Гц, 2H), 6,82 (с, 1H), 6,24 (с, 1H), 4,56 (т, J = 6,8 Гц, 1H), 4,34 (м, 1H), 4,11 (м, 1H), 3,60 (с, 1H), 3,43 (с, 3H), 3,10 (с, 1H), 2,59 (с, 4H), 2,43-2,24 (м, 11H), 2,12 (с, 2H), 1,99 (с, 1H), 1,78 (с, 2H), 1,63 (с, 4H), 1,23 (с, 2H), 1,11 (с, 1H), 0,96 (т, J = 7,4 Гц, 3H). ЖХМС (ИЭР): RT = 1,083 мин, полученное m/z 875,2 [M+H]+.
Соединение 002
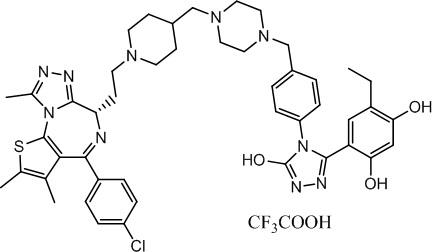
4-(4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-гидрокси-4H-1,2,4-триазол-3-ил)-6-этилбензол-1,3-диол, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,95 (с, 1H), 9,60 (с, 1H), 9,36 (с, 1H), 7,51 (с, 2H), 7,40 (с, 2H), 7,22 (с, 2H), 6,87 (с, 1H), 6,24 (с, 1H), 5,32 (с, 1H), 4,29 (с, 1H), 2,85-2,58 (м, 11H), 2,36 (м, 6H), 2,00 (м, 5H), 1,62 (с, 3H), 1,23 (с, 10H), 0,99 (т, J = 7,5 Гц, 3H), 0,84 (д, J = 7,0 Гц, 2H). ЖХМС (ИЭР): RT = 1,023 мин, полученное m/z 861,2 [M-CF3COOH+H]+.
Соединение 003
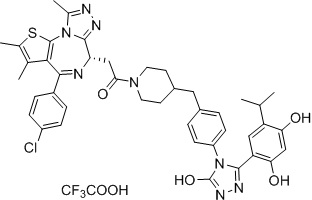
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)этанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,92 (с, 1H), 9,61-9,50 (м, 2H), 7,51-7,44 (м, 4H), 7,21 (д, J = 8,3 Гц, 2H), 7,11 (д, J = 8,0 Гц, 2H), 6,77 (с, 1H), 6,27 (с, 1H), 4,58 (т, J = 6,4 Гц, 2H), 4,34 (д, J = 12,1 Гц, 2H), 4,11 (д, J = 13,2 Гц, 1H), 3,60-3,59 (м, 1H), 3,38-3,35 (м, 1H), 3,6-2,95 (м, 2H), 2,60-2,57 (м, 3H), 2,52-2,50 (м, 2H), 2,42 (с, 3H), 1,85-1,51 (м, 6H), 1,24-1,00 (м, 2H), 0,96 (т, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,817 мин, полученное m/z 791,2 [M-CF3COOH+H]+.
Соединение 004
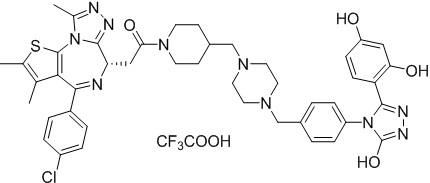
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидроксифенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,95 (с, 1H), 9,59-9,50 (м, 2H), 7,50-7,37 (м, 6H), 7,21-7,06 (м, 3H), 6,25-6,17 (м, 2H), 5,20-4,88 (м, 4H), 4,59-4,56 (м, 2H), 4,37-4,34 (м, 2H), 3,98-3,90 (м, 2H), 3,67-3,61 (м, 2H), 3,40-3,33 (м, 2H), 3,17-2,73 (м, 7H), 2,60-2,58 (м, 4H), 2,49 (с, 3H), 1,99 (с, 1H), 1,75-1,69 (м, 2H), 1,63 (с, 3H). ЖХМС (ИЭР): RT = 1,282 мин, полученное m/z 845,7 [M-CF3COOH-H]-.
Соединение 005
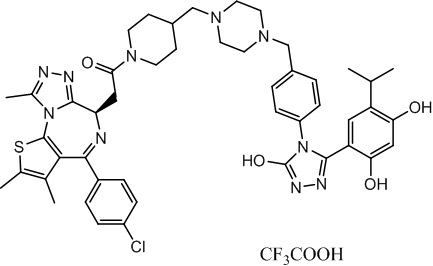
2-((6R)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,95 (с, 1H), 9,61 (с, 1H), 9,37 (с, 1H), 7,55-7,15 (м, 8H), 6,82 (с, 1H), 6,26 (с, 1H), 4,59-4,54 (м, 1H), 4,35-4,30 (м, 1H), 4,15-4,10 (м, 2H), 3,75-3,50 (м, 8H), 3,37-3,30 (м, 2H), 3,24-2,90 (м, 8H), 2,63 (с, 4H), 2,42 (с, 3H), 1,77-1,70 (м, 2H), 1,63 (с, 3H), 0,98 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,235 мин, полученное m/z 889,5 [M-CF3COOH+H]+.
Соединение 006
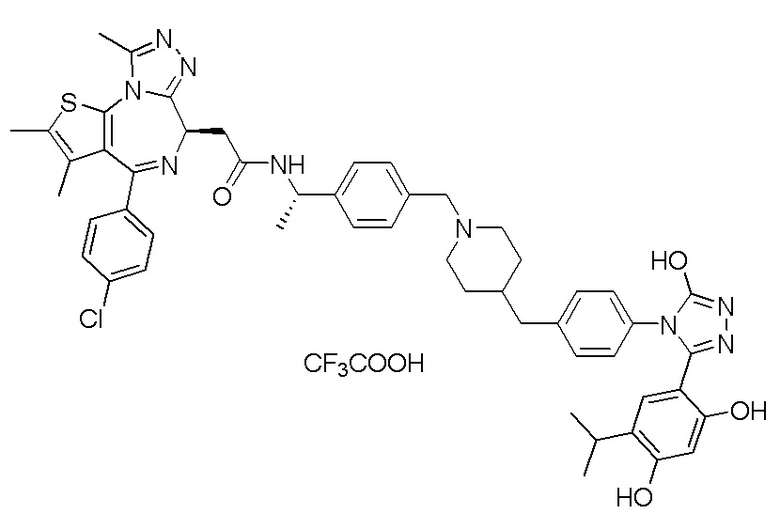
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((R)-1-(4-((1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метил)фенил)этил)ацетамид, трифторуксусная кислота.
1H ЯМР (400 МГц, ДМСО-d6): δ 11,92 (с, 1H), 10,05-9,15 (м, 3H), 8,76 (д, J = 7,8 Гц, 1H), 7,55-7,45 (м, 6H), 7,37-7,30 (м, 2H), 7,14-7,09 (м, 4H), 6,77 (с, 1H), 6,27 (д, J = 4,5 Гц, 1H), 5,04-4,95 (м, 1H), 4,50-4,46 (м, 1H), 4,26-4,24 (м, 2H), 3,43-3,17 (м, 5H), 2,98-2,96 (м, 1H), 2,67-2,60 (м, 2H), 2,61 (с, 3H), 2,39 (с, 3H), 1,71-1,62 (м, 2H), 1,55-1,40 (м, 3H), 1,38-1,28 (м, 5H), 0,94 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,433 мин, полученное m/z 924 [M-CF3COOH+H]+.
Соединение 009
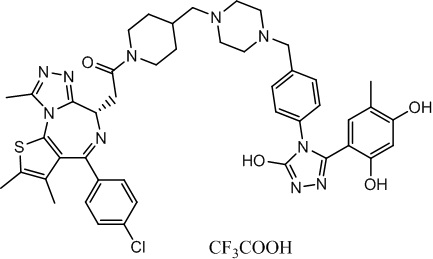
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-метилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,93 (с, 1H), 9,60 (с, 1H), 9,31 (с, 1H), 7,51-7,42 (м, 6H), 7,22 (д, J = 8,4 Гц, 2H), 6,95 (с, 1H), 6,24 (с, 1H), 4,58 (т, J = 6,7 Гц, 1H), 4,35 (д, J = 12,9 Гц, 1H), 4,15-4,01 (м, 2H), 3,68-3,33 (м, 3H), 3,07-2,85 (м, 6H), 2,60 (с, 3H), 2,55-2,50 (м, 6H), 2,42 (с, 3H), 2,02-1,99 (м, 1H), 1,97 (с, 3H), 1,86-1,75 (м, 2H), 1,63 (с, 3H), 1,35-0,88 (м, 2H). ЖХМС (ИЭР): RT = 1,35 мин, полученное m/z 861,4 [M-CF3COOH+H]+.
Соединение 010
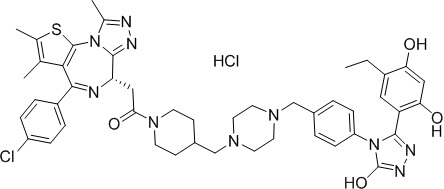
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-он гидрохлорид. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,97 (с, 1H), 11,33(с, 1H), 9,70-9,40 (м, 2H), 7,65-7,63 (м, 2H), 7,53-7,43 (м, 4H), 7,24 (д, J = 8,2 Гц, 2H), 6,96 (с, 1H), 6,32 (с, 1H), 4,63 (т, J = 6,8 Гц, 1H), 4,39-4,33 (м, 4H), 3,79-3,43 (с, 10H), 3,16-3,06 (м, 3H), 2,65-2,60 (м, 4H), 2,43-2,38 (м, 5H), 2,12-1,88 (м, 4H), 1,63 (с, 3H), 0,96 (т, J = 7,4 Гц, 3H). ЖХМС (ИЭР): RT = 1,07 мин, полученное m/z 875,1 [M-HCl+H]+.
Соединение 011
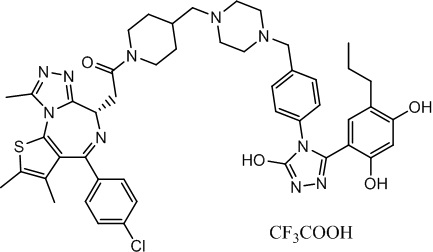
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-пропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-он, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,97 (с, 1H), 9,70-9,40 (м, 2H), 8,38(с, 4H), 7,50-7,42 (м, 6H), 7,26 (д, J = 8,2 Гц, 2H), 7,11 (д, J = 8,2 Гц, 2H), 6,77 (с, 1H), 6,26 (с, 1H), 4,56 (т, J = 6,8 Гц, 1H), 4,39-4,20 (м, 2H), 3,33-3,30 (м, 4H), 2,59-2,56 (м, 5H), 250-2,13 (м, 11H), 1,62-1,63 (м, 8H), 1,36-1,00 (м, 4H), 0,76 (т, J = 7,4 Гц, 3H). ЖХМС (ИЭР): RT = 1,47 мин, полученное m/z 889,3 [M-CF3COOH+H]+.
Соединение 012
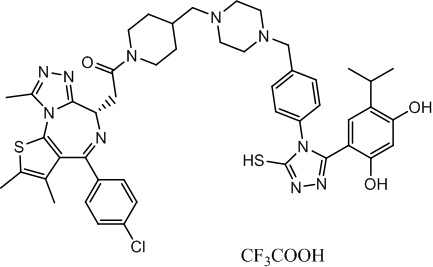
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,92 (с, 1H), 9,66 (с, 1H), 9,43 (с, 1H), 7,51-7,26 (м, 5H), 7,27 (д, J = 8,0 Гц, 2H), 6,84 (с, 1H), 6,25 (с, 1H), 4,58 (т, J = 6,7 Гц, 1H), 4,35 (д, J = 12,9 Гц, 1H), 4,15-4,13 (м, 1H), 3,80-3,30 (м, 13H), 3,15-3,10 (м, 2H), 3,03-2,87 (м, 2H), 2,60-2,58 (м, 4H), 2,42 (с, 3H), 2,24-1,94 (м, 5H), 1,87 (с, 2H), 0,97 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,123 мин, полученное m/z 905,1 [M-CF3COOH+H]+.
Соединение 013
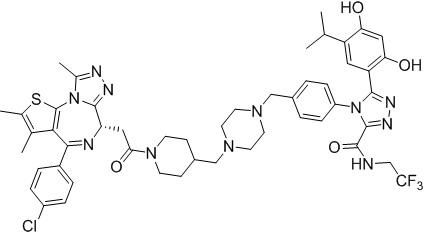
4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 10,45 (с, 1H), 9,75-9,58 (м, 2H), 7,50-7,30 (м, 6H), 6,62 (с, 1H), 6,34 (с, 1H), 4,58-4,55 (м, 1H), 4,36-4,33 (м, 1H), 4,13-4,10 (м, 1H), 3,98-3,94 (м, 2H), 3,60-3,49 (м, 4H), 3,15-3,11 (м, 1H), 2,93-2,90 (м, 1H), 2,60 (с, 4H), 2,41-2,30 (м, 10H), 2,14-2,13 (м, 2H), 1,82-1,79 (м, 3H), 1,63 (с, 3H), 1,23-1,12 (м, 1H), 1,16 (т, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,190 мин, полученное m/z 998,3 [M+H]+.
Соединение 014
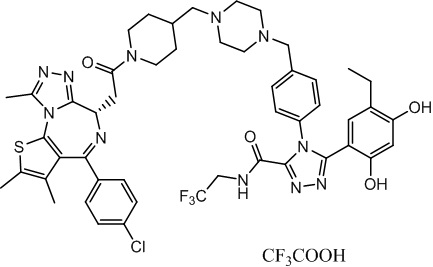
4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,71-9,65 (м, 2H), 7,52-7,30 (м, 8H), 6,68 (с, 1H), 6,31 (с, 1H), 5,32-5,30 (м, 1H), 5,00-4,50(м, 4H), 4,58 (т, J = 6,8 Гц, 2H), 4,36-4,32 (м, 2H), 4,16-1,10 (м, 2H), 4,03-3,91 (м, 3H), 3,81-3,58 (м, 3H), 3,40-2,90 (м, 6H), 2,64-2,50 (м, 5H), 2,42 (с, 3H), 2,26-2,24 (м, 2H), 2,00-1,98 (м, 1H), 1,87-1,74 (м, 1H), 1,63 (с, 3H), 0,89 (т, J = 7,4 Гц, 3H). ЖХМС (ИЭР): RT = 1,193 мин, полученное m/z 984,1 [M-CF3COOH+H]+.
Соединение 015
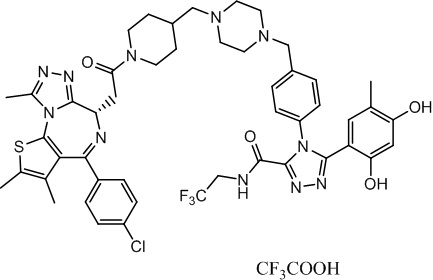
4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-метилфенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,70-9,62 (м, 2H), 9,38-9,02 (м, 1H), 7,60-7,20 (м, 8H), 6,72 (с, 1H), 6,28 (с, 1H), 4,58 (т, J = 6,7 Гц, 1H), 4,36 (д, J = 12,4 Гц, 2H), 4,15-4,13 (м, 2H), 4,01-3,90 (м, 10H), 3,64-3,63 (м, 3H), 3,37-3,35 (м, 1H), 3,07-2,95 (м, 7H), 2,60-2,58 (м, 4H), 2,42 (с, 3H), 1,87 (с, 4H), 1,73-1,70 (м, 1H), 1,63 (с, 3H). ЖХМС (ИЭР): RT = 1,385 мин, полученное m/z 970,1 [M-CF3COOH+H]+.
Соединение 016
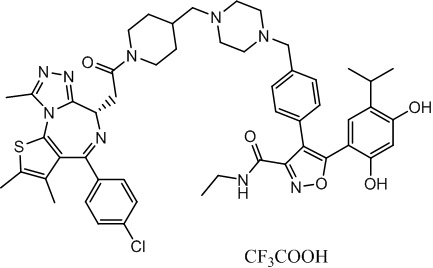
4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-этилизоксазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,79 (с, 1H), 9,67 (с, 1H), 8,87 (с, 1H), 7,55-7,19 (м, 9H), 6,76 (с, 1H), 6,44 (с, 1H), 4,57 (т, J = 6,7 Гц, 1H), 4,35 (д, J = 11,5 Гц, 2H), 4,15-4,13 (м, 2H), 3,64-3,59 (м, 7H), 3,39-3,33 (м, 3H), 3,26-3,20 (м, 3H), 3,13-3,10 (м, 4H), 3,02-2,95 (м, 3H), 2,60-2,58 (м, 4H), 2,42 (с, 3H), 1,77-1,66 (м, 2H), 1,63 (с, 3H), 1,09 (т, J = 7,2 Гц, 3H), 0,93 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,486 мин, полученное m/z 944,6 [M-CF3COOH+H]+.
Соединение 017
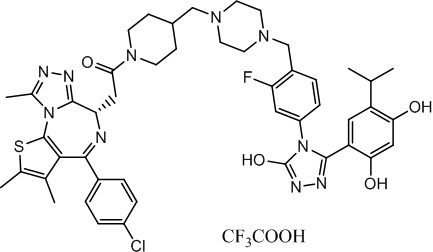
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)-2-фторбензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-он, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 12,00 (с, 1H), 9,64 (с, 1H), 9,39 (с, 1H), 7,51-7,42 (м, 5H), 7,14-7,00 (м, 2H), 6,91 (с, 1H), 6,26 (с, 1H), 4,58-4,55 (м, 1H), 4,36-4,33 (м, 1H), 4,15-4,10 (м, 1H), 3,70-3,35 (м, 5H), 3,10-2,90 (м, 8H), 2,60-2,50 (м, 6H), 2,50-2,48 (м, 5H), 2,33-2,30 (м, 1H), 2,10-2,00 (м, 1H), 1,85-1,80 (м, 2H), 1,63 (с, 3H), 1,23-1,12 (м, 1H), 1,03 (т, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,130 мин, полученное m/z 907,4 [M-CF3COOH+H]+.
Соединение 018
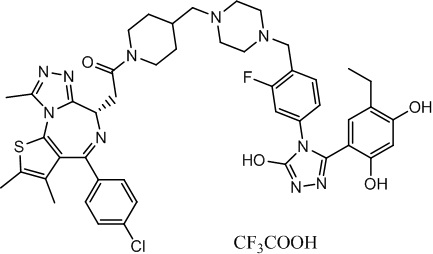
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)-3-фторбензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-он, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,50-7,37 (м, 5H), 7,05-6,95 (м, 2H), 6,46-6,30 (м, 1H), 6,25 (с, 1H), 5,33 (с, 1H), 4,57 (т, J = 6,7 Гц, 2H), 4,32-4,30 (м, 2H), 4,09-4,07 (м, 2H), 3,60-3,53 (м, 4H), 3,10-3,08 (м, 1H), 2,59-2,58 (м, 4H), 2,450-2,40 (м, 5H), 2,33 (с, 3H), 2,26-2,08 (м, 5H), 2,04-1,94 (м, 2H), 1,77-1,75 (м, 2H), 1,63 (с, 3H), 1,23-1,20 (м, 3H). ЖХМС (ИЭР): RT = 1,073 мин, полученное m/z 893,1 [M-CF3COOH+H]+.
Соединение 019
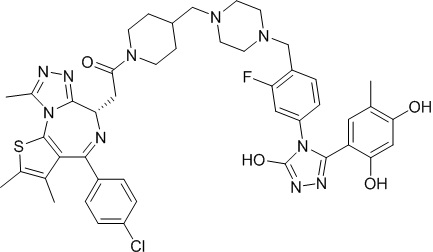
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((R)-1-(4-((1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метил)фенил)этил)ацетамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,95 (с, 1H), 9,59 (с, 2H), 7,46-7,33 (м, 5H), 7,35 (т, J = 8,1 Гц, 1H), 7,03 (д, J = 11,2 Гц, 1H), 6,95 (д, J = 7,9 Гц, 1H), 6,88 (с, 1H), 6,24 (с, 1H), 4,56 (т, J = 6,5 Гц, 1H), 4,33 (д, J = 12,3 Гц, 1H), 4,10 (д, J = 11,9 Гц, 1H), 3,60-3,59 (с, 1H), 3,49 (с, 2H), 3,10-3,00 (м, 1H), 2,59-2,58 (м, 4H), 2,41-2,34 (м, 7H), 2,09-2,08 (м, 3H), 1,95 (с, 3H), 1,76-1,75 (м, 3H), 1,63-1,60 (м, 4H), 1,27-0,81 (м, 4H). ЖХМС (ИЭР): RT = 1,355 мин, полученное m/z 877,2 [M-H]-.
Соединение 027
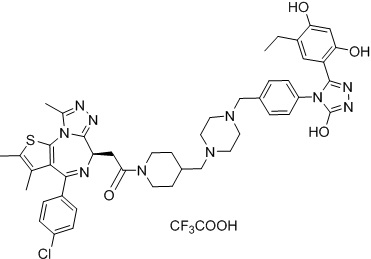
2-((6R)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,95 (с, 1H), 9,62 (с, 1H), 9,38 (с, 1H), 7,50-7,20 (м, 8H), 6,87 (с, 1H), 6,24 (с, 1H), 4,58 (т, J = 6,7 Гц, 1H), 4,46-4,11 (м, 8H), 3,72-3,63 (м, 2H), 3,40-3,35 (м, 2H), 312-3,04 (м, 4H), 2,42-2,40 (м, 4H), 2,39 (с, 3H), 2,35-2,33 (м, 2H), 1,85-1,72 (м, 3H), 1,63 (с, 3H), 1,20-1,10 (м, 2H), 1,01 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,420 мин, полученное m/z 875,2 [M-CF3COOH+H]+.
Соединение 028
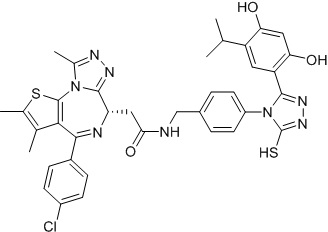
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4H-1,2,4-триазол-4-ил)бензил)ацетамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,56 (с, 1H), 8,79 (с, 1H), 8,07 (с, 1H), 7,52 (д, J =8,4 Гц, 2H), 7,41 (д, J =8,4 Гц, 2H), 7,30 (д, J =8,0 Гц, 2H), 7,18 (д, J =8,4 Гц, 2H), 6,84 (с, 1H), 6,23 (с, 1H), 4,58-4,55 (м, 1H), 4,42-4,32 (м, 2H), 3,35-3,30 (м, 2H), 3,00-2,95 (м, 1H), 2,67 (с, 3H), 2,41 (с, 3H), 1,61 (с, 3H), 0,99-0,95 (м, 6H). ЖХМС (ИЭР): RT = 1,715 мин, полученное m/z 739,2 [M+H]+.
Соединение 029
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)фенил)пиперидин-4-карбонил)пиперазин-1-ил)этан-1-он. 1H ЯМР (400 МГц, ДМСО-d6) δ 10,36 (с, 1H), 10,14 (с, 1H), 9,89 (с, 1H), 7,51-7,42 (м, 6H), 7,33 (с, 1H), 6,97 (д, J =8,8 Гц, 2H), 6,50 (с, 1H), 4,61-4,57 (м, 1H), 3,73-3,40 (м, 12H), 3,15-3,11 (м, 1H), 2,70-2,67 (м, 2H), 2,60 (с, 3H), 2,42 (с, 3H), 2,00-1,95 (м, 1H), 1,73-1,64 (м, 4H), 1,63 (с, 3H), 1,16 (т, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,551 мин, полученное m/z 889,5 [M+H]+.
Соединение 032
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4H-1,2,4-триазол-4-ил)фенокси)этил)ацетамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,84 (с, 1H), 9,61 (с, 1H), 9,42 (с, 1H), 8,48 (т, J = 5,6 Гц, 1H), 7,44 (дд, J = 22,7, 8,7 Гц, 4H), 7,15 (д, J = 8,9 Гц, 2H), 6,95 (д, J = 9,0 Гц, 2H), 6,87 (с, 1H), 6,24 (с, 1H), 4,52 (т, J = 7,0 Гц, 1H), 4,01 (т, J = 5,6 Гц, 2H), 3,49-3,43 (м, 2H), 3,27-3,25 (м, 2H), 2,98-2,91 (м, 1H), 2,59 (с, 3H), 2,41 (с, 3H), 1,61 (с, 3H), 0,99 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,568 мин, полученное m/z 769,1 [M+H]+.
Соединение 033
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4H-1,2,4-триазол-4-ил)фенокси)этокси)этил)ацетамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,58 (с, 1H), 8,31 (с, 1H), 7,49 (д, J =8,8 Гц, 2H), 7,43(д, J =8,4 Гц, 2H), 7,13 (д, J =8,0 Гц, 2H), 6,94 (д, J =8,4 Гц, 2H), 6,24 (с, 1H), 4,58-4,55 (м, 1H), 4,11-4,09 (м, 2H), 3,76-3,74 (м, 2H), 3,53-3,50 (м, 2H), 3,30-3,22 (м, 4H), 3,00-2,95 (м, 1H), 2,67 (с, 3H), 2,41 (с, 3H), 1,62 (с, 3H), 0,99-0,95 (м, 6H). ЖХМС (ИЭР): RT = 1,730 мин, полученное m/z 813,2 [M+H]+.
Соединение 034
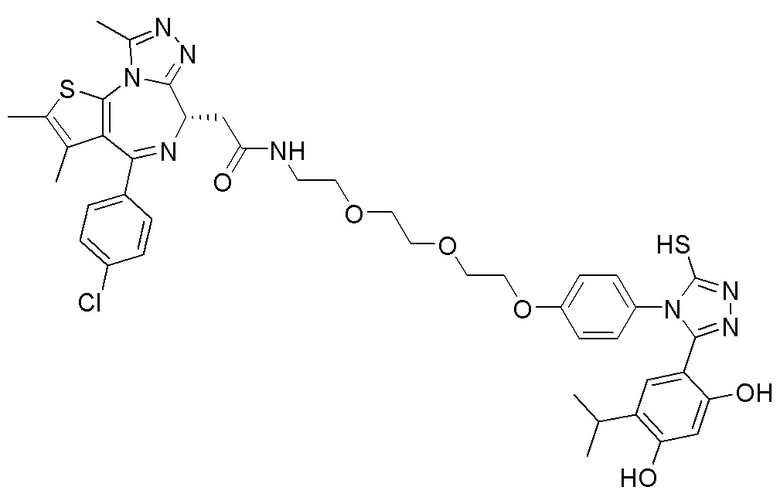
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(2-(2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4H-1,2,4-триазол-4-ил)фенокси)этокси)этокси)этил)ацетамид. 1H ЯМР (400 МГц, ДМСО): δ 13,83 (с, 1H), 9,60 (с, 1H), 9,39 (с, 1H), 8,29-8,27 (м, 1H), 7,48 (д, J = 8,5 Гц, 2H), 7,42 (д, J = 8,5 Гц, 2H), 7,12 (д, J = 8,9 Гц, 2H), 6,92 (д, J = 8,9 Гц, 2H), 6,86 (с, 1H), 6,24 (с, 1H), 4,50 (т, J = 7,1 Гц, 1H), 4,08-4,07 (м, 2H), 3,73 (д, J = 4,4 Гц, 2H), 3,58 (д, J = 8,0 Гц, 4H), 3,46 (т, J = 5,8 Гц, 2H), 3,28-3,16 (м, 5H), 3,02-2,92 (м, 1H), 2,59 (с, 3H), 2,40 (с, 3H), 2,00-1,99 (м, 1H), 1,62 (с, 3H), 0,99 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,748 мин, полученное m/z 857,7 [M+H]+.
Соединение 037
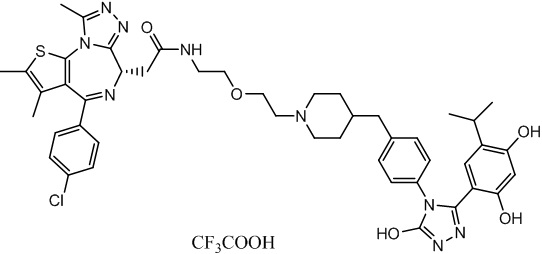
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(2-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)этокси)этил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,93 (с, 1H), 9,61 (с, 1H), 9,41 (с, 1H), 9,03-8,98 (м, 1H), 8,31 (с, 1H), 7,49-7,38 (м, 4H), 7,13-7,01 (м, 4H), 6,74 (с, 1H), 6,26 (с, 1H), 4,51 (т, J = 7,2 Гц, 2H), 3,73 (с, 2H), 3,49 (д, J = 5,3 Гц, 4H), 3,27 (д, J = 7,5 Гц, 6H), 2,93-2,85 (м, 2H), 2,67 (с, 1H), 2,59 (с, 3H), 2,39 (с, 3H), 2,33 (с, 1H), 1,71-1,69 (м, 3H), 1,61 (с, 3H), 1,43-1,42 (м, 1H), 0,92 (д, J = 6,2 Гц, 6H). ЖХМС (ИЭР): RT = 1,120 мин, полученное m/z 878,2 [M-CF3COOH+H+].
Соединение 038
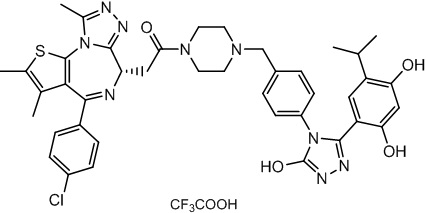
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)этанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,99 (с, 1H), 9,64 (с, 1H), 9,36 (с, 1H), 7,53-7,27 (м, 8H), 6,90 (с, 1H), 6,25 (с, 1H), 4,43 (с, 2H), 4,33 (д, J = 33,0 Гц, 4H), 3,68-3,60 (м, 4H), 3,20-3,11 (м, 4H), 2,99 (с, 3H), 2,60 (с, 3H), 2,42 (с, 3H), 1,63 (с, 3H), 1,02 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,129 мин, полученное m/z 792,4 [M-CF3COOH+H]+.
Соединение 039
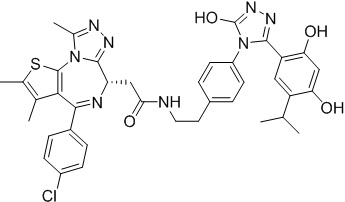
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)фенэтил)ацетамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,91 (с, 1H), 9,58 (с, 1H), 9,39 (с, 1H), 8,36-8,30 (м, 1H), 7,45 (дд, J = 24,9, 8,6 Гц, 4H), 7,24 (д, J = 8,4 Гц, 2H), 7,10 (д, J = 8,3 Гц, 2H), 6,80 (с, 1H), 6,25 (с, 1H), 4,51 (т, J = 7,0 Гц, 1H), 3,32-3,27 (м, 2H), 3,23-3,20 (м, 2H), 2,97-2,95 (м, 1H), 2,75-2,70 (м, 2H), 2,59 (с, 3H), 2,41 (с, 3H), 1,62 (с, 3H), 0,97 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,524 мин, полученное m/z 737,6 [M+H+].
Соединение 040
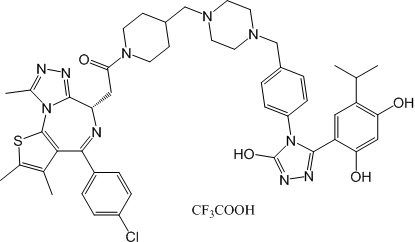
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,95 (с, 1H), 9,62 (с, 1H), 9,38 (с, 1H), 7,58-7,31 (м, 6H), 7,17 (т, J = 22,5 Гц, 2H), 6,83 (с, 1H), 6,26 (с, 1H), 4,57 (т, J = 6,7 Гц, 1H), 4,35 (д, J = 12,9 Гц, 1H), 4,15 (с, 1H), 3,66-3,60 (м, 8H), 3,43-3,31 (м, 2H), 3,21-2,81 (м, 7H), 2,76-2,55 (м, 5H), 2,42 (с, 3H), 2,05-2,02 (м, 1H), 1,90-1,68 (м, 2H), 1,63 (с, 3H), 0,98 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,097 мин, полученное m/z 889,3 [M-CF3COOH+H]+.
Соединение 041
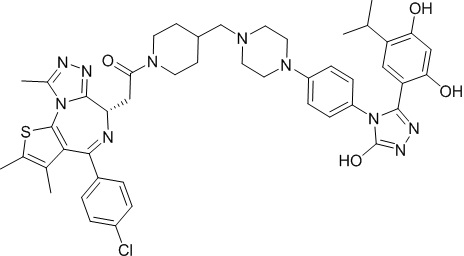
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)фенил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон. 1H ЯМР MeOD-d4 (400 МГц): δ 7,46-7,40 (м, 4H), 7,17 (м, 2H), 7,08 (м, 2H), 6,69 (с, 1H), 6,28 (с, 1H), 4,69 (д, J = 6,6 Гц, 1H), 4,57 (м, 2H), 3,76-3,58 (м, 4H), 3,23 (м, 7,4 Гц, 2H), 2,99 (с, 1H), 2,70 (с, 4H), 2,45 (с, 3H), 2,18 (т, J = 3,8 Гц, 1H), 2,02 (с, 1H), 1,70 (с, 3H), 1,60-1,57 (м, 1H), 1,37 (д, J = 1,3 Гц, 4H), 1,28 (с, 5H), 0,91 (с, 3H), 0,89 (с, 3H). ЖХМС (ИЭР): RT = 1,112 мин, полученное m/z 875,7 [M+H]+.
Соединение 042
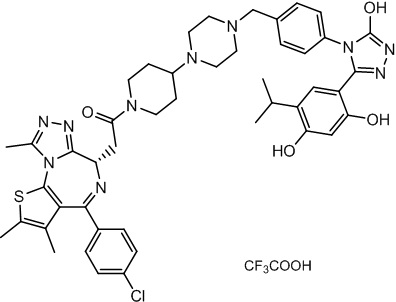
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)пиперидин-1-ил)этан-1-он, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,95 (с, 1H), 9,61 (с, 1H), 9,38 (с, 1H), 8,44 (с, 1H), 7,51-7,42 (м, 6H), 7,21 (д, J = 7,6 Гц, 2H), 6,82 (с, 1H), 6,26 (с, 1H), 4,57-4,50 (м, 2H), 4,26-4,20 (м, 2H), 4,00-3,95 (м, 2H), 3,69-3,50 (м, 6H), 3,33-2,95 (м, 7H), 2,67 (с, 4H), 2,55 (с, 3H), 2,36 (с, 3H), 1,62 (с, 3H), 0,97 (т, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 0,720 мин, полученное m/z 875,3 [M-CF3COOH+H]+.
Соединение 043
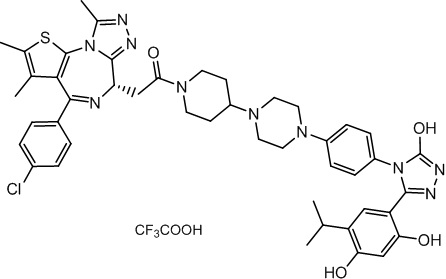
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)фенил)пиперазин-1-ил)пиперидин-1-ил)этанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,88 (с, 1H), 9,61 (с, 2H), 9,43 (с, 1H), 7,62-7,40 (м, 6H), 7,25-6,92 (м, 5H), 6,78 (с, 1H), 6,27 (с, 1H), 4,55-4,53 (м, 2H), 4,36-4,33 (м, 1H), 3,90 (д, J = 12,6 Гц, 2H), 3,60-3,59 (м, 4H), 3,22-3,18 (м, 4H), 2,99-2,97 (м, 4H), 2,61 (с, 3H), 2,42 (с, 3H), 2,41-2,06 (м, 4H), 1,64 (с, 3H), 0,96 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,371 мин, полученное m/z 861,7 [M-CF3COOH+H]+.
Соединение 044
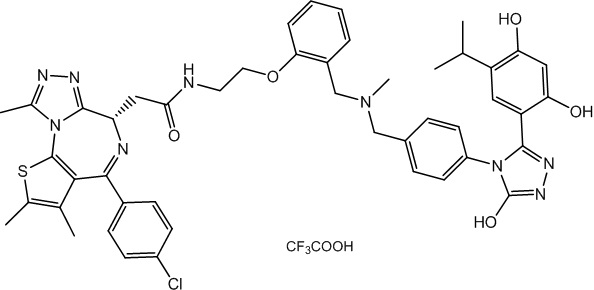
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(3-(((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)(метил)амино)метил)фенокси)этил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,98 (с, 1H), 9,61 (с, 1H), 9,33 (с, 2H), 8,64 (с, 1H), 7,56-6,83 (м, 13H), 6,23 (с, 1H), 4,27-4,25 (м, 2H), 4,09-4,06 (м, 2H), 3,19-3,10 (м, 1H), 3,02-2,93 (м, 1H), 2,68 (с, 3H), 2,58-2,55 (м, 4H), 2,35 (с, 3H), 1,53-1,50 (м, 3H), 1,25-1,20 (м, 4H), 0,97-0,93 (м, 6H). ЖХМС (ИЭР): RT = 1,381 мин, полученное m/z 886,3 [M-CF3COOH+H]+.
Соединение 045
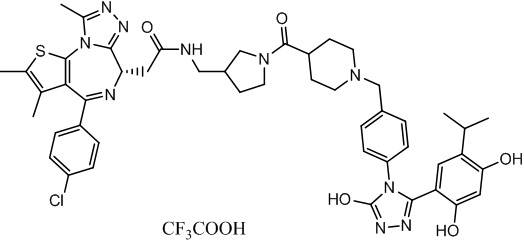
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пирролидин-3-ил)метил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,98 (с, 1H), 9,61 (с, 1H), 9,33 (с, 1H), 8,44 (с, 1H), 7,50-7,42 (м, 6H), 7,26(д, J = 6,8 Гц, 2H), 6,86 (с, 1H), 6,24 (с, 1H), 4,48-4,45 (м, 1H), 4,26-4,20 (м, 2H), 3,69-3,50 (м, 6H), 3,33-3,10 (м, 2H), 3,02-2,95 (м, 2H), 2,67 (с, 3H), 2,55 (с, 3H), 2,38-2,36 (м, 4H), 2,25 (с, 3H), 1,86-1,82 (м, 4H), 1,61 (с, 3H), 1,01-0,99 (м, 6H). ЖХМС (ИЭР): RT = 1,30 мин, полученное m/z 917,3 [M-CF3COOH+H]+.
Соединение 046
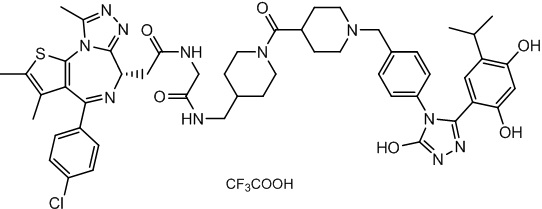
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пиперидин-4-ил)метил)амино)-2-оксоэтил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,98 (с, 1H), 9,61 (с, 1H), 9,33 (с, 2H), 8,58-8,56 (м, 1H), 7,78-7,65 (м, 1H), 7,53-7,46 (м, 6H), 7,25(д, J = 8,0 Гц, 2H), 6,87(с, 1H), 6,24 (с, 1H), 4,54-4,51 (м, 1H), 4,40-4,30 (м, 2H), 3,98-3,60 (м, 4H), 3,50-3,40 (м, 6H), 3,02-2,85 (м, 7H), 2,61-2,51 (м, 4H), 2,41 (с, 3H), 2,38-2,35 (м, 1H), 1,86-1,60 (м, 9H), 1,01-0,99 (м, 6H). ЖХМС (ИЭР): RT = 1,298 мин, полученное m/z 988,3 [M-CF3COOH+H]+.
Соединение 047
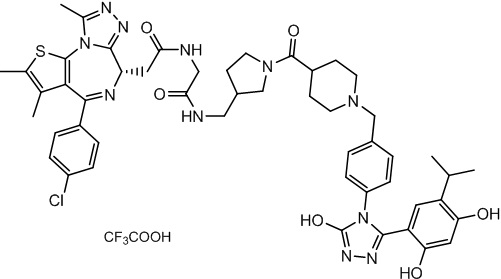
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пирролидин-3-ил)метил)амино)-2-оксоэтил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,98 (с, 1H), 9,61 (с, 1H), 9. 9,34 (с, 2H), 8,58-8,56 (м, 1H), 7,89-7,85 (м, 1H), 7,50-7,46 (м, 6H), 7,28-7,24 (м, 2H), 6,86 (с, 1H), 6,25 (с, 1H), 4,54-4,51 (м, 1H), 4,40-4,30 (м, 2H), 3,98-3,60 (м, 3H), 3,50-3,40 (м, 5H), 3,02-2,85 (м, 4H), 2,61-2,51 (м, 4H), 2,41 (с, 3H), 2,38-2,35 (м, 2H), 1,86-1,60 (м, 10H), 1,01-0,99 (м, 6H). ЖХМС (ИЭР): RT = 1,295 мин, полученное m/z 974,3 [M-CF3COOH+H]+.
Соединение 048
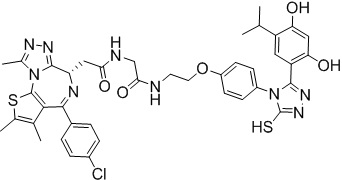
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-((2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4H-1,2,4-триазол-4-ил)фенокси)этил)амино)-2-оксоэтил)ацетамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,58 (с, 1H), 8,59 (s 1H), 8,07 (с, 1H), 7,50-7,47 (м, 4H), 7,12 (д, J =8,4 Гц, 1H), 6,93 (д, J =8,4 Гц, 1H), 6,24 (с, 1H), 4,54-4,51 (м, 1H), 4,01-3,98 (м, 2H), 3,83-3,68 (м, 2H), 3,55-3,40 (м, 2H), 3,00-2,95 (м, 1H), 2,67-2,61 (м, 2H), 2,60 (с, 3H), 2,41 (с, 3H), 2,37-2,32 (м, 2H), 1,61 (с, 3H), 0,99-0,95 (м, 6H). ЖХМС (ИЭР): RT = 1,666 мин, полученное m/z 826,2 [M+H]+.
Соединение 049
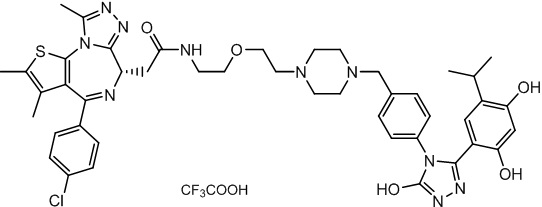
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(2-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)этокси)этил)ацетамид, трифторуксусная кислота, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,93 (с, 1H), 9,61 (с, 1H), 9,40(с, 1H), 8,28 (с, 1H), 7,49-7,38 (м, 4H), 7,27 (д, J = 8,2 Гц, 2H), 7,12 (д, J = 8,3 Гц, 3H), 6,76 (с, 1H), 6,27 (с, 1H), 4,49 (т, J = 6,0 Гц, 1H), 3,43-3,30 (м, 8H), 3,27-3,15 (м, 4H), 2,97-2,92 (м, 1H), 2,59-2,55 (м, 8H), 2,43-2,38 (м, 6H), 1,62 (с, 3H), 0,93 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,074 мин, полученное m/z 879,3 [M-CF3COOH+H+].
Соединение 050
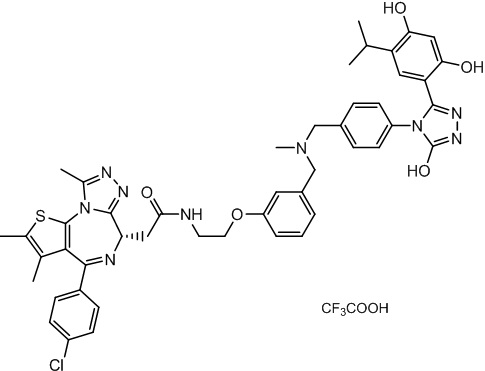
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(3-(((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)(метил)амино)метил)фенокси)этил)ацетамид, трифторуксусная кислота, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,98 (с, 1H), 9,65 (с, 1H), 9,37 (с, 1H), 8,54 (с, 1H), 7,64-6,98 (м, 13 H), 6,87 (с, 1H), 6,25 (с, 1H), 4,55-4,48 (м, 1H), 4,40-4,15 (м, 3H), 4,08-4,04 (м, 2H), 3,56-3,53 (м, 2H), 3,23-3,20 (м, 2H), 3,06-2,91 (м, 1H), 2,59 (с, 3H), 2,40 (с, 3H), 2,00-1,95 (м, 1H), 1,59 (с, 3H), 1,25-1,23 (м, 4H), 0,99 (д, J = 6,0 Гц, 6H). ЖХМС (ИЭР): RT = 1,24 мин, полученное m/z 886,5 [M-CF3COOH+H]+.
Соединение 051
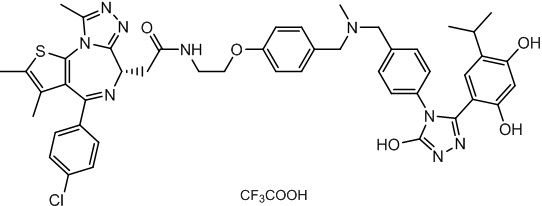
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(3-(((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)(метил)амино)метил)фенокси)этил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,93 (с, 1H), 9,58 (с, 1H), 9,38 (с, 1H), 8,53 (с, 1H), 7,62-6,57 (м, 14 H), 6,25 (с, 1H), 4,54-4,47 (м, 1H), 4,05-3,98 (м, 2H), 3,50-3,30 (м, 5H), 2,96-2,91 (м, 3H), 2,67 (с, 3H), 2,40 (с, 3H), 2,33 (с, 1H), 1,62-1,57 (м, 3H), 1,24 (с, 4H), 0,96-0,93 (м, 6H). ЖХМС (ИЭР): RT = 1,355 мин, полученное m/z 886,2 [M-CF3COOH+H]+.
Соединение 052
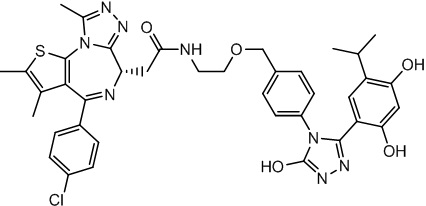
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)окси)этил)ацетамид. 1H ЯМР (400 МГц, ДМСО-d6):δ 11,91 (с, 1H), 9,57 (с, 1H), 9,36 (с, 1H), 8,33 (т, J = 5,4 Гц, 1H), 7,55-7,25 (м, 6H), 7,14 (д, J = 8,3 Гц, 2H), 6,86 (с, 1H), 6,24 (с, 1H), 4,51-4,48 (м, 3H), 3,52-3,47 (м, 2H), 3,32-3,24 (м, 4H), 3,02-2,93 (м, 1H), 2,59 (с, 3H), 2,41 (с, 3H), 1,61 (с, 3H), 0,99 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,549 мин, полученное m/z 767,2 [M+H+].
Соединение 053
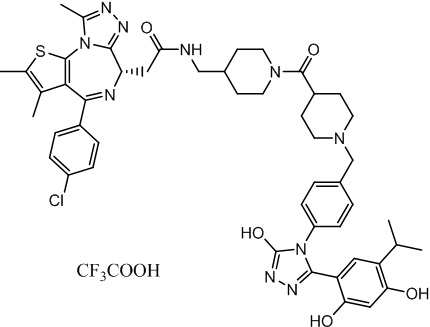
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пиперидин-4-ил)метил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,97 (с, 1H), 9,62 (с, 2H), 9,35 (с, 1H), 8,24 (с, 1H), 7,51-7,40 (м, 6H), 7,25 (д, J =7,6 Гц, 2H), 6,86 (с, 1H), 6,25 (с, 1H), 4,53-4,51 (м, 1H), 4,38-3,92 (м, 5H), 3,19-3,10 (м, 3H), 3,02-2,65 (м, 7H), 2,67 (с, 3H), 2,35 (с, 3H), 1,77-1,62 (м, 10H), 1,25-1,20 (м, 2H), 0,97-0,93 (м, 8H). ЖХМС (ИЭР): RT = 1,392 мин, полученное m/z 931,7 [M-CF3COOH+H]+.
Соединение 054
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-((2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)фенокси)этил)амино)-2-оксоэтил)ацетамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,85 (с, 1H), 9,56 (с, 1H), 9,37 (с, 1H), 8,60 (т, J = 6,0 Гц, 1H), 8,06 (т, J = 5,4 Гц, 1H), 7,47 (кв, J = 8,9 Гц, 4H), 7,08 (д, J = 8,9 Гц, 2H), 6,92 (д, J = 8,9 Гц, 2H), 6,83 (с, 1H), 6,24 (с, 1H), 4,52 (т, J = 7,2 Гц, 1H), 3,99 (т, J = 5,7 Гц, 2H), 3,49-3,43 (м, 4H), 3,36-3,30 (м, 2H), 3,03-2,93 (м, 1H), 2,58 (с, 3H), 2,41 (с, 3H), 1,62 (с, 3H), 0,99 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,645 мин, полученное m/z 810,6 [M+H]+.
Соединение 055
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-((2-(2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)фенокси)этокси)этил)амино)-2-оксоэтил)ацетамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,86 (с, 1H), 9,57 (с, 1H), 9,37 (с, 1H), 8,58-8,56 (м, 1H), 7,91-7,89 (м, 1H), 7,50-7,44 (м, 4H), 7,07 (д, J = 9,0 Гц, 2H), 6,93 (т, J = 10,4 Гц, 2H), 6,82 (с, 1H), 6,24 (с, 1H), 4,52 (т, J = 7,3 Гц, 1H), 4,08-4,06 (м, 3H), 3,76-3,64 (м, 5H), 3,30-3,25 (м, 4H), 3,00-2,92 (м, 1H), 2,59 (с, 3H), 2,40 (с, 3H), 1,62 (с, 3H), 0,98 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,636 мин, полученное m/z 852,2 [M-H]-.
Соединение 056
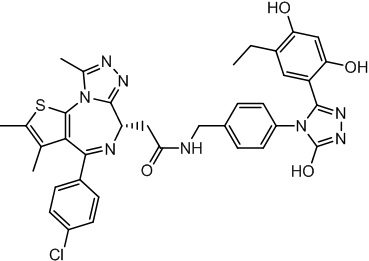
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)ацетамид. 1H ЯМР (400 МГц, ДМСО): δ 8,76 (с, 1H), 7,49 (д, J = 8,7 Гц, 2H), 7,40 (д, J = 8,5 Гц, 2H), 7,28 (д, J = 8,4 Гц, 2H), 7,12 (д, J = 8,4 Гц, 2H), 6,91 (с, 1H), 6,23 (с, 1H), 4,57-4,51 (м, 1H), 4,34 (м, 3H), 2,60 (с, 3H), 2,41 (с, 3H), 2,38-2,33 (м, 2H), 2,00 (д, J = 7,7 Гц, 1H), 1,61 (с, 3H), 1,23 (с, 4H), 1,00 (т, J = 7,5 Гц, 3H).
ЖХМС (ИЭР): LCMS-010 (LCMS 2020-004) RT = 1,525 мин, метод: A70B30+-, (A: 0,1% МК/H2O B: 0,1 % МК/АЦН, кол. sunFire C18), масса, рассч. для C36H33ClN8O4S 708,20, полученное m/z 709,6 [M+H]+.
Соединение 057
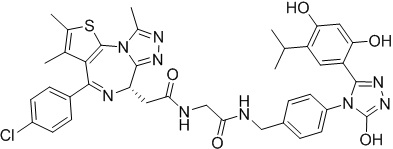
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)амино)-2-оксоэтил)ацетамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,90(с, 1H), 9,55 (с, 1H), 9,36 (с, 1H), 8,74 (т, J = 5,8 Гц, 1H), 8,29 (т, J = 6,0 Гц, 1H), 7,54-7,41 (м, 4H), 7,17 (д, J = 8,3 Гц, 2H), 7,07 (т, J = 11,9 Гц, 2H), 6,87 (с, 1H), 6,23 (с, 1H), 4,52 (т, J = 7,4 Гц, 1H), 4,32-4,28 (м, 2H), 3,89-3,84 (м, 1H), 3,76-3,71 (м, 1H), 3,63-3,40 (м, 3H), 3,39-3,35 (м, 1H), 3,30-3,26 (м, 3H), 2,41 (с, 3H), 1,62 (с, 3H), 1,00 (дд, J = 6,8, 1,5 Гц, 6H). ЖХМС (ИЭР): RT = 1,641 мин, полученное m/z 780,6 [M+H]+.
Соединение 058
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-(2-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)этил)пиперидин-1-ил)этанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,87 (с, 1H), 9,61 (с, 1H), 9,42 (с, 1H), 7,52-7,42 (м, 4H), 7,04 (дд, J = 30,5, 8,8 Гц, 4H), 6,80 (с, 1H), 6,27 (с, 1H), 4,61-4,54 (м, 1H), 4,34-4,30 (м, 1H), 4,15-4,14 (м, 1H), 3,87-3,83 (м, 2H), 3,57-3,50 (м, 4H), 3,24-2,89 (м, 10H), 2,60 (с, 3H), 2,42 (с, 3H), 1,79-1,75 (м, 1H), 1,68-1,63 (м, 8H), 0,97 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,112 мин, полученное m/z 889,4 [M-CF3COOH+H+].
Соединение 059
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)азетидин-3-ил)метил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,55 (д, J = 8,1 Гц, 2H), 7,52-7,24 (м, 6H), 6,87 (с, 1H), 6,20 (с, 1H), 4,64 (с, 1H), 4,33 (с, 3H), 4,05 (с, 2H), 3,74 (с, 1H), 3,58-3,33 (м, 6H), 3,01 (м, 4H), 2,69 (д, J = 3,2 Гц, 3H), 2,45 (с, 3H), 1,97 (м, 5H), 1,69 (с, 3H), 1,29 (с, 4H), 1,05-0,92 (м, 6H). ЖХМС (ИЭР): RT = 1,039 мин, полученное m/z 903,4 [M-CF3COOH+H]+.
Соединение 060
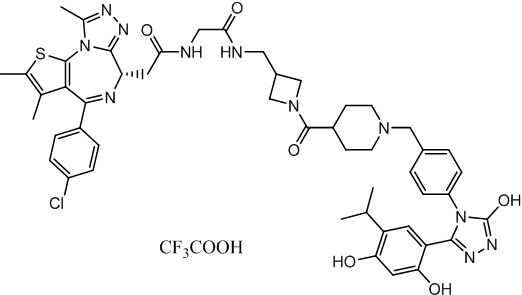
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)азетидин-3-ил)метил)амино)-2-оксоэтил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,45 (м, 8H), 6,87 (с, 1H), 6,20 (с, 1H), 4,65 (т, J = 6,6 Гц, 1H), 4,31 (с, 3H), 3,99 (м, 3H), 3,81-3,64 (м, 2H), 3,47 (с, 5H), 3,05 (м, 3H), 2,86 (с, 1H), 2,69 (с, 3H), 2,58 (с, 1H), 2,44 (с, 3H), 2,20 (м, 1H), 1,95 (м, 5H), 1,69 (д, J = 2,2 Гц, 3H), 1,30 (с, 4H), 1,01 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,063 мин, полученное m/z 960,3 [M-CF3COOH+H]+.
Соединение 061
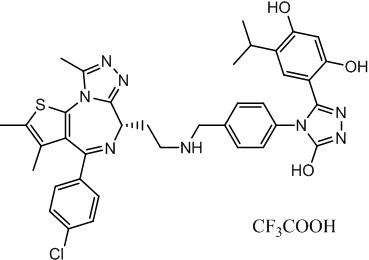
4-(4-(4-((2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)амино)фенил)-5-гидрокси-4H-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,93 (с, 1H), 9,60 (с, 1H), 9,31 (с, 1H), 8,89-8,80(м, 2H), 7,51-7,46 (м, 6H), 7,24-7,22 (м, 2H), 6,95 (с, 1H), 6,24 (с, 1H), 4,35-4,24 (м, 3H), 3,75-3,33 (м, 3H), 3,07 (д, J = 47,4 Гц, 6H), 2,76-2,66(м, 3H), 2,60 (с, 3H), 2,42 (с, 3H), 1,97 (с, 3H), 1,63 (с, 3H), 1,01-0,88 (м, 6H). ЖХМС (ИЭР): RT = 1,347 мин, полученное m/z 709,2 [M-CF3COOH+H]+.
Соединение 062
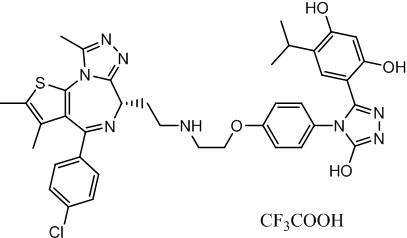
(S)-4-(4-(4-(2-((2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)амино)этокси)фенил)-5-гидрокси-4H-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,87 (с, 1H), 9,58 (с, 1H), 9,37 (с, 1H), 8,84-8,81 (м, 2H), 7,49 (с, 4H), 7,14 (д, J = 8,9 Гц, 2H), 6,98 (д, J = 9,0 Гц, 2H), 6,84 (с, 1H), 6,25 (с, 1H), 4,33 (д, J = 7,6 Гц, 1H), 4,26-4,23 (м, 2H), 3,72-3,60 (м, 2H), 3,03-2,93 (м, 1H), 2,72-2,69 (м, 3H), 2,61 (с, 3H), 2,40 (с, 3H), 2,35-2,33 (м, 1H), 1,62 (с, 3H), 0,99 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,358 мин, полученное m/z 739,2 [M-CF3COOH+H]+.
Соединение 063
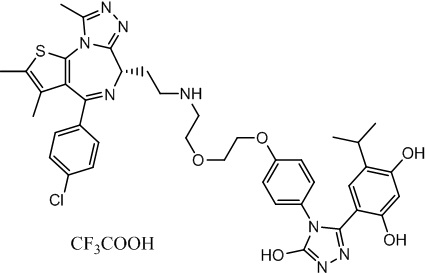
(S)-4-(4-(4-(2-(2-((2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)амино)этокси)этокси)фенил)-5-гидрокси-4H-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,87 (с, 1H), 9,59 (с, 1H), 9,38 (с, 1H), 8,68-8,50 (м, 2H), 7,50 (с, 4H), 7,09 (д, J = 8,9 Гц, 2H), 6,91 (д, J = 9,0 Гц, 2H), 6,82 (с, 1H), 6,25 (с, 1H), 4,33-4,28 (м, 1H), 4,12-4,11 (м, 2H), 3,80-3,70 (м, 5H), 3,44-3,40 (м, 1H), 3,30-3,25 (м, 2H), 3,02-2,93 (м, 1H), 2,68-2,55 (м, 2H), 2,60 (с, 3H), 2,40 (с, 3H), 1,61 (с, 3H), 0,98 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,385 мин, полученное m/z 783,5 [M-CF3COOH+H]+.
Соединение 064
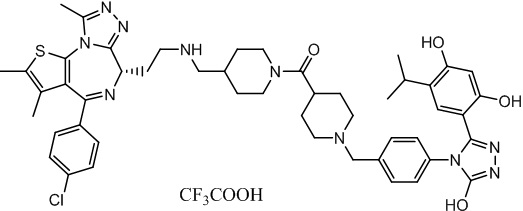
(4-(((2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)амино)метил)пиперидин-1-ил)(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метанон, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,57 (д, J = 8,3 Гц, 2H), 7,51 (д, J = 8,5 Гц, 2H), 7,42 (м, 4H), 6,87 (с, 1H), 6,22 (с, 1H), 4,42 (с, 1H), 4,34 (с, 2H), 3,58 (м, 6H), 3,06 (д, J = 8,3 Гц, 6H), 2,77 (д, J = 6,5 Гц, 2H), 2,71 (с, 3H), 2,44 (с, 3H), 2,21-2,15 (м, 1H), 1,99 (м, 7H), 1,70 (с, 3H), 1,30 (с, 7H), 1,01 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,042 мин, полученное m/z 917,3 [M-CF3COOH+H]+.
Соединение 065
(S)-4-(4-(4-(2-((2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)(метил)амино)этокси)фенил)-5-гидрокси-4H-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол. 1H ЯМР (400 МГц, ДМСО-d6): δ 7,49 (с, 4H), 7,14 (д, J = 8,9 Гц, 2H), 6,79-6,77 (м, 3H), 6,25 (с, 1H), 4,33 (т, J = 7,6 Гц, 1H), 3,96-3,94 (м, 2H), 3,03-2,93 (м, 1H), 2,78-2,75 (м, 4H), 2,61 (с, 3H), 2,40 (с, 3H), 2,33 (с, 1H), 1,62 (с, 3H), 0,99 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,417 мин, полученное m/z 753,7 [M+H]+.
Соединение 066
(3-(((2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)амино)метил)пирролидин-1-ил)(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метанон, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,48 (м, 7,9 Гц, 8H), 6,88 (с, 1H), 6,21 (с, 1H), 4,38 (м, 3H), 3,88 (м, 2H), 3,56 (м, 5H), 3,22 (д, J = 5,6 Гц, 2H), 3,06 (д, J = 7,3 Гц, 3H), 2,79 (с, 3H), 2,71 (с, 3H), 2,60 (с, 1H), 2,44 (с, 3H), 2,34-2,11 (м, 2H), 2,07-1,81 (м, 5H), 1,70 (с, 3H), 1,27 (м, 4H), 1,02 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 0,978 мин, полученное m/z 903,3 [M-CF3COOH+H]+.
Соединение 067
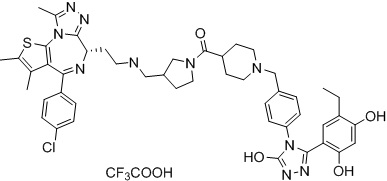
(3-(((2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)амино)метил)пирролидин-1-ил)(1-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,99 (с, 1H), 9,64 (с, 2H), 9,36 (с, 1H), 8,68-8,65 (м, 2H), 7,52-7,49 (м, 6H), 7,26 (д, J = 8,3 Гц, 2H), 6,91 (с, 1H), 6,24 (с, 1H), 4,31-4,29 (м, 3H), 3,47-3,25 (м, 7H), 3,10-2,80 (м, 4H), 2,64-2,60 (м, 5H), 2,43-2,29 (м, 5H), 2,05-1,78 (м, 6H), 1,62 (с, 3H), 1,23-1,20 (м, 3H), 1,01 (т, J = 7,5 Гц, 3H). ЖХМС (ИЭР): RT = 0,946 мин, полученное m/z 889,3 [M-CF3COOH+H]+.
Соединение 068
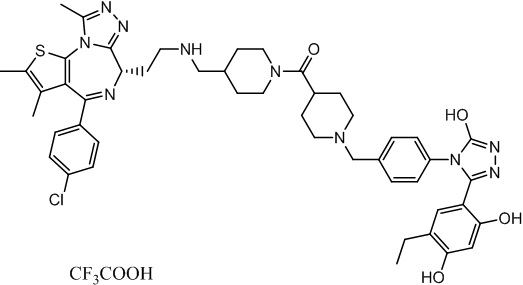
(4-(((2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)амино)метил)пиперидин-1-ил)(1-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метанон, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО): δ 11,98 (с, 1H), 9,63 (с, 2H), 9,35 (с, 1H), 8,56 (с, 2H), 7,49 (м, 5H), 7,27 (д, J = 8,2 Гц, 2H), 6,91 (с, 1H), 6,23 (с, 1H), 4,30 (м, 4H), 2,96 (с, 5H), 2,64 (м, 8H), 2,43-2,34 (м, 4H), 1,99 (с, 3H), 1,80 (с, 4H), 1,62 (с, 3H), 1,51-1,42 (м, 1H), 1,23 (с, 5H), 1,01 (т, J = 7,5 Гц, 3H). ЖХМС (ИЭР): RT = 0,958 мин, полученное m/z 903,3 [M-CF3COOH+H]+.
Соединение 070
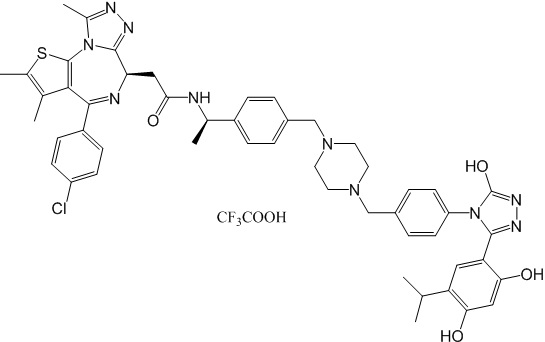
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((R)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)фенил)этил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,93 (с, 1H), 9,61 (с, 1H), 9,34 (с, 1H), 8,73 (с, 1H), 7,56-7,31 (м, 10H), 7,19 (с, 2H), 6,84 (с, 1H), 6,27 (с, 1H), 4,99 (с, 1H), 4,47 (д, J = 8,6 Гц, 1H), 4,30 (с, 1H), 3,36-3,30 (м, 7H), 3,23-3,20 (м, 2H), 2,98-2,96 (м, 2H), 2,65-2,58 (м, 7H), 2,39 (с, 3H), 1,56 (с, 3H), 1,39 (д, J = 6,6 Гц, 3H), 0,98 (д, J = 6,7 Гц, 6H). ЖХМС (ИЭР): RT = 1,081 мин, полученное m/z 925,5 [M-CF3COOH+H]+.
Соединение 071
(S)-4-(4-(4-(2-(2-((2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)(метил)амино)этокси)этокси)фенил)-5-гидрокси-4H-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 7,55-7,37 (м, 4H), 7,11-7,09 (м, 1H), 6,88 (д, J = 8,1 Гц, 2H), 6,69 (с, 1H), 6,26 (с, 1H), 4,37-4,35 (м, 1H), 4,06-3,67 (м, 9H), 3,11-2,96 (м, 4H), 2,79-2,70 (м, 2H), 2,66 (д, J = 8,6 Гц, 3H), 2,43 (с, 3H), 1,67 (с, 3H), 1,29-1,25 (м, 3H), 0,90-0,89 (м, 6H). ЖХМС (ИЭР): RT = 1,347 мин, полученное m/z 797,3 [M-CF3COOH+H]+.
Соединение 072
N-(4-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетамидо)фенил)-1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,64-7,31 (м, 13 H), 6,89 (с, 1H), 6,21 (с, 1H), 4,71 (дд, J = 8,6, 5,5 Гц, 1H), 4,36-4,33 (м, 2H), 3,64-3,47 (м, 6H), 3,13-3,09 (м, 3H), 2,71 (с, 3H), 2,45 (с, 3H), 2,19-1,95 (м, 3H), 1,70 (с, 3H), 1,02 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,748 мин, полученное m/z 925,9 [M-CF3COOH+H]+.
Соединение 073
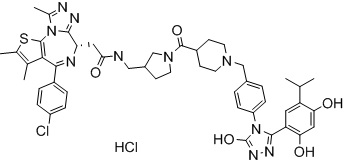
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пирролидин-3-ил)метил)ацетамида гидрохлорид. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,99 (с, 1H), 10,20 (с, 1H), 9,61 (с, 1H), 9,33 (с, 2H), 8,44 (с, 1H), 7,55-7,41 (м, 6H), 7,25(д, J = 6,8 Гц, 2H), 6,87(с, 1H), 6,28 (с, 1H), 4,27-4,25 (м, 1H), 4,09-4,06 (м, 2H), 3,69-3,20 (м, 11H), 3,02-2,85 (м, 4H), 2,61-2,51 (м, 4H), 2,41 (с, 3H), 1,86-1,82 (м,5H), 1,61 (м, 3H), 1,01-0,99 (м, 6H). ЖХМС (ИЭР): RT = 1,305 мин, полученное m/z 917,4 [M-HCl+H]+.
Соединение 074
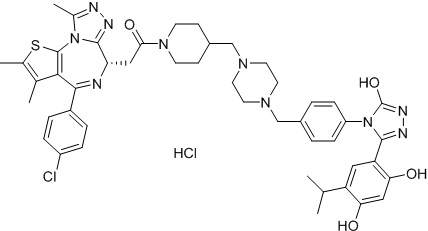
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этенона гидрохлорид. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,95 (с, 1H), 10,68(м, 1H), 9,62 (с, 1H), 9,38 (с, 1H), 7,64-7,44 (м, 6H), 7,25 (д, J = 8,4 Гц, 2H), 6,93 (с, 1H), 6,31 (с, 1H), 4,63 (т, J = 6,7 Гц, 1H), 4,41-4,15 (м, 3H), 3,79-3,40 (м, 12H), 3,43-3,00 (м, 4H), 2,76-2,55 (м, 5H), 2,42 (с, 3H), 2,05-2,02 (м, 1H), 1,90-1,68 (м, 2H), 1,63 (с, 3H), 0,98 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,31 мин, полученное m/z 889,6 [M-HCl+H]+.
Соединение 076
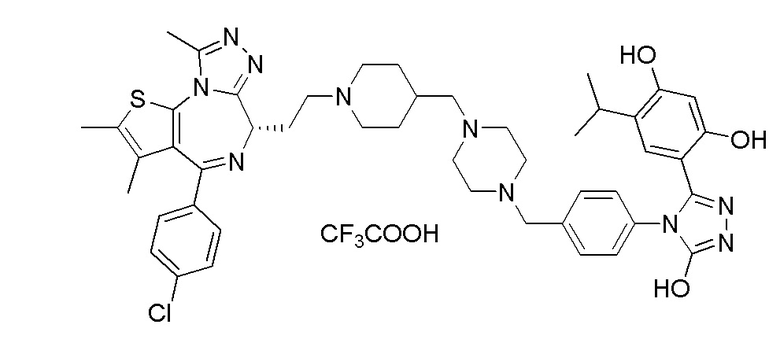
4-(4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)этил)пиперидин-4-ил)метил)пиперидин-1-ил)метил)фенил)-5-гидрокси-4H-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,58-7,45 (м, 8H), 6,83 (с, 1H), 6,23 (с, 1H), 4,38 (т, J = 6,1 Гц, 1H), 4,16 (с, 2H), 3,75-3,70 (м, 4H), 3,21-2,95 (м, 12H), 2,71 (с, 3H), 2,65-2,61 (м, 2H), 2,44 (с, 3H), 2,17-2,04 (м, 3H), 1,70 (с, 3H), 1,55-1,50 (м, 2H), 0,98 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,224 мин, полученное m/z 875,5 [M-CF3COOH+H]+.
Соединение 077
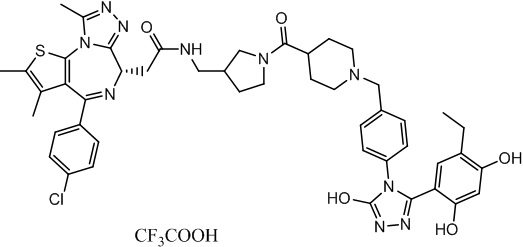
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((1-(1-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пирролидин-3-ил)метил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,46 (м, 8H), 6,89 (с, 1H), 6,18 (с, 1H), 4,64 (с, 1H), 4,32 (с, 2H), 3,51 (с, 7H), 3,06 (с, 2H), 2,85 (с, 2H), 2,70 (с, 3H), 2,44 (с, 6H), 1,96 (м, 6H), 1,69 (с, 4H), 1,30 (с, 5H), 1,03 (с, 3H). ЖХМС (ИЭР): RT = 1,054 мин, полученное m/z 903,1 [M-CF3COOH+H]+.
Соединение 078
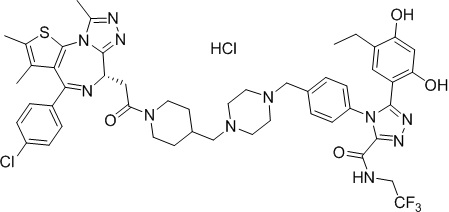
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид гидрохлорид. 1H ЯМР (400 МГц, ДМСО-d6): 9,75-9,66 (м, 2H), 7,61-7,37 (м, 8H), 6,75 (с, 1H), 6,34 (с, 1H), 4,60-4,57 (м, 1H), 4,37-4,34 (м, 2H), 4,21-4,16 (м, 2H), 3,99-3,95 (м, 2H), 3,66-3,30 (м, 11H), 3,18-3,12 (м, 3H), 2,67-2,57 (м, 4H), 2,44 (с, 3H), 2,33-2,29 (м, 2H), 1,76-1,60 (м, 4H), 1,63 (с, 3H), 1,24 (с, 1H), 0,95-0,91 (м, 4H). ЖХМС (ИЭР): RT = 1,415 мин, полученное m/z 984,4 [M-HCl+H]+.
Соединение 079
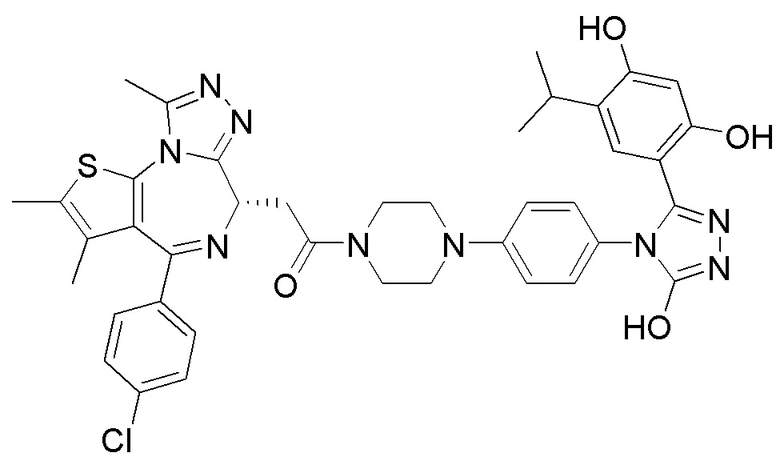
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)фенил)пиперазин-1-ил)этан-1-он. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,85 (с, 1H), 9,59 (с, 2H), 7,50-7,43 (м, 4H), 7,07-6,96 (м, 4H), 6,80 (с, 1H), 6,27 (с, 1H), 4,62-4,59 (т, 1H), 3,81-3,77 (м, 2H), 3,70-3,66 (м, 2H), 3,48-3,40 (м, 2H), 3,29-3,26 (м, 2H), 3,00-2,97 (м, 1H), 2,63 (с, 3H), 2,45 (с, 3H), 1,64 (с, 3H), 0,98-0,97 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,573 мин, полученное m/z 778,1 [M+H]+.
Соединение 080
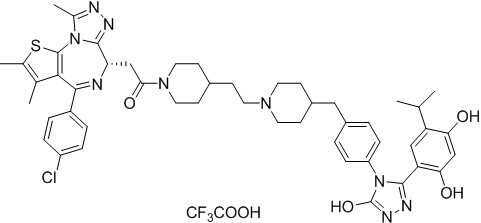
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-(2-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)этил)пиперидин-1-ил)этан-1-он, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,93 (с, 1H), 9,63 (с, 1H), 9,42 (с, 1H), 7,51-7,43 (м, 4H), 7,22-7,12 (м, 4H), 6,77 (с, 1H), 6,27 (с, 1H), 4,59-4,56 (т, J = 13,2 Гц, 1H), 4,36-4,33 (м, 1H), 4,13-4,10 (м, 1H), 3,70-3,33 (м, 3H), 3,22-2,96 (м, 7H), 2,60 (с, 3H), 1,99-2,01 (м, 1H), 1,78-1,59 (м, 10H), 1,39-1,24 (м, 6H), 1,01 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,193 мин, полученное m/z 902,2 [M-CF3COOH+H]+.
Соединение 081
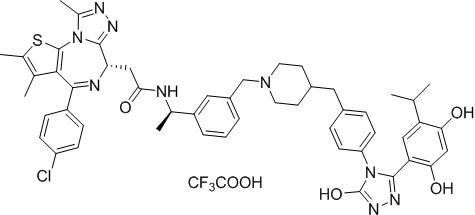
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((R)-1-(3-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)фенил)этил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,91 (с, 1H), 9,60-9,40 (м, 3H), 8,73-8,71 (м, 2H), 7,52-7,10 (м, 12H), 6,76 (с, 1H), 6,26 (с, 1H), 4,02-4,00 (м, 1H), 4,48-4,46 (м, 1H), 4,27-4,26 (м, 2H), 4,94-3,59 (м, 4H), 3,43-3,33 (м, 3H), 2,98-2,86 (м, 3H), 2,68-2,66 (м, 4H), 2,40 (с, 3H), 1,76-1,72 (м, 2H), 1,56 (с, 3H), 1,43-1,24 (м, 3H), 0,94 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,410 мин, полученное m/z 924,3 [M-CF3COOH+H]+.
Соединение 082
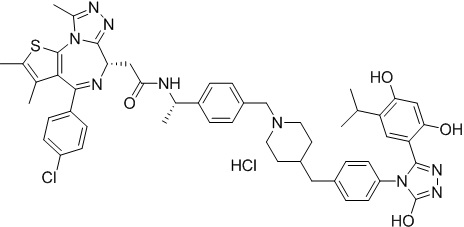
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((R)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)фенил)этил)ацетамида гидрохлорид. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,92 (с, 1H), 9,83 (с, 1H), 9,62 (с, 1H), 9,40 (с, 1H), 8,78-8,76 (м, 2H), 7,57-7,44 (м,6H), 7,37-7,32 (м, 2H), 7,20-7,09 (м, 4H), 6,77 (с, 1H), 6,28 (с, 1H), 5,00 (т, J = 6,7 Гц, 1H), 4,49-4,46 (м, 1H), 4,25-4,24 (м, 2H), 3,40-3,12 (м, 5H), 2,98-2,96 (м, 1H), 2,86-2,82 (м, 2H), 2,67-2,60 (м, 4H), 2,39 (с, 3H), 1,71-1,68 (м, 4H), 1,55 (с, 3H), 1,46-1,39 (м, 4H), 0,95 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,285 мин, полученное m/z 924,6 [M-HCl+H]+.
Соединение 083
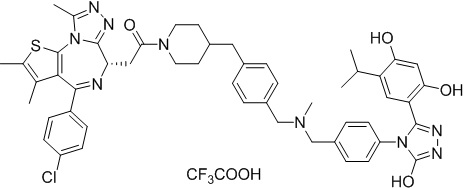
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-(4-(((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)(метил)амино)метил)бензил)пиперидин-1-ил)этан-1-он, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,97 (с, 1H), 9,81 (с, 1H), 9,80 (с, 1H), 9,61 (с, 1H), 7,52-7,26 (м, 12H), 6,90 (с, 1H), 6,24 (с, 1H), 4,57 (т, J = 6,7 Гц, 1H), 4,45-4,11 (м, 8H), 3,59 (с, 1H), 3,39-3,35 (с, 1H), 3,06-2,98 (м, 2H), 2,60-2,58 (м, 5H), 2,52-2,49 (м, 2H), 2,41 (с, 3H), 1,83 (с, 1H), 1,68-1,63 (м, 5H), 1,02 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,203 мин, полученное m/z 924,2 [M-CF3COOH+H]+.
Соединение 084
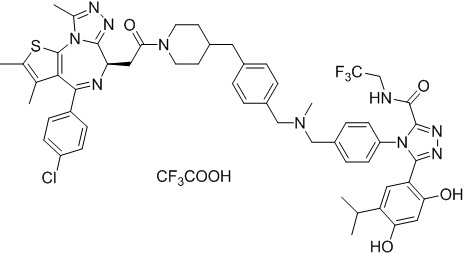
(S)-4-(4-(((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)бензил)(метил)амино)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): 9,70-9,64 (м, 3H), 7,57-7,31 (м, 12H), 6,77 (с, 1H), 6,29 (с, 1H), 4,59-3,94 (м, 11H), 3,72-3,63 (м, 1H), 3,40-3,33 (м, 1H), 2,96-2,92 (м, 2H), 2,60-2,49 (м, 8H), 2,42 (с, 3H), 2,09 (м, 1H), 2,01 (м, 1H), 1,66-1,63 (м, 5H), 1,01 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,293 мин, полученное m/z 1033,1 [M-CF3COOH+H]+.
Соединение 085
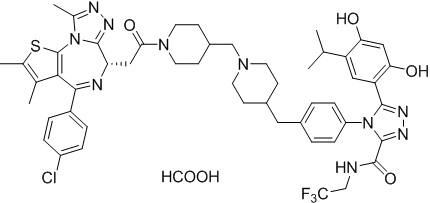
(S)-4-(4-((1-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперидин-4-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, муравьиная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,57 (с, 1H), 9,38 (с, 1H), 8,33 (с, 1H), 7,50-7,42 (м, 4H), 7,29-7,23 (м, 4H), 6,61 (с, 1H), 6,35 (с, 1H), 4,58 (м, 1H), 4,33 (м, 1H), 4,15 (м, 1H), 3,98-3,94 (м, 2H), 3,42-3,38 (м, 2H), 3,11 (м, 2H), 2,93-2,89 (м, 1H), 2,60 (с, 3H), 2,65-2,55 (м, 3H), 2,44 (с, 3H), 2,11-2,10 (м, 2H), 1,79 (м, 4H), 1,63-1,54 (м, 7H), 1,24-1,21 (м, 2H), 0,81 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,460 мин, полученное m/z 997,3 [M-CF3COOH+H]+.
Соединение 086
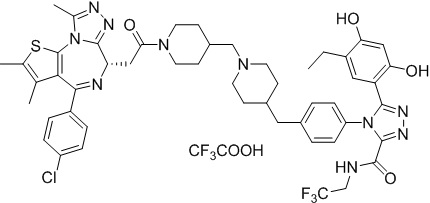
(S)-4-(4-((1-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперидин-4-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,73-9,59 (м, 2H), 8,82 (с, 1H), 9,38 (с, 1H), 7,51-7,43 (м, 4H), 7,29-7,24 (м, 4H), 6,61 (с, 1H), 6,33 (с, 1H), 4,60-4,56 (м, 1H), 4,38-4,34 (м, 1H), 4,23-4,21 (м, 1H), 3,98-3,94 (м, 2H), 3,64-3,52 (м, 3H), 3,40-3,15 (м, 3H), 2,98-2,86 (м, 3H), 2,62-2,58 (м, 5H), 2,42 (с, 3H), 2,27-2,21 (м, 3H), 1,87-1,73 (м, 6H), 1,63 (с, 4H), 1,38-1,10 (м, 2H), 0,84-0,88 (м, 3H). ЖХМС (ИЭР): RT = 1,534 мин, полученное m/z 983,4 [M-CF3COOH+H]+.
Соединение 087
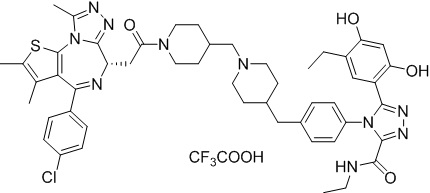
(S)-4-(4-((1-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперидин-4-ил)метил)фенил)-N-этил-5-(5-этил-2,4-дигидроксифенил)-1H-1,2,4l4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,25 (с, 1H), 8,98 (с, 1H), 7,51-7,43 (м, 4H), 7,26 (с, 4H), 6,56 (с, 1H), 6,33 (с, 1H), 4,58 (т, J = 6,7 Гц, 1H), 4,38-4,35 (м, 1H), 4,19-4,08 (м, 1H), 3,78-3,36 (м, 5H), 3,19-3,16 (м, 4H), 2,98-2,81 (м, 3H), 2,67-2,60 (м, 6H), 2,42 (с, 3H), 2,26-2,22 (м, 3H), 1,89-1,74 (м, 5H), 1,63 (с, 3H), 1,60-1,24 (м, 4H), 1,06-1,03 (м, 3H), 0,86-0,83 (м, 3H). ЖХМС (ИЭР): RT = 1,409 мин, полученное m/z 929,3 [M-CF3COOH+H]+.
Соединение 088
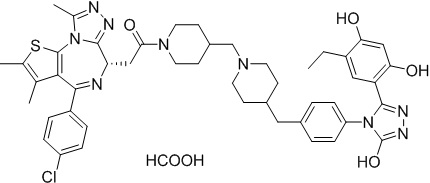
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)пиперидин-1-ил)этан-1-он, муравьиная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,89 (с, 1H), 9,56 (с, 1H), 9,37 (с, 1H), 8,15 (с, 1H), 7,51-7,42 (м, 4H), 7,18-7,08 (м, 4H), 6,80 (с, 1H), 6,26 (с, 1H), 4,59-4,15 (м, 3H), 3,70-3,59 (м, 1H), 3,40-3,38 (м, 3H), 3,12-2,99 (м, 3H), 2,60 (с, 3H), 2,42(с, 3H), 2,39-2,30 (м, 4H), 2,29-1,98 (м, 2H), 1,83-1,80 (м, 2H), 1,64-1,57 (м, 7H), 1,29-1,25 (м, 2H), 0,98-0,94 (м, 4H). ЖХМС (ИЭР): RT = 1,337 мин, полученное m/z 874,1 [M-HCOOH+H]+.
Соединение 089
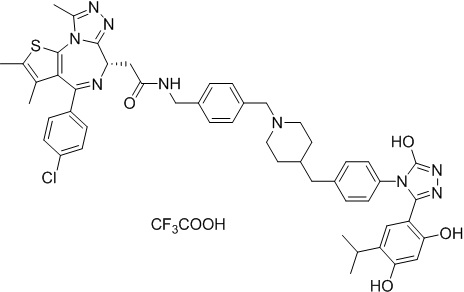
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)бензил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,50-7,22 (м, 12H), 6,69 (с, 1H), 6,26 (с, 1H), 4,66-4,65 (м, 1H), 4,51-4,49 (м, 2H), 4,28-4,26 (м, 2H), 3,45-3,35 (м, 4H), 2,99-2,91 (м, 3H), 2,68 (с, 3H), 2,64-2,62 (м, 2H), 2,35 (с, 3H), 1,89-1,85 (м, 3H), 1,68 (с, 3H), 1,48-1,44 (м, 2H), 0,89 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,153 мин, полученное m/z 910,2 [M-CF3COOH+H]+.
Соединение 090
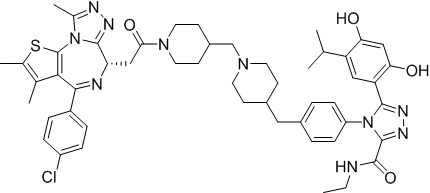
(S)-4-(4-((1-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперидин-4-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-этил-4H-1,2,4-триазол-3-карбоксамид. 1H ЯМР (400 МГц, ДМСО-d6): δ 10,69 (д, J =1,2 Гц, 1H), 9,77 (с, 1H), 8,95 (т, J =1,6 Гц, 1H), 7,50-7,41 (м, 4H), 7,26-7,25 (м, 4H), 6,75 (с, 1H), 6,35 (с, 1H), 4,58 (т, J = 6,8 Гц, 1H), 4,32-4,32 (м, 1H), 4,25-4,20 (м, 1H), 3,65-3,60 (м, 1H), 3,16-3,14 (м, 4H), 2,91-2,88 (м, 3H), 2,59 (с, 3H), 2,54-2,50 (м, 3H), 2,41 (с, 3H), 2,40-2,38 (м, 1H), 2,11-2,01 (м, 2H), 1,98-1,97 (м, 2H), 1,79-1,66 (м, 4H), 1,57 (с, 3H), 1,57-1,45 (м, 5H), 1,03 (т, J = 6,8 Гц, 3H), 0,83 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 2,294 мин, полученное m/z 943,0 [M+H]+.
Соединение 091
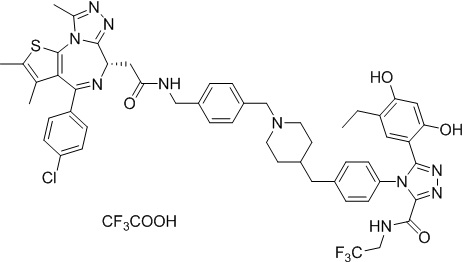
(S)-4-(4-((1-(4-((2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетамидо)метил)бензил)пиперидин-4-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): 9,74-9,62 (м, 2H), 8,81 ( t, J = 6,7 Гц, 1H), 7,50-7,40 (м, 8H), 7,27-7,24 (м, 4H), 6,60 (с, 1H), 6,32 (с, 1H), 4,57-4,27 (м, 5H), 3,98-3,94 (м, 2H), 3,37-3,32 (м, 4H), 2,90-2,85 (м, 2H), 2,60 (с, 3H), 2,54-2,50 (м, 2H), 2,41 (с, 3H), 2,24-2,20 (м, 2H), 1,75-1,61 (м, 6H), 1,40-1,25 (м, 3H), 0,86-0,83 (м, 3H). ЖХМС (ИЭР): RT = 1,383 мин, полученное m/z 1005,2 [M-CF3COOH+H]+.
Соединение 092
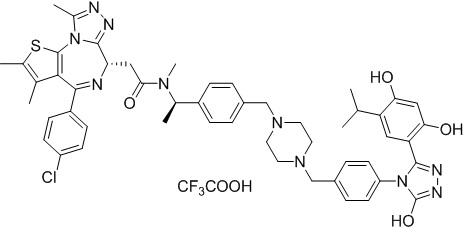
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((R)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)фенил)этил)-N-метилацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): 7,50-7,31 (м, 12H), 7,30-7,29 (м, 2H), 6,76 (с, 1H), 6,24 (с, 1H), 5,98 (с, 1H), 4,78-4,75 (м, 3H), 3,48-3,37 (м, 8H), 3,18-2,89 (м, 8H), 2,71-2,55 (м, 5H), 2,46 (с, 3H), 1,74-1,29 (м, 5H), 0,93-0,92 (м, 6H). ЖХМС (ИЭР): RT = 1,172 мин, полученное m/z 939,3 [M-CF3COOH+H]+.
Соединение 093
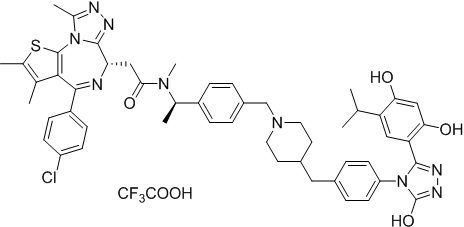
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-((R)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)фенил)этил)-N-метилацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,50-7,41 (м, 8H), 7,30-7,20 (м, 4H), 6,87 (д, J = 3,2 Гц, 1H), 6,26 (с, 1H), 4,78 (т, J = 6,7 Гц, 1H), 4,30-4,29 (м, 2H), 3,35-3,33 (м, 2H), 3,10 (с, 3H), 3,10-3,09 (м, 1H), 2,71 (с, 3H), 2,65 (с, 3H), 2,65-2,63 (м, 3H), 2,45 (с, 3H), 1,93-1,90 (м, 3H), 1,70 (с, 3H), 1,59-1,57 (м, 2H), 1,38-1,30 (м, 4H), 0,86 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,203 мин, полученное m/z 938,3 [M-CF3COOH+H]+.
Соединение 094
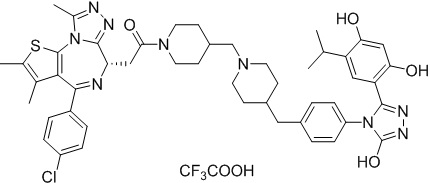
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)пиперидин-1-ил)этан-1-он, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,94 (с, 1H), 9,62 (с, 1H), 9,48 (с, 1H), 8,38 (с, 1H), 7,51 (д, J =7,6 Гц, 2H), 7,44 (д, J =7,6 Гц, 2H), 7,22 (д, J =7,6 Гц, 2H), 7,13 (д, J =7,6 Гц, 2H), 6,77 (с, 1H), 6,27 (с, 1H), 4,58 (т, J = 6,7 Гц, 1H), 4,37-4,34 (м, 1H), 4,18-4,16 (м, 1H), 3,66-3,60 (м, 2H), 3,20-3,10 (м, 1H), 2,99-2,84 (м, 4H), 2,56 (с, 3H), 2,52-2,50 (м, 3H), 2,40 (с, 3H), 2,10-2,00 (м, 1H), 1,83-1,73 (м, 5H), 1,63 (с, 3H), 1,48-1,44 (м, 2H), 1,25-1,20 (m ,3H), 0,96 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,174 мин, полученное m/z 888,2 [M-CF3COOH+H]+.
Соединение 095
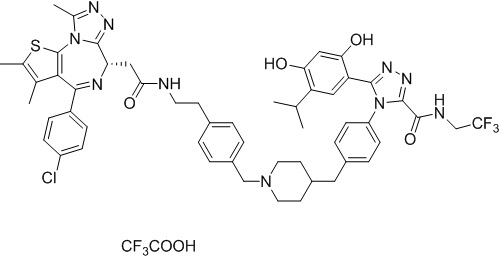
(S)-4-(4-((1-(4-(2-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетамидо)этил)бензил)пиперидин-4-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,82 (с, 1H), 9,62 (с, 1H), 9,38 (с, 1H), 7,50-7,20 (м, 12H), 6,60 (с, 1H), 6,33 (с, 1H), 4,52 (т, J = 6,7 Гц, 1H), 4,46-4,11 (м, 1H), 3,95-3,90 (м, 2H), 3,40-3,55 (м, 10H), 3,30-3,22 (м, 4H), 2,90-2,79 (м, 2H), 2,67-2,61 (м, 2H), 2,55 (с, 3H), 2,41 (с, 3H), 1,85-1,72 (м, 3H), 1,63 (с, 3H), 1,30-1,20 (м, 2H), 0,82 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,253 мин, полученное m/z 1033,3 [M-CF3COOH+H]+.
Соединение 096
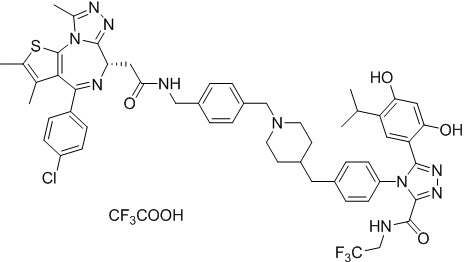
(S)-4-(4-((1-(4-((2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетамидо)метил)бензил)пиперидин-4-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,62-9,50 (м, 2H), 8,88 (с, 1H), 7,50-7,42 (м, 8H), 7,28-7,26 (м, 4H), 6,77 (с, 1H), 6,34 (с, 1H), 4,58 (т, J = 6,7 Гц, 1H), 4,39-4,38 (м, 3H), 4,32-4,25 (м, 3H), 3,98-3,95 (м, 5H), 3,70-3,65 (м, 2H), 3,25-3,20 (м, 1H), 1,85-2,83 (м, 3H), 2,42-2,40 (м, 4H), 2,39 (с, 3H), 1,85-1,72 (м, 3H), 1,63 (с, 3H), 1,20-1,10 (м, 2H), 0,82 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,255 мин, полученное m/z 1019,3 [M-CF3COOH+H]+.
Соединение 097
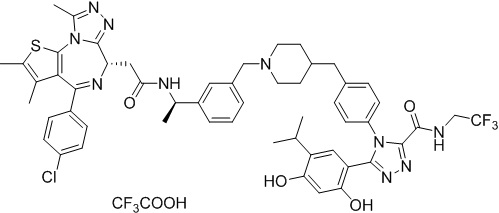
4-(4-((1-(3-((R)-1-(2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетамидо)этил)бензил)пиперидин-4-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,78 (с, 1H), 9,60-9,50 (м, 2H), 8,73 (д, J =7,6 Гц, 1H), 7,52-7,40 (м, 7H), 7,31-7,24 (м, 6H), 6,59 (с, 1H), 6,34 (с, 1H), 5,00 (т, J = 6,7 Гц, 1H), 4,49-4,46 (м, 1H), 4,28-4,26 (м, 2H), 3,99-3,97(м, 2H), 3,38-3,35 (м, 2H), 3,32-3,24 (м, 2H), 3,13-3,10 (м, 3H), 2,59 (с, 3H), 2,50-2,48 (м, 2H), 2,41 (с, 1H), 1,75-1,72 (м, 3H), 1,63 (с, 3H), 1,44-1,41 (м, 4H), 1,22 (т, J = 6,8 Гц, 3H), 0,98 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,455 мин, полученное m/z 1033,3 [M-CF3COOH+H]+.
Соединение 098
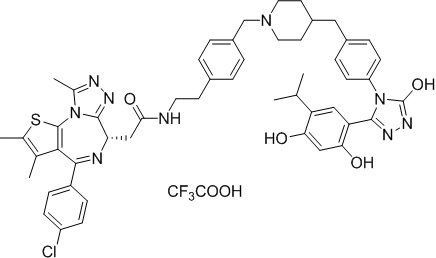
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)фенэтил)ацетамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,91 (с, 1H), 9,62-9,38 (м, 3H), 8,31 (д, J =2,4 Гц, 1H), 7,50-7,33 (м, 8H), 7,19-7,09 (м, 4H), 6,76-6,75 (м, 1H), 6,26-6,24 (м, 1H), 4,51-4,49 (м, 1H), 4,21-3,92 (м, 2H), 3,44-3,25 (м, 2H), 2,98-2,82 (м, 7H), 2,68-2,66 (м, 4H), 2,41 (с, 3H), 1,73-1,71 (м, 3H), 1,68-1,66 (м, 3H), 1,35-1,33 (м, 2H), 0,94 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,172 мин, полученное m/z 924,3 [M-CF3COOH+H]+.
Соединение 099
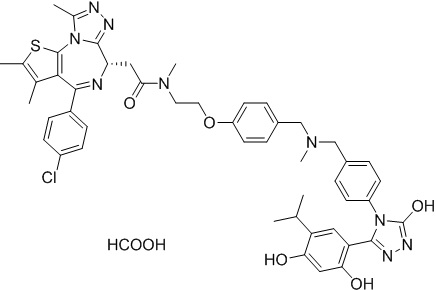
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(2-(4-(((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)(метил)амино)метил)фенокси)этил)-N-метилацетамид, муравьиная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,92 (с, 1H), 9,75-9,30 (м, 2H), 8,37 (с, 3H), 7,43-7,12 (м, 11H), 6,95-6,90 (м, 2H), 6,76 (с, 1H), 6,26 (с, 1H), 4,58-4,55 (м, 1H), 4,31-4,24 (м, 1H), 4,06-4,04 (м, 1H), 3,45 (с, 3H), 3,42 (с, 3H), 3,27 (с, 2H), 2,95-2,92 (м, 2H), 2,59 (с, 3H), 2,42-2,41 (м, 3H), 2,04 (с, 3H), 1,62 (д, J = 9,2 Гц, 3H), 0,91 (д, J = 7,2 Гц, 6H). ЖХМС (ИЭР): RT = 1,403 мин, полученное m/z 900,2 [M-HCOOH+H]+.
Соединение 100
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(3-(4-(((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)(этил)амино)метил)фенокси)пропил)ацетамид, муравьиная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,92 (с, 1H), 9,81-9,32 (м, 2H), 8,44-8,29 (м, 4H), 7,42-7,33 (м, 7H), 7,22- 7,12 (м, 4H), 6,85 (д, J = 8,4 Гц, 2H), 6,74 (с, 1H), 6,27 (с, 1H), 4,52-4,49 (м, 1H), 3,99-3,96 (м, 2H), 3,49 (с, 2H), 3,45 (с, 2H), 3,20-3,14 (м, 1H), 2,95-2,91 (м, 1H), 2,59 (с, 3H), 2,42-2,33 (м, 6H), 1,91-1,97 (м, 2H), 1,59 (с, 3H), 0,96 (т, J = 7,2 Гц , 3H), 0,89 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,398 мин, полученное m/z 914,2 [M-HCOOH+H]+.
Соединение 101
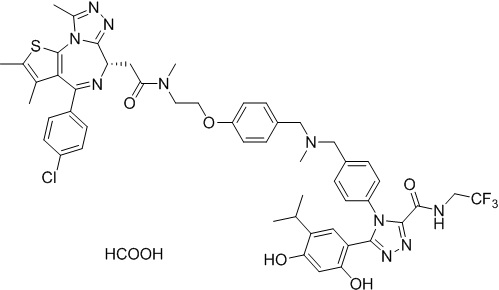
(S)-4-(4-(((4-(2-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-метилацетамидо)этокси)бензил)(метил)амино)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, муравьиная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,54-7,42 (м, 2H), 7,41-7,29 (м, 8H), 7,08-7,02 (м, 2H),6,74 (с, 1H), 6,26 (д, J = 1,6 Гц , 1H), 4,76-4,72 (м, 1H), 4,57 (с, 3H), 4,22-4,21 (м, 1H), 4,08-3,96 (м, 6H), 3,40 (с, 2H), 3,13 (с, 2H), 3,01-2,89 (м, 1H), 2,68 (с, 3H), 2,55 (с, 3H), 2,44 (с, 4H), 1,68 (д, J = 6,4 Гц, 3H), 0,89 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,457 мин, полученное m/z 1009,2 [M-HCOOH+H]+.
Соединение 102
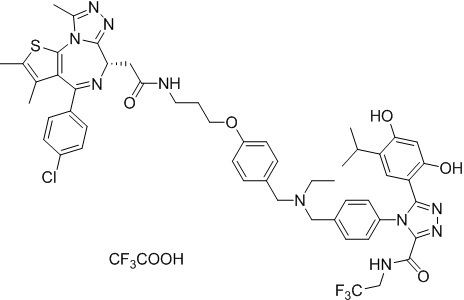
(S)-4-(4-(((4-(3-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетамидо)пропокси)бензил)(этил)амино)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,71-9,63 (м, 3H), 8,32-8,31 (м, 1H), 7,57-7,45 (м, 2H), 7,43-7,37 (м, 8H), 7,02 (д, J = 8,4 Гц, 2H), 6,77 (с, 1H), 6,29 (с, 1H), 4,52-4,49 (м, 1H), 4,32-4,23 (м, 4H), 4,06-3,94 (м, 4H), 3,31-3,24 (м, 4H), 2,96-2,91 (м, 3H), 2,59 (с, 3H), 2,40 (с, 3H), 1,93-1,90 (м, 2H), 1,61 (с, 3H), 1,24 (т, J = 7,2 Гц, 3H), 0,90 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,456 мин, полученное m/z 1023,2 [M-CF3COOH+H]+.
Соединение 103
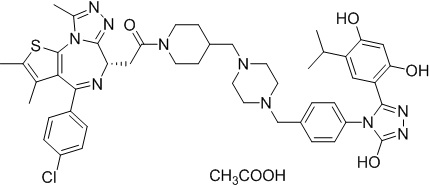
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-он ацетат.
1H ЯМР (400 МГц, ДМСО-d6): δ 11,92 (с, 2H), 9,58 (с, 1H), 9,40 (с, 1H), 7,50-7,42 (м, 4H), 7,30 (д, J = 8,0 Гц, 2H), 7,14 (д, J = 8,0 Гц, 2H), 6,77 (с, 1H), 6,27 (с, 1H), 4,59-4,55 (м, 1H), 4,36-4,32 (м, 1,H), 4,13-4,10 (м, 1H), 3,60-3,58 (м, 1H), 3,46 (с, 1H), 3,38-3,32 (м, 6H), 3,11-2,95 (м, 2H), 2,51-2,50 (м, 4H), 2,41-2,33 (м, 8H), 2,15 (с, 2H), 1,91 (с, 3H), 1,81-1,68 (м, 3H), 1,63 (с, 3H), 1,24-1,22 (м, 1H), 0,94 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,512 мин, полученное m/z 889,3 [M-CH3COOH+H]+.
Соединение 104
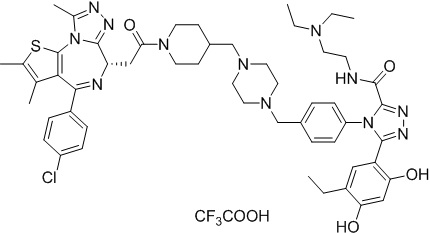
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-N-(2-(диэтиламино)этил)-5-(5-этил-2,4-дигидроксифенил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,72 (с, 1H), 9,22-9,10 (м, 2H), 7,51-7,30 (м, 8H), 6,77 (с, 1H), 6,34 (с, 1H), 4,58 (т, J = 6,7 Гц, 1H), 4,46-4,35 (м, 1H), 4,20-4,10 (м, 1H), 3,70-3,65 (м, 3H), 3,35-3,16 (м, 8H), 3,10-2,80 (м, 7H), 2,67 (с, 3H), 2,42 (с, 3H), 2,34-2,23 (м, 6H), 1,85-1,70 (м, 3H), 1,63 (с, 3H), 1,18 (д, J = 6,9 Гц, 6H), 0,89 (т, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,275 мин, полученное m/z 1001,2 [M-CF3COOH+H]+.
Соединение 105
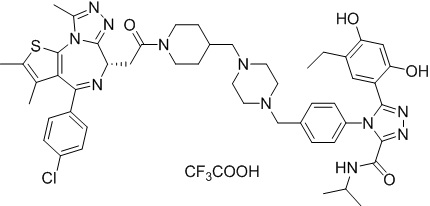
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-изопропил-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ9,69 (с, 1H), 7,51-7,28 (м, 8H), 6,62 (с, 1H), 6,31 (с, 1H), 4,59-3,92 (м, 4H), 3,77-3,61 (м, 13H), 3,26-2,88 (м, 8H), 2,67 (с, 3H), 2,38 (с, 3H), 2,33-2,22 (м, 2H), 1,87-1,72 (м, 2H), 1,63 (с, 3H), 1,13-1,06 (м, 6H), 0,89-0,85 (м, 3H). ЖХМС (ИЭР): RT = 1,200 мин, полученное m/z 944,2 [M-CF3COOH+H]+.
Соединение 106
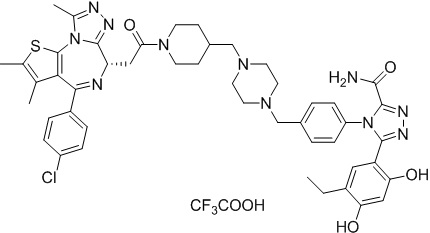
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,62 (с, 1H), 8,29 (с, 1H), 7,71 (с, 1H), 7,51-7,32 (м, 9H), 6,61 (с, 1H), 6,36 (с, 3H), 4,58 (т, J = 6,7 Гц, 1H), 4,46-4,33 (м, 1H), 4,22-4,10 (м, 1H), 3,68-3,55 (м, 6H), 3,20-2,80 (м, 6H), 2,75-2,67 (м, 2H), 2,67 (с, 3H), 2,41 (с, 3H), 2,32-2,24 (м, 3H), 2,05-1,98 (м, 1H), 1,75-1,65 (м, 3H), 1,63 (с, 3H), 1,20-1,10 (м, 3H), 0,86 (т, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,117 мин, полученное m/z 902,2 [M-CF3COOH+H]+.
Соединение 107
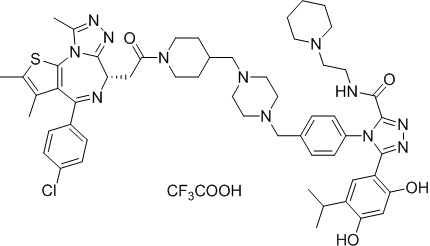
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2-(пиперидин-1-ил)этил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ7,55-7,40 (м, 8H), 6,70 (с, 1H), 6,31 (с, 1H), 5,11-5,00 (м, 6H), 4,75-4,20 (м, 2H), 3,88-3,39 (м, 12H), 2,97-2,91 (м, 8H), 2,74-2,70 (м, 3H), 2,45-2,44 (м, 3H), 1,94-1,68 (м, 11H), 1,63-1,20 (м, 3H), 0,92-0,90 (м, 2H). ЖХМС (ИЭР): RT = 0,915 мин, полученное m/z 1027,6 [M-CF3COOH+H]+.
Соединение 108
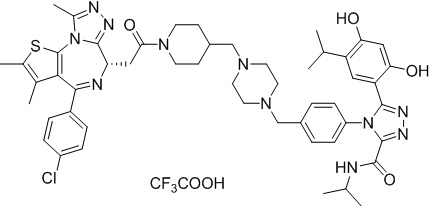
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-изопропил-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,76 (с, 1H), 8,93-8,75 (м, 1H), 7,50-7,31 (м, 9H), 6,60 (с, 1H), 6,34 (с, 1H), 4,70-3,85 (м, 4H), 3,62-3,45 (м, 2H), 3,20-2,92 (м, 9H), 2,78-2,57 (м, 5H), 2,42-2,00 (м, 7H), 1,87-1,60 (м, 8H), 1,11-1,07 (м, 6H), 0,95-0,75 (м, 6H). ЖХМС (ИЭР): RT = 1,196 мин, полученное m/z 958,2 [M-CF3COOH+H]+.
Соединение 109
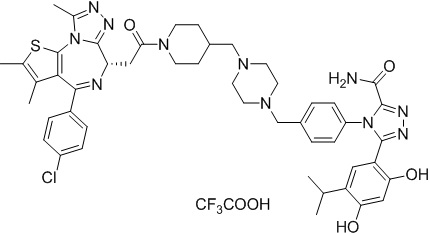
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,81 (с, 1H), 8,32 (с, 1H), 7,72 (с, 1H), 7,51-7,37 (м, 8H), 6,20 (с, 1H), 6,34 (с, 1H), 4,60-4,12 (м, 3H), 3,17-2,93 (м, 11H), 2,67-2,50 (м, 4H), 2,41-2,33 (м, 4H), 2,05-2,02 (м, 6H), 1,63 (с, 3H), 1,23-0,84 (м, 10H). ЖХМС (ИЭР): RT = 1,136 мин, полученное m/z 916,2 [M-CF3COOH+H]+.
Соединение 110
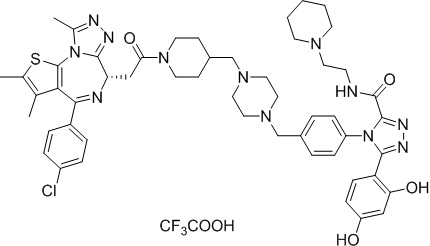
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидроксифенил)-N-(2-(пиперидин-1-ил)этил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,27-9,25 (м, 2H), 7,51-7,29 (м, 9H), 6,92-6,90 (м, 2H), 6,21-6,18 (м, 2H), 4,60-4,56 (м, 1H), 4,41-4,35 (м, 1H), 4,22-4,18 (м, 1H), 3,57-3,50 (м, 5H), 3,42-3,19 (м, 3H), 2,94-2,86 (м, 5H), 2,60 (с, 3H), 2,44-2,33 (м, 8H), 2,23-2,05 (м, 2H), 1,87-1,56 (м, 12H), 1,26-0,99 (м, 5H). ЖХМС (ИЭР): RT = 1,131 мин, полученное m/z 985,5 [M-CF3COOH+H]+.
Соединение 111
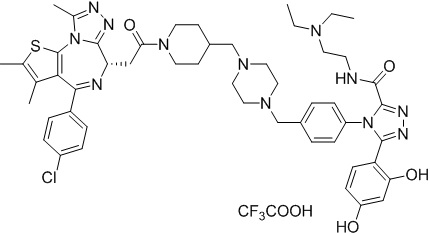
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-N-(2-(диэтиламино)этил)-5-(2,4-дигидроксифенил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,24-9,22 (м, 3H), 7,52-7,29 (м, 9H), 6,91 (д, J = 8,4 Гц, 1H), 6,22-6,17 (м, 2H), 4,60-4,55 (м, 1H), 4,38-4,33 (м, 2H), 4,21-4,13 (м, 2H), 3,69-3,51 (м, 4H), 3,42-3,32 (м, 1H), 3,25-2,80 (м, 15H), 2,60 (с, 4H), 2,42 (с, 5H), 2,04 (с, 1H), 1,89-1,69 (м, 2H), 1,63 (с, 3H), 1,21-1,16 (м, 6H). ЖХМС (ИЭР): RT = 0,946 мин, полученное m/z 973,3 [M-CF3COOH+H]+.
Соединение 112
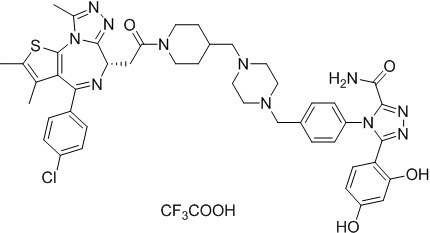
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидроксифенил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 10,15-9,51 (м, 1H), 8,84 (с, 1H), 8,31 (с, 1H), 7,51-7,26 (м, 9H), 7,01-6,83 (м, 1H), 6,29-6,14 (м, 2H), 4,60-4,55 (м, 1H), 4,39-4,33 (м, 1H), 4,20-4,14 (м, 2H), 3,67-3,61 m, 6H), 3,42-3,33 (м, 2H), 3,15-2,92 (м, 6H), 2,68-2,58 (м, 5H), 2,42 (с, 4H), 2,05 (с, 1H), 1,88-1,71 (м, 2H), 1,63 (с, 3H), 1,31-0,96 (м, 2H). ЖХМС (ИЭР): RT = 1,190 мин, полученное m/z 874,2 [M-CF3COOH+H]+.
Соединение 117
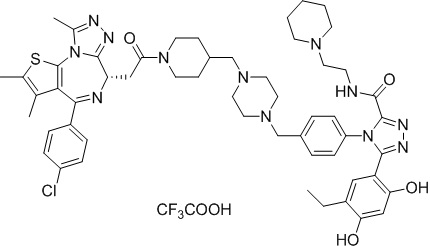
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2-(пиперидин-1-ил)этил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,72 (с, 1H), 9,62-9,60 (м, 1H), 9,00 (с, 1H), 7,51-7,33 (м, 10H), 6,77 (с, 1H), 6,30 (с, 1H), 4,58 (т, J = 6,7 Гц, 2H), 4,30-4,20 (м, 2H), 4,15-4,10 (м, 2H), 3,63-3,50 (м, 7H), 3,20-3,17 (м, 2H), 2,91-2,88 (м, 4H), 2,60 (с, 3H), 2,42 (с, 3H), 2,33-2,27 (м, 4H), 1,83-1,60 (м, 14H), 1,20-1,10 (м, 2H), 0,91-0,87 (м, 4H). ЖХМС (ИЭР): RT = 0,996 мин, полученное m/z 1013,2 [M-CF3COOH+H]+.
Соединение 118
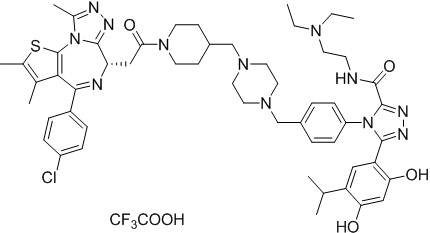
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-N-(2-(диэтиламино)этил)-5-(2,4-дигидрокси-5-изопропилфенил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,55-7,38 (м, 8H), 6,70 (с, 1H), 6,31 (с, 1H), 4,76-4,68 (м, 5H), 4,30-4,20 (м, 1H), 3,86-3,50 (м, 11H), 3,12-2,96 (м, 10H), 2,71 (с, 3H), 2,45 (с, 3H), 2,20-2,10(м, 1H), 1,98-1,90(м, 2H), 1,70 (с, 3H), 1,40-1,38 (м, 1H), 1,31 (т, J = 6,8 Гц, 6H), 0,90 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,005 мин, полученное m/z 1015,2 [M-CF3COOH+H]+.
Соединение 119
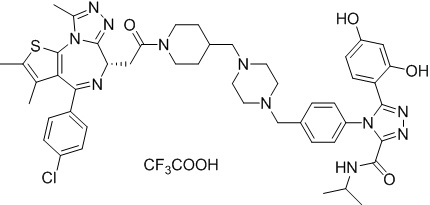
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидроксифенил)-N-изопропил-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, CD3OD): δ 7,46-7,26(м, 9H), 6,87 (д, J =8,8 Гц, 1H), 6,22 (д, J=2,4 Гц, 1H), 6,18 (дд, J1 =8,4 Гц, J2 =2,4 Гц, 1H), 4,70-4,50 (м, 3H), 4,28-4,26 (м, 2H), 4,04-4,02 (м, 1H), 3,65-3,58 (м ,4H), 3,30-3,23 (м, 1H), 2,72-2,62 (м, 12H), 2,44-2,39 (м, 5H), 1,94-1,91 (м, 3H), 1,69 (с, 3H), 1,20 (д, J = 6,8 Гц, 6H). ЖХМС (ИЭР): RT = 1,411 мин, полученное m/z 916,2 [M-CF3COOH+H]+.
Соединение 120
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-4H-1,2,4-триазол-3-карбоксамида гидрохлорид. 1H ЯМР (400 МГц, CD3OD): δ 7,89-7,87 (м, 2H), 7,67-7,60 (м, 6H), 6,83-6,81 (м, 1H), 6,46-6,43 (м, 1H), 5,13-5,11 (м, 1H), 4,65-4,59 (м, 3H), 4,22-4,21 (м ,1H), 3,93-3,71 (м, 9H), 3,31-3,28 (м, 8H), 3,01 (с, 3H), 2,87-2,82 (м, 1H), 2,36-2,32 (м, 3H), 2,13-2,01 (м, 2H), 1,72 (с, 3H), 1,55-1,29 (м, 2H), 0,93-0,91 (м, 3H). ЖХМС (ИЭР): RT = 1,130 мин, полученное m/z 902,2 [M-HCl+H]+.
Соединение 121

(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-4H-1,2,4-триазол-3-карбоксамида гидрохлорид. 1H ЯМР (400 МГц, CD3OD): δ 7,89-7,87 (м, 2H), 7,67-7,60 (м, 6H), 6,83-6,81 (м, 1H), 6,46-6,43 (м, 1H), 5,13-5,11 (м, 1H), 4,65-4,59 (м, 3H), 4,22-4,21 (м ,1H), 3,93-3,71 (м, 9H), 3,31-3,28 (м, 8H), 3,01 (с, 3H), 2,87-2,82 (м, 1H), 2,36-2,32 (м, 3H), 2,13-2,01 (м, 2H), 1,72 (с, 3H), 1,55-1,29 (м, 2H), 0,93-0,91 (м, 3H). ЖХМС (ИЭР): RT = 1,130 мин, 937,34, полученное m/z 902,2 [M-HCl+H]+.
Соединение 123
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-пропилфенил)-N-(2-(пиперидин-1-ил)этил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,70 (с, 1H), 9,25 (с, 1H), 9,05 (с, 1H), 7,51-7,32 (м, 8H), 6,66 (с, 1H), 6,30 (с, 1H), 4,59-4,56 (м, 1H), 4,35-4,33 (м, 4H), 4,17-4,15 (м, 4H), 3,55-3,53 (м, 2H), 3,50-3,49 (м, 6H), 3,30-3,28 (м, 2H), 3,18-3,16 (м, 2H), 3,11-2,95 (м, 6H), 2,60 (с, 3H), 2,50 (с, 3H), 2,25-2,23 (м, 2H), 1,63-1,60 (м, 6H), 1,58 (с, 3H), 1,33-1,31 (м, 4H), 1,10-1,08 (м, 2H), 0,75-0,72 (м, 3H). ЖХМС (ИЭР): RT = 1,066 мин, полученное m/z 1027,5 [M-CF3COOH+H]+.
Соединение 124
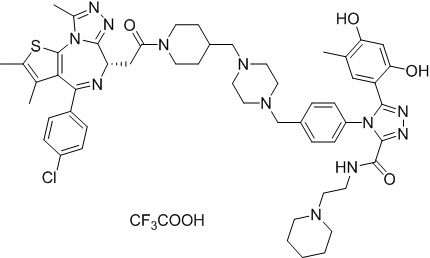
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-метилфенил)-N-(2-(пиперидин-1-ил)этил)-4H-1,2,4-триазол-3-карбоксамид, трифторуксусная кислота. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,73 (с, 1H), 9,25 (с, 1H), 9,02 (с, 1H), 7,52-7,47 (м, 2H), 7,46-7,41 (м, 2H), 7,40-7,35 (м, 2H), 7,33-7,28 (м, 2H), 6,72 (с, 1H), 6,28 (с, 1H), 4,60-4,54 (м, 1H), 4,40-4,32 (м, 1H), 4,22-4,13 (м, 1H), 3,25-3,09 (м, 10H), 3,05-2,78 (м, 12H), 2,59 (с, 3H), 2,41 (с, 3H), 2,11-1,94 (м, 3H), 1,88 (с, 4H), 1,83-1,62 (м, 12H). ЖХМС (ИЭР): RT = 1,017 мин, полученное m/z 999,4 [M-CF3COOH+H]+.
Соединение 125
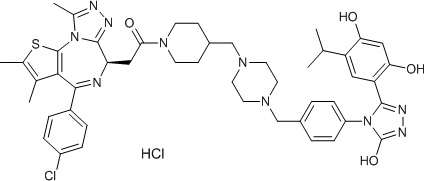
(R)-2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-она гидрохлорид. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,95 (с, 1H), 11,26(с, 1H), 9,62 (с, 1H), 9,31 (с, 1H), 7,64-7,44 (м, 6H), 7,25 (д, J = 8,4 Гц, 2H), 6,93 (с, 1H), 6,31 (с, 1H), 4,63 (т, J = 6,7 Гц, 1H), 4,41-4,15 (м, 3H), 3,79-3,40 (м, 12H), 3,43-3,00 (м, 4H), 2,76-2,55 (м, 5H), 2,42 (с, 3H), 2,05-2,02 (м, 1H), 1,90-1,68 (м, 2H), 1,63 (с, 3H), 0,98 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): Rt = 1,088 мин, полученное m/z 889,6 [M-HCl+H+].
Соединение 126
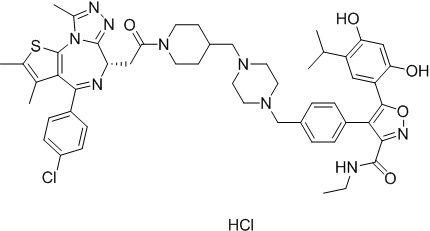
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-этилизоксазол-3-карбоксамида гидрохлорид. 1H ЯМР (400 МГц, ДМСО-d6): 9,85 (с, 1H), 9,67 (с, 1H), 8,93-8,90 (м, 1H) 7,52-7,31 (м, 8H), 6,82 (с, 1H), 6,48 (с, 1H), 4,60 (т, J = 6,7 Гц, 1H), 4,37-4,23 (м, 2H), 4,17-4,02 (м, 2H), 3,74-2,98 (м, 19H), 2,67-2,65 (м, 4H), 2,42 (с, 3H), 2,16-2,14 (м, 1H), 1,94-1,92 (м, 2H), 1,63 (с, 3H), 1,23-1,11 (м, 3H), 0,98 (д, J = 6,9 Гц, 6H). ЖХМС (ИЭР): RT = 1,420 мин, полученное m/z 944,6 [M-HCl+H]+.
Пример 5: Исследование различных молекул T-PEACH
Материалы и методы
Анализ связывания HSP90α методом флуоресцентной поляризации (ФП)
Готовили мастер-микс с аналитическим буфером, БСА и ФИТЦ-гелданамицином. В 96-луночном планшете готовили 3-кратное серийное разведение каждого соединения в диапазоне от 40 мкМ до 2,0 нМ. Также в 96-луночном планшете рекомбинантный белок HSP90α разводили до 28 мкг/мл. Потом в 384-луночный планшет добавляли 10 мкл мастер-микса и 5 мкл разведенного соединения на лунку в дублирующие лунки и смешивали путем кратковременного встряхивания. Потом добавляли 5 мкл разведенного белка HSP90α на лунку, смешивали путем кратковременного встряхивания, инкубировали при 25°C в течение 30, 60 и 120 мин и измеряли флуоресценцию на планшет-ридере EnVision. Значения мП с вычтенным фоном рассчитывали по исходным данным EnVision, а четырехпараметрическую кривую «log[ингибитор] vs ответ» аппроксимировали, используя GraphPad Prism 7.0
Анализ связывания бромодомена
Штаммы фага T7, воспроизводящие разные белки бромодомена человека, выращивали параллельно в 24-луночных блоках в клетках-хозяевах E. coli, полученных из штамма BL21. E. coli выращивали до log-фазы, инфицировали фагом T7 из замороженного исходного материала (множественность заражения = 0,4) и инкубировали со встряхиванием при 32°C до лизиса (90-150 мин). Лизаты центрифугировали при 5000 x g и фильтровали 0,2 мкм для удаления клеточного дебриса. Покрытые стрептавидином магнитные гранулы обрабатывали биотинилированными низкомолекулярными или ацетилированными пептидными лигандами в течение 30 мин при комнатной температуре для создания аффинных смол для анализа бромодомена. Гранулы с лигандами блокировали избытком биотина и промывали блокирующим буфером SEA BLOCK (Pierce Scientific) с 1% БСА, 0,05% Твин 20 и 1 мМ ДТТ для удаления несвязанных лигандов и снижения неспецифического связывания фага. Реакции связывания проводили посредством смешивания бромодоменов, аффинных гранул с лигандами и исследуемых соединений в 1X буфере для связывания (16% SEA BLOCK, 0,32X ФСБ, 0,02% БСА, 0,04% Твин 20, 0,004% азид натрия и 7,9 мМ ДТТ). Исследуемые соединения готовили в виде 1000X исходных растворов в 100% ДМСО, после чего разводили 1:25 в моноэтиленгликоле (МЭГ). Затем соединения разводили непосредственно для анализа так, чтобы конечные концентрации ДМСО и МЭГ составляли 0,1% и 2,4%, соответственно. Все реакции проводили в полипропиленовых 384-луночных планшетах в конечном объеме 0,02 мл. Аналитические планшеты инкубировали при комнатной температуре со встряхиванием в течение 1 ч и промывали аффинные гранулы промывочным буфером (1X ФСБ, 0,05% Твин 20). Затем гранулы ресуспендировали в элюирующем буфере (1X ФСБ, 0,05% Твин 20, 2 мкМ небиотинилированного аффинного лиганда) и инкубировали при комнатной температуре со встряхиванием в течение 30 мин. Концентрацию бромодоменов в элюатах измеряли с помощью кПЦР. Процентный контроль соединения определяли по следующему уравнению:
% Ктрл = (Сигнал СОЕДИНЕНИЯ - Сигнал ПК)/(Сигнал ОК - Сигнал ПК)
Анализ связывания BRD4 методом гомогенной флуоресценции с временным разрешением (ГФВР)
Готовили мастер-микс с аналитическим буфером, 1,8 мкг/мл рекомбинантного белка BRD4 (домены BD1 + BD2) и 200-кратными разведениями Tb-меченного донора и меченного красителем акцептора. Готовили 40-кратные разведения ацетилированных и неацетилированных лигандов в 1X аналитическом буфере BRD TR-FRET. Также готовили 3-кратное серийное разведение каждого соединения в диапазоне от 40 мкМ до 2,0 нМ. В 384-луночный планшет добавляли 5 мкл разведенного лиганда и 5 мкл разведенного соединения на лунку в дублирующие лунки и смешивали путем кратковременного встряхивания. Потом добавляли 10 мкл мастер-микса на лунку, смешивали путем кратковременного встряхивания, инкубировали при 25°C в течение 2 ч и измеряли флуоресценцию на планшет-ридере EnVision. Отношение 665 нм/615 нм рассчитывали по исходным данным EnVision. Данные нормализовали, используя усреднение «положительных» и «отрицательных» считываний для всего планшета. Четырехпараметрическую кривую «log[ингибитор] vs ответ» аппроксимировали, используя GraphPad Prism 7.0
Проточная цитометрия деградации белка
Клетки MV4-11 высевали в 24-луночные планшеты для тканевого культивирования при плотности 350000 клеток/450 мкл/лунка и инкубировали в условиях 37°C/5% CO2 в течение 1 ч. Затем клетки обрабатывали соединениями в различных концентрациях и инкубировали в условиях 37°C/5% CO2 в течение 24 ч. Клетки собирали, промывали один раз, подсчитывали и добавляли 200 мкл 1% параформальдегида/ФСБ и инкубировали в течение 15 мин при комнатной температуре. Добавляли 200 мкл 1X ФСБ/0,4% Тритон X-100 и инкубировали в течение 15 мин при 4°C. Клетки промывали три раза и ресуспендировали в 50 мкл 1X ФСБ/0,2% Тритон X-100. Добавляли 2 мкл/106 клеток анти-BRD4 антитела (ABCAM, № 128874) и смешивали путем пипетирования. Клетки инкубировали в течение 30 мин при комнатной температуре в темноте, промывали три раза и ресуспендировали в 50 мкл 1X ФСБ/0,2% Тритон X-100. Добавляли козье антикроличье антитело IgG H&L (разведение 1:2000), смешивали путем пипетирования и инкубировали в течение 30 мин при комнатной температуре в темноте. И наконец, клетки промывали три раза и ресуспендировали в 200 мкл ФСБ для проточного цитометрического анализа. Эффективность ингибирования соединения определяли по следующему уравнению и анализировали, используя GraphPad Prism 7.0:
% ингибирования = 100-(D-B)/(S-B)*100%.
S: Интенсивность флуоресценции MV4-11 с антителом
D: Интенсивность флуоресценции в присутствии разных разведений соединений с антителом
B: Интенсивность флуоресценции только MV4-11
Проводили аналогичные эксперименты по проточной цитометрии для ERBB2 в клетках карциномы молочной железы человека BT-474 (ATCC, № HTB-20) и IGF1R, EGFR и RAF1 в клетках эмбриональной почки человека HEK-293 (ATCC, № CRL-1573), используя анти-ERBB2 (R&D, № FAB1129P), анти-IGF1R (Cell Signaling Technology, № 9750), анти-EGFR (Cell Signaling Technology, № 139690) и анти-RAF1 (ABCAM, № ab181115) антитела.
Вестерн-блоттинг
Клетки острого миелоидного лейкоза человека MV4-11 (ATCC, № CRL-9591) высевали в 6-луночные планшеты для тканевого культивирования и через 1 ч добавляли соединения в различных концентрациях и инкубировали в условиях 37°C/5% CO2 в течение 24 ч. Затем клетки собирали путем центрифугирования, промывали один раз холодным ФСБ, аспирировали супернатанты и лизировали клеточный осадок с помощью лизисного буфера RIPA, содержащего коктейль из ингибиторов протеаз/фосфатаз, при 4°C. Общую концентрацию белка клеточных лизатов определяли с помощью набора для анализа белка BCA. Образцы нормализовали относительно эквивалентных концентраций белка, добавляли 5X загрузочного буфера, нагревали до 100°C в течение 10 мин и охлаждали до комнатной температуры. 20 μл каждого образца на лунку загружали в гель ДСН-ПААГ и проводили электрофорез в течение 20 мин при 80 В, потом при 120 В в течение 1,5 ч. Затем проводили электроблоттинг гелей на нитроцеллюлозные мембраны с использованием метода влажного переноса при 250 мА в течение 2,5 ч. Мембраны инкубировали с блокирующим буфером в течение 1 ч и 3 раза промывали ТБСТ в течение 5 мин. Затем мембраны инкубировали с антителами к BRD4 (Cell Signaling Technology, № 13440) и бета-актину (Cell Signaling Technology, № 3700), разведенными в блокирующем буфере согласно рекомендациям производителя, при 4°C в течение ночи. После 3 раз промывки блоты инкубировали с соответствующим меченным вторичным антителом в течение 1 ч при комнатной температуре и снова промывали. Изображения считывали на LI-COR, а значения оптической плотности полос определяли с помощью программного обеспечения ImageJ. Данные анализировали, используя GraphPad Prism 7.0.
Аналогичные эксперименты по вестерн-блоттингу проводили для BRD2 и BRD3 в клетках MV4-11 с использованием анти-BRD2 (Cell Signaling Technology, № 139690) и анти-BRD3 (Cell Signaling Technology, № 50818).
ГФВР-анализ MYC
Экспрессию белка MYC набор для анализа клеток c-Myc человека (Cisbio, № 63ADK053PEG), анализ гомогенной флуоресценции с временным разрешением (ГФВР). Клетки MV4-11 высевали в 96-луночный планшет для тканевого культивирования при плотности 100000 клеток/90 мкл/лунка и инкубировали в условиях 37°C/5% CO2 в течение 1 ч, а затем обрабатывали соединениями в различных концентрациях (10-точечные 3-кратные серийные разведения, начиная с 10 мкМ) и инкубировали в условиях 37°C/5% CO2 в течение 24 ч. Клетки собирали путем центрифугирования, супернатант удаляли путем аспирации, добавляли 10 мкл лизисного буфера и инкубировали в течение 45 мин при комнатной температуре со встряхиванием. В 384-луночном планшете смешивали 10 мкл клеточного лизата/лунка с 10 мкл предварительно смешанного раствора антител, содержащего меченные криптатом антитела против человеческого MYC-Eu3+, приготовленные в буфере для обнаружения, и инкубировали в течение ночи при комнатной температуре, после чего измеряли сигнал. Рассчитывали отношения сигналов испускания акцептора и донора для каждой отдельной лунки (отношение = 665 нм/620 нм x 104). Эффективность ингибирования каждого соединения определяли по следующему уравнению и анализировали, используя GraphPad Prism 7.0:
% ингибирования = 100-(D-B)/(S-B)*100%.
S: Отношение при максимуме (положительны контроль)
D: Отношение при наличии разных разведения соединения с клетками
B: Отношение при минимуме (пустой контроль)
Анализ клеточной токсичности
Клетки MV4-11 высевали в 96-луночные планшеты для тканевого культивирования при плотности 4500 клеток/90 мкл/лунка и инкубировали в условиях 37°C/5% CO2 в течение 24 ч. Затем клетки обрабатывали соединениями в различных концентрациях (10-точечные 3-кратные серийные разведения, начиная с 20 мкМ) с конечной концентрацией 0,5% ДМСО/лунка и инкубировали в условиях 37°C/5% CO2 в течение 72 ч. В каждую лунку добавляли по 10 мкл реагента для клеточной пролиферации CCK-8 (WST-8), инкубировали в условиях 37°C/5% CO2 в течение 3-4 ч и измеряли поглощение на 450 нм на планшет-ридере EnVision. Эффективность ингибирования соединения определяли по следующему уравнению и анализировали, используя GraphPad Prism 7.0:
% ингибирования = 100-(D-B)/(S-B)*100%.
S: Поглощение при максимуме (клетки с ДМСО)
D: Поглощение при наличии разных разведения соединения с клетками
B: Поглощение при минимуме (среда с ДМСО)
Исследования на мышах с ксенотрансплантатом опухоли
Клетки острого миелоидного лейкоза MV4-11 и диффузной В-крупноклеточной лимфомы SU-DHL-4 (ATCC, № CRL-2957) культивировали в среде, дополненной 10% фетальной бычьей сывороткой в условиях 37°C/5% CO2. 5 x 106 клеток MV-4-11 или 1 x 107 клеток SU-DHL-4 собирали и ресуспендировали в 0,1 мл бессывороточной среды с матригелем (1:1 об./об.) на мышь для подкожной инокуляции анестезированных изофлураном самцов бестимусных мышей BALB/c или мышей C.B-17 scid, соответственно (которых содержали в соответствии с руководством по уходу за животными AAALAC). После того, как средний объем опухолей достигал 100-200 мм3, убирали выбросы по объему опухолей, а оставшихся животных случайным образом делили на группы по 6-8 со сходными средними объемами опухолей в каждой группе. Растворы соединения 074 и соединения 078 готовили в 45% ПЭГ300 и 55% и нормальном солевом растворе и доводили до pH 3,0-7,0 с помощью 0,15 М раствора бикарбоната натрия. Животным вводили внутривенную дозу при 25 мг/кг, 50 мг/кг или 100 мг/кг 1X/неделя в течение 3 или 4 недель. Внешний вид и поведение каждой мыши оценивали и записывали ежедневно. Массу тела и объем опухолей измеряли и записывали каждые 2-4 дня, а результаты выражали в виде среднего по группе ± СПС. Проводили попарные статистические сравнения между группами с помощью однофакторного ANOVA, а статистически значимым считали p < 0,05.
Фармакокинетика и тканевое распределение
Раствор соединения 074 готовили в 30% ПЭГ300 и 70% и нормальном солевом растворе и доводили до pH 3,0-7,0 с помощью 0,15 М раствора бикарбоната натрия. Взвешивали 15 самок мышей CB-17 SCID (которых содержали в соответствии с руководством по уходу за животными AAALAC) и вводили им 5 мг/кг соединения 074 путем одной внутривенной инъекции. У каждой мыши брали по 0,10 мл крови из поднижнечелюстной вены и добавляли гепарин натрия в качестве антикоагулянта. Образцы получали до введения соединения, через 1 ч, 6 ч, 24 ч и 48 ч после введения, при этом в один момент времени образца получали от 3 мышей. После получения образцы помещали на лед, а животных умерщвляли для получения опухолевых и нормальных тканей. Разработка метода и анализ всех образцов были проведены аналитической лабораторией в Shanghai Medicilon Inc. Для контроля качества проводили внутрисуточную оценку точности образцов во время анализа образцов, при этом была необходима точность контроля качества более 66,7% образцов, составляющая 80-120%. Фармакокинетические параметры рассчитывали, используя программное обеспечение Phoenix WinNonlin7.0.
Результаты
Для конструирования различных молекул T-PEACH был разработан ряд схем синтеза. Репрезентативный пример приведен ниже между связывающим HSP90 фрагментом и связывающим BET фрагментом (+)-JQ1. Аналогичная химия применима к другим молекулам T-PEACH без ограничения связывающими HSP90 фрагментами и (+)-JQ1.
Анализ связывания HSP90α методом флуоресцентной поляризации (ФП), в котором измеряли конкуренцию с ФИТЦ-гелданамицином, использовали, чтобы оценить способность молекул T-PEACH связываться с HSP90. Как показано в таблице 1, молекулы T-PEACH, содержащие HSP90-связывающие фрагменты, известные из литературы, в целом соответствовали опубликованным данным по взаимосвязи активности и структуры (ВАС).
Включение связывающего BET фрагмента (+)-JQ1 со сходной молекулярной массой со связывающим HSP90 фрагментом в T-PEACH оказывало минимальное влияние на связывание молекул T-PEACH с HSP90α в этом анализе. На это существует ряд причин: во-первых, сокристаллические структуры этих фрагментов с их соответствующими белками доступны и делают возможным точный молекулярный дизайн на основе структуры; и, во-вторых, связку конструируют так, чтобы обеспечить жесткость с подходящей длиной.
Таблица 1: ФП-анализ связывания HSP90α
*A. IC50 < 100 нМ; B. IC50= 100-1000 нМ; C. IC50 > 1000 нМ
Существует более 40 белков человека, которые содержат один или более мотивов бромодоменов, причем каждый член семейства BET содержит два отдельных бромодомена, называемых BD1 и BD2, которые могут независимо связываться с ацетилированными лизинами. Чтобы оценить способность соединения 074 связываться с рядом рекомбинантных белков бромодоменов, использовали сайт-направленный конкурентный анализ связывания лигандов. Как показано в таблице 2, 10 μМ соединения 074 были способны эффективно конкурировать за связывание лиганда с обоими бромодоменами, присутствующими в каждом из белков BRD2, BRD3, BRD4 и BRD4. Однако соединение 074 практически не связывалось с рядом других белков бромодоменов.
Таблица 2: Анализ связывания бромодомена с 10 μМ соединения 074
*A. < 10%; B. 11-75%; C. > 75%
Также оценивали ингибирование связывания белка BRD4 (BD1 + BD2) с его субстратом рядом молекул T-PEACH, используя анализ ГФВР, как показано в таблице 3. Молекулы T-PEACH, содержащие BRD4-связывающий фрагмент, известный из литературы, в целом соответствуют опубликованному анализу ВСА. Эти BRD4-связывающие фрагменты включают каркасы на основе (+)-JQ1, в особенности соединения, имеющие структуры, сходные с OTX-15 и (+)-JQ1.
Включение шаперон-связывающего фрагмента, такого как связывающий HSP90 фрагмент, оказывало минимальное влияние на связывание молекул T-PEACH с BRD4 в этом анализе. На это существует ряд причин: во-первых, сокристаллические структуры этих фрагментов с их соответствующими белками доступны и делают возможным точный молекулярный дизайн на основе структуры; и, во-вторых, связку конструируют так, чтобы обеспечить жесткость с подходящей длиной.
Таблица 3: ГФВР-анализ связывания BRD4 (BD1+BD2)
*A. IC50 < 100 нМ; B. IC50= 100-1000 нМ; C. IC50 > 1000 нМ
Химерные молекулы T-PEACH разработаны для индукции направленной деградации белка. Как показано в таблице 4, для клеток MV4-11, обработанных молекулами T-PEACH, в которых BET-связывающий фрагмент и HSP90-связывающий фрагмент ковалентно связаны, 50% или более клеточного белка BRD4 было разрушено в течение 24 ч согласно измерениям в проточном цитометрическом анализе. В противоположность этому, не наблюдалось существенной деградации BRD4, когда клетки MV4-11 обрабатывали ингибитором BET (+)-JQ1 или HSP90-связывающим соединением (1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4H-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-оном). Соединение 005 представляет собой контрольную молекулу T-PEACH, содержащую не связывающий BET фрагмент (-)-JQ1, и не разрушает BRD4. Кроме того, когда клетки предварительно обрабатывали комбинацией связывающего HSP90 фрагмента и (+)-JQ1, способность соединения 40 разрушать BRD4 была существенно снижена. Это демонстрирует необходимость того, чтобы оба связывающих фрагмента были ковалентно связаны в конструкции T-PEACH.
Таблица 4: Анализ деградации BRD4 методом проточной цитометрии
*A. Деградация > 50%; B. 10% < Деградация = 10-50%; C. Деградация < 10%
#Наибольший процент деградации наблюдали при концентрациях 40-1000 нМ
&Клетки предварительно обрабатывали комбинацией HSP90-связывающего фрагмента и (+)-JQ1 в течение 30 минут перед добавлением соединения 40
Чтобы дополнительно оценить деградацию BRD4, клетки MV4-11 обрабатывали в течение 24 ч различными концентрациями соединений T-PEACH и оценивали экспрессию BRD4 с помощью вестерн-блоттинга. Как показано на Фиг. 1, деградацию BRD4 наблюдали при концентрациях соединения 074 100 и 300 нМ. Важно отметить, что когда клетки MV-411 обрабатывали как соединением 074, так и ингибитором протеасом бортезомибом, деградация BRD4 блокировалась (Фиг. 2). Это демонстрирует, что молекулы T-PEACH индуцируют направленную деградацию белка посредством UPS.
Хотя (+)-JQ1 связывает все белки семейства BET, возможно, что молекула T-PEACH, содержащая фрагмент (+)-JQ1, может проявлять большую селективность в деградации белков из-за отталкивания зарядов и/или пространственного столкновения между отдельными мишенями-членами семейства BET и шапероном или шаперонным комплексом. Чтобы проверить это, клетки MV4-11 обрабатывали PROTAC dBET1 на основе (+)-JQ1 (Winter et al, Science, 2015, 348:1376-1381) и соединением 047 в течение 24 ч и оценивали экспрессию BRD2, BRD3 и BRD4 с помощью проточной цитометрии. Как показано в таблице 5, dBET1 индуцировал деградацию BRD2, BRD3 и BRD4 со сходной активностью. В отличие от этого, одно соединение 047 индуцировало существенную деградацию BRD4. Это указывает на то, что случайные связывающие мишень фрагменты можно преобразовать в селективные разрушители с использованием технологии T-PEACH.
Таблица 5: Анализ деградации белков семейства BET методом проточной цитометрии
Известно, что BRD4 регулирует экспрессию гена MYC. Как показано в таблице 6, было обнаружено, что выбранные молекулы T-PEACH снижают экспрессию белка MYC в клетках MV4-11 после 24-часовой обработки по оценке в анализе ГФВР.
Таблица 6: ГФВР-анализ экспрессии белка MYC
*A. IC50 < 100 нМ; B. IC50= 100-1000 нМ; C. IC50 > 1000 нМ
Молекулы T-PEACH могут содержать шапероны и шаперонные комплексы, которые характеризуются некоторым диапазоном аффинности связывания. В разных вариантах осуществления необходимо использовать связывающий фрагмент с высокой аффинностью, связывающий фрагмент со средней аффинностью или связывающий фрагмент с низкой аффинностью. Поскольку связывающий HSP90 фрагмент, который взаимодействует с N-концевым АТФ-связывающим карманом HSP90, может ингибировать активность HSP90 и индуцировать деградацию клиентских белков HSP90, некоторые молекулы T-PEACH будут не только индуцировать деградацию необходимого целевого белка или белков (которые могут быть или не быть клиентскими белками HSP90), но также одновременно индуцировать деградацию клиентских белков HSP90. Эта комбинация активности деградации может повышать активность молекул T-PEACH по сравнению с другими технологиями направленной деградации белков, нацеленными на ту же мишень(и). Как показано в таблице 1, соединение 074 обладает умеренной эффективностью связывания с HSP90. Чтобы оценить селективность соединения 074 в отношении BRD4 (который не является чувствительным клиентским белком HSP90) по сравнению с известными чувствительными клиентскими белками HSP90, проводили анализ методом проточной цитометрии с различными линиями клеток, экспрессирующими клиентские белки HSP90: ERBB2 в клетках карциномы молочной железы HER2) и IGF1R, EGFR и RAF1 в клетках эмбриональной почки HEK-293. Как показано в таблице 7, соединение 074 демонстрировало значения IC50 339-1055 нМ в отношении деградации этих клиентов HSP90, что было в 6-18 раз выше, чем значение IC50 59 нМ в отношении деградации BRD4, определенное методом вестерн-блоттинга в клетках MV4-11. Это указывает на то, что молекула T-PEACH с HSP90-связывающим фрагментом со средней аффинностью проявляет селективность в отношении предполагаемой мишени деградации BRD4 по сравнению с другими известными клиентскими белками HSP90.
Таблица 7: Анализ деградации клиентских белков HSP90 соединением 074 методом проточной цитометрии
*Клетки BT-474; **клетки HEK-293
Как показано в таблице 8, обработка различными молекулами T-PEACH сильно ингибировала рост и выживаемость клеток MV4-11 в анализе цитотоксичности.
Таблица 8: Анализ цитотоксичности MV4-11
*A. IC50 < 100 нМ; B. IC50= 100-1000 нМ; C. IC50 > 1000 нМ
Соединения 074 и 078 были выбраны для исследования эффективности in vivo в моделях с опухолевыми ксенотрансплантатами у мышей. В модели с ксенотрансплантом MV4-11 25 мг/кг, 50 мг/кг и 100 мг/кг соединения 074 вводили внутривенно 1X/неделя. Как показано на Фиг. 3а, через 3 недели после введения дозы группа с 100 мг/кг демонстрировала существенное ингибирование роста опухолей, при этом 4 из 6 животных не имели опухоли в конце исследования. Группа с 50 мг/кг также демонстрировала существенное ингибирование роста опухолей, при этом 1 из 6 животных не имело опухоль в конце исследования. Для сравнения, внутрибрюшинное введение 25 мг/кг 1X/сутки ингибитора BET (+)-JQ1 давало умеренное ингибирование роста опухолей. Ни в одной группе не наблюдали гибели животных или существенного влияния на массу тела (Фиг. 3b).
В модели с ксенотрансплантом SU-DHL-4 50 мг/кг и 100 мг/кг соединений 074 и 078 вводили внутривенно 1X/неделя. Как показано на Фиг. 4а, через 4 недели после введения дозы группы с 100 мг/кг в случае обоих соединений демонстрировали существенное ингибирование роста опухолей со значениями опухоль vs контроль (Т/С) 41% и 28% для соединений 074 и 078, соответственно. Для сравнения, пероральное введение 100 мг/кг 1X/сутки находящегося на клинической стадии ингибитора BET OTX-015 (Boi, Clin Cancer Res, 2015, 21:1628-38) демонстрировало значение T/C 45%. Гибели животных или существенного влияния на массу тела не наблюдали при любом уровне дозы (Фиг. 4b).
Чтобы исследовать опухоль-селективное удержание молекул T-PEACH, проводили исследование фармакокинетики и тканевого распределения в модели с ксенотрансплантатом опухоли MV4-11 у мышей. 5 мг/кг соединения 074 вводили путем однократной внутривенной дозы, а животных умерщвляли в разные моменты времени в течение 48 часов, чтобы оценить фармакокинетику соединения в плазме, сердце, печени, легких и опухолевых тканях. Как показано в таблице 9, хотя начальные концентрации соединения 074 в сердце, печени и легких были выше по сравнению с наблюдаемыми в опухолях, время его полужизни в опухолях, составляющее 32,10 ч, было в 4,6-9,5 раза большим, чем в плазме и других органах, что демонстрирует опухоль-селективное удержание этой молекулы T-PEACH.
Таблица 9: Фармакокинетика и распределение соединения 074 в
модели с ксенотрансплантатом MV4-11 у мышей
Для специалистов в данной области техники будет очевидно существование модификаций и вариаций описанных способов и композиций по настоящему изобретению без отступления от объема и сущности изобретения. Хотя изобретение было описано в связи с конкретными вариантами осуществления, следует понимать, что заявленное изобретение не должно быть излишне ограничено такими конкретными вариантами осуществления. Действительно, предусмотрены различные модификации описанных вариантов осуществления изобретения, которые понятны специалистам в соответствующей области, к которой относится данное изобретение, как находящиеся в пределах объема изобретения, представленного нижеприведенной формулой изобретения.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Все упоминаемые в данном документе патенты и публикации включены в данный документ посредством ссылки в той же степени, как если бы каждый независимый патент и каждая независимая публикация были специально и отдельно указаны как включенные посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛО[1,4]ДИАЗЕПИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1989 |
|
RU2117670C1 |
| СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2809763C2 |
| СОЕДИНЕНИЕ СУЛЬФОНАМИДА ИЛИ СУЛЬФИНАМИДА, ОБЛАДАЮЩЕЕ ЭФФЕКТОМ ИНДУЦИРОВАНИЯ ДЕГРАДАЦИИ БЕЛКА BRD4, И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2830112C1 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| БЕНЗОКСАЗЕПИНОВЫЕ ИНГИБИТОРЫ PI3K И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2600927C2 |
| БЕНЗОКСАЗЕПИНОВЫЕ ИНГИБИТОРЫ PI3 И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2654068C1 |
| ИНГИБИТОРЫ МУТАЦИИ HER2 | 2022 |
|
RU2834124C2 |
| ИНГИБИТОРЫ КИНАЗЫ | 2013 |
|
RU2637944C2 |
| МОДУЛЯТОРЫ МОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ | 2019 |
|
RU2797323C2 |
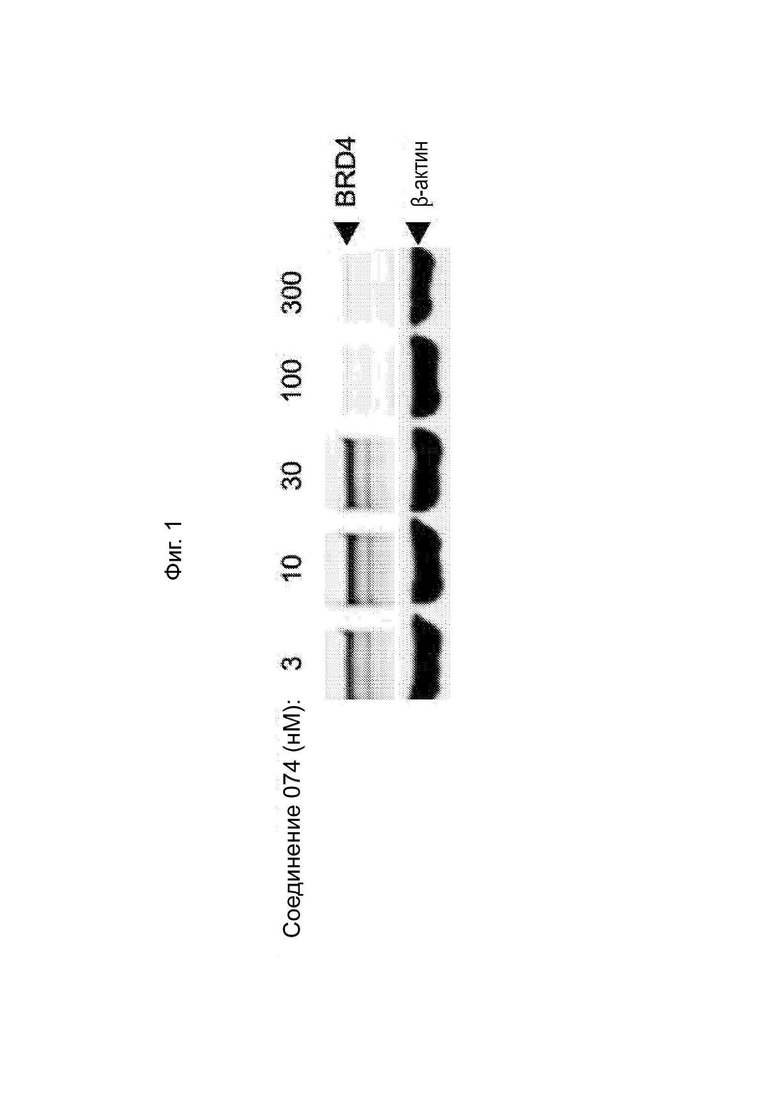
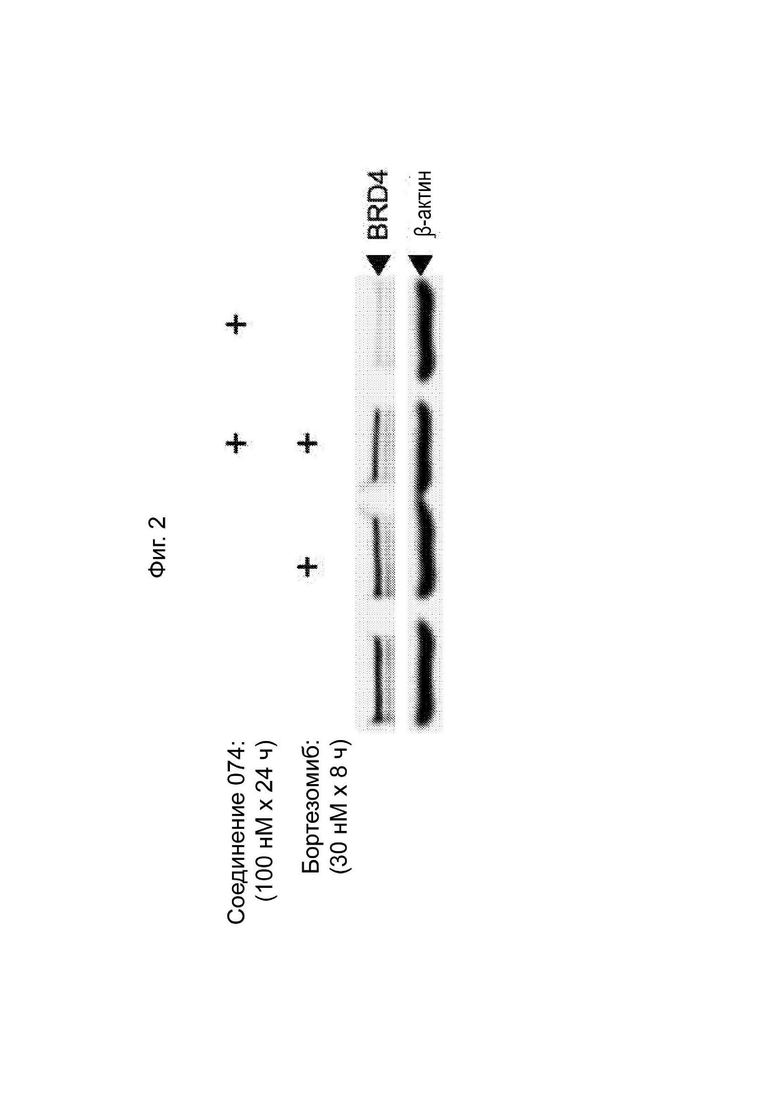
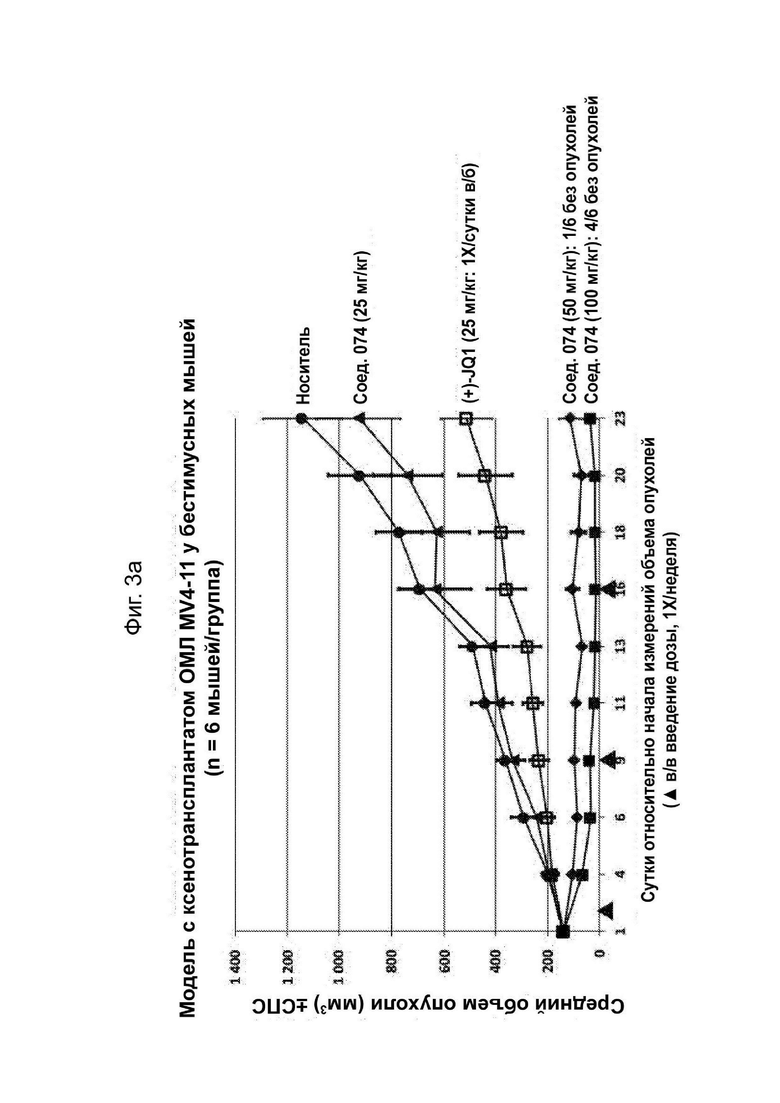
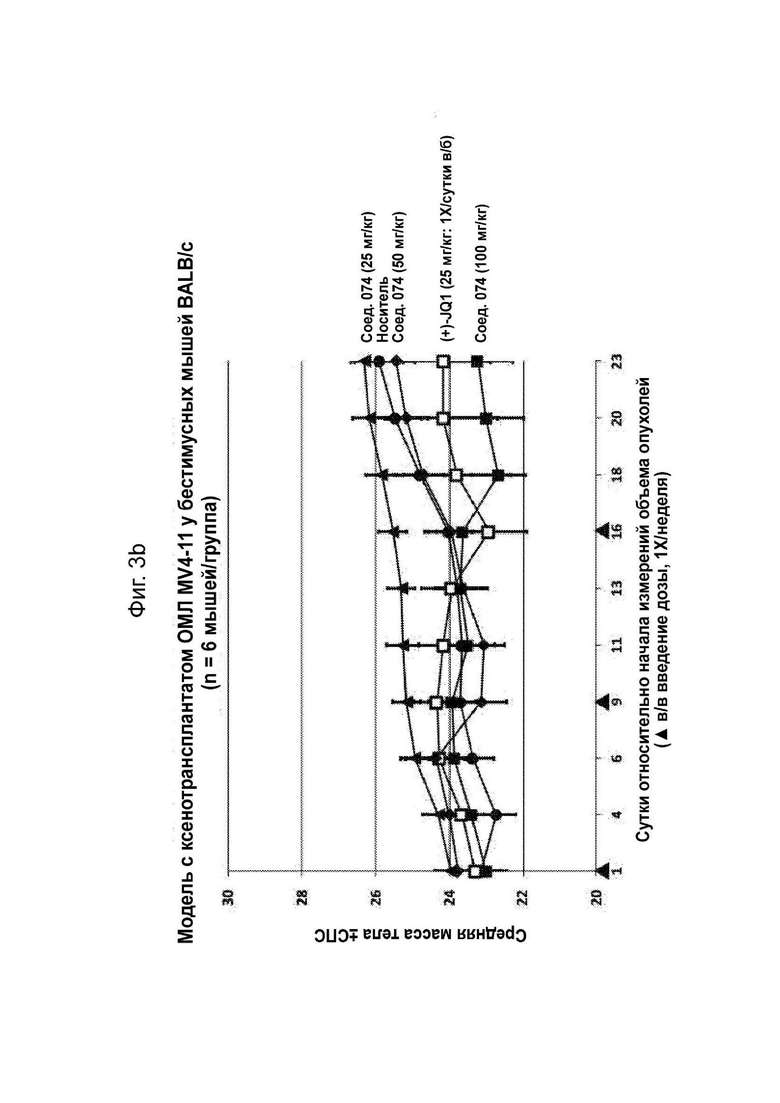
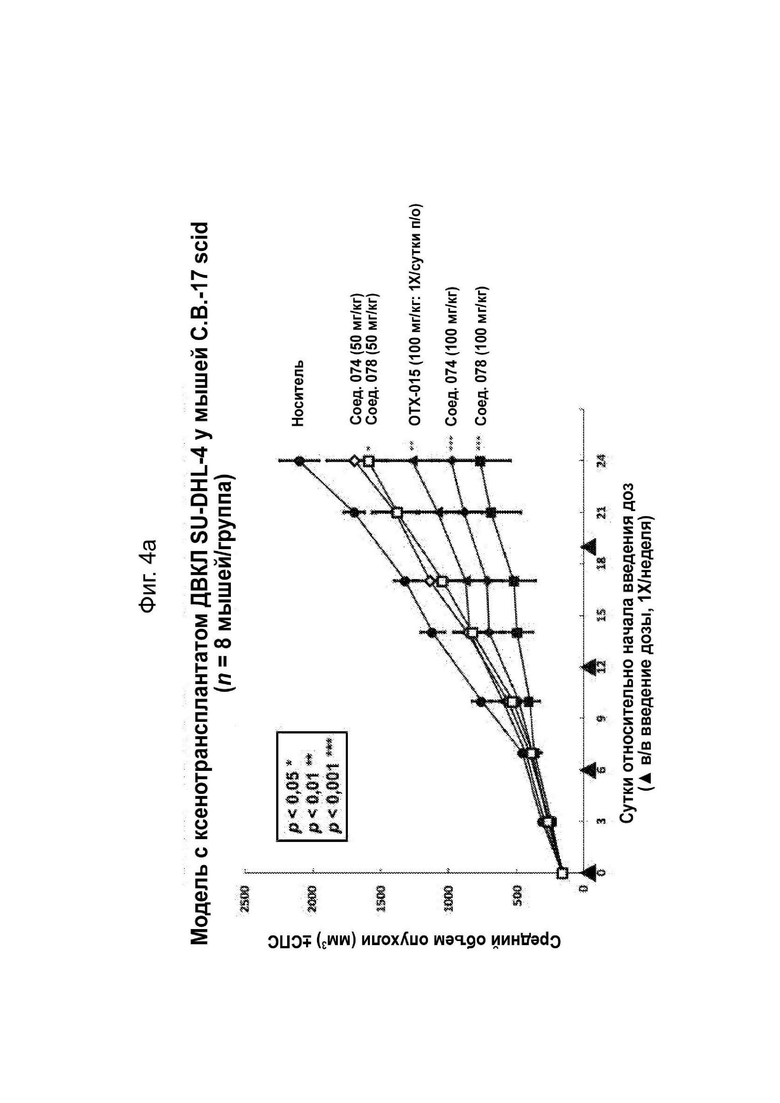
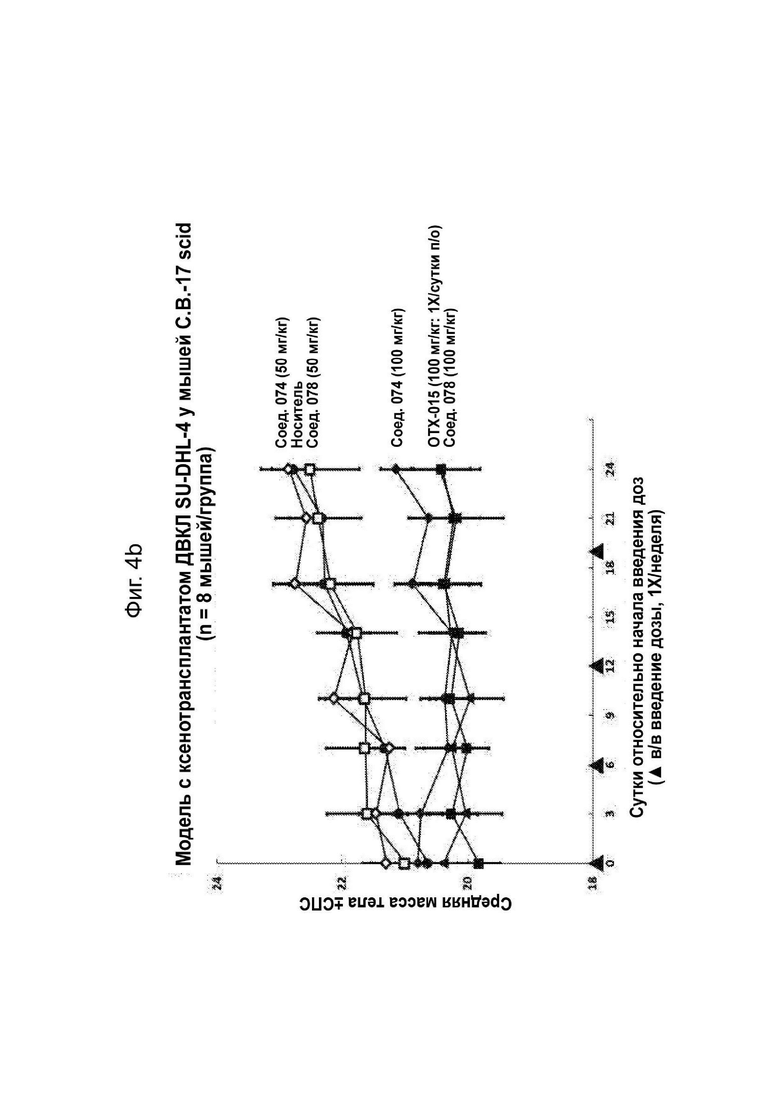
Изобретение относится к области органической и медицинской химии, а именно к соединению формулы I или его фармацевтически приемлемой соли, где X представляет собой C(O) или (C1-C4)алкилен; A представляет собой 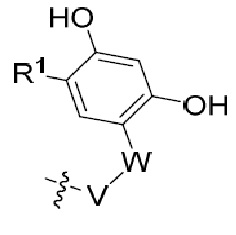 ; W представляет собой 5- или 6-членный гетероарил, содержащий 2 или 3 гетероатома кольца, выбранных из азота и кислорода, необязательно замещенный 1-3 группами, выбранными из R2; V представляет собой фенил, необязательно замещенный 1-3 группами, выбранными из R3; R1 представляет собой (C1-C4)алкил или галоген(C1-C4)алкил; R2 представляет собой -ORa, -SRa, -C(O)NRaRb, или -C(O)NRa(C1-4алкилен)NRaRb; каждый из Ra и Rb независимо выбран из водорода и (C1-C4)алкила, где указанный (C1-C4)алкил необязательно замещен одним или более галогеном или 3-7-членным гетероциклилом, содержащим 1 гетероатом кольца, выбранный из азота; R3 представляет собой галоген; и L представляет собой линкер, как указано в формуле изобретения. Кроме того, изобретение относится к группе индивидуальных соединений, а также к фармацевтической композиции для деградации белка BRD4 и к применению соединения формулы I для лечения рака, восприимчивого к деградации BRD4. Технический результат изобретения заключается в создании химер для направленной на опухоль деградации белка (T-PEACH), содержащих первый фрагмент, который способен связываться с целевым белком (например, BRD4) или белками, и второй фрагмент, который способен связывать белок-шаперон или белковый компонент шаперонного комплекса. 6 н. и 15 з.п. ф-лы, 6 ил., 9 табл., 5 пр.
; W представляет собой 5- или 6-членный гетероарил, содержащий 2 или 3 гетероатома кольца, выбранных из азота и кислорода, необязательно замещенный 1-3 группами, выбранными из R2; V представляет собой фенил, необязательно замещенный 1-3 группами, выбранными из R3; R1 представляет собой (C1-C4)алкил или галоген(C1-C4)алкил; R2 представляет собой -ORa, -SRa, -C(O)NRaRb, или -C(O)NRa(C1-4алкилен)NRaRb; каждый из Ra и Rb независимо выбран из водорода и (C1-C4)алкила, где указанный (C1-C4)алкил необязательно замещен одним или более галогеном или 3-7-членным гетероциклилом, содержащим 1 гетероатом кольца, выбранный из азота; R3 представляет собой галоген; и L представляет собой линкер, как указано в формуле изобретения. Кроме того, изобретение относится к группе индивидуальных соединений, а также к фармацевтической композиции для деградации белка BRD4 и к применению соединения формулы I для лечения рака, восприимчивого к деградации BRD4. Технический результат изобретения заключается в создании химер для направленной на опухоль деградации белка (T-PEACH), содержащих первый фрагмент, который способен связываться с целевым белком (например, BRD4) или белками, и второй фрагмент, который способен связывать белок-шаперон или белковый компонент шаперонного комплекса. 6 н. и 15 з.п. ф-лы, 6 ил., 9 табл., 5 пр.
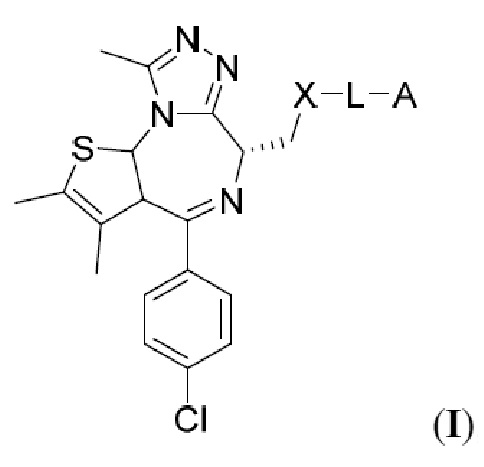
1. Соединение формулы I:
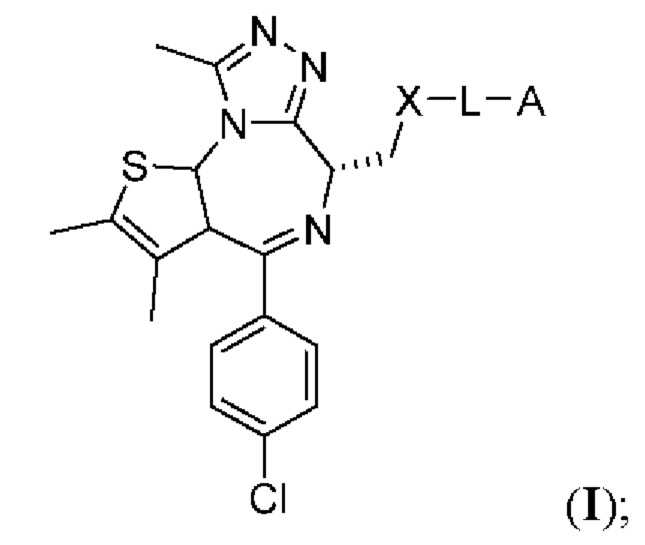
или его фармацевтически приемлемая соль, где
X представляет собой С(О) или (С1-С4)алкилен;
А представляет собой 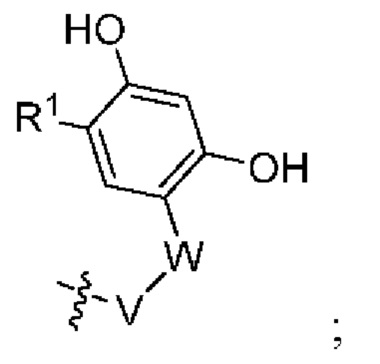 W представляет собой 5- или 6-членный гетероарил, содержащий 2 или 3 гетероатома кольца, выбранных из азота и кислорода, необязательно замещенный 1-3 группами, выбранными из R2;
W представляет собой 5- или 6-членный гетероарил, содержащий 2 или 3 гетероатома кольца, выбранных из азота и кислорода, необязательно замещенный 1-3 группами, выбранными из R2;
V представляет собой фенил, необязательно замещенный 1-3 группами, выбранными из R3;
R1 представляет собой (С1-С4)алкил или галоген(С1-С4)алкил;
R2 представляет собой -ORa, -SRa, -C(O)NRaRb, или -C(O)NRa(C1-4алкилен)NRaRb;
каждый из Ra и Rb независимо выбран из водорода и (С1-С4)алкила, где указанный (С1-С4)алкил необязательно замещен одним или более галогеном или 3-7-членным гетероциклилом, содержащим 1 гетероатом кольца, выбранный из азота;
R3 представляет собой галоген; и
L представляет собой 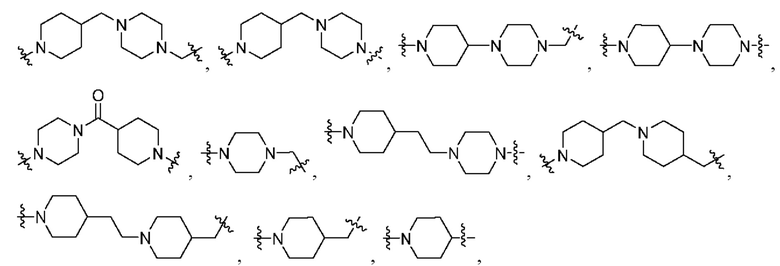
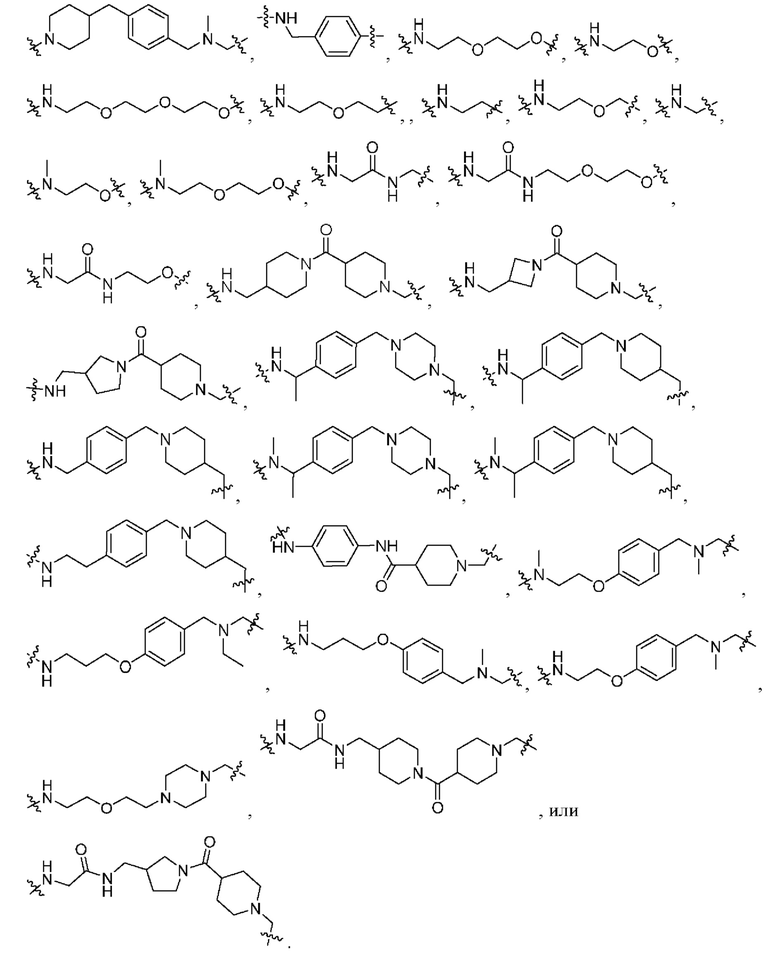
2. Соединение по п. 1 или его фармацевтически приемлемая соль, где А представляет собой
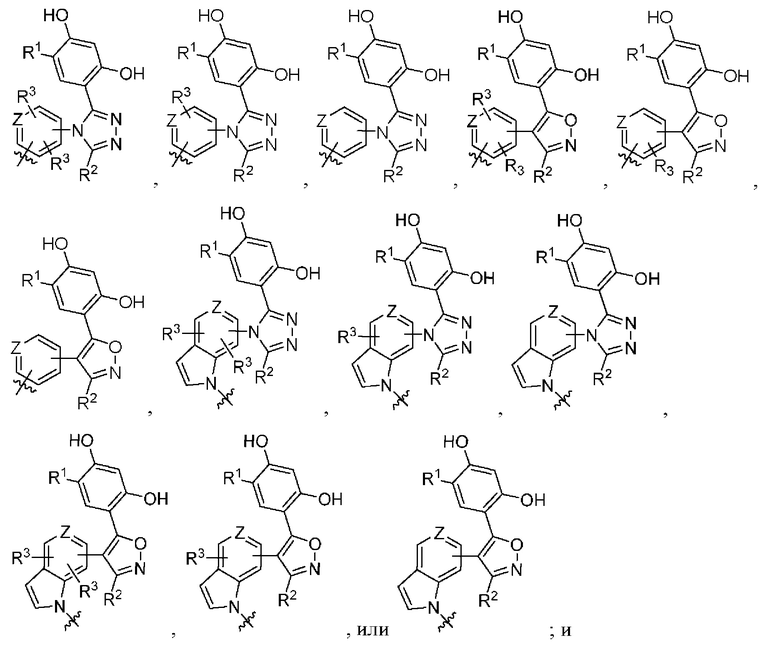
Z представляет собой N или СН.
3. Соединение по п. 2 или его фармацевтически приемлемая соль, где Z представляет собой СН.
4. Соединение по любому из пп. 1-3 или его фармацевтически приемлемая соль, где А представляет собой
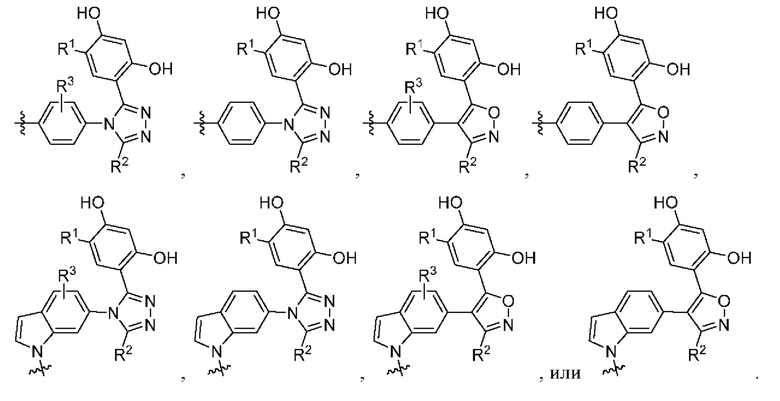
5. Соединение по любому из пп. 1-4 или его фармацевтически приемлемая соль, где А представляет собой
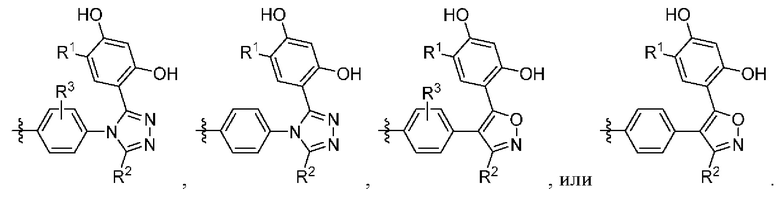
6. Соединение по любому из пп. 1-5 или его фармацевтически приемлемая соль, где А представляет собой
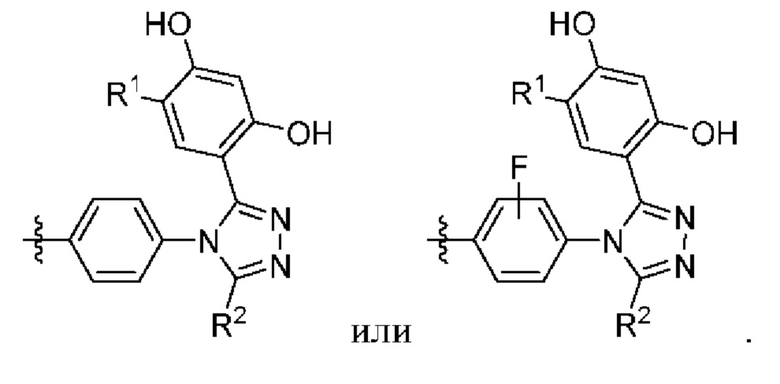
7. Соединение по любому из пп. 1-6, отличающееся тем, что соединение представляет собой соединение формулы II:
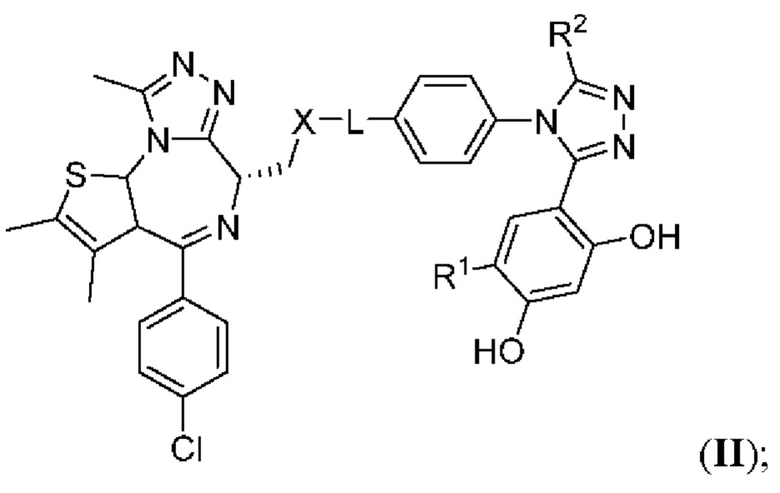
или его фармацевтически приемлемую соль.
8. Соединение по любому из пп. 1-7 или его фармацевтически приемлемая соль, где R1 представляет собой (С1-С4)алкил.
9. Соединение по любому из пп. 1-8 или его фармацевтически приемлемая соль, где R1 представляет собой изопропил, метил, пропил или этил.
10. Соединение по любому из пп. 1-9 или его фармацевтически приемлемая соль, где R1 представляет собой изопропил или этил.
11. Соединение по любому из пп. 1-10 или его фармацевтически приемлемая соль, где R2 представляет собой ОН, SH, -C(O)NHCH2CF3, -C(O)NHCH2CH3, -C(O)NH(CH2)2N(CH2CH3)2, -C(O)NHCH(CH3)2, C(O)NH2, -С(O)NН(СН2)2пиперидинил.
12. Соединение по любому из пп. 1-11 или его фармацевтически приемлемая соль, где R2 представляет собой -C(O)NHCH2CF3 или ОН.
13. Соединение по любому из пп. 1-12 или его фармацевтически приемлемая соль, отличающиеся тем, что соединение представляет собой соединение формулы III:
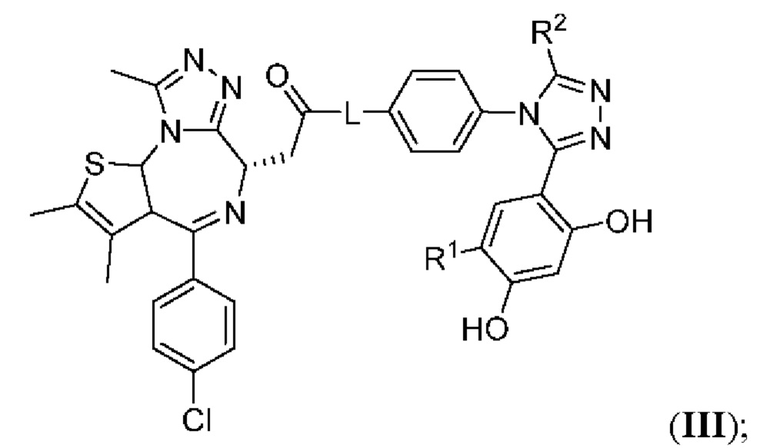
или его фармацевтически приемлемую соль.
14. Соединение по п. 1, отличающееся тем, что соединение представляет собой соединение формулы IV:
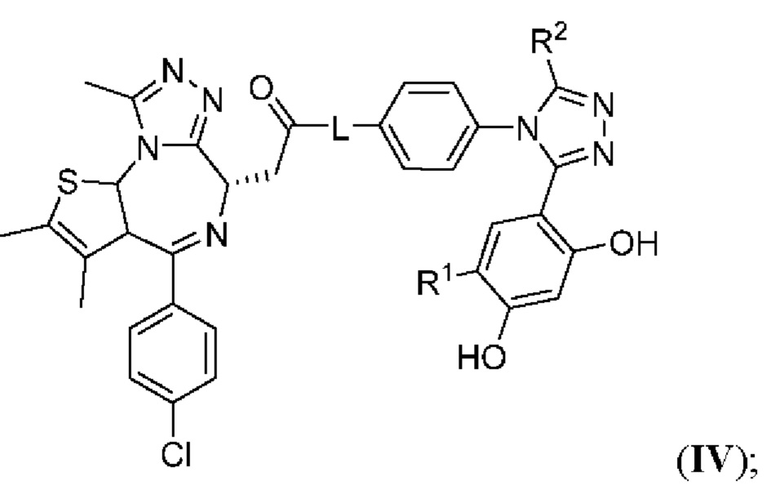
или их фармацевтически приемлемая соль, где R1 представляет собой (С1-С4)алкил; R2 представляет собой -C(O)NRaRb или ОН; Ra представляет собой водород или (С1-С2)алкил; и
Rb представляет собой (С1-С4)алкил, необязательно замещенный 1-3 галогенами.
15. Соединение по п. 14 или его фармацевтически приемлемая соль, где Ra представляет собой водород.
16. Соединение по п. 14 или 15 или его фармацевтически приемлемая соль, где Rb представляет собой (С1-С4)алкил, замещенный 1-3 галогенами.
17. Соединение, выбранное из:
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6H-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон;
4-(4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)этил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-гидрокси-4Н-1,2,4-триазол-3-ил)-6-этилбензол-1,3-диол;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)этанон;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидроксифенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин- 1-ил)метил)пиперидин-1-ил)этанон;
2-((6R)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((R)-1-(4-((1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метил)фенил)этил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-метилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1 -ил)метил)пиперидин-1-ил)этан-1-он;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-пропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1 -ил)метил)пиперидин-1 -ил)этан-1-он;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон;
4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-метилфенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5- изопропилфенил)-N-этилизоксазол-3-карбоксамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)-2-фторбензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-он;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)-3-фторбензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-он;
2-((6R)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин- 1-ил)метил)пиперидин-1-ил)этанон;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4Н-1,2,4-триазол-4-ил)бензил)ацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)фенил)пиперидин-4-карбонил)пиперазин-1-ил)этан-1-он;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4Н-1,2,4-триазол-4-ил)фенокси)этил)ацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-(2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4Н-1,2,4-триазол-4-ил)фенокси)этокси)этил)ацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)--(2-(2-(2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4Н-1,2,4-триазол-4-ил)фенокси)этокси)этокси)этил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-(2-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)этокси)этил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)этанон;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)фенэтил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)фенил)пиперазин-1-ил)метил)пиперидин-1-ил)этанон;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)пиперидин-1 -ил)этан-1 -он;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)фенил)пиперазин- 1-ил)пиперидин-1-ил)этанон;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-(3-(((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)(метил)амино)метил)фенокси)этил)ацетамид;
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пирролидин-3-ил)метил)ацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-(((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пиперидин-4-ил)метил)амино)-2-оксоэтил)ацетамид;
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-(((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пирролидин-3-ил)метил)амино)-2-оксоэтил)ацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-((2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-меркапто-4Н-1,2,4-триазол-4-ил)фенокси)этил)амино)-2-оксоэтил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-(2-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)этокси)этил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)окси)этил)ацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пиперидин-4-ил)метил)ацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-((2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)фенокси)этил)амино)-2-оксоэтил)ацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-((2-(2-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)фенокси)этокси)этил)амино)-2-оксоэтил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)амино)-2-оксоэтил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-(2-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин- 1-ил)этил)пиперидин-1-ил)этанон;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)азетидин-3-ил)метил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-(((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)азетидин-3-ил)метил)амино)-2-оксоэтил)ацетамид;
4-(4-(4-((2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)этил)амино)фенил)-5-гидрокси-4Н-1,2,4-триазол-3-ил)-6-изопропилбензол- 1,3-диол;
(S)-4-(4-(4-(2-((2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-1][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)этил)амино)этокси)фенил)-5-гидрокси-4Н-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол;
(S)-4-(4-(4-(2-(2-((2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)этил)амино)этокси)этокси)фенил)-5-гидрокси-4Н-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол;
(4-(((2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)этил)амино)метил)пиперидин-1-ил)(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метанон;
(S)-4-(4-(4-(2-((2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)этил)(метил)амино)этокси)фенил)-5-гидрокси-4Н-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол;
(3-(((2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)этил)амино)метил)пирролидин-1-ил)(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метанон;
(3-(((2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)этил)амино)метил)пирролидин-1-ил)(1-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метанон;
(4-(((2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а] [1,4] диазепин-6-ил)этил)амино)метил)пиперидин-1-ил)(1-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-ил)метанон;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((R)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)фенил)этил)ацетамид;
(S)-4-(4-(4-(2-(2-((2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)этил)(метил)амино)этокси)этокси)фенил)-5-гидрокси-4Н-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол;
N-(4-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетамидо)фенил)-1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбоксамид;
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((1-(1-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пирролидин-3-ил)метил)ацетамид;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1 -ил)метил)пиперидин-1-ил)этенон;
4-(4-(4-((4-((1-(2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)этил)пиперидин-4-ил)метил)пиперидин-1-ил)метил)фенил)-5-гидрокси-4Н-1,2,4-триазол-3-ил)-6-изопропилбензол-1,3-диол;
2-((6S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((1-(1-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-4-карбонил)пирролидин-3-ил)метил)ацетамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)фенил)пиперазин- 1-ил)этан-1-он;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-(2-(4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)этил)пиперидин-1-ил)этан-1-он;
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((R)-1-(3-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)фенил)этил)ацетамид;
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((R)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)фенил)этил)ацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-(4-(((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)(метил)амино)метил)бензил)пиперидин-1-ил)этан-1-он;
(S)-4-(4-(((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)бензил)(метил)амино)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((1-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперидин-4-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((1-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперидин-4-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((1-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперидин-4-ил)метил)фенил)-N-этил-5-(5-этил-2,4-дигидроксифенил)-1Н-1,2,414-триазол-3-карбоксамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(5-этил-2,4-дигидроксифенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)пиперидин-1-ил)этан-1-он;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)бензил)ацетамид;
(S)-4-(4-((1-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперидин-4-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-этил-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((1-(4-((2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетамидо)метил)бензил)пиперидин-4-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
2-((S-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((R)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)фенил)этил)-N-метилацетамид;
2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-((R)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)фенил)этил)-N-метилацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин- 1-ил)метил)пиперидин- 1-ил)этан-1-он;
(S)-4-(4-((1-(4-(2-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетамидо)этил)бензил)пиперидин-4-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((1-(4-((2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетамидо)метил)бензил)пиперидин-4-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
4-(4-((1-(3-((R)-1-(2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетамидо)этил)бензил)пиперидин-4-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперидин-1-ил)метил)фенэтил)ацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(2-(4-(((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)(метил)амино)метил)фенокси)этил)-N-метилацетамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-(3-(4-(((4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)(этил)амино)метил)фенокси)пропил)ацетамид;
(S)-4-(4-(((4-(2-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-N-метилацетамидо)этокси)бензил)(метил)амино)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-(((4-(3-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетамидо)пропокси)бензил)(этил)амино)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2,2,2-трифторэтил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-он ацетат;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-N-(2-(диэтиламино)этил)-5-(5-этил-2,4-дигидроксифенил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-изопропил-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-(2-(пиперидин-1-ил)этил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-изопропил-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидроксифенил)-N-(2-(пиперидин-1-ил)этил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-N-(2-(диэтиламино)этил)-5-(2,4-дигидроксифенил)-4Н-1,2,4-триазол-3-карбоксамид; (S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f[1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидроксифенил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-N-(2-(пиперидин-1-ил)этил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-N-(2-(диэтиламино)этил)-5-(2,4-дигидрокси-5-изопропилфенил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидроксифенил)-N-изопропил-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(5-этил-2,4-дигидроксифенил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-пропилфенил)-N-(2-(пиперидин-1-ил)этил)-4Н-1,2,4-триазол-3-карбоксамид;
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-метилфенил)-N-(2-(пиперидин-1-ил)этил)-4Н-1,2,4-триазол-3-карбоксамид;
(R)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1 -ил)этан-1-он; и
(S)-4-(4-((4-((1-(2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f],[1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)ацетил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)фенил)-5-(2,4-дигидрокси-5-изопропилфенил)-N-этилизоксазол-3-карбоксамид; или фармацевтически приемлемая соль любого из вышеуказанных.
18. Соединение, представляющее собой (S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-он, или его фармацевтически приемлемая соль.
19. Соединение, представляющее собой (S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-а][1,4]диазепин-6-ил)-1-(4-((4-(4-(3-(2,4-дигидрокси-5-изопропилфенил)-5-гидрокси-4Н-1,2,4-триазол-4-ил)бензил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-она гидрохлорид.
20. Фармацевтическая композиция для деградации белка BRD4, содержащая соединение по любому из пп. 1-19 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
21. Применение терапевтически эффективного количества соединения по любому из пп. 1-19 или его фармацевтически приемлемой соли для лечения рака, восприимчивого к деградации BRD4.
| CN 108084193 A, 29.05.2018 | |||
| CN 108129484 A, 08.06.2018 | |||
| WO 2014128070 A1, 28.08.2014 | |||
| WO 2012075456 A1, 07.06.2012 | |||
| WO 2014128111 A1, 28.08.2014 | |||
| Прибор для определения кривизны буровых скважин | 1930 |
|
SU22645A1 |
Авторы
Даты
2024-06-07—Публикация
2020-04-08—Подача