Область техники
[0001]
Перекрестная ссылка на родственные заявки
По этой заявке испрашивается приоритет заявки на патент Японии № 2019-035603, поданной 28 февраля 2019 и заявки на патент Японии № 2019-112619, поданной 18 июня 2019, полное содержание которых включено в настоящий документ в качестве ссылки. Настоящее описание относится к противоопухолевому агенту, усилителю противоопухолевого эффекта и набору препарата.
Уровень техники
[0002]
Факторы роста фибробластов (FGF) экспрессируются в различных тканях и являются одними из факторов роста, регулирующих пролиферацию и дифференциацию клеток. Физиологическая активность FGF опосредуется рецепторами фактора роста фибробластов (FGFR), которые являются специфическими рецепторами клеточной поверхности. FGFR принадлежат к семейству рецепторных протеинтирозинкиназ и включают внеклеточный лиганд-связывающий домен, единственный трансмембранный домен и внутриклеточный домен тирозинкиназы. До настоящего времени были идентифицированы четыре типа FGFR (FGFR1, FGFR2, FGFR3 и FGFR4). FGFR связываются с FGF с образованием димеров и активируются фосфорилированием. Активация рецепторов вызывает мобилизацию и активацию специфических молекул нисходящей трансдукции сигнала, тем самым развивая физиологические функции. Были сделаны некоторые сообщения о взаимосвязи между аберрантной передачей сигналов FGF/FGFR и различными опухолями человека. Считается, что аберрантная активация передачи сигналов FGF/FGFR в опухолях человека может быть связана со сверхэкспрессией FGFR и/или амплификацией гена, мутацией гена, хромосомной транслокацией, вставкой и инверсией, слиянием генов или аутокринным или паракринным механизмом за счет перепроизводства FGF (лиганды) (NPL 1, 2, 3 и 4).
[0003]
С другой стороны, развитие противораковой иммунотерапии развивается в качественно нового способа лечения рака.
[0004]
Активация адаптивного иммунного ответа инициируется связыванием комплексов антигенный пептид-MHC с Т-клеточными рецепторами (TCR). Это связывание дополнительно определяется костимуляцией или коингибированием за счет связывания между костимулирующей молекулой семейства B7 и ее семейством рецепторов CD28. То есть для того, чтобы Т-клетки специфически активировали антиген, необходимы два характеристических события передачи сигнала, и Т-клетки, которые получили только антигенную стимуляцию без костимуляции от семейства В7, входят в состояние анергии, и индуцируется иммунная толерантность.
[0005]
Воспользовавшись этим механизмом для подавления активации антигенспецифических Т-клеток, раковые клетки ускользают от системы иммунного надзора и продолжают расти. Следовательно, для лечения рака считается эффективным вызывать противоопухолевые иммунные ответы в организме больных раком через усиление костимуляции и блокирование коингибирования, а также для предотвращения ускользания опухоли от иммунной системы. Были сделаны различные предложения для противораковой иммунотерапии, направленной на костимулирующие молекулы (стимулирующие костимулирующие молекулы) или коингибирующие молекулы (ингибирующие костимулирующие молекулы) (NPL 5). Например, ниволумаб (моноклональное антитело IgG4 человека против PD-1 человека) используют для лечения злокачественной меланомы и т. д. в качестве ингибитора иммунной контрольной точки, который активирует Т-клетки через ингибирование связывания PD-1 с его лигандами (PD-L1 и PD-L2) (PTL 1 и NPL 6). Кроме того, в качестве ингибитора иммунной контрольной точки, который отличается от ниволумаба по типу антител, используют пембролизумаб для лечения злокачественной меланомы, немелкоклеточного рака легкого и т.д. (NPL 6).
[0006]
(S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он, который является соединением 3,5-дизамещенного бензолалкинила, или его соль, известен в качестве ингибитора FGFR. Комбинации ингибиторов FGFR и других противоопухолевых агентов были описаны до настоящего времени (PTL 2 и PTL 3). Что касается объединенного введения ингибитора FGFR и ингибитор иммунной контрольной точки, например, PTL 4 описывает способ с применением ингибитора FGFR и анти-PD-1 антитела или анти-PD-L1 антитела в комбинации.
[0007]
Сообщалось о многих случаях, связанных с ингибитором иммунной контрольной точки, и было выяснено, что длительное введение приводит к резистентности к лекарственным средством, и механизм этого был изучен (NPL 9, NPL 10 и NPL 11). В качестве примера использования ингибитора иммунной контрольной точки и ингибитора FGFR, например, сообщалось об испытании эрдафитиниба (JNJ-42756493) в исследовании фазы II (NCT02365597) для лечения рака уротелия, в котором ингибитор FGFR вводили субъектам, которых ранее лечили PD-1 или PD-L1. Кроме того, до сих пор проводят комбинированное тестирование вофатамаба, который представляет собой анти-FGFR3 антитело, и пембролизумаба (NCT03123055). Что касается длительного введения, были сделаны сообщения о комбинированном применении эверолимуса и пазопаниба, который является ингибитором мультикиназы, который обладает эффектом ингибирования FGFR, о комбинированном применении вофатамаба и доцетаксела и продолжительном введении атезолизумаба (NPL 12).
Список литературы
Патентная литература
[0008]
PTL 1: WO2004/004771
PTL 2: WO2013/108809
PTL 3: WO2017/150725
PTL 4: WO2016/161239
Не патентная литература
[0009]
NPL 1: Nat. Rev. Cancer, 10, 116-129 (2010)
NPL 2: J. Clin. Oncol., 24, 3664-3671 (2006)
NPL 3: Mol. Cancer Res., 3, 655-667 (2005)
NPL 4: Cancer Res., 70, 2085-2094 (2010)
NPL 5: Nat. Rev. Cancer, 12, 252-264 (2012)
NPL 6: N. Engl. J. Med., 366, 2443-2454 (2012)
NPL 7: The Breast, 37, 126-133 (2018)
NPL 8: Oncotarget, 8, 16052-16074 (2017)
NPL 9: Cell, 168, 707-723 (2017)
NPL 10: N. Engl. J. Med., 375, 819-829 (2016)
NPL 11: Sci. Transl. Med. 9, eaal 3604 (2017)
NPL 12: JCO Precision Oncology (DOI: 10.1200/P0.18.00117), July 24, 2018
NPL 13: Cellular Physiology and Biochemistry, 33, pp. 633-645 (2014)
NPL 14: Frontiers in Immunology, 9, 2018, Article 1310.doi:10.3389/fimmu.2018.01310
Сущность изобретения
Техническая проблема
[0010]
Объектом настоящего описания является получение новой комбинированной терапии, которая обладает превосходным противоопухолевым действием для онкологических пациентов, которые резистентны к ингибиторам иммунной контрольной точки, с применением (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли.
Решение проблемы
[0011]
С учетом приведенных обстоятельств, авторы настоящего изобретения обнаружили, что вышеуказанные проблемы могут быть решены комбинированным применением (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она (далее также названного «соединение 1»), который является соединение, обладающим активностью ингибирования FGFR, или его соли, с ингибитором иммунной контрольной точки.
[0012]
Следовательно, в настоящем описании представлены следующие пункты 1-55.
[0013]
Пункт 1. Противоопухолевый агент, содержащий (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль в качестве активного ингредиента, где противоопухолевый агент вводят в комбинации с пембролизумабом, онкологическому пациенту с резистентностью к ингибиторам иммунной контрольной точки.
[0014]
Пункт 2. Противоопухолевый агент по п. 1, где опухоль имеет аберрацию в пути FGFR.
[0015]
Пункт 3. Противоопухолевый агент по п. 2, где аберрацией в пути FGFR является, по меньшей мере, один член, выбранный из группы, состоящей из сверхэкспрессии FGFR, генетической аберрации FGFR и аберрантной подачи сигнала FGFR.
[0016]
Пункт 4. Противоопухолевый агент по п. 1-3, где лечение противоопухолевым агентом дает долговременный ответ у индивидуума после прекращения лечения.
[0017]
Пункт 5. Противоопухолевый агент по любому из пп. 1-4, где (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль применяют до, одновременно или пембролизумаба.
[0018]
Пункт 6. Противоопухолевый агент по любому из пп. 1-5, где (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль применяют непрерывно или периодически.
[0019]
Пункт 7. Противоопухолевый агент по любому из пп. 1-15, где (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль и пембролизумаб вводят в лечении с одной терапевтической схемой.
[0020]
Пункт 8. Противоопухолевый агент по любому из пп. 1-7, где для опухоли с резистентностью к ингибиторам иммунной контрольной точки, противоопухолевый агент применяют для введения (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли один раз в сутки в дозе, выбранной из группы, состоящей из 4 мг, 8 мг, 12 мг, 16 мг и 20 мг и для введения ниволумаба в дозе, выбранной из группы, состоящей из 1 мг/кг с 3-недельными интервалами, 2 мг/кг с 3-недельными интервалами, 3 мг/кг с 3-недельными интервалами, 80 мг с 3-недельными интервалами, 240 мг с 3-недельными интервалами, 1 мг/кг с 2-недельными интервалами, 2 мг/кг с 2-недельными интервалами, 3 мг/кг с 2-недельными интервалами, 80 мг с 2-недельными интервалами и 240 мг с 2-недельными интервалами.
[0021]
Пункт 9. Противоопухолевый агент по любому из пп. 1-8, где для опухоли с резистентностью к ингибиторам иммунной контрольной точки, (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли вводят один раз в сутки в дозе, выбранной из группы, состоящей из 8 мг, 12 мг, 16 мг и 20 мг и пембролизумаб вводят в дозе 200 мг с 3-недельными интервалами.
[0022]
Пункт 10. Противоопухолевый агент по любому из пп. 1-9, где опухолью с резистентностью к ингибиторам иммунной контрольной точки является рак пищевода или немелкоклеточный рак легких.
[0023]
Пункт 11. Фармацевтическая композиция, содержащая пебюролизумаб и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль в качестве активных ингредиентов.
[0024]
Пункт 12. Фармацевтическая композиция по п. 21, для лечения рака с резистентностью к ингибиторам иммунной контрольной точки.
[0025]
Пункт 13. Применение пембролизумаба и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для производства противоопухолевого агента для лечения рака с резистентностью к ингибиторам иммунной контрольной точки.
[0026]
Пункт 14. Применение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для производства противоопухолевого агента для введения в комбинации с пембролизумабом, пациенту с резистентностью к ингибиторам иммунной контрольной точки.
[0027]
Пункт 15. Применение пембролизумаба для производства противоопухолевого агента для введения в комбинации с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его солью пациенту с резистентностью к ингибиторам иммунной контрольной точки.
[0028]
Пункт 16. Комбинация пембролизумаба и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для применения в лечении рака с резистентностью к ингибиторам иммунной контрольной точки.
[0029]
Пункт 17. (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для применения в комбинированной терапии с пембролизумабом, в лечении рака с резистентностью к ингибиторам иммунной контрольной точки.
[0030]
Пункт 18. Пембролизумаб для применения в комбинированной терапии с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его солью в лечении рака с резистентностью к ингибиторам иммунной контрольной точки.
[0031]
Пункт 19. Применение пембролизумаба и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для лечения рака с резистентностью к ингибиторам иммунной контрольной точки.
[0032]
Пункт 20. Применение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для лечения рака с резистентностью к ингибиторам иммунной контрольной точки комбинированной терапией с пембролизумабом.
[0033]
Пункт 21. Применение пембролизумаба для лечения рака с резистентностью к ингибиторам иммунной контрольной точки комбинированной терапией с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его солью.
[0034]
Пункт 22. Способ лечения рака с резистентностью к ингибиторам иммунной контрольной точки, где способ содержит введение терапевтически эффективного количества (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли и терапевтически эффективного количества пембролизумаба человеку, нуждающемуся в этом.
[0035]
Пункт 23. Противоопухолевый агент, содержащий (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль в качестве активного ингредиента, где противоопухолевый агент вводят в комбинации с пембролизумабом, онкологическому пациенту, которому вводили ингибиторы иммунной контрольной точки.
[0036]
Пункт 24. Фармацевтическая композиция, содержащая пембролизумаб и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль в качестве активных ингредиентов, для лечения рака у онкологического пациента, которому не вводили ингибиторы иммунной контрольной точки.
[0037]
Пункт 25. Фармацевтическая композиция по п. 24, для лечения рака с резистентностью к ингибиторам иммунной контрольной точки.
[0038]
Пункт 26. Применение пембролизумаба и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для производства противоопухолевого агента для лечения рака у онкологического пациента, которому не вводили ингибиторы иммунной контрольной точки.
[0039]
Пункт 27. Применение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для производства противоопухолевого агента, вводимого в комбинации с пембролизумабом, онкологическому пациенту, которому не вводили ингибиторы иммунной контрольной точки.
[0040]
Пункт 28. Применение пембролизумаба для производства противоопухолевого агента для введения в комбинации с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли онкологическому пациенту, которому не вводили ингибиторы иммунной контрольной точки.
[0041]
Пункт 29. Комбинация пембролизумаба и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для применения в лечении рака у онкологического пациента, которому не вводили ингибиторы иммунной контрольной точки.
[0042]
Пункт 30. (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль для применения в комбинированной терапии пембролизумабом в лечении рака у онкологического пациента, которому не вводили ингибиторы иммунной контрольной точки.
[0043]
Пункт 31. Пембролизумаб для применения в комбинированной терапии с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его солью в лечении рака у онкологического пациента, которому не вводили ингибиторы иммунной контрольной точки.
[0044]
Пункт 32. Применение пембролизумаба и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для лечения рака у онкологического пациента, которому не вводили ингибиторы иммунной контрольной точки.
[0045]
Пункт 33. Применение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для лечения рака у онкологического пациента, которому не вводили ингибиторы иммунной контрольной точки, комбинированной терапией с пембролизумабом.
[0046]
Пункт 34. Применение пембролизумаба для лечения рака у онкологического пациента, которому не вводили ингибиторы иммунной контрольной точки, комбинированной терапией с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его солью.
[0047]
Пункт 35. Способ лечения рака у онкологического пациента, которому не вводили ингибиторы иммунной контрольной точки, где способ содержит введение терапевтически эффективного количества (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли и терапевтически эффективного количества пембролизумаба человеку, нуждающемуся в этом.
[0048]
Пункт 36. Композиция, применение, комбинация, (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль, пембролизумаб или способ по любому из пп. 11-22, где опухоль имеет аберрацию в пути FGFR.
[0049]
Пункт 37. Композиция, применение, комбинация, (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его сольпембролизумаб или способ по п. 46, где аберрацией в пути FGFR является, по меньшей мере, один член, выбранный из группы, состоящей из сверхэкспрессии FGFR, генетической аберрации FGFR и аберрантной подачи сигнала FGFR.
[0050]
Пункт 38. Противоопухолевый агент, содержащий (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль в качестве активного ингредиента, где противоопухолевый агент вводят в комбинации с пембролизумабом онкологическому пациенту с резистентностью к ингибиторам иммунной контрольной точки и без аберраций в пути FGFR.
[0051]
Пункт 39. Фармацевтическая композиция, содержащая пембролизумаб и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль в качестве активных ингредиентов, для лечения рака без аберраций в пути FGFR.
[0052]
Пункт 40. Фармацевтическая композиция по п. 24, для лечения рака с резистентностью к ингибиторам иммунной контрольной точки.
[0053]
Пункт 41. Применение пембролизумаба и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для производства противоопухолевого агента для лечения рака без аберраций в пути FGFR.
[0054]
Пункт 42. Применение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для производства противоопухолевого агента для введения в комбинации с пембролизумабом онкологическому пациенту без аберраций в пути FGFR.
[0055]
Пункт 43. Применение пембролизумаба для производства противоопухолевый агент для введения в комбинации с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его солью онкологическому пациенту без аберраций в пути FGFR.
[0056]
Пункт 44. Комбинация пембролизумаба и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для применения в лечении рака без аберраций в пути FGFR.
[0057]
Пункт 45. (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль для применения в комбинированной терапии с пембролизумабом в лечении рака без аберраций в пути FGFR.
[0058]
Пункт 46. Пембролизумаб для применения в комбинированной терапии с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его солью в лечении рака без аберраций в пути FGFR.
[0059]
Пункт 47. Применение пембролизумаба и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для лечения рака без аберраций в пути FGFR.
[0060]
Пункт 48. Применение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли для лечения рака без аберраций в пути FGFR комбинированной терапией с пембролизумабом.
[0061]
Пункт 49. Применение пембролизумаба для лечения рака без аберраций в пути FGFR комбинированной терапией с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его солью.
[0062]
Пункт 50. Способ для лечения рака без аберраций в пути FGFR, где способ содержит введение терапевтически эффективного количества (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли и терапевтически эффективного количества пембролизумаба человеку, нуждающемуся в этом.
[0063]
Пункт 51. Композиция, применение, комбинация, (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль, пембролизумаб или способ по любому из пп. 11-50, где лечение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его солью и пембролизумабом дает устойчивый ответ у индивидуума после превращения лечения.
[0064]
Пункт 52. Композиция, применение, комбинация, (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль, пембролизумаб или способ по любому из пп. 11-51, где (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль применяют до, одновременно или после пембролизумаба.
[0065]
Пункт 53. Композиция, применение, комбинация, (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль, пембролизумаб или способ по любому из пп. 11-52, где (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль применяют непрерывно или периодически.
[0066]
Пункт 54. Композиция, применение, комбинация, (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль, пембролизумаб или способ по любому из пп. 11-53, где (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль и пембролизумаб вводят в лечении по одной терапевтической схеме.
[0067]
Пункт 55. Композиция, применение, комбинация, (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль, пембролизумаб или способ по любому из пп. 11-54, где (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль и пембролизумаб применяют следующим образом: онкологическому пациенту с резистентностью к ингибиторам иммунной контрольной точки, (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль вводят один раз в сутки в дозе, выбранной из группы, состоящей из 4 мг, 8 мг, 12 мг, 16 мг и 20 мг; и пембролизумаб вводят в дозе, выбранной из группы, состоящей из 1 мг/кг с 3-недельными интервалами, 2 мг/кг с 3-недельными интервалами и 200 мг с 3-недельными интервалами.
Преимущества изобретения
[0068]
Настоящее описание может предоставить новую комбинированную терапию, которая обладает превосходными противоопухолевыми действиями на онкологических пациентов, которые резистентны к ингибиторам иммунной контрольной точки, с применением (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли.
Краткое описание чертежей
[0069]
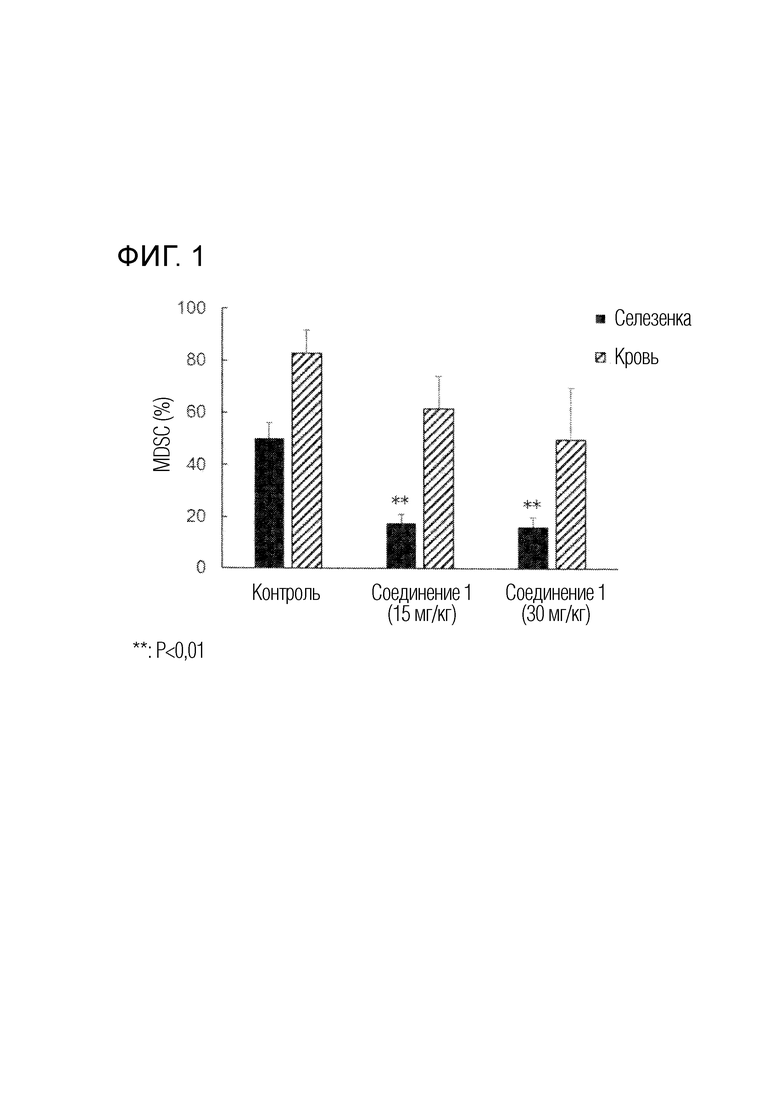
На фиг. 1 показаны результаты примера 2 (влияние соединения 1 на миелоидные супрессорные клетки (MDSC)).
Описание вариантов осуществления
[0070]
Настоящее описание относится к предоставлению, например, комбинированного применения соединения, обладающего активностью ингибитора FGFR, и ингибитора иммунной контрольной точки, то есть, противоопухолевого агента, содержащего соединение, обладающее активностью ингибитора FGFR, вводимого в комбинации с ингибитором иммунной контрольной точки, усилителя проитвоопухолевого эффекта, содержащим соединение, обладающее активностью ингибитора FGFR, комбинации соединения, обладающего активностью ингибитора FGFR и ингибитора иммунной контрольной точки, и применения соединения, обладающего активностью ингибитора FGFR в производстве лекарственного средства для лечения опухолей, вводимого в комбинации с ингибитором иммунной контрольной точки.
[0071]
В настоящем описании, (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он, который обладает превосходным противоопухолевым действием при применении в комбинации с ингибитором иммунной контрольной точки, является соединением дизамещенного бензолалкинила, имеющим следующую структуру. В настоящем описании, это соединение просто обозначено «соединение 1». Соединение 1 описано в примере соединения 2 в PTL 2, описанном выше. Сообщалось, что соединение 1 или его соль обладает превосходным действием ингибитора FGFR и ингибирует способность рецепторных протеинтирозинкиназ (FGFR1, FGFR3 и FGFR4) фосфорилировать тирозин в последовательности субстратного пептида (PTL 2).
[0072]

[0073]
Соединение 1 или его фармацевтически приемлемая соль в настоящем описании могут быть синтезированы любым способом; например, оно может быть синтезировано согласно способу получения, описанному в PTL 2.
[0074]
В настоящем описании соединение 1 может применяться как есть или в форме фармацевтически приемлемой соли. Фармацевтически приемлемая соль соединения 1 особо не ограничивается, и примеры включают аддитивные соли с неорганическими кислотами, такими как хлористоводородная кислота и серная кислота, или с органическими кислотами, такими как уксусная кислота, лимонная кислота, винная кислота и малеиновая кислота; соли с щелочными металлами, такими как калий и натрий; соли щелочноземельных металлов, таких как кальций и магний; соли с органическими основаниями, такими как соли аммония, соли этиламина и соли аргинина; и подобные.
[0075]
В настоящем описании, ингибиторы иммунной контрольной точки действуют на молекулы иммунной контрольной точки и оказывают действие индуцирования противоопухолевых иммунных ответов в телах субъектов и предотвращают ускользание опухоли от иммунного ответа.
[0076]
Примеры таких ингибиторов иммунной контрольной точки включают вещества, которые улучшают функцию костимулирующих молекул (стимулирующих костимулирующих молекул) и веществ, которые ингибируют функцию коингибирующих молекул (ингибирующих костимулирующих молекул). Примеры молекул иммунной контрольной точки включают молекулы семейства B7 (B7-1, B7-2, PD-L1, PD-L2 и т.д.), семейства CD28 (CTLA-4, PD-1 и т.д.), суперсемейства TNF (4-1BBL, OX40L) и суперсемейства TNF рецептора (4-1BB, OX40). Вещества, которые таргетируют молекулы иммунной контрольной точки, могут применяться в качестве ингибиторов иммунной контрольной точки. Примеры включают антагонисты пути PD-1, агонисты пути ICOS, антагонисты пути CTLA-4, агонисты пути CD28, антагонисты пути BTLA, агонисты пути 4-1BB и подобные.
[0077]
Антагонисты пути PD-1ингибируют иммунодепрессивные сигналы PD-1, экспрессированного на T клетках, и его лигандов PD-L1 или PD-L2. Примеры включают анти-PD-1 антитела, анти-PD-L1 антитела, анти-PD-L2 антитела, PD-1 внеклеточные домены, PD-L1 внеклеточные домены, PD-L2 внеклеточные домены, PD-1-Ig (слитый белок PD-1 внеклеточного домена и FC область Ig), PD-L1-Ig, PD-L2-Ig, PD-1 миРНК, PD-L1 миРНК, PD-L2 миРНК и подобные.
[0078]
Примеры этих антител включают иммуноглобулины (IgA, IgD, IgE, IgG, IgM, IgY и т.д.), Fab фрагменты, F(ab’)2 фрагменты, фрагменты одноцепочечного антитела (scFv), однодоменные антитела и диатело (Nat. Rev. Immunol., 6:343-357, 2006). Они включают моноклональные антитела и поликлональные антитела, такие как антитела человека, гуманизированные антитела, химерные антитела, антитела мыши, антитела ламы и антитела курицы. Предпочтительны гуманизированное IgG моноклональное антитело или IgG моноклональное антитело человека.
[0079]
Эти агонисты или антагонисты могут быть получены общеизвестным способом получения.
[0080]
Кроме того, анти-PD-1 антитела уже продаются или будут продаваться как пембролизумаб, и они также могут применяться.
[0081]
В настоящем описании, ингибиторы иммунной контрольной точки могут применяться отдельно или в комбинации двух или нескольких.
[0082]
В настоящем описании, при применении двух или нескольких ингибиторов иммунной контрольной точки, например, анти-PD-1 антитело, анти-CTLA-4 антитело и подобные ингибиторы иммунной контрольной точки могут применяться в комбинации, или биспецифические антитела, которые могут связываться с разными молекулами иммунной контрольной точки, также могут применяться. Примеры биспецифических антител включают XmAb20717 (PD-1 x CTLA-4), которые могут быть связаны с обоими PD-1 и CTLA-4.
[0083]
Лечение в настоящем описании включает процедуры, выполняемые с целью лечения или облегчения заболеваний или с целью подавления прогрессирования или рецидива заболевания или облегчения симптомов. Лечение включает введение лекарственных средств до или после хирургической процедуры или введение лекарственных средств во время, до или после радиационной терапии.
[0084]
Терапевтически эффективные количества антител и соединения 1 или их соли, которые блокируют взаимодействие с молекулами иммунной контрольной точки, не ограничены и зависят от нескольких факторов, включая стадию и тяжесть рака, а также других факторов, связанных со здоровьем пациента. Специалисты в данной области техники знают, как определить терапевтически эффективные количества.
[0085]
Варианты осуществления настоящего описания применяют для опухолей, имеющих аберрации пути FGFR. В варианте осуществления, FGFR выбирают из группы, состоящей из FGFR1, FGFR2, FGFR3 и FGFR4.
[0086]
В варианте осуществления, опухоли, к которым применяется настоящее изобретение, предпочтительно, являются опухолями, имеющими аберрации в пути FGFR. Аберрации в пути FGFR включают сверхэкспрессию FGFR, генетическую аберрацию FGFR и аберрантную подачу сигнала FGFR.
[0087]
В варианте осуществления настоящего описания, наличие аберраций FGF/FGFR не имеет значения; тем не менее, субъектом введения является, преимущественно, тот, у кого есть аберрации в пути FGFR. Соединение 1 может усиливать противоопухолевый эффект ингибитора иммунной контрольной точки даже при типах рака без генетической аберрации FGFR. Известно, что на восприимчивость рака к ингибитору иммунной контрольной точки также влияет микросреда опухоли. Микросреда включает, но не ограничивается ими, группы клеток, контролируемые активацией пути FGF/FGFR, такие как опухолеассоциированные фибробласты (CAF). Эти группы клеток, как известно, уменьшают восприимчивость рака к ингибитору иммунной контрольной точки. Считается, что введение соединения 1 вызывает изменения в микросреде, включая инактивацию CAF, тем самым усиливая действие ингибитора иммунной контрольной точки на рак.
[0088]
Примеры сверхэкспрессии FGFR включают экспрессию гена и высокую экспрессию белков генного продукта. Экспрессия FGFR может быть определена способами, известными специалистам в данной области техники. Экспрессия генов и высокая экспрессия белков генного продукта могут быть определены известными способами, такими как способы с применением антител (иммуногистохимия, ферментный иммуноанализ (ELISA), проточная цитометрия, иммуноблоттинг и т.д.), способы с применением нуклеиновых кислот (гибридизация in situ, ПЦР, нозерн-блоттинг и т.д.) и способы на основе общих принципов этих способов. Устройством определения может быть любое известное устройство (GeneChip, микрочип и т.д.).
[0089]
Вариант осуществления настоящего раскрытия используется для опухолей, имеющих генетические аберрации FGFR. Генетические аберрации в пути FGFR включают амплификацию гена, генную мутацию, хромосомную транслокацию, вставку и инверсию, слияние генов, генетическую перестройку и т.д.). Некоторые генетические аберрации в опухолях уже описаны в документах, доступных специалистам в данной области техники (NPL 7 и NPL 8). Генетическая аберрация FGFR может быть обнаружена с помощью методов, известных специалистам в данной области техники, например, пиросеквенирования, секвенирования ДНК, включая секвенирование следующего поколения (NGS), методов на основе ПЦР, включая аллель-специфические цепные реакции ПЦР, сравнительную геномную гибридизацию на основе микрочипов (aCGH), флуоресцентную гибридизацию in situ (FISH) и хромогенную гибридизацию in situ (CISH).
[0090]
Кроме того, вариант осуществления настоящего описания применяют для опухолей с активированной подачей сигналов FGFR. FGFR связываются с FGF с образованием димеров и активируются после фосфорилирования, что индуцирует мобилизацию и активацию определенных молекул нисходящей трансдукции сигнала, тем самым развивая физиологические функции.
[0091]
Активация подачи сигналов FGFR может быть определена способами, известными специалистам в данной области техники. Активация подачи сигнала может быть определена, например, через определение FGF, которые являются субстратами для FGFR; через определение состояния прямого фосфорилирования FGFR, которые являются фосфорилированными ферментами, или биологической активности, включая ферментную активность; через определение состояния фосфорилирования внутриклеточных субстратов и внутриклеточных белков, существующих в нисходящем сигнальном каскаде FGFR или биологической активности, включая ферментную активность; или через определение генных продуктов или генных транскриптов.
[0092]
В другом варианте осуществления, опухоли, к которым применяется настоящее описание, также включают опухоли, не имеющие аберрации в пути FGFR.
[0093]
В настоящем описании, предпочтительные примеры дозы соединения 1 или его соли в сутки на день введения включают от 4 мг до 160 мг, 4 мг до 24 мг, 12 до 24 мг, 16 до 24 мг, 20 мг и подобные. Более конкретно, примеры множества доз и суточной дозы в день введения включают один раз в сутки, 4 мг, 8 мг, 12 мг, 16 мг, 20 мг и подобные. В другом варианте осуществления, предпочтительные примеры множества доз и суточной дозы в день введения включают 8 мг, 12 мг, 16 мг, 20 мг и подобные. В другом варианте осуществления, предпочтительные примеры множества доз и суточной дозы в день введения включают 12 мг, 16 мг, 20 мг и подобные. В другом варианте осуществления, предпочтительные примеры множества доз и суточной дозы в день введения включают 20 мг и подобные.
[0094]
В варианте осуществления настоящего описания, в случае типа рака, для которого желателен более сильный эффект (например, опухоль головного мозга), доза соединения 1 или его соль включает дозу, превышающую 20 мг один раз в сутки.
[0095]
Если дозу соединения 1 или его соли в сутки вводят периодически, доза соединения 1 или его соли в сутки составляет, например, от примерно 2 до 1000 мг, предпочтительно, от 10 до 500 мг, более предпочтительно, от 20 до 200 мг и даже более предпочтительно, от 50 до 160 мг.
[0096]
Что касается схемы введения, соединение 1 или его соль могут быть введены каждый день или периодически.
[0097]
В настоящем описании, «введением каждый день» может быть схема введения на основе цикла, в котором дозирование проводят в течение 21 дней каждый день (один цикл), и перерыв в применении препарата может быть предоставлен в конце каждого цикла.
[0098]
В настоящем описании, «периодическое введение» особенно не ограничено, пока удовлетворяются условия введения, по меньшей мере, два раза в неделю, и интервал введения, по меньшей мере, один день между дозированием (количество дней между определенным днем введения и следующим днем введения).
[0099]
Примеры включают схему введения на основе 1-недельного цикла, в которой соединение 1 или его соль вводят, по меньшей мере, два раза каждые один-три дня в цикле (с интервалом между определенным днем введения и следующим днем введения 1-3 дня) и этот цикл проводят один раз или повторяют два раза или более;
схему введения на основе 14-дневного цикла, в которой соединение 1 или его соль вводят 4-7 раз каждые 1-3 дня на цикл (с интервалом между определенным днем введения и следующим днем введения 1-3 дня) и этот цикл проводят один раз или повторяют два раза или более;
схему введения на основе 14-дневного цикла, в которой в течение 14 дней, составляющих один цикл, соединение 1 или его соль вводят в дни 1, 4, 8 и 11;
схему введения на основе 14-дневного цикла, в которой в течение 14 дней, составляющих один цикл, соединение 1 или его соль вводят в дни 1, 3, 5, 7, 9, 11 и 13; и
схему введения на основе 14-дневного цикла, в которой в течение 14 дней, составляющих один цикл, соединение 1 или его соль вводят в дни 1, 3, 5, 8, 10 и 12.
[0100]
В варианте осуществления настоящего описания, примером схемы введения является такой, в котором 160 мг соединения 1 или его соли вводят один раз в сутки в дни 1, 3, 5, 8, 10 и 12. Доза соединения 1 или его соли может быть понижена до 120 мг, 80 мг, 56 мг, 36 мг, 24 мг, 16 мг или 8 мг.
[0101]
В настоящем описании, с целью улучшения противоопухолевой активности пембролизумаба соединением 1 или его солью, суточная доза ингибитора пембролизумаба в день введения составляет, предпочтительно, 30-100%, более предпочтительно, 50-100%, даже более предпочтительно, 70-100%, еще более предпочтительно, 80-100%, кроме того, еще более предпочтительно, 90-100% и кроме того, еще более предпочтительно, 100%, от рекомендованной дозы в случае введения только пембролизумаба.
[0102]
Предпочтительная доза пембролизумаба при отдельном введении составляет, например, 100 до 200 мг на дозу или 200 или 400 мг на дозу. В другом варианте осуществления, предпочтительная доза пембролизумаба при отдельном введении составляет, например, 1,0 до 2,0 мг/кг (массы тела) на дозу или 2,0 мг/кг (массы тела) на дозу.
[0103]
В настоящем описании предпочтительная доза пембролизумаба в день на день введения составляет, например, 100-400 мг на дозу, или 200 или 400 мг на дозу. В другом варианте осуществления настоящего описания, предпочтительная доза пембролизумаба в день на день введения составляет, например, 1,0-2,0 мг/кг (массы тела) на дозу, или 2,0 мг/кг (массы тела) на дозу. Кроме того, интервал введения пембролизумаба составляет предпочтитиельно 3-4 недели, и более предпочтительно, 3 недели.
[0104]
Примеры дозы соединения 1 или его соли по настоящему описанию в день на день введения, и дозы пембролизумабаа в сутки, или предпочтительная комбинация применения и дозирования включает следующие:
4 мг - 160 мг соединения 1 или его соли по настоящему описанию и 100-400 мг пембролизумаба на дозу.
4 мг - 160 мг соединения 1 или его соли по настоящему описанию и 100-200 мг пембролизумаба на дозу.
4 мг - 160 мг соединения 1 или его соли по настоящему описанию и 200 мг пембролизумаба на дозу.
4 мг - 160 мг соединения 1 или его соли по настоящему описанию и 400 мг пембролизумаба на дозу.
4 мг - 160 мг соединения 1 или его соли по настоящему описанию и 1,0-2,0 мг/кг (массы тела) на дозу пембролизумаба.
4 мг - 160 мг соединения 1 или его соли по настоящему описанию и 2,0 мг/кг (массы тела) на дозу пембролизумаба.
4 мг - 160 мг соединения 1 или его соли по настоящему описанию и 200 мг пембролизумаба с 3-недельными интервалами.
4 мг - 160 мг соединения 1 или его соли по настоящему описанию и 400 мг пембролизумаба с 3-недельными интервалами.
4 мг - 24 мг соединения 1 или его соли по настоящему описанию и 100-400 мг пембролизумаба на дозу.
4 мг - 24 мг соединения 1 или его соли по настоящему описанию и 100-200 мг пембролизумаба на дозу.
4 мг - 24 мг соединения 1 или его соли по настоящему описанию и 200 мг пембролизумаба на дозу.
4 мг - 24 мг соединения 1 или его соли по настоящему описанию и 400 мг пембролизумаба на дозу.
4 мг - 24 мг соединения 1 или его соли по настоящему описанию и 1,0-2,0 мг/кг (массы тела) на дозу пембролизумаба.
4 мг - 24 мг соединения 1 или его соли по настоящему описанию и 2,0 мг/кг (массы тела) на дозу пембролизумаба.
4 мг - 24 мг соединения 1 или его соли по настоящему описанию и 200 мг пембролизумаба с 3-недельными интервалами.
4 мг - 24 мг соединения 1 или его соли по настоящему описанию и 400 мг пембролизумаба с 3-недельными интервалами.
12-24 мг соединения 1 или его соли по настоящему описанию и 100-400 мг пембролизумаба на дозу.
12-24 мг соединения 1 или его соли по настоящему описанию и 100-200 мг пембролизумаба на дозу.
12-24 мг соединения 1 или его соли по настоящему описанию и 200 мг пембролизумаба на дозу.
12-24 мг соединения 1 или его соли по настоящему описанию и 400 мг пембролизумаба на дозу.
12-24 мг соединения 1 или его соли по настоящему описанию и 1,0-2,0 мг/кг (массы тела) на дозу пембролизумаба.
12-24 мг соединения 1 или его соли по настоящему описанию и 2,0 мг/кг (массы тела) на дозу пембролизумаба.
12-24 мг соединения 1 или его соли по настоящему описанию и 200 мг пембролизумаба с 3-недельными интервалами.
12-24 мг соединения 1 или его соли по настоящему описанию и 400 мг пембролизумаба с 3-недельными интервалами.
16-24 мг соединения 1 или его соли по настоящему описанию и 100-400 мг пембролизумаба на дозу.
16-24 мг соединения 1 или его соли по настоящему описанию и 100-200 мг пембролизумаба на дозу.
16-24 мг соединения 1 или его соли по настоящему описанию и 200 мг пембролизумаба на дозу.
16-24 мг соединения 1 или его соли по настоящему описанию и 400 мг пембролизумаба на дозу.
16-24 мг соединения 1 или его соли по настоящему описанию и 1,0-2,0 мг/кг (массы тела) на дозу пембролизумаба.
16-24 мг соединения 1 или его соли по настоящему описанию и 2,0 мг/кг (массы тела) на дозу пембролизумаба.
16-24 мг соединения 1 или его соли по настоящему описанию и 200 мг пембролизумаба с 3-недельными интервалами.
16-24 мг соединения 1 или его соли по настоящему описанию и 400 мг пембролизумаба с 3-недельными интервалами.
[0105]
Примеры множества доз и дозы соединения 1 или его соли по настоящему описанию в сутки в день введения, и дозы пембролизумаба в сутки, или комбинации применения и дозирования включают следующие:
4 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 100-400 мг пембролизумаба на дозу.
4 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 100-200 мг пембролизумаба на дозу.
4 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 200 мг пембролизумаба на дозу.
4 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 400 мг пембролизумаба на дозу.
4 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 1,0-2,0 мг/кг (массы тела) на дозу пембролизумаба.
4 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 2,0 мг/кг (массы тела) на дозу пембролизумаба.
4 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 200 мг пембролизумаба с 3-недельными интервалами.
4 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 400 мг пембролизумаба с 3-недельными интервалами.
8 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 100-400 мг пембролизумаба на дозу.
8 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 100-200 мг пембролизумаба на дозу.
8 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 200 мг пембролизумаба на дозу.
8 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 400 мг пембролизумаба на дозу.
8 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 1,0-2,0 мг/кг (массы тела) на дозу пембролизумаба.
8 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 2,0 мг/кг (массы тела) на дозу пембролизумаба.
8 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 200 мг пембролизумаба с 3-недельными интервалами.
8 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 400 мг пембролизумаба с 3-недельными интервалами.
12 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 100-400 мг пембролизумаба на дозу.
12 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 100-200 мг пембролизумаба на дозу.
12 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 200 мг пембролизумаба на дозу.
12 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 400 мг пембролизумаба на дозу.
12 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 1,0-2,0 мг/кг (массы тела) на дозу пембролизумаба.
12 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 2,0 мг/кг (массы тела) на дозу пембролизумаба.
12 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 200 мг пембролизумаба с 3-недельными интервалами.
12 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 400 мг пембролизумаба с 3-недельными интервалами.
16 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 100-400 мг пембролизумаба на дозу.
16 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 100-200 мг пембролизумаба на дозу.
16 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 200 мг пембролизумаба на дозу.
16 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 400 мг пембролизумаба на дозу.
16 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 1,0-2,0 мг/кг (массы тела) на дозу пембролизумаба.
16 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 2,0 мг/кг (массы тела) на дозу пембролизумаба.
16 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 200 мг пембролизумаба с 3-недельными интервалами.
16 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 400 мг пембролизумаба с 3-недельными интервалами.
20 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 100-400 мг пембролизумаба на дозу.
20 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 100-200 мг пембролизумаба на дозу.
20 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 200 мг пембролизумаба на дозу.
20 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 400 мг пембролизумаба на дозу.
20 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 1,0-2,0 мг/кг (массы тела) на дозу пембролизумаба.
20 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 2,0 мг/кг (массы тела) на дозу пембролизумаба.
20 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 200 мг пембролизумаба с 3-недельными интервалами.
20 мг соединения 1 или его соли по настоящему описанию один раз в сутки и 400 мг пембролизумаба с 3-недельными интервалами.
[0106]
Применяемое отношение соединения 1 или его соли к пембролизумабу в настоящем описании особенно не ограничено, но может быть установлено так, чтобы количество пембролизумаба составляло, предпочтительно, в диапазоне 10-10000 массовых частей и, более предпочтительно, 100-1000 массовых частей, по отношению к 100 массовым частям соединения 1 или его соли.
[0107]
В настоящем описании, отношение смешивания соединения 1 или его соли в дозированной форме, содержащей соединение 1 или его соль, особенно не ограничено, но может быть подходящим образом установлено в диапазоне, например, 100-100000% масс. и, предпочтительно, 1000-10000% масс. В настоящем описании, отношение смешивания ингибитора иммунной контрольной точки в дозированной форме, содержащей ингибитор иммунной контрольной точки, особенно не ограничено, но может быть подходящим образом установлено в диапазоне, например, 100-100000% масс. и предпочтительно, 1000-10000% масс. В варианте осуществления, котором противоопухолевый агент составляют во множестве дозированных форм, вышеупомянутые предпочтительные соотношения смешивания означают отношение смешивания активного ингредиента к общей массе дозированной формы, содержащей активный ингредиент, скорее чем отношение активного ингредиента к общему количеству дозированной формы, содержащей активный ингредиент, и дозированной формы, не содержащей активный ингредиент. Например, отношение смешивания соединения 1 или его соли означает % масс. соединения 1 или его соли по отношению к только дозированной форме, содержащей соединение 1 или его соль.
[0108]
В одном варианте настоящего описания, комбинированную терапию настоящего изобретения вводят пациентам, которых не лечили гормональной терапией, иммунотерапией (противораковым пептидом, вакцинной терапией и т.д.), хирургией или химиотерапевтическими агентами, т.е. ранее не леченным пациентам. В другом варианте осуществления, комбинированную терапию вводят пациентам, которые не достигли стабильного ответа после предыдущего лечения химиотерапевтическими агентами.
[0109]
В одном варианте осуществления настоящего описания, комбинированную терапию по настоящему изобретению вводят пациентам, у которых отсутствует опыт лечения ингибиторами иммунной контрольной точки. В другом варианте осуществления, комбинированную терапию вводят пациентам, которые имеют опыт лечения ингибитором FGFR.
[0110]
В одном варианте осуществления настоящего описания, «устойчивые ответы» означает, что устойчивые ответы на рак расширяются и сохраняются при проведении иммунотерапии с применением ингибитора иммунной контрольной точки и т.д. для субъекта. Устойчивые ответы могут быть определены, например, измерением связывания T-лимфоцитов с ингибитором иммунной контрольной точки.
[0111]
В настоящем описании, «рекомендованная доза» является дозой, которая дает максимальный терапевтический эффект в диапазоне, который может безопасно применяться без развития серьезных подобных эффектов, определенных клиническими испытаниями, и т.д. Конкретные примеры включают дозы, которые описаны во вкладышах в упаковку, беседах, инструкциях по лечению и т.д., и которые были одобрены или рекомендованы общественными институтами или организациями, такими как Japan Pharmaceuticals и Medical Devices Agency (PMDA), U.S. Food и Drug Administration (FDA) и European Medicines Agency (EMA). Дозы, которые были одобрены любыми общественными агентствами PMDA, FDA и EMA являются предпочтительными.
[0112]
Схема введения противоопухолевого агента по настоящему описанию может быть подходящим образом выбрана согласно типу рака, стадии рака и подобным.
[0113]
В случае соединения 1 или его соли, схема ежедневного введения на 1-21 день (например, 3 недели (21 день)) является предпочтительной; однако может быть перерыв в применении препарата после этой схемы и ежедневное введение в течение 3 недель (21 дня) является более предпочтительным. Схема введения ингибитора иммунной контрольной точки включает, предпочтительно, 2-недельные - 4-недельные интервалы, например. Схема введения пембролизумаба включает, предпочтительно, 2-недельные, 3-недельные или 4-недельные интервалы и более предпочтительно, 3-недельные интервалы. В настоящем описании, введение лекарственного средства A с интервалами X дней означает, что если днем, в который вводят лекарственное средство A, является днем 1, следующим днем является день 2 и днем после него является день 3 . . . , лекарственное средство вводят в следующий раз в день X+1. Кроме того, если схема введения рассчитана, «1 неделя», «2 недели», «3 недели» и «4 недели» означает «7 дней», «14 дней» «21 день» и «28 дней», соответственно. Поэтому, в настоящем описании, введение лекарственного средства с интервалами 3 недели означает, что если днем, в который вводят лекарственное средство A, является днем 1, лекарственное средство A будет вводиться в следующий раз в день 22.
[0114]
Количество суточных доз противоопухолевого агента настоящего описания может быть должным образом выбрано согласно типу рака, стадии рака и подобным. В случае комбинированного введения с пембролизумабом, количество доз составляет, предпочтительно, один раз в сутки.
[0115]
Порядок введения соединения 1 или его соли и пембролизумаба может быть должным образом выбрано согласно типу рака, стадии рака и подобным; однако, в одной терапевтической схеме, любой из них может вводиться первым или оба из них могут вводиться одновременно.
[0116]
В одном варианте осуществления настоящего описания, соединение 1 или его соль улучшает действие пембролизумаба. В другом варианте осуществления, пембролизумаб улучшает действие соединения 1 или его соли.
[0117]
В одном варианте осуществления настоящего описания, хотя PD-L1 может экспрессироваться или не экспрессироваться, субъектом введения является, предпочтительно, такой, который экспрессирует 1% или более и, более предпочтительно, 50% или более, PD-L1.
[0118]
В одном варианте осуществления настоящего описания, субъектом имеется тот, который имеет опухоль с положительным результатом теста на экспрессию PD-L1. Экспрессия PD-L1 может быть определена с применением анти-человеческого PD-L1 антитела для диагностических целей или его антигенсвязывающего фрагмента в IHC анализе на FFPE или замороженных срезах ткани образцов опухолей, взятых у пациента. В общем, считается, что врач назначит диагностические тесты для определения экспрессии PD-L1 с применением образцов опухолевой ткани от пациента до начала комбинированного введения ингибитора иммунной контрольной точки и ингибитора FGFR; однако предполагают, что врач может назначить диагностические тесты до или после начала лечения, после начала лечения, например, в конце цикла лечения.
[0119]
В настоящем описании, «рак» или «опухоль» относится к физиологическим состояниям млекопитающего, характеризующимся нерегулируемым ростом клеток. «Рак» или «опухоль» имеют одинаковое значение в настоящей спецификации и применяются взаимозаменяемо. Раки включают солидные и гематологические раки. Примеры включают, но не ограничены ими, карциному, лимфому, лейкоз, бластому, саркому и пограничные злокачественные образования (карциноиды).
[0120]
Примеры раков, таргетируемых комбинированным способом настоящего описания, включают рак головы и шеи, рак органов пищеварения (рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак печени, рак желчных путей (например, желчного пузыря и холангиокарциному), рак поджелудочной железы, рак уротелия, рак тонкой кишки, толстой кишки). рак кишечника (например, колоректальный рак, рак толстой кишки и рак прямой кишки), рак легких (например, немелкоклеточный рак легких, мелкоклеточный рак легких и мезотелиому (например, злокачественную мезотелиому плевры, мезотелиому брюшины и мезотелиому перикарда)), рак груди, рак половых органов (рак яичников, рак матки (например, рак шейки матки, рак тела матки и рак эндометрия) и т. д.), рак почек, рак мочевого пузыря, рак простаты, рак яичка, рак кожи (например, злокачественную меланому и рак эпидермиса), рак крови (например, множественную миелому и острый миелоидный лейкоз), опухоль костей и мягких тканей, рабдомиосаркому, опухоль головного мозга, злокачественную шванному, нейроэндокринную опухоль, рак щитовидной железы и подобные. В одном варианте осуществления, мишенями являются рак мочевого пузыря, рак уротелия, рак органов пищеварения (рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак печени, рак желчных путей (например, желчный пузырь и холангиокарцинома), рак поджелудочной железы, рак тонкой кишки, рак толстой кишки. (например, колоректальный рак, рак толстой кишки и рак прямой кишки), рак яичников, рак головы и шеи и рак матки (например, рак шейки матки и рак тела матки). Предпочтительным является рак уротелия, рак пищевода и немелкоклеточный рак легких; и более предпочтительным является рак пищевода и немелкоклеточный рак легких. Упомянутые здесь виды рака включают не только первичное поражение, но также рак, метастазирующий в другие органы (например, печень). Противоопухолевый агент настоящего описания также может быть использован в послеоперационной адъювантной химиотерапии, проводимой для предотвращения рецидива после хирургического удаления опухоли, или может использоваться в предоперационной адъювантной химиотерапии, проводимой для хирургического удаления опухоли.
[0121]
В одном варианте осуществления настоящего описания, примеры раков, таргетируемых комбинированным способом, включают злокачественную меланому, немелкоклеточный рак легких, лимфому Ходжкина, рак уротелия, солидный рак с высокочастотной микросателлитной нестабильностью (MSI-High), почечно-клеточный рак, рак головы и шеи, рак пищевода и рак органов пищеварения.
[0122]
Используемый в настоящем описании термин «комбинированная (терапия)» предназначен для определения терапии, которая включает применение комбинации двух или нескольких соединений/лекарственных средств (как определено выше). Таким образом, «комбинированная (терапия)», «комбинация» и применение соединений/лекарственных средств «в комбинации» в настоящей заявке может означать соединения/лекарства, вводимые как часть одной и той же общей терапевтической схемы. Доза каждого из двух или более соединений/лекарственных средств может быть разной: каждое из них можно вводить одновременно или в разное время. Следовательно, понятно, что соединения/ лекарственные средства комбинации могут быть введены последовательно (например, до или после) или одновременно, либо в одном фармацевтическом составе (т.е. вместе), либо в разных фармацевтических составах (т.е. отдельно). Один и тот же состав одновременно является единым составом. С другой стороны, разные фармацевтические составы не являются целостными.
[0123]
В настоящем описании термины «схема» и «терапевтическая схема» относятся к плану, который показывает в хронологическом порядке тип и количество лекарственных средств, продолжительность, процедуру и т. д. при лечении лекарственным средством, и который показывает дозу, способ введения, порядок введения и день введения каждого лекарственного средства. Лечение по одной терапевтической схеме включает, например, способ, которым начинают введение объединяемых лекарственных средств, одновременно или по существу одновременно в первый день цикла. Лечение по одной терапевтической схеме также включает, например, один цикл продолжительностью три недели, в котором введение препарата А начинают первым, а введение препарата В начинают через неделю; однако оба препарата вводятся по существу одновременно в одном цикле.
[0124]
Терапевтическая схема соединения 1 или его соли и пембролизумаба настоящего описания может включать не только соединение 1 или его соль и пембролизумаб, но также и другие лекарственные средства.
[0125]
Форма введения противоопухолевого агента настоящего описания не ограничена и может быть соответствующим образом выбрана в зависимости от терапевтической цели. Ее конкретные примеры включают пероральные препараты (таблетки, таблетки с покрытием, порошки, гранулы, капсулы, растворы и т.д.), инъекции, суппозитории, пластыри, мази и подобные. Для соединения 1 или его соли предпочтительными являются пероральные препараты. Для пембролизумаба могут использоваться вышеупомянутые формы введения, и инъекции являются предпочтительными.
[0126]
Согласно противоопухолевому агенту настоящего описания, пембролизумаб и соединение 1 или его соль, которые являются активными ингредиентами, могут использоваться непосредственно в качестве противоопухолевого агента. В зависимости от формы введения можно использовать фармацевтически приемлемый носитель для приготовления композиции общеизвестным способом. Примеры таких носителей включают различные носители, обычно используемые в обычных лекарственных средства, такие как эксципиенты, связующие агенты, разрыхлители, смазывающие вещества, разбавители, солюбилизирующие агенты, суспендирующие агенты, изотонирующие агенты, регуляторы pH, буферы, стабилизаторы, красители, ароматизаторы и подобные.
[0127]
Противоопухолевый агент настоящего описания может быть составлен в виде множества дозированных форм или может быть составлен в виде единой дозированной формы на основе формы введения и схемы введения каждого активного ингредиента. Кроме того, составы могут производиться и продаваться в одной упаковке, подходящей для комбинированного введения, или составы могут производиться и продаваться в отдельных упаковках. То же самое относится к вариантам осуществления фармацевтической композиции. Соответственно, «фармацевтическая композиция, содержащая пембролизумаб и соединение 1 или его соль в качестве активных ингредиентов» включает фармацевтическую композицию, полученную путем раздельного составления активных ингредиентов во множестве дозированных форм, и фармацевтическую композицию, полученную путем составления активных ингредиентов в виде единой дозированной формы. Фармацевтическая композиция, полученная путем раздельного составления активных ингредиентов во множестве дозированных форм, включает фармацевтическую композицию, полученную составлением составов в единой упаковке, подходящей для комбинированного введения, и фармацевтическую композицию, полученную составлением составов в отдельных упаковках.
[0128]
Настоящее описание относится к набору препарата, содержащему противоопухолевый агент, включающему соединение 1 или его соль, и инструкцию по применению, в которой указано, что соединение 1 или его соль вводят онкологическим больным в комбинации с пембролизумабом. В «руководстве по применению», используемом в настоящем документе, может устанавливать вышеупомянутую дозу. Независимо от того, является ли она юридически обязательной, инструкция, которая рекомендует вышеупомянутые дозы, является предпочтительной. Конкретные примеры включают в себя вкладыши в упаковку, буклеты и подобные. Набором препарата, содержащим руководство по применению, может быть такой, в котором инструкция по применению напечатана или приложена к упаковке препарата набора, или может быть такой, в котором инструкция по применению вложена вместе с противоопухолевым агентом в упаковку набора препарата.
[0129]
Примеры способов определения механизма действия ингибитором FGFR и демонстрации резистентности к ингибиторам иммунной контрольной точки включают, но не ограничены ими, способ исследования модулирования иммунной микросреды опухоли (NPL 13).
[0130]
Микросреда рака важна для эффективности ингибиторов иммунной контрольной точки, и известно, что опухолеассоциированные фибробласты (CAF) играют важную роль. FGF представляют собой факторы, регулирующие рост клеток фибробластов, и их рецепторы, FGFR, представляют собой молекулы, которые получают сигналы от FGF в клетках и способствуют росту клеток. Миелоидные супрессорные клетки (MDSC) представляют собой незрелые миелоидные клетки, которые увеличиваются в опухолевых тканях, лимфатических узлах и периферической крови при патологических состояниях и, как известно, обладают сильной иммунодепрессивной активностью.
[0131]
Было описано, что MDSC может применяться в качестве прогностического маркера эффективности ингибиторов иммунной контрольной точки и может играть роль в резистентности пациента к ингибиторам иммунной контрольной точки (NPL 14).
[0132]
В настоящем описании, резистентность (также именуемая толерантностью или непреодолимой способностью) к ингибиторам иммунной контрольной точки включает состояния субъектов, у которых терапевтический эффект не ожидается после введения ингибитора иммунной контрольной точки, и у которых прогрессирование заболевания подтверждается, по меньшей мере, одной клинической оценкой; и состояния субъектов, при которых нельзя ожидать терапевтического действия ингибиторов иммунной контрольной точки, хотя субъект не имеет непереносимости ингибитора иммунной контрольной точки, рецидива после введения ингибиторов иммунной контрольной точки или опыта лечения ингибиторами иммунной контрольной точки. В одном варианте осуществления также рассматривается, что в фармакологических тестах не демонстрируются эффективные действия ингибиторов иммунной контрольной точки, такие как ответы клеточных линий, которые не считаются проявляющими действие. Резистентность включает естественную резистентность, при которой противоопухолевый агент не проявляет эффективности с начала лечения, и приобретенную резистентность, при которой противоопухолевый агент, который первоначально был эффективен, становится неэффективным по мере продолжения лечения и приводит к обострению рака. В настоящем описании резистентность включает в себя как естественную, так и приобретенную резистентность.
[0133]
В настоящем описании рефрактерность к ингибиторам иммунной контрольной точки означает, что ингибитор иммунной контрольной точки становится неэффективным и не демонстрирует действие после введения ингибитора иммунной контрольной точки. Полагает, что одной из причин рефрактерности является резистентность.
[0134]
Противоопухолевый агент настоящего описания может применяться для лечения рака. «Противоопухолевое действие» по отношению к онкологическому пациенту, который получает лечение по терапевтической схеме, такой как комбинированная терапия, описанная в настоящем описании, означает, по меньшей мере, одну оценку из, например, PFS (выживание без прогрессирования), DCR (частота контроля заболевания), DOR (длительность ответа), OS (общая выживаемость), ORR (частота объективных ответов), DCR (частота контроля заболевания), TTR (время до ответа), PRO (результаты лечения по оценке пациента) и подобные. В одном варианте осуществления, оценка опухоли для комбинированной терапии, описанная в настоящем описании для солидных опухолей, основана на критериях RECIST 1.1 criteria (Response Evaluation Criteria in Solid Tumors) и противоопухолевое действие описывается как SD (стабильное заболевание), PR (частичный ответ), CR (полный ответ) и PD (прогрессирующее заболевание). Оценка опухоли при опухолях мозга может проводиться стандартной МРТ опухоли мозга, включая МРТ до и после улучшения, с применением Gd-MRI (гадолиний (Gd)) хелатного контрастного агента.
Примеры
[0135]
Настоящее раскрытие более подробно поясняется ниже со ссылкой на Примеры и Эталонный пример; тем не менее, настоящее описание не ограничено этими Примерами, и многие модификации могут быть сделаны специалистом в данной области техники в рамках технической идеи настоящего описания.
[0136]
Пример 1: Клиническое испытание пациентов с раком, резистентным к противораковой иммунотерапии (например, немелкоклеточным раком легких, раком пищевода и раком уротелия) комбинированным применением применение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли и пембролизумаба.
В этом исследовании оценивают эффективность и безопасность комбинированного применения соединения 1 или его соли и пембролизумаба у сверхэкспрессирующих FGFR онкологических пациентов (с, например, немелкоклеточным раком легких, раком пищевода или раком уротелия), на основе клинического испытания, зарегистрированного как JapicCTI-195063 Japan Pharmaceutical Information Center. Более конкретно, введение проводят в течение заранее определенного периода времени (например, 24 недели). Соединение 1 или его соль перорально вводят пациента в разных дозах (например, 20 мг) в течение 21 дня, и пембролизумаб (например, 200 мг на введение) вводят внутривенной капельной инфузией каждые три недели (каждый 21 день). Один цикл составляет 21 день и его повторяют. В некоторых случаях, плацебо может применяться в качестве контроля, и соединение 1 или его соль и/или пембролизумаб может дополнительно вводиться другим пациентам. Более того, комбинированное введение соединения 1 или его соли может проводиться у пациентов, которые имеют опыт лечения пембролизумабом.
[0137]
Комбинированное применение соединения 1 или его соли и пембролизумаба может предоставлять терапевтические эффекты, которых нельзя ожидать от монотерапий по отдельности с использованием каждого из них. Например, в варианте осуществления настоящего описания, может быть обнаружено, что это комбинированное использование имеет более высокую степень воздействия, чем, по меньшей мере, один из результатов измерения лечения любым из них. Более того, например, в варианте осуществления настоящего описания, синергетический эффект может быть получен путем комбинированного применения соединения 1 или его соли и пембролизумаба.
[0138]
Комбинированное применение соединения 1 или его соли и пембролизумаба может быть более эффективным, чем отдельное применение любого из них, согласно, по меньшей мере, одному из следующих результатов измерения: пониженное количество раковых клеток, регрессия размера опухоли, пониженная скорость инфильтрации раковых клеток в периферические органы, пониженная скорость метастазирования опухоли или роста опухоли, частота объективных ответов и увеличенное выживание без прогрессирования или общее выживание.
[0139]
Пример 2: Влияние иммунитета в опухоли в модели подкожно имплантированных мыши клеток рака груди 4T1
Клеточную линию рака груди мышей 4T1 подкожно имплантируют 6-недельным самцам мышей BALB/cAJcl. День имплантации клеток устанавливают как день 0, и соединение 1 перорально вводят ежедневно, начиная со следующего дня (день 1) в течение 14 дней в дозе 15 мг/кг/сутки. В день после последнего введения (день 15), фракции лимфоцитов выделяют из опухоли, селезенки и периферической крови, и миелоидные супрессорные клетки (MDSC) (CD11b+/Gr-1+ клетки), CD4-положительные T-клетки и CD8-положительные T-клетки измеряют с применением клеточного сортера. Более того, получение модели подкожно имплантированных клеток рака груди мыши 4T1, введение лекарственного средства и измерение каждой клетки проводят по той же методике, как описано выше, за исключением того, что меняют дозу соединения 1-30 мг/кг/сутки. В качестве контроля проводят ту же операцию, как описано выше, за исключением того, что соединение 1 не вводят. На фиг. 1 показаны результаты.
[0140]
Введение соединения 1 в любой дозе дает значительное снижение MDSC в фракциях лимфоцитов селезенки (t-тест Стьюдента, P<0,01), по сравнению с контролем без введения лекарственного средства. MDSC во фракциях лимфоцитов периферической крови имеют тенденцию к снижению дозозависимым образом по сравнению с контролем. CD4-положительные T-клетки во фракциях лимфоцитов периферической крови и CD8-поожительные T-клетки во фракциях лимфоцитов селезенки и фракциях лимфоцитов периферической крови имеют тенденцию к повышению дозозависимым образом по сравнению с контролем.
[0141]
Эти результаты подтвердили ингибирующее действие соединения 1 на MDSC в моделях in vivo и, таким образом, позволили предположить возможность того, что соединение 1 оказывает противоопухолевое действие через механизм иммунодепрессии. Кроме того, поскольку количество CD4-положительных Т-клеток и CD8-положительных Т-клеток увеличивалось из-за введения соединения 1, была подтверждена активация соединением 1 иммунной активности у мышей, несущих рак. Приведенные выше результаты позволяют предположить, что комбинированное применение соединения 1 или его соли с ингибитором иммунной контрольной точки усиливает противоопухолевый эффект.
[0142]
Хотя клеточные линии рака груди мышей 4T1, применяемые в примере 2, являются клетками рака груди, которые не имеют генетической аберрации FGFR, введение соединения 1 подтверждает ингибирующее действие на MDSC, а также повышенные CD4-положительные T-клетки и CD8-положительные Т-клетки, показывая, что соединение 1 обладает противоопухолевым действием через механизм иммунодепрессии. Более того, введение вофатамаба, который является анти-FGFR3 антителом, пациентам с раком уротелия, вызывает изменение рака с «холодного» состояния (низкой чувствительности к ингибиторам иммунной контрольной точки) на «горячее» состояние (высокой чувствительности к ингибиторам иммунной контрольной точки); таким образом, ответ при комбинированном применении с пембролизумабом наблюдается даже у пациентов без генетической аберрации FGFR (W. Choi et al., presentation at AACR Special Conference on Bladder Cancer: Transforming Field, May 18-21, 2019, Denver, USA).
Группа изобретений относится к области медицины и фармацевтики и может быть использована для лечения рака с резистентностью к ингибиторам иммунной контрольной точки. Предложено применение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли в комбинированной терапии с пембролизумабом, а также способ лечения рака с резистентностью к ингибиторам иммунной контрольной точки, включающий введение указанной комбинации. Группа изобретений обеспечивает лечение рака с резистентностью к ингибиторам иммунной контрольной точки за счет увеличения Т-клеток и усиление эффекта пембролизумаба за счет снижения количества миелоидных супрессорных клеток(MDSC). 6 н.п. ф-лы, 1 ил., 2 пр.
1. Применение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его аддитивной соли с неорганической кислотой, органической кислотой, щелочным металлом, щелочноземельным металлом или органическим основанием в комбинированной терапии с пембролизумабом для лечения рака с резистентностью к ингибиторам иммунной контрольной точки.
2. Применение пембролизумаба в комбинированной терапии с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его аддитивной солью с неорганической кислотой, органической кислотой, щелочным металлом, щелочноземельным металлом или органическим основанием для лечения рака с резистентностью к ингибиторам иммунной контрольной точки.
3. Применение пембролизумаба и (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его аддитивной соли с неорганической кислотой, органической кислотой, щелочным металлом, щелочноземельным металлом или органическим основанием для лечения рака с резистентностью к ингибиторам иммунной контрольной точки.
4. Применение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его аддитивной соли с неорганической кислотой, органической кислотой, щелочным металлом, щелочноземельным металлом или органическим основанием для лечения рака с резистентностью к ингибиторам иммунной контрольной точки комбинированной терапией с пембролизумабом.
5. Применение пембролизумаба для лечения рака с резистентностью к ингибиторам иммунной контрольной точки комбинированной терапией с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его аддитивной солью с неорганической кислотой, органической кислотой, щелочным металлом, щелочноземельным металлом или органическим основанием.
6. Способ лечения рака с резистентностью к ингибиторам иммунной контрольной точки, где способ содержит введение терапевтически эффективного количества (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его аддитивной соли с неорганической кислотой, органической кислотой, щелочным металлом, щелочноземельным металлом или органическим основанием и терапевтически эффективного количества пембролизумаба человеку, нуждающемуся в этом.
| AU 2017226389 A2, 08.11.2018 | |||
| WO 2016161239 A1, 06.10.2016 | |||
| 3,5-ДИЗАМЕЩЕННОЕ АЛКИНИЛБЕНЗОЛЬНОЕ СОЕДИНЕНИЕ И ЕГО СОЛЬ | 2013 |
|
RU2576384C1 |
| AU 2017226389 A2, 08.11.2018. | |||
Авторы
Даты
2024-07-01—Публикация
2020-02-28—Подача