Изобретение относится к области электрохимических производств и каталитической химии, в частности к способу получения 2-этилгексаноата хрома(III) (2-ЭГХ) состава Cr(2-EH)3, где 2-EH - кислотный остаток 2-этилгексановой кислоты, который может найти применение в процессе каталитической тримеризации этилена и получения гексена-1, который используется в качестве сомономера при производстве различных марок полиэтилена (линейного полиэтилена, полиэтилена низкого давления), а также для получения смазочных материалов и присадок к ним, пластификаторов, поверхностно-активных веществ.
Далее в тексте заявителем приведены термины, которые необходимы для облегчения однозначного понимания сущности заявленных материалов и исключения противоречий и/или спорных трактовок при выполнении экспертизы по существу.
Электрохимическая реакция - химический процесс, протекающий с участием электрического тока.
Электролиз - процесс проведения химической реакции при использовании электрического тока.
Электросинтез - процесс проведения химической реакции при использовании электрического тока, направленный на количественное получение химических соединений.
Электролит - рабочий раствор при проведении процесса электролиза, в котором происходит электрохимическая реакция.
Электролизер - устройство для проведения процесса электролиза.
Фоновая соль - вещество, добавляемое в раствор для обеспечения электропроводности рабочего раствора при проведении электролиза.
Анод - электрод, имеющий положительный потенциал.
Катод - электрод, имеющий отрицательный потенциал.
Рабочий электрод - электрод, на котором протекает целевой процесс.
Вспомогательный электрод - электрод, на котором протекает электрохимический процесс, противоположный по знаку потенциала рабочему электроду.
Металлоорганические и комплексные соединения хрома широко используются в процессах олигомеризации и полимеризации этилена. Например, в промышленных процессах полимеризации этилена и пропилена в качестве прекатализаторов (веществ, приобретающих каталитические свойства после активации) используются комплексы хрома с органическими лигандами [K.A. Alferov, G.P. Belov, Y. Meng. Chromium catalysts for selective ethylene oligomerization to 1-hexene and 1-octene: Recent results. Applied Catalysis A, General. 2017. 542. 71-124; T.M. Zilbershtein, V.A. Kardash, V.V. Suvorova, A.K. Golovko. Decene formation in ethylene trimerization reaction catalyzed byCr-pyrrole system. Applied Catalysis A: General. 2014. 475. 371-378].
Известны промышленные процессы гомогенной олигомеризации и тримеризации этилена, использующие хромсодержащие прекатализаторы. Например, в процессе олигомеризации этилена фирм SABIC Global Technologies B.V. [EP 3880360 B1, 22.09.2021], Lotte Chemical Corporation [US 10981155 B2, 20.04.2021; US10981154B2, 20.04.2021], Exxonmobil Chemical Company [US 2008/0188633 A1, 20.08.2009], Sumitomo Chemical Company, Limited [US 6521806 B1, 18.02.2003], Chevron Phillips Chemical Company LP [US6455648B1, 24.09.2002; US 5814575 A, 29.09.1998; US 5763723 A, 09.06.1998; US5382738A, 17.01.1995; US 5376612 A, 27.12.1994], Union Carbide Corporation [US 4777315 A, 11.10.1988], Aerojet-General Corporation [US 3968135 A, 06.07.1976].
Известен способ химического получения карбоксилатов хрома, основанный на обменной реакции в двухфазной водно-органической системе [US3932285A, 13.01.1976]. Однако полученные таким образом карбоксилаты хрома представляют частично гидратированные комплексы, активность которых в каталитическом процессе тримеризации авторами не проверялась.
Известен способ получения карбоксилатов хрома, включающий кипячение гидратированной соли хрома (III) с избытком карбоновой кислоты [R.С. Mehrotra, R. Bohra. Metal carboxylates. Academic Press Inc. (London) Ltd. 1983. 396 pp.; US3968135A, 06.07.1976]. Помимо длительности процесса данный метод характеризуется неполнотой превращения и наличием в продукте непрореагировавшей кислоты и следов воды.
Известен способ получения 2-этилгексаноата хрома, представляющий реакцию безводных хлорида хрома и 2-этилгексаноата натрия в среде тетрагидрофурана. [KR 102024402 B1, 23.09.2019; US 2013150605 A1, 13.06.2013]. Процесс дает продукт высокого качества, но характеризуется использованием больших количеств легковоспламеняющегося растворителя и необходимостью отделения непрореагировавшего карбоксилата натрия.
Известен способ синтеза 2-этилгексаноата хрома, основанный на механохимической активации смеси твердых безводных хлорида хрома (III) и 2-этилгексаноата натрия с последующей термообработкой и экстракцией реакционной массы углеводородным растворителем [RU 2553995 C1, 20.06.2015]. Процесс привлекателен высоким качеством продукта и отсутствием процессов отгонки растворителей. К недостаткам метода относится использование для его реализации дорогого и материалоемкого смесительного оборудования, способного работать (включая стадии загрузки и выгрузки) в условиях сухой атмосферы.
Недостатком указанных выше способов получения карбоксилатов является использование хлорида хрома, являющегося гигроскопичным и подверженного частичному гидролизу, что приводит в конечном итоге к образованию гидратированных карбоксилатов переменного состава. При этом в процессе синтеза выделяется хлороводород, негативно воздействующий на окружающую среду.
Технической проблемой, на решение которой направлено изобретение, является расширение арсенала способов получения 2-этилгексаноата хрома (III), новым, свободным от недостатков аналогов способом, позволяющим удешевить производство целевого продукта за счет снижения времени процесса и уменьшения энергопотребления, требуемого для его протекания по сравнению с химическими обменными реакциями, а также упрощения используемого оборудования по сравнению с процессом механохимической активации.
Технический результат заявленного технического решения состоит в реализации указанного назначения, в возможности проведения высокоэффективного синтеза 2-этилгексаноата хрома за счет использования растворяемого во время электросинтеза хромового анода, являющегося источником ионов хрома (III). Анодно генерируемые ионы Cr3+ способны взаимодействовать с молекулами 2-этилгексановой кислоты или ее кислотным остатком в растворе с образованием 2-этилгексаноата хрома.
Техническая проблема решается, и технический результат достигается заявляемым электрохимическим способом получения 2-этилгексаноата хрома (III) формулы
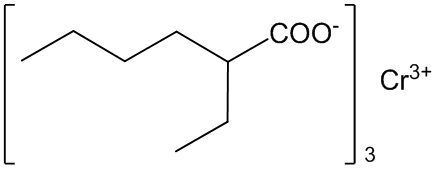
включающим проведение электролиза раствора 2-этилгексановой кислоты в ацетонитриле в бездиафрагменном электролизере в присутствии фоновой соли и с использованием электрохимически «растворимого» хромового анода.
Электролиз осуществляют в неразделенной (без разделения анодного и катодного пространств) электрохимической ячейке с катодом из платины, графита, никеля или нержавеющей стали и электрохимически «растворимого» анода из металлического хрома. Основной катодной реакцией является выделение водорода, поэтому в качестве катода имеет смысл выбирать материал с низким перенапряжением выделения водорода, например, нержавеющую сталь, никель или платину. Влияние площади катода на электрохимический процесс ограничивается в первую очередь изменением электропроводности системы, в промышленном электролизере следует стремиться к ее максимальному увеличению.
В качестве анода может использоваться металлический хром в виде пластины, стержня, либо насыпной электрод, состоящий из чешуйчатого электрохимически рафинированного хрома, помещенного на дно электролизера с подведенным контактом из графита, стеклоуглерода или платины.
Процесс осуществляют без контроля потенциала хромового анода при анодной плотности тока 1.0-50.0 мА×см-2, температуре электролита 20-60°С и концентрации 2-этилгексановой кислоты 0.1-0.15 M.
Количество взятого для проведения электрохимического процесса ацетонитрила определяется растворимостью исходных соединений (фоновой соли, 2-этилгексановой кислоты) и продукта электролиза (2-ЭГХ). Количество ацетонитрила определяется проведением процесса в гомогенных условиях и отсутствием в реакционной смеси твердой фазы, за исключением металлических частиц хрома, взятых в качестве электрохимически «растворимого» анода. Использование разбавленных растворов и большое количество ацетонитрила, относительно взятых в реакцию реагентов, также не является желательным, так как приводит к снижению общей электропроводности системы, падению плотности тока, росту приложенного к электрохимической ячейке напряжения и дополнительным энергетическим затратам, расходуемым на нагрев реакционной смеси в ходе электролиза и при упаривании растворителя на стадии выделения целевого продукта.
Фоновую соль используют предпочтительно в диапазоне концентраций от 0.01 до 0.1 М, так как при меньшей концентрации электропроводность рабочего раствора может быть недостаточной для проведения электролиза, а при концентрациях фоновой соли более 0.1 М заметного изменения электропроводности раствора не происходит и имеет место дополнительный расход фоновой соли, что нецелесообразно с точки зрения экономической составляющей разработанного электрохимического процесса.
Исходную 2-этилгексановую кислоту используют предпочтительно в диапазоне концентраций 0.1-0.15 М, так как при бóльших концентрациях возможно снижение электропроводности системы за счет увеличения доли алифатической составляющей, что приводит к ухудшению показателей электрохимического процесса (снижение плотности тока, повышение электрохимического потенциала на электродах, протекание побочных реакций разложения растворителя, 2-этилгексановой кислоты и фоновой соли) и снижению выходов целевого продукта (2-ЭГХ).
Преимущественно электролиз проводят в интервале температур 20-60°С, так как при температурах ниже 20°С имеет место низкая растворимость фоновой соли и образующегося продукта электросинтеза, что приводит к образованию осадка. Использование более высоких температур (более 60°С) приводит к интенсивному испарению растворителя и увеличению суммарного расхода энергии, затрачиваемой на обогрев системы.
Интервал изменения анодной плотности тока 1.0-50.0 мА×см-2 обусловлен возможностью протекания побочных реакций, наподобие конденсации по Кольбе, при более высоких плотностях тока, приводя к разложению исходного реагента - 2-этилгексановой кислоты и протеканию иных неустановленных процессов, характеризующихся образованием продуктов неустановленной природы и снижению выхода целевого продукта. Проведение электрохимического процесса при плотностях тока менее 1.0 мА×см-2 приводит к увеличению времени электролиза и значительно снижает скорость образования целевого продукта (2-ЭГХ).
В качестве фоновой соли используют соль, содержащую катион на основе лития, третичного или четвертичного аммония и анион галогенидной природы, например, триэтиламмония хлорид, тетрабутиламмония бромид, лития хлорид. Основными требованиями, предъявляемым к фоновой соли, является хорошая растворимость в органических растворителях (в данном случае в ацетонитриле), возможность ее легкого обезвоживания (не должна разлагаться при нагревании), коммерческая доступность и не дороговизна. В качестве анионной части фоновой соли рассматриваются анионы галогенидной природы, такие как хлориды и бромиды. Первые (хлориды) имеют преимущество, связанное со стоимостью их производных, которые намного дешевле соответствующих бромидсодержащих производных. Исходя из вышеперечисленного, при реализации данного электрохимического процесса в качестве фоновой соли могут быть использованы: лития хлорид (растворимость хлоридов лития в органических растворителях намного выше, чем для производных на основе ионов натрия и калия), триэтиламмония хлорид (может быть легко осушен в результате возгонки) и тетрабутиламмоний бромид (может быть легко обезвожен при расплавлении, Тпл 104℃). Использование в качестве фоновой соли других производных, с анионами отличными от хлора и брома, приводит к их разложению в условиях электросинтеза.
Заявленный способ в целом осуществляют следующим образом.
В качестве электролизера используют сосуд круглой или цилиндрической формы, снабженный жидкостной рубашкой и термостатом для поддержания постоянной температуры, системой подачи сухого азота и механической мешалкой. В качестве анода (электрода с положительной полярностью) используют металлический хром в компактном или грубодисперсном виде, например, пластины, стержень, куски, чешуйки, порошок. В случае дисперсного хрома ток к аноду подводится с помощью токоподвода, например, из платины, графита, стеклоуглерода. В качестве катода используется материал с низким перенапряжением выделения водорода, например, платина, никель, нержавеющая сталь в виде цилиндрического электрода или электрода иной геометрической формы. В электролизер помещают ацетонитрил, 2-этилгексановую кислоту и фоновую соль, например, галогенид тетраалкиламмония, или галогенид триалкиламмония, или галогенид лития. Включают перемешивание, поток инертного газа (азота) и термостат, доводят температуру до заданного значения. Через реактор пропускают электрический ток (анодная плотность тока 1.0-50.0 мА×см-2) в количестве, соответствующем теоретическому (из расчета 1F, где F - постоянная Фарадея, равная 96 485 Кл×моль-1 или 26.8 мА×час×моль-1, относительно взятой в реакцию 2-этилгексановой кислоты). После окончания электролиза электролит переносят в роторный испаритель и отгоняют растворитель (ацетонитрил) при пониженном или атмосферном давлении. Полученную твердую массу растворяют в горячем гексане или гептане и охлаждают до комнатной температуры. Выпавший осадок фоновой соли удаляют фильтрованием. Полученный фильтрат переносят в роторный испаритель, где путем отгонки растворителя выделяют твердый 2-этилгексаноат хрома (III).
Получаемый 2-этилгексаноат хрома (III) представляет собой аморфную твердую массу темно-зеленого цвета, растворимую в малополярных органических растворителях (любые парафиновые и ароматические углеводороды - гексан, гептан, бензол, толуол, циклогексан, этилбензол, ксилолы, или их смесь).
Характеристики получаемого 2-этилгексаноата хрома (III) (2-ЭГХ):
ИК-спектроскопия (KBr, см-1): 2960 (сл.), 2936 (сл.), 2860 (сл.), 1715 (сл.), 1610 (ср.), 1530 (с.), 1460 (ср.), 1420 (с.), 1320 (сл.), 1113 (сл.), 915 (ср.), 800 (сл.), 760 (сл.), 730 (сл.), 660 (сл.), 600 (сл.), 550 (сл.).
Элементный анализ. Рассчитано для C24H45CrO6 (MW: 481.61 г моль-1): C 59.9; H 9.4; Cr 10.8; O 19.9%. Найдено: C 60.4; H 10.1; Cr 9.1%.
Масс-спектр ИЭР, m/z рассчитано для C24H45CrO6 (M 481.26): [(2-EH)3Cr - 2-EH]+ 338.15, найдено 338.15.
Заявленный способ синтеза хромсодержащего прекатализатора процесса тримеризации этилена - 2-этилгексаноат хрома (III) позволяет использовать промышленно выпускаемые и коммерчески доступные реагенты: ацетонитрил и 2-этилгексановую кислоту категории ХЧ без их дополнительной очистки, за исключением удаления следов воды, а также не предъявляет повышенные требования к содержанию примесей в используемом металлическом хроме. Возможно использование хромового электрода с содержанием основного вещества до 99 % масс. (в соответствии с паспортом производителя).
При осуществлении заявляемого способа были использованы следующие средства, включая реагенты, растворители и оборудование:
- ацетонитрил ч.д.а., например, производства АО «ЭКОС-1»,
- кислота 2-этилгексановая 99%, например, производства Alfa Aesar,
- хлорид лития х.ч., например, производства АО «ЛенРеактив»,
- хлорид триэтиламмония, например, производства АО «ЛенРеактив»,
- бромид тетрабутиламмония 99%, например, производства Acros Organics,
- азот марки 6.0, например, производства ООО «НИИ КМ»,
- гексан, например, по ГОСТ 4517-2016,
- гептан, например, по ГОСТ 25828-83,
- хром электролитический ЭРХ-1 в виде крупнодисперсного порошка 0,8-1мм, например, ТУ 14-22-164-2002,
- хром металлический, например, по ГОСТ 5905-2004,
- никель металлический в виде пластины, например, по ГОСТ 849-2018,
- нержавеющая сталь, например, марки 12Х18Н12Т, по ГОСТ 5632-2014,
- платина металлическая, например, по ГОСТ 12341-81,
- ИК-Фурье спектрометр ФТ-801,
- масс-спектрометр с ионной ловушкой AmazonX (Bruker Daltonic GmbH, Германия),
- элементный анализ проводился на высокотемпературном анализаторе Elementar vario MACRO cube (Германия),
- электролизы проводили при использовании источника питания АКИП-1137-200-1.
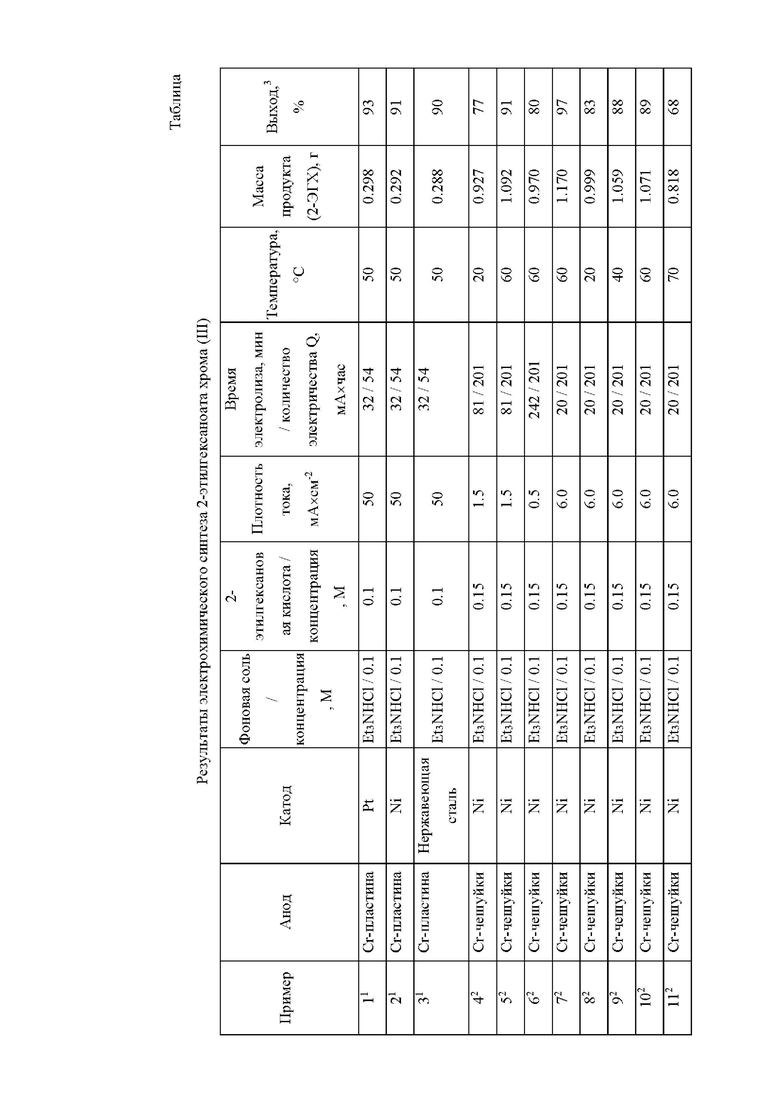
Изобретение иллюстрируется примерами конкретного выполнения. Для удобства восприятия условия электрохимических синтезов 2-этилгексаноата хрома (III) (2-ЭГХ) приведены в таблице, где:
1условия электросинтеза: растворитель - ацетонитрил; объем электролита - 20 мл; анод - металлический хром (пластина, рабочая площадь S = 2 см2, две стороны); катод - платина, никель, нержавеющая сталь (рабочая площадь S = 4 см2).
2условия электросинтеза: растворитель - ацетонитрил; объем электролита - 50 мл; анод - насыпной хромовый электрод (Cr-чешуйки) массой 20 г и площадью поверхности 100 см2; катод - пластина из платины, никеля или нержавеющей стали (рабочая площадь S = 60 см2).
3по взятой в реакцию 2-этилгексановой кислоте.
Пример 1.
Синтез осуществляют в электролизере в виде трехгорлой стеклянной колбы объемом 50 мл с компактным хромовым анодом рабочей площадью 1 см2, выполненным из пластинки металлического хрома толщиной 0.5 мм и сторонами 1 мм (общая площадь 2 см2, две стороны), и платиновой пластиной (общая площадь 4 см2, две стороны) в качестве катода. Рабочий раствор для электролиза готовят растворением в 20 мл ацетонитрила 0.32 мл (0.289 г, 2 ммоль) 2-этилгексановой кислоты концентрации 0.1 М и 0.27 г (2 ммоль) хлорида триэтиламмония концентрации 0.1 М. Полученный раствор подвергают электролизу при анодной плотности тока 50.0 мА×см-2, пропуская через раствор ток силой 100 мА в течение 32 мин (количество электричества Q = 54 мА×час рассчитывается исходя из постоянной Фарадея F равной 96 485 Кл×моль-1 или 26.8 мА×час×моль-1) при температуре 50°С. После окончания электролиза реакционную смесь упаривают на роторном испарителе и экстрагируют продукты электролиза из полученного остатка гексаном при температуре 50°С (3 × 10 мл), а выпавший осадок хлорида триэтиламмония отфильтровывают на фильтре Шотта (пор. 100). Далее из полученного экстракта полностью отгоняют растворитель и сушат полученный остаток при пониженном давлении (0.13 атм) с постепенным повышением температуры от комнатной до 160°С, получая густую массу темно-зеленого цвета. Дальнейшая осушка полученного остатка позволяет получить 2-этилгексаноат хрома (III) (2-ЭГХ) в количестве 0.298 г (выход 93%).
Пример 2.
Отличается от Примера 1 использованием катода из никеля (пластина, общая площадь 4 см2, две стороны). В результате данного процесса получено 0.292 г (выход 91%) 2-этилгексаноата хрома (III).
Пример 3.
Отличается от Примера 1 использованием катода из нержавеющей стали (пластина, общая площадь 4 см2, две стороны). В результате данного процесса получено 0.288 г (выход 90%) 2-этилгексаноата хрома (III).
Пример 4.
Пример 4 выполняют аналогично примеру 1, отличается тем, что электросинтез осуществляют в электролизере объемом 100 мл, снабженной водяной рубашкой для подключения термостата, а роль анода выполняет хром марки ЭРХ-1 в виде чешуек со средним размером 2×20 мм и толщиной 0.5 мм в количестве 20 г, насыпанный на дно электролизера (диаметр дна 4 см, рабочая площадь хромового анода S = 100 см2). В качестве катода используют электрод из никеля (пластина) рабочей площадью 60 см2. Рабочий раствор для электролиза готовят растворением в 50 мл ацетонитрила 1.2 мл (1.084 г, 7.5 ммоль) 2-этилгексановой кислоты концентрации 0.15 М и 0.68 г (5 ммоль) хлорида триэтиламмония концентрации 0.1 М. Полученный раствор подвергают электролизу при силе тока 150 мА (анодная плотность тока 1.5 мА×см-2) при температуре 20°С в течение 81 мин (Q = 201 мА×час). В результате данного процесса получено 0.927 г (выход 77 %) 2-этилгексаноата хрома (III).
Пример 5.
Отличается от Примера 4 проведением электролиза при температуре 60°С. В ходе электролиза не происходит образования твердых продуктов электросинтеза и выпадения осадка. Получено 1.092 г (выход 90 %) 2-этилгексаноата хрома (III).
Пример 6.
Отличается от Примера 5 проведением электролиза при пропускании тока силой 50 мА (плотность тока 0.5 мА×см-2) в течение 242 мин. Получено 0.970 г (выход 80 %) 2-этилгексаноата хрома (III).
Пример 7.
Отличается от Примера 5 использованием силы тока равной 600 мА (плотность тока 6.0 мА×см-2) и временем электролиза 20 мин. Получено 1.170 г (выход 97 %) 2-этилгексаноата хрома (III).
Пример 8.
Отличается от Примера 4 проведением электролиза при силе тока 600 мА (плотность тока 6.0 мА×см-2). В результате данного процесса получено 0.999 г (выход 83%) 2-этилгексаноата хрома (III).
Пример 9.
Отличается от Примера 8 проведением электролиза при температуре 40°С. В результате данного процесса получено 1.059 г (выход 88%) 2-этилгексаноата хрома (III).
Пример 10.
Отличается от Примера 8 проведением электролиза при температуре 60°С. В результате данного процесса получено 1.059 г (выход 88%) 2-этилгексаноата хрома (III).
Пример 11.
Отличается от Примера 8 проведением электролиза при температуре 70°С. В результате данного процесса получено 0.818 г (выход 68%) 2-этилгексаноата хрома (III).
Пример 12.
Отличается от Примера 5 пропусканием через рабочий раствор количества электричества, в 1.5 раза превышающее теоретически рассчитанное (Q = 302 мА×час) при увеличении времени электролиза до 122 мин. Получено 1.130 г (выход 93 %) 2-этилгексаноата хрома (III).
Пример 13.
Отличается от Примера 4 использованием 0.07 г (1.6 ммоль) хлорида лития концентрации 0.03 М в качестве фоновой соли. Полученный раствор подвергают электролизу при силе тока 100 мА (плотность тока 1.0 мА×см-2) и температуре 50°С. В результате данного процесса получено 0.388 г (выход 32 %) 2-этилгексаноата хрома (III).
Пример 14.
Отличается от Примера 13 использованием плотности тока равной 1.5 мА×см-2 (сила тока 150 мА). В результате данного процесса получено 0.595 г (выход 49 %) 2-этилгексаноата хрома (III).
Пример 15.
Отличается от Примера 4 использованием 1.6 г (5 ммоль) бромида тетрабутиламмония в качестве фоновой соли. Полученный раствор подвергают электролизу при силе тока 150 мА и температуре 50°С. Получено 0.997 г (выход 82 %) 2-этилгексаноата хрома (III).
Пример 16.
Отличается от Примера 5 использованием 0.068 г (0.5 ммоль) хлорида триэтиламмония (концентрация 0.01 М). Полученный раствор подвергают электролизу при силе тока 150 мА и температуре 60°С (время электролиза 81 мин). Получено 1.044 г (выход 87 %) 2-этилгексаноата хрома (III).
Пример 17.
Отличается от Примера 16 приведением процесса электролиза при силе тока 100 мА и временем электролиза 121 мин. Получено 1.071 г (выход 89 %) 2-этилгексаноата хрома (III).
Таким образом, заявлен новый электрохимический способ получения 2-этилгексаноата хрома (III), являющегося прекатализатором процесса тримеризации этилена в гексен-1, расширяющий арсенал способов получения этого соединения, более экологичный за счет отсутствия образования хлороводорода, позволяющий удешевить производство целевого продукта за счет снижения времени процесса и уменьшения энергопотребления, требуемого для его протекания по сравнению с химическими обменными реакциями, а также упрощения используемого оборудования по сравнению с процессом механохимической активации.
Электрохимический способ получения 2-этилгексаноата хрома - прекатализатора тримеризации этилена в гексен-1
Таблица
Результаты электрохимического синтеза 2-этилгексаноата хрома (III)
Электрохимический способ получения 2-этилгексаноата хрома - прекатализатора тримеризации этилена в гексен-1
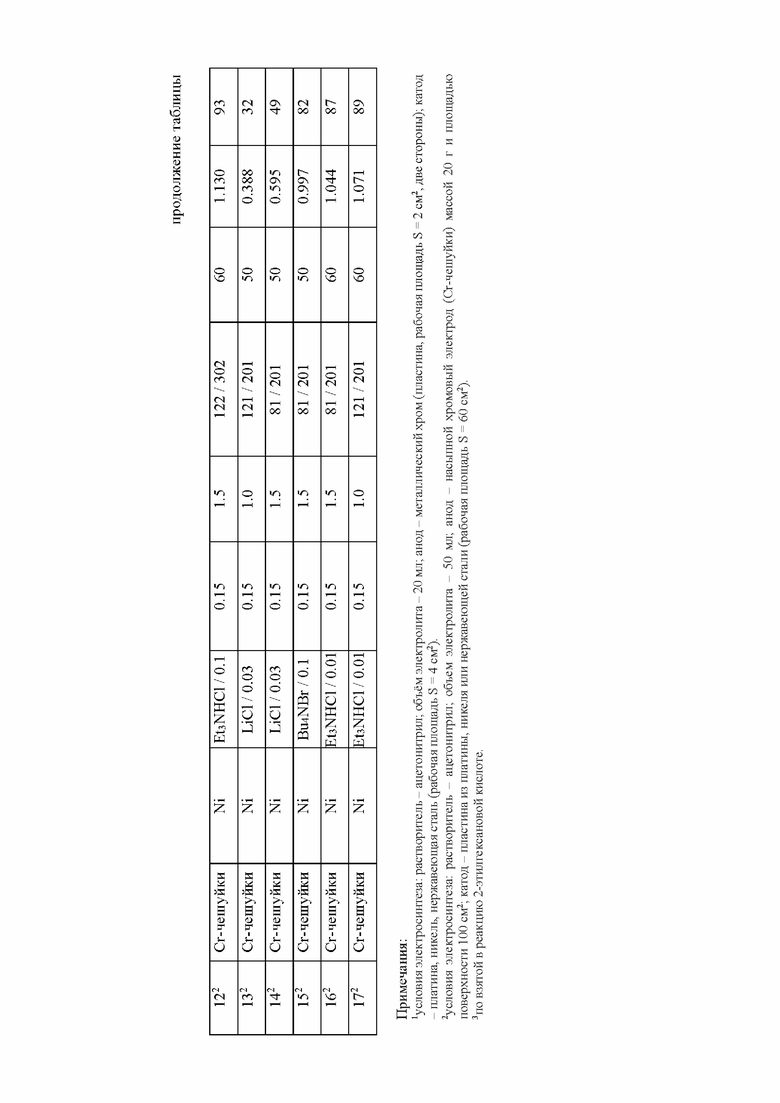
продолжение таблицы
Примечания:
1условия электросинтеза: растворитель - ацетонитрил; объем электролита - 20 мл; анод - металлический хром (пластина, рабочая площадь S = 2 см2, две стороны); катод - платина, никель, нержавеющая сталь (рабочая площадь S = 4 см2).
2условия электросинтеза: растворитель - ацетонитрил; объем электролита - 50 мл; анод - насыпной хромовый электрод (Cr-чешуйки) массой 20 г и площадью поверхности 100 см2; катод - пластина из платины, никеля или нержавеющей стали (рабочая площадь S = 60 см2).
3по взятой в реакцию 2-этилгексановой кислоте.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2-ЭТИЛГЕКСАНОАТОВ МЕТАЛЛОВ | 1996 |
|
RU2127250C1 |
| ЭЛЕКТРОХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ НИКЕЛЬОРГАНИЧЕСКИХ СИГМА-КОМПЛЕКСОВ | 2009 |
|
RU2396375C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ЭТИЛГЕКСАНОАТОВ МЕТАЛЛОВ | 1996 |
|
RU2137751C1 |
| Способ получения оксида хрома /III/ | 1989 |
|
SU1788087A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛОВОГО ЭФИРА П-АМИНОБЕНЗОЙНОЙ КИСЛОТЫ (АНЕСТЕЗИН) | 2006 |
|
RU2302405C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭФИРОВ КИСЛОТ ФОСФОРА | 2001 |
|
RU2199545C1 |
| Способ регенерации хроматных растворов пассивирования | 2018 |
|
RU2691791C1 |
| СПОСОБ РЕГЕНЕРАЦИИ ХРОМАТНОГО РАСТВОРА ПАССИВИРОВАНИЯ ЦИНКА | 2018 |
|
RU2685840C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТИЛАЦЕТОНАТОВ МЕТАЛЛОВ МЕДИ(II) И ЦИНКА(II) | 2005 |
|
RU2281935C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКОКСИДОВ ТИТАНА | 1995 |
|
RU2079503C1 |
Изобретение относится к электрохимическому способу получения 2-этилгексаноата хрома (III), включающему проведение электролиза раствора 2-этилгексановой кислоты в ацетонитриле в бездиафрагменном электролизере в присутствии фоновой соли и с использованием электрохимически «растворимого» хромового анода. Технический результат заключается в возможности проведения высокоэффективного синтеза 2-этилгексаноата хрома (III) состава Cr(2-EH)3, где 2-EH - кислотный остаток 2-этилгексановой кислоты, с выходом до 97% с использованием металлического хрома в качестве исходного реагента. Заявляемый способ расширяет арсенал способов получения 2-этилгексаноата хрома (III), является более экологичным за счет отсутствия образования хлороводорода, позволяет удешевить производство целевого продукта за счет снижения времени процесса и уменьшения энергопотребления, требуемого для его протекания по сравнению с химическими обменными реакциями, а также упрощения используемого оборудования по сравнению с процессом механохимической активации. 9 з.п. ф-лы, 1 табл., 17 пр. 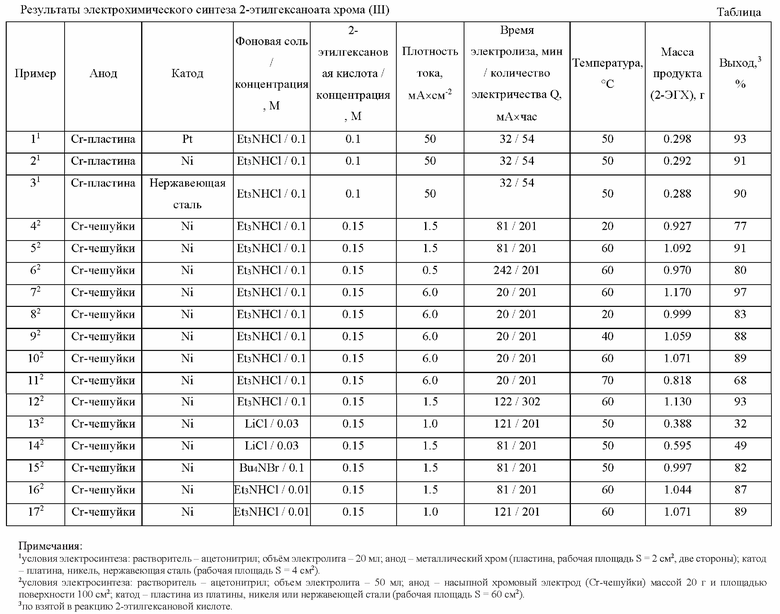
1. Электрохимический способ получения 2-этилгексаноата хрома (III), включающий проведение электролиза раствора 2-этилгексановой кислоты в ацетонитриле в бездиафрагменном электролизере в присутствии фоновой соли и с использованием электрохимически «растворимого» хромового анода.
2. Электрохимический способ по п.1, отличающийся тем, что электрохимически растворимым хромовым анодом является хром в виде пластины, куска или стержня.
3. Электрохимический способ по п.1, отличающийся тем, что электрохимически растворимым хромовым анодом является хром в виде чешуек или порошка.
4. Электрохимический способ по п.3, отличающийся тем, что ток к аноду подводится с помощью токоподвода из платины, графита, стеклоуглерода.
5. Электрохимический способ по п.1, отличающийся тем, что в качестве катода используется материал с низким перенапряжением выделения водорода.
6. Электрохимический способ по п.5, отличающийся тем, что в качестве катода используют катод из платины, графита, никеля или нержавеющей стали.
7. Электрохимический способ по п.1, отличающийся тем, что в качестве фоновой соли используют соль, содержащую катион на основе лития, третичного или четвертичного аммония и анион галогенидной природы.
8. Электрохимический способ по п.1, отличающийся тем, что 2-этилгексановую кислоту используют преимущественно в концентрации 0.1-0.15 М.
9. Электрохимический способ по п.1, отличающийся тем, что фоновую соль используют преимущественно в концентрации 0.01-0.1 М.
10. Электрохимический способ по п.1, отличающийся тем, что электролиз ведут предпочтительно при температуре 20-60°С и катодной плотности тока 1.0-50.0 мА×см-2.
| СПОСОБ ПОЛУЧЕНИЯ КОМПОНЕНТА КАТАЛИТИЧЕСКОЙ СИСТЕМЫ ДЛЯ ОЛИГОМЕРИЗАЦИИ ЭТИЛЕНА, КОМПОНЕНТ КАТАЛИТИЧЕСКОЙ СИСТЕМЫ, КАТАЛИТИЧЕСКАЯ СИСТЕМА ДЛЯ ОЛИГОМЕРИЗАЦИИ ЭТИЛЕНА НА ОСНОВЕ ЭТОГО КОМПОНЕНТА И СПОСОБ ОЛИГОМЕРИЗАЦИИ ЭТИЛЕНА | 2013 |
|
RU2553995C1 |
| US 2013150605 A1, 13.06.2013 | |||
| KR 102024402 B1, 23.09.2019. | |||
Авторы
Даты
2024-07-09—Публикация
2023-12-22—Подача