Изобретение относится к биотехнологии, в частности, к генетической инженерии и иммунологии и может быть использовано в медицине и смежных отраслях для повышения экспрессии белков в культивируемых клетках яичника китайского хомячка.
Одной из глобальных проблем, стоящих перед биотехнологией, является повышение выхода интересующих белков, синтезируемых клетками прокариот и эукариот. Наиболее часто используемой культивируемой клеточной линией являются клетки яичника китайского хомячка (СНО; подлинии S, K1). Несмотря на доступность ряда других клеточных линий млекопитающих, таких как клетки почки детеныша хомячка, клетки мышиной миеломы NS0, эмбриональные клетки почки человека (НЕKK293) и эмбриональные клетки сетчатки глаза человека РегС6, почти 70% всех рекомбинантных терапевтических белков, производятся в клетках яичника китайского хомяка.
Популярность клеток СНО можно объяснить следующими причинами. Во-первых, за последние два десятилетия было продемонстрировано, что использование клеток СНО для производства рекомбинантных белков является безопасным для человека. Во-вторых, относительно низкая удельная продуктивность клеточных линий млекопитающих в случае СНО может быть преодолена посредством увеличения количества копий генов целевых белков. Для клеток СНО доступны мощные системы амплификации генов, такие как амплификация генов, опосредованная дигидрофолатредуктазой или глутаминсинтетазой (GS). В-третьих, клетки СНО обладают способностью к эффективной посттрансляционной модификации и продуцируют рекомбинантные белки с гликоформами, совместимыми и биоактивными для человека формами. Наконец, клетки СНО линии обладают высокой скоростью роста и относительно легко адаптируются к росту в суспензии, что является предпочтительной характеристикой для крупномасштабного культивирования в биореакторах. В настоящее время биореакторы объемом более 10000 л используются для суспензионных культур рекомбинантных клеток СНО, продуцирующих терапевтические антитела (Baker P.J., et al. // Applied microbiology and biotechnology, 2012, v. 93, p. 229).
Таким образом, культивируемые клетки млекопитающих, особенно культивируемые клетки яичника китайского хомячка, стали доминирующей системой для производства рекомбинантных белков для последующего клинического применения из-за их способности к правильному фолдингу, сборке и посттрансляционной модификации белков.
Векторы экспрессии для производства рекомбинантных белков обычно используют сильный вирусный или клеточный промотор/энхансер для управления экспрессией рекомбинантного гена (Gopalkrishnan R.V., et al. // Nucleic Acids Res., 1999, v. 27, p.4775). При этом в качестве терминаторов транскрипции используют общепринятые последовательности, такие как: SV40 polyA, BGH polyA, синтетический сигнал полиаденилирования Synt polyA. Необходимо отметить, что по сравнению с инициацией транскрипции о влиянии терминации транскрипции на уровень экспрессии репортерного гена известно гораздо меньше. Однако недавно было показано влияние последовательности, расположенной после сигнала полиаденилирования, на количество транскриптов и уровень продукции интересующего белка (Boldyreva L.V., et al. // Molecular. Biology Reports, 2021, v. 48, p.1539).
Известна рекомбинантная плазмидная ДНК pIRES-eGFP-Synt, содержащая ген eGFP под контролем CMV промотора, а также следующие элементы:
- элемент IRES, разделяющий рамки считывания гена eGFP и пео;
- ген neo, обеспечивающий устойчивость к антибиотику неомицину;
- синтетическая последовательность Synt polyA в качестве терминатора транскрипции.
Однако при трансфекции клеток СНО плазмидной ДНК pIRES-eGFP-Synt уровень экспрессии белка eGFP был таким же, как при использовании плазмидных ДНК с общепринятыми сильными терминаторами транскрипции BGH polyA и SV40 polyA (Wang Х-у, et al. // Front. Bioeng. Biotechnol., 2022, v. 10).
Наиболее близкой к заявляемой рекомбинантной плазмидной ДНК-прототипом, является рекомбинантная плазмидная ДНК pTTC-Hsap-dC, обеспечивающая экспрессию репортерного белка eGFP в культивируемых клетках почки эмбриона человека (НЕК293Т), содержащая следующие элементы:
- ген eGFP под контролем промотора hPGK человека и синтетической последовательности dC в качестве терминатора транскрипции;
- ген mCherry под контролем промотора CMV и терминатора транскрипции SV40 polyA;
- ориджины репликации плазмиды ori и fl ori.
При трансфекции клеток почки эмбриона человека (НЕК293Т) плазмидной ДНК pTTC-Hsap-dC наблюдали увеличение транскриптов гена eGFP всего в 2 раза по сравнению с исходной плазмидной ДНК pTTC-Hsap-WT (Boldyreva L.V., et al. // Molecular. Biology Reports, 2021, v. 48, p. 1539).
Недостатком известной плазмиды является низкий уровень экспрессии рекомбинантного белка eGFP.
Задачей изобретения является создание рекомбинантной плазмидной ДНК, позволяющей значительно повысить уровень экспрессии интересующего рекомбинантного белка за счет использования специально разработанного терминатора транскрипции.
Технический результат: получение плазмиды phPGK-eGFP-CATTCGCC-CMV-mCherry, обеспечивающей высокую экспрессию репортерного белка eGFP в культивируемых клетках яичника китайского хомячка.
Сущность заявленного изобретения заключается в следующем.
На первом этапе разработана синтетическая последовательность области терминации транскрипции длиной 182 п. н., содержащая мотив CATTCGCC длиной 8 п.н., расположенный на расстоянии 29 п. н. ниже от сигнала полиаденилирования, имеющая нуклеотидную последовательность SEQ ID NO 1 и обеспечивающая высокий уровень экспрессии белка eGFP.
На втором этапе сконструирована рекомбинантная плазмидная ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry для высоко эффективной наработки интересующих рекомбинантных белков. Плазмидная ДНК hPGK-eGFP-CATTCGCC-CMV-mCherry содержит последовательность гена eGFP, фланкированную уникальными сайтами рестрикции Smal и EcoRI. Наличие данных уникальных сайтов рестрикции позволяет сделать быструю замену последовательности гена eGFP на последовательность любого другого интересующего гена. В плазмидной ДНК hPGK-eGFP-CATTCGCC-CMV-mCherry экспрессия белка eGFP контролируется промотором гена hPGK человека и терминатором транскрипции, имеющем последовательность SEQ ID NO 1. Исходным генетическим материалом для конструирования плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry служит плазмидная ДНК pTTC-Hsap-WT (Boldyreva L.V., et al. // Molecular Biology Reports, 2021, v. 48, p. 1539) размером 6214 п.н.
Плазмидная ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry была получена следующим образом. В плазмидной ДНК pTTC-Hsap-WT был удален один из двух сайтов эндонуклеазы рестрикции SpeI, находящийся внутри последовательности промотора гена hPGK человека. Для этого с матрицы плазмидной ДНК pTTC-Hsap-WT с помощью ПЦР был наработан фрагмент длиной 1032 п.н. с использованием праймеров hPGK-XbaI-for (5'-ATAATCTAGAACCCTCGCAGACGGACAGC-3') и pTTC-hPGK-eGFP-GA-R (5'-CTCGATCCTCGAGTGTCACCTAAATC-3'). Сайты рестрикции Xbal и XhoI в последовательностях праймеров выделены курсивом. Данный фрагмент, обработанный эндонуклеазами рестрикции XbaI и XhoI, был встроен в плазмидную ДНК pTTC-Hsap-WT, предварительно обработанную эндонуклеазами рестрикции SpeI и XhoI. Поскольку сайты эндонуклеаз рестрикции SpeI и XbaI имеют одинаковые липкие концы, лигирование такого фрагмента с плазмидной ДНК pTTC-Hsap-WT приводит к нарушению сайта рестрикции SpeI внутри последовательности промотора гена hPGK человека и образованию плзамидной ДНК pTTC-Hsap-WT-delSpeI. В результате сайт рестрикции SpeI, расположенный в области терминации транскрипции гена eGFP, стал уникальным. В полученную плазмидную ДНК pTTC-Hsap-WT-delSpel по сайтам рестрикции SpeI и BsiWI был клонирован двуцепочечный олигонуклеотид, содержащий липкие концы сайтов рестрикции SpeI и BsiWI. Олигонуклеотид был получен при отжиге двух одноцепочечных олигонуклеотидов: 29-36-CATTCGCC-fwd (5'-CTAGTCATGCGTCAATTCATTCGCCGATTATCTTTAAC-3') и 29-36-CATTCGCC-rev (5'-GTACGTTAAAGATAATCGGCGAATGAATTGACGCATGA-3'). В результате была получена плазмидная ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry, имеющая нуклеотидную последовательность SEQ ID NO 2, которая характеризуется следующими признаками:
- имеет размер 6214 п. н.;
- кодирует зеленый флуоресцентный белок eGFP под контролем промотора гена hPGK человека и сильного терминатора транскрипции, имеющего специфическую 8 п.н. последовательность CATTCGCC и обеспечивающего высокий уровень экспрессии белка eGFP;
- последовательность гена eGFP фланкирована уникальными сайтами рестрикции SmaI и EcoRI, обеспечивающими возможность быстрой замены гена eGFP на любой другой интересующий репортерный ген;
- в качестве нормировочного контроля содержит последовательность красного флуоресцентного белка mCherry под контролем промотора CMV и терминатора транскрипции SV40, имеющего стабильную экспрессию;
- содержит ген устойчивости к антибиотику ампициллину AmpR, необходимый для селекции целевых плазмид на этапе клонирования, а также ориджины репликации плазмиды ori и Г1 ori.
Графическая карта плазмиды представлена на фиг. 1.
Для анализа уровня экспрессии белка eGFP клетки СНО были трансфицированы плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry. Конструкция CMV-mCherry использовалась в качестве контроля для нормирования eGFP сигнала. В качестве контроля также была получена плазмидная ДНК phPGK- eGFP-Synt_polyA-CMV-mCherry, содержащая в области терминации транскрипции гена eGFP общепринятый синтетический сигнал полиаденилирования Synt polyA (Wang Х-у, et al. // Front. Bioeng. Biotechnol., 2022, v. 10).
Полученными плазмидными ДНК были трансфицированы клетки СНО. Спустя 48 часов после трансфекции был проведен цитофлуорометрический анализ экспрессии белка eGFP. В результате было обнаружено, что уровень экспрессии белка eGFP в СНО клетках, трансфицированных плазмидной ДНК phPGK-eGFP- CATTCGCC-CMV-mCherry, более чем в 3 раза превышает уровень экспрессии eGFP в клетках, трансфицированных плазмидной ДНК phPGK-eGFP-Synt_polyA- CMV-mCherry.
Изобретение иллюстрируется следующими фигурами:
Фиг. 1. Графическая карта плазмиды phPGK-eGFP-CATTCGCC-CMV-mCherry, обеспечивающая высокую экспрессию репортерного белка eGFP в культивируемых клетках яичника китайского хомячка.
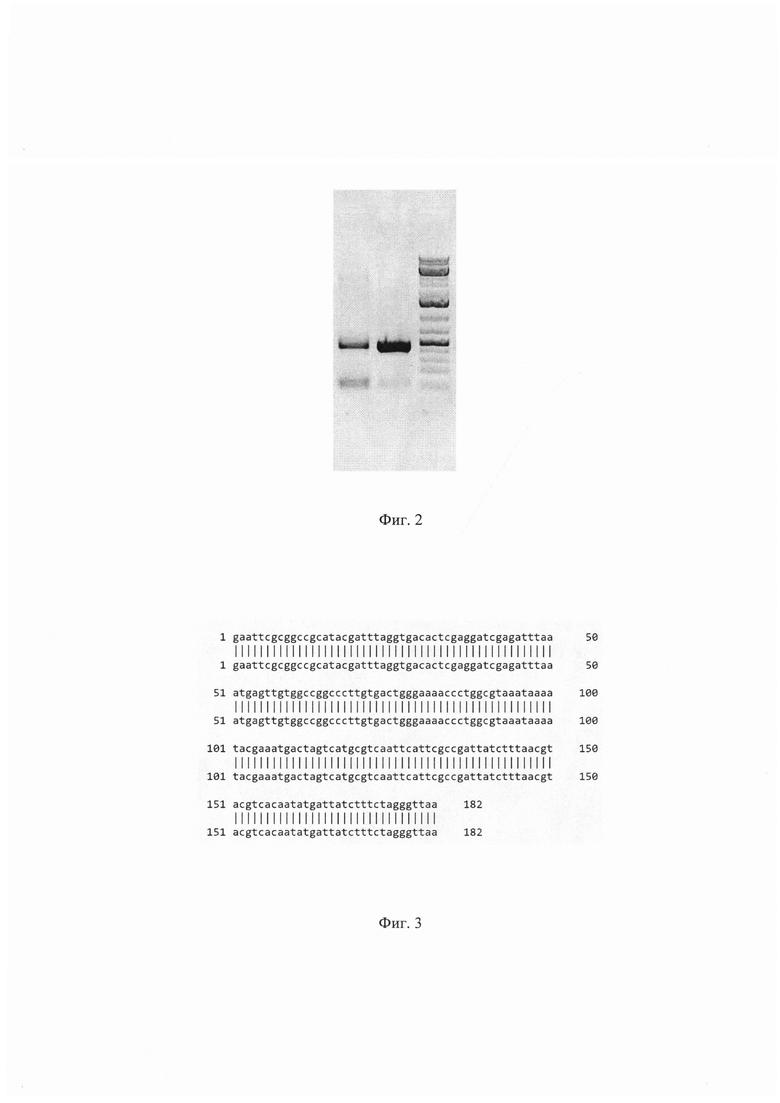
Фиг. 2. Электрофореграмма продукта ПЦР, полученного с праймеров 29-36- CATTCGCC-fwd (5’-CTAGTCATGCGTCAATTCATTCGCCGATTATCTTTAAC-3’) и Sv40T-R (5’-TGATACCGCTCGCCGCAGC-3’) для определения наличия вставки по сайтам узнавания для эндонуклеаз Spel и BsiWI. Дорожка 1 - ПЦР продукт, полученный с использованием плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry в качестве матрицы. Длина ПЦР продукта - 440 п.н.; дорожка 2 - ПЦР продукт, полученный с использованием плазмидной ДНК pTTC-Hsap-WT-delSpel в качестве матрицы. Длина ПЦР продукта - 409 п.н.; дорожка 3 - маркер молекулярного веса (1 кВ).
Фиг. 3. Выравнивание последовательности терминатора транскрипции полученного клона плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry, содержащей мотив CATTCGCC, длиной 8 п. н., на теоретически ожидаемую последовательность.
Для лучшего понимания сущности изобретения, оно иллюстрируется следующими примерами конкретного осуществления.
Пример 1. Конструирование плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry.
На основе выявленного 8 п.н. мотива CATTCGCC подбирают комплиментарную последовательность начала 3'-обращенного концевого повтора транспозона piggyBac (3'-TR). Затем с 5'-конца добавляют сайт узнавания эндонуклеазой рестрикции SpeI. С 3'-конца добавляют сайт узнавания для эндонуклеазы BsiWI. К полученной последовательности нуклеотидов (в данном случае 5'-CTAGTCATGCGTCAATTCATTCGCCGATTATCTTTAAC-3') подбирают антисмысловую цепь - обратную комплиментарную последовательность, фланкированную сайтами узнавания для эндонуклеаз BsiWI с 5'-конца и SpeI с 3'-конца, так, чтобы при отжиге со смысловой цепью получились липкие концы (в данном случае 5'-GTACGTTAAAGATAATCGGCGAATGAATTGACGCATGA-3').
После синтеза выбранных последовательностей, полученные олигонуклеотиды отжигают друг на друга после 10 сек денатурации при 95°С. В результате получают двуцепочечный фрагмент ДНК, содержащий 8 п.н. мотив CATTCGCC и фланкированный сайтами узнавания для эндонуклеаз рестрикции SpeI с 5'-конца и BsiWI с 3'-конца.
Исходную плазмиду pTTC-Hsap-WT модифицируют с целью вставки 8 п.н. мотива CATTCGCC на расстоянии 29 п. н. ниже сайта polyA. Для этого плазмидную ДНК pTTC-Hsap-WT-delSpel гидролизуют эндонуклеазами SpeI и BsiWI, после чего полученный вектор лигируют с двуцепочечным фрагментом ДНК, описанным выше в данном примере, при помощи Т4 ДНК лигазы.
Клонирование полученной плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry (фиг. 1). Для этого компетентные клетки Е. coli трансформируют phPGK-eGFP-CATTCGCC-CMV-mCherry. Селекцию трансформированных клеток Е. coli производят с помощью бактериальной среды с ампициллином.
Для верификации плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry проводят ПЦР с праймерами For (5''-CTAGTCATGCGTCAATTCATTCGCCGATTATCTTTAAC-3') и Rev (5'-TGATACCGCTCGCCGCAGC-3'). ПЦР проводят в 25 мкл реакционной смеси, содержащей 0.5 ед. акт.Taq ДНК-полимеразы (Fermentas), 12.5 пмоль каждого олигонуклеотида, 0.2 мМ каждого дезоксинуклеозидтрифосфата, 75 мМ Трис-НС1 (рН 8.8), 20 мМ (NH4)2SO4, 0.01% детергента tween-20, 2.5 мМ MgSO4. Проводят 30 циклов по схеме: 95°С /20 сек, 60°С/30 сек, 72°С/40 сек после 3 минут денатурации при 95°С. ПЦР продукты разделяют в 2% агарозном геле и окрашивают SYBR Safe (Life Technologies, USA). ПЦР продукты, полученные в данной реакции, имеют следующие размеры: без вставки - 404 п.н., со вставкой 469 п.н. (фиг. 2). Последовательность терминатора транскрипции полученного клона плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry была подтверждена с помощью секвенирования стандартным способом с использованием праймера EGFP-int3 (5'-ТСAAGGTGАACTTCAAGATCCG-3'). На фиг. 3 представлено выравнивание просеквенированной последовательности терминатора транскрипции длиной 182 п.н. полученного клона плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry на теоретически ожидаемую последовательность. В верхней строке на фиг. 3 представлена теоретические ожидаемая последовательность, в нижней строке показана просеквенированная последовательность терминатора транскрипции полученного клона плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry.
Пример 2. Трансфекция культивируемых клеток яичника китайского хомячка СНО.
Культуру клеток СНО трансфицировали плазмидной ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry. В качестве контроля параллельную культуру клеток СНО трансформировали равным количеством плазмидной ДНК phPGK-eGFP-Synt_polyA-CMV-mCherry. Трансформированные культуры клеток инкубировали в питательной среде в течение 48 часов при температуре +37°С и содержании СO2 в воздухе, равном 5%.
Пример 3. Цитофлуорометрический анализ уровня экспрессии репортерного белка eGFP в трансфицированных клетках СНО.
После трансфекции клетки собирали, промывали раствором PBS, осаждали. Экспрессию eGFP в клетках анализировали с помощью проточной цитометрии. В качестве контроля использовали нетрансфицированные клетки СНО. В качестве нормировочного контроля использовали клетки СНО, трансфицированные плазмидной ДНК pTTC-Hsap-WT. Результаты приведены в таблице 1.

Полученные результаты показали, что использование плазмиды phPGK-eGFP-CATTCGCC-CMV-mCherry, содержащей терминатор транскрипции SEQ ID NO 1, позволяет повысить уровень экспрессии репортерного белка eGFP более чем в три раза, по сравнению с плазмидой phPGK-eGFP-Synt_polyA-CMV-mCherry, содержащей терминатор транскрипции Synt polyA.
Таким образом, предложена плазмидная ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry для высоко эффективной наработки интересующих рекомбинантных белков, в которой в качестве репортера может быть использована последовательность, кодирующая интересующий белок, при этом репортер находится под контролем промотора hPGK человека, а в качестве терминатора транскрипции содержит разработанную уникальную последовательность SEQ ID NO 1, обеспечивающую высокий уровень экспрессии интересующего белка по сравнению с общепринятыми терминаторами транскрипции (например, по сравнению с широко используемым синтетическим сигналом полиаденилирования Synt polyA
--->
Перечень последовательностей
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="Перечень SEQ ID NO
1-2.xml" softwareName="WIPO Sequence" softwareVersion="2.0.0"
productionDate="2023-06-20">
<ApplicantFileReference>1</ApplicantFileReference>
<ApplicantName languageCode="ru">Федеральное государственное
бюджетное учреждение науки Институт молекулярной и клеточной биологии
Сибирского отделения Российской академии наук (ИМКБ СО
РАН)</ApplicantName>
<ApplicantNameLatin>Institute of Molecular and Cellular Biology,
Siberian Branch of Russian Academy of Sciences</ApplicantNameLatin>
<InventionTitle languageCode="ru"> Рекомбинантная плазмидная ДНК
рhPGK-eGFP-CATTCGCC-CMV-mCherry, обеспечивающая высокую экспрессию
репортерного белка eGFP в культивируемых клетках яичника китайского
хомячка</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>182</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..182</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
/INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>GAATTCGCGGCCGCATACGATTTAGGTGACACTCGAGGATCGAGATTTA
AATGAGTTGTGGCCGGCCCTTGTGACTGGGAAAACCCTGGCGTAAATAAAATACGAAATGACTAGTCATG
CGTCAATTCATTCGCCGATTATCTTTAACGTACGTCACAATATGATTATCTTTCTAGGGTTAA</INSDS
eq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>6214</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..6214</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>CTAAATTGTAAGCGTTAATATTTTGTTAAAATTCGCGTTAAATTTTTGTTA
AATCAGCTCATTTTTTAACCAATAGGCCGAAATCGGCAAAATCCCTTATAAATCAAAAGAATAGACCGAG
ATAGGGTTGAGTGTTGTTCCAGTTTGGAACAAGAGTCCACTATTAAAGAACGTGGACTCCAACGTCAAAG
GGCGAAAAACCGTCTATCAGGGCGATGGCCCACTACGTGAACCATCACCCTAATCAAGTTTTTTGGGGTC
GAGGTGCCGTAAAGCACTAAATCGGAACCCTAAAGGGAGCCCCCGATTTAGAGCTTGACGGGGAAAGCCG
GCGAACGTGGCGAGAAAGGAAGGGAAGAAAGCGAAAGGAGCGGGCGCTAGGGCGCTGGCAAGTGTAGCGG
TCACGCTGCGCGTAACCACCACACCCGCCGCGCTTAATGCGCCGCTACAGGGCGCGTCCCATTCGCCATT
CAGGCTGCGCAACTGTTGGGAAGGGCGATCGGTGCGGGCCTCTTCGCTATTACGCCAGCTGGCGAAAGGG
GGATGTGCTGCAAGGCGATTAAGTTGGGTAACGCCAGGGTTTTCCCAGTCACGACGTTGTAAAACGACGG
CCAGTGAGCGCGCGTAATACGACTCACTATAGGGCGAATTGGGGCGCGCCATTCTAGATGATACCGCTCG
CCGCAGCCGAACGACCGAGCGCAGCGAGTCAGTGAGCGAGGAAGCGGAAGAGCGCCCAATACGCAAACCG
CCTCTCCCCGCGCGTTGGCCGATTCATTAATGCAGCTGGCACGACAGGTTTCCCGACTGGAAAGCGGGCA
GTGAGCGCAACGCAATTAATGTGAGTTAGCTCACTCATTAGGCACCCCAGGCTTTACACTTTATGCTTCC
GGCTCGTATGTTGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGCTATGACCATGATTAC
GCCAAGCTCTAGCTAGAGGTCGACGGTATACAGACATGATAAGATACATTGATGAGTTTGGACAAACCAC
AACTAGAATGCAGTGAAAAAAATGCTTTATTTGTGAAATTTGTGATGCTATTGCTTTATTTGTAACCATT
ATAAGCTGCAATAAACAAGTTGATATCTTACTTGTACAGCTCGTCCATGCCGCCGGTGGAGTGGCGGCCC
TCGGCGCGTTCGTACTGTTCCACGATGGTGTAGTCCTCGTTGTGGGAGGTGATGTCCAACTTGATGTTGA
CGTTGTAGGCGCCGGGCAGCTGCACGGGCTTCTTGGCCTTGTAGGTGGTCTTGACCTCAGCGTCGTAGTG
GCCGCCGTCCTTCAGCTTCAGCCTCTGCTTGATCTCGCCCTTCAGGGCGCCGTCCTCGGGGTACATCCGC
TCGGAGGAGGCCTCCCAGCCCATGGTCTTCTTCTGCATTACGGGGCCGTCGGAGGGGAAGTTGGTGCCGC
GCAGCTTCACCTTGTAGATGAACTCGCCGTCCTGCAGGGAGGAGTCCTGGGTCACGGTCACCACGCCGCC
GTCCTCGAAGTTCATCACGCGCTCCCACTTGAAGCCCTCGGGGAAGGACAGCTTCAAGTAGTCGGGGATG
TCGGCGGGGTGCTTCACGTAGGCCTTGGAGCCGTACATGAACTGAGGGGACAGGATGTCCCAGGCGAAGG
GCAGGGGGCCACCCTTGGTCACCTTCAGCTTGGCGGTCTGGGTGCCCTCGTAGGGGCGGCCCTCGCCCTC
GCCCTCGATCTCGAACTCGTGGCCGTTCACGGAGCCCTCCATGTGCACCTTGAAGCGCATGAACTCCTTG
ATGATGGCCATGTTATCCTCCTCGCCCTTGCTCACCCCAAGCTTTCTTCGTCGCTGTCTCCGCTTCTTCC
TGCCATACATGGATCCGAGCTCGGTACCAAGCGAGGGTCTCCCTATAGTGAGTCGTATTAATTTCGATAA
GCCAGTAAGCAGTGGGTTCTCTAGTTAGCCAGAGAGCTCTGCTTATATAGACCTCCCACCGTACACGCCT
ACCGCCCATTTGCGTCAATGGGGCGGAGTTGTTACGACATTTTGGAAAGTCCCGTTGATTTTGGTGCCAA
AACAAACTCCCATTGACGTCAATGGGGTGGAGACTTGGAAATCCCCGTGAGTCAAACCGCTATCCACGCC
CATTGATGTACTGCCAAAACCGCATCACCATGGTAATAGCGATGACTAATACGTAGATGTACTGCCAAGT
AGGAAAGTCCCATAAGGTCATGTACTGGGCATAATGCCAGGCGGGCCATTTACCGTCATTGACGTCAATA
GGGGGCGTACTTGGCATATGATACACTTGATGTACTGCCAAGTGGGCAGTTTACCGTAAATACTCCACCC
ATTGACGTCAATGGAAAGTCCCTATTGGCGTTACTATGGGAACATACGTCATTATTGACGTCAATGGGCG
GGGGTCGTTGGGCGGTCAGCCAGGCGGGCCATTTACCGTAAGTTATGTAACGCGGAACTCCATATATGGG
CTATGAACTAATGACCCCGTAATTGATTACTATTAATGCTAGCAGATCTACCGGTCGGGGTTGGGGTTGC
GCCTTTTCCAAGGCAGCCCTGGGTTTGCGCAGGGACGCGGCTGCTCTGGGCGTGGTTCCGGGAAACGCAG
CGGCGCCGACCCTGGGTCTCGCACATTCTTCACGTCCGTTCGCAGCGTCACCCGGATCTTCGCCGCTACC
CTTGTGGGCCCCCCGGCGACGCTTCCTGCTCCGCCCCTAAGTCGGGAAGGTTCCTTGCGGTTCGCGGCGT
GCCGGACGTGACAAACGGAAGCCGCACGTCTCACTAGAACCCTCGCAGACGGACAGCGCCAGGGAGCAAT
GGCAGCGCGCCGACCGCGATGGGCTGTGGCCAATAGCGGCTGCTCAGCGGGGCGCGCCGAGAGCAGCGGC
CGGGAAGGGGCGGTGCGGGAGGCGGGGTGTGGGGCGGTAGTGTGGGCCCTGTTCCTGCCCGCGCGGTGTT
CCGCATTCTGCAAGCCTCCGGAGCGCACGTCGGCAGTCGGCTCCCTCGTTGACCGAATCACCGACCTCTC
TCCCCAGCCCGGGACCATGGTGAGCAAGGGCGAGGAGCTGTTCACCGGGGTGGTGCCCATCCTGGTCGAG
CTGGACGGCGACGTAAACGGCCACAAGTTCAGCGTGTCCGGCGAGGGCGAGGGCGATGCCACCTACGGCA
AGCTGACCCTGAAGTTCATCTGCACCACCGGCAAGCTGCCCGTGCCCTGGCCCACCCTCGTGACCACCCT
GACCTACGGCGTGCAGTGCTTCAGCCGCTACCCCGACCACATGAAGCAGCACGACTTCTTCAAGTCCGCC
ATGCCCGAAGGCTACGTCCAGGAGCGCACCATCTTCTTCAAGGACGACGGCAACTACAAGACCCGCGCCG
AGGTGAAGTTCGAGGGCGACACCCTGGTGAACCGCATCGAGCTGAAGGGCATCGACTTCAAGGAGGACGG
CAACATCCTGGGGCACAAGCTGGAGTACAACTACAACAGCCACAACGTCTATATCATGGCCGACAAGCAG
AAGAACGGCATCAAGGTGAACTTCAAGATCCGCCACAACATCGAGGACGGCAGCGTGCAGCTCGCCGACC
ACTACCAGCAGAACACCCCCATCGGCGACGGCCCCGTGCTGCTGCCCGACAACCACTACCTGAGCACCCA
GTCCGCCCTGAGCAAAGACCCCAACGAGAAGCGCGATCACATGGTCCTGCTGGAGTTCGTGACCGCCGCC
GGGATCACTCTCGGCATGGACGAGCTGTACAAGTAAGAATTCGCGGCCGCATACGATTTAGGTGACACTC
GAGGATCGAGATTTAAATGAGTTGTGGCCGGCCCTTGTGACTGGGAAAACCCTGGCGTAAATAAAATACG
AAATGACTAGTCATGCGTCAATTCATTCGCCGATTATCTTTAACGTACGTCACAATATGATTATCTTTCT
AGGGTTAATCTAGTATACGCGTATGCGGCCGCTTAATTAATCCAGCTTTTGTTCCCTTTAGTGAGGGTTA
ATTGCGCGCTTGGCGTAATCATGGTCATAGCTGTTTCCTGTGTGAAATTGTTATCCGCTCACAATTCCAC
ACAACATACGAGCCGGAAGCATAAAGTGTAAAGCCTGGGGTGCCTAATGAGTGAGCTAACTCACATTAAT
TGCGTTGCGCTCACTGCCCGCTTTCCAGTCGGGAAACCTGTCGTGCCAGCTGCATTAATGAATCGGCCAA
CGCGCGGGGAGAGGCGGTTTGCGTATTGGGCGCTCTTCCGCTTCCTCGCTCACTGACTCGCTGCGCTCGG
TCGTTCGGCTGCGGCGAGCGGTATCAGCTCACTCAAAGGCGGTAATACGGTTATCCACAGAATCAGGGGA
TAACGCAGGAAAGAACATGTGAGCAAAAGGCCAGCAAAAGGCCAGGAACCGTAAAAAGGCCGCGTTGCTG
GCGTTTTTCCATAGGCTCCGCCCCCCTGACGAGCATCACAAAAATCGACGCTCAAGTCAGAGGTGGCGAA
ACCCGACAGGACTATAAAGATACCAGGCGTTTCCCCCTGGAAGCTCCCTCGTGCGCTCTCCTGTTCCGAC
CCTGCCGCTTACCGGATACCTGTCCGCCTTTCTCCCTTCGGGAAGCGTGGCGCTTTCTCATAGCTCACGC
TGTAGGTATCTCAGTTCGGTGTAGGTCGTTCGCTCCAAGCTGGGCTGTGTGCACGAACCCCCCGTTCAGC
CCGACCGCTGCGCCTTATCCGGTAACTATCGTCTTGAGTCCAACCCGGTAAGACACGACTTATCGCCACT
GGCAGCAGCCACTGGTAACAGGATTAGCAGAGCGAGGTATGTAGGCGGTGCTACAGAGTTCTTGAAGTGG
TGGCCTAACTACGGCTACACTAGAAGGACAGTATTTGGTATCTGCGCTCTGCTGAAGCCAGTTACCTTCG
GAAAAAGAGTTGGTAGCTCTTGATCCGGCAAACAAACCACCGCTGGTAGCGGTGGTTTTTTTGTTTGCAA
GCAGCAGATTACGCGCAGAAAAAAAGGATCTCAAGAAGATCCTTTGATCTTTTCTACGGGGTCTGACGCT
CAGTGGAACGAAAACTCACGTTAAGGGATTTTGGTCATGAGATTATCAAAAAGGATCTTCACCTAGATCC
TTTTAAATTAAAAATGAAGTTTTAAATCAATCTAAAGTATATATGAGTAAACTTGGTCTGACAGTTACCA
ATGCTTAATCAGTGAGGCACCTATCTCAGCGATCTGTCTATTTCGTTCATCCATAGTTGCCTGACTCCCC
GTCGTGTAGATAACTACGATACGGGAGGGCTTACCATCTGGCCCCAGTGCTGCAATGATACCGCGAGACC
CACGCTCACCGGCTCCAGATTTATCAGCAATAAACCAGCCAGCCGGAAGGGCCGAGCGCAGAAGTGGTCC
TGCAACTTTATCCGCCTCCATCCAGTCTATTAATTGTTGCCGGGAAGCTAGAGTAAGTAGTTCGCCAGTT
AATAGTTTGCGCAACGTTGTTGCCATTGCTACAGGCATCGTGGTGTCACGCTCGTCGTTTGGTATGGCTT
CATTCAGCTCCGGTTCCCAACGATCAAGGCGAGTTACATGATCCCCCATGTTGTGCAAAAAAGCGGTTAG
CTCCTTCGGTCCTCCGATCGTTGTCAGAAGTAAGTTGGCCGCAGTGTTATCACTCATGGTTATGGCAGCA
CTGCATAATTCTCTTACTGTCATGCCATCCGTAAGATGCTTTTCTGTGACTGGTGAGTACTCAACCAAGT
CATTCTGAGAATAGTGTATGCGGCGACCGAGTTGCTCTTGCCCGGCGTCAATACGGGATAATACCGCGCC
ACATAGCAGAACTTTAAAAGTGCTCATCATTGGAAAACGTTCTTCGGGGCGAAAACTCTCAAGGATCTTA
CCGCTGTTGAGATCCAGTTCGATGTAACCCACTCGTGCACCCAACTGATCTTCAGCATCTTTTACTTTCA
CCAGCGTTTCTGGGTGAGCAAAAACAGGAAGGCAAAATGCCGCAAAAAAGGGAATAAGGGCGACACGGAA
ATGTTGAATACTCATACTCTTCCTTTTTCAATATTATTGAAGCATTTATCAGGGTTATTGTCTCATGAGC
GGATACATATTTGAATGTATTTAGAAAAATAAACAAATAGGGGTTCCGCGCACATTTCCCCGAAAAGTGC
CAC</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СОЗДАНИЯ ТРАНСГЕННЫХ ЛИНИЙ КЛЕТОК МЛЕКОПИТАЮЩЕГО СО СТАБИЛЬНЫМ И ВЫСОКИМ УРОВНЕМ ЭКСПРЕССИИ ТРАНСГЕННОГО БЕЛКА | 2009 |
|
RU2425882C1 |
| ЭКСПРЕССИОННЫЙ ПЛАЗМИДНЫЙ ВЕКТОР МОНОЦИСТРОННОЙ ЭКСПРЕССИИ РЕКОМБИНАНТНЫХ БЕЛКОВ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ, ЛИНИЯ КЛЕТОК МЛЕКОПИТАЮЩИХ-ПРОДУЦЕНТОВ РЕКОМБИНАНТНОГО БЕЛКА, СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА | 2013 |
|
RU2552170C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ ХИМЕРНОЕ АНТИТЕЛО ПРОТИВ ФАКТОРА НЕКРОЗА ОПУХОЛИ-АЛЬФА ЧЕЛОВЕКА, ЛИНИЯ ЭУКАРИОТИЧЕСКИХ КЛЕТОК-ПРОДУЦЕНТ ХИМЕРНОГО АНТИТЕЛА И СПОСОБ ПОЛУЧЕНИЯ ХИМЕРНОГО АНТИТЕЛА | 2013 |
|
RU2555533C9 |
| ЭКСПРЕССИОННЫЙ ПЛАЗМИДНЫЙ ВЕКТОР ДЛЯ ГЕТЕРОЛОГИЧНОЙ ЭКСПРЕССИИ РЕКОМБИНАНТНЫХ БЕЛКОВ, ВЫСОКОЧАСТОТНОЙ ИНТЕГРАЦИИ И УСИЛЕННОЙ АМПЛИФИКАЦИИ ЭКСПРЕССИОННОЙ КАССЕТЫ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ, БИЦИСТРОННАЯ мРНК, СПОСОБ ПОЛУЧЕНИЯ СТАБИЛЬНЫХ ЛИНИЙ ПРОДУЦЕНТОВ РЕКОМБИНАНТНЫХ БЕЛКОВ С ИСПОЛЬЗОВАНИЕМ УКАЗАННОГО ВЕКТОРА, СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ | 2011 |
|
RU2488633C1 |
| Набор рекомбинантных плазмидных ДНК для получения рекомбинантных вирусов Сендай штамм Москва (варианты) | 2021 |
|
RU2787724C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBiPr-ABIgA2m1F16-ht ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУНОГЛОБУЛИНА А ИЗОТИПА IGA2m1 | 2016 |
|
RU2671477C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBiPr-ABIgA1FI6-ht ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУНОГЛОБУЛИНА А ИЗОТИПА IGA1 | 2016 |
|
RU2656142C1 |
| СПОСОБ СОЗДАНИЯ РЕКОМБИНАНТНОГО АДЕНОВИРУСА ПТИЦ ДЛЯ ВАКЦИНАЦИИ И ГЕННОЙ ТЕРАПИИ | 2007 |
|
RU2326942C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBiPr-ABIgA1FI6-Intht ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУНОГЛОБУЛИНА А ИЗОТИПА IgA1 | 2016 |
|
RU2664184C2 |
| Способ получения димерной формы мутантного иммуноглобулина IgA2m1-изотипа в клетках млекопитающих | 2023 |
|
RU2822889C1 |
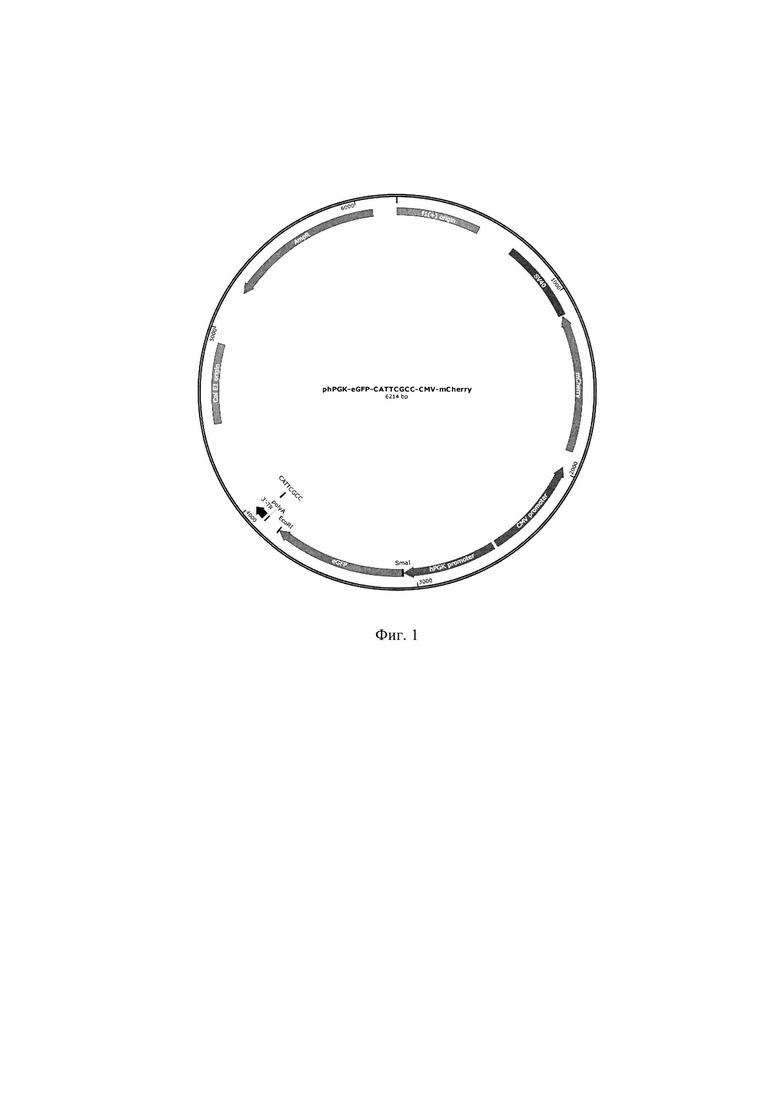
Изобретение относится к биотехнологии. Предложена рекомбинантная плазмидная ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry, обеспечивающая экспрессию репортерного белка eGFP в культивируемых клетках яичника китайского хомячка, размером 6214 п. н., имеющая нуклеотидную последовательность SEQ ID NO 2. Указанная плазмида содержит следующие элементы в соответствии с графической картой, представленной на фиг. 1: промотор гена hPGK человека и терминатор транскрипции, размером 182 п. н., представленный в SEQ ID NO 1 и состоящий из 3'-обращенного концевого повтора транспозона piggyBac (3'-TR), сигнала полиаденилирования polyA и имеющего мотив CATTCGCC; последовательность гена eGFP, фланкированную уникальными сайтами рестрикции SmaI и EcoRI; последовательность красного флуоресцентного белка mCherry под контролем промотора CMV и терминатора транскрипции SV40; ген устойчивости к ампициллину AmpR, необходимый для селекции целевых плазмид на этапе клонирования, ориджины репликации плазмиды ori и f1 ori. Изобретение обеспечивает высокую экспрессию репортерного белка eGFP в культивируемых клетках яичника китайского хомячка. 3 ил., 1 табл., 3 пр.
Рекомбинантная плазмидная ДНК phPGK-eGFP-CATTCGCC-CMV-mCherry, обеспечивающая экспрессию репортерного белка eGFP в культивируемых клетках яичника китайского хомячка, размером 6214 п. н., имеющая нуклеотидную последовательность SEQ ID NO 2, содержащая в соответствии с графической картой, представленной на фиг. 1:
- промотор гена hPGK человека и терминатор транскрипции, размером 182 п. н., представленный в SEQ ID NO 1 и состоящий из 3'-обращенного концевого повтора транспозона piggyBac (3'-TR), сигнала полиаденилирования polyA и имеющего мотив CATTCGCC;
- последовательность гена eGFP, фланкированную уникальными сайтами рестрикции SmaI и EcoRI;
- последовательность красного флуоресцентного белка mCherry под контролем промотора CMV и терминатора транскрипции SV40;
- ген устойчивости к ампициллину AmpR, необходимый для селекции целевых плазмид на этапе клонирования, ориджины репликации плазмиды ori и f1 ori.
| BOLDYREVA L.V | |||
| ET AL | |||
| Fine gene expression regulation by minor sequence variations downstream of the polyadenylation signal | |||
| Mol Biol Rep | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| OMELINA E.S | |||
| ET AL | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПОДАЧИ УГЛЯ В ТЕНДЕР ПАРОВОЗА | 1920 |
|
SU293A1 |
Авторы
Даты
2024-07-09—Публикация
2023-07-07—Подача