Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к фармацевтической композиции, содержащей конъюгат тромболитический пептид-тетрагидроизохинолин и фармацевтически приемлемый носитель, имеющей значение рН менее рН 6,5.
Краткое описание чертежей
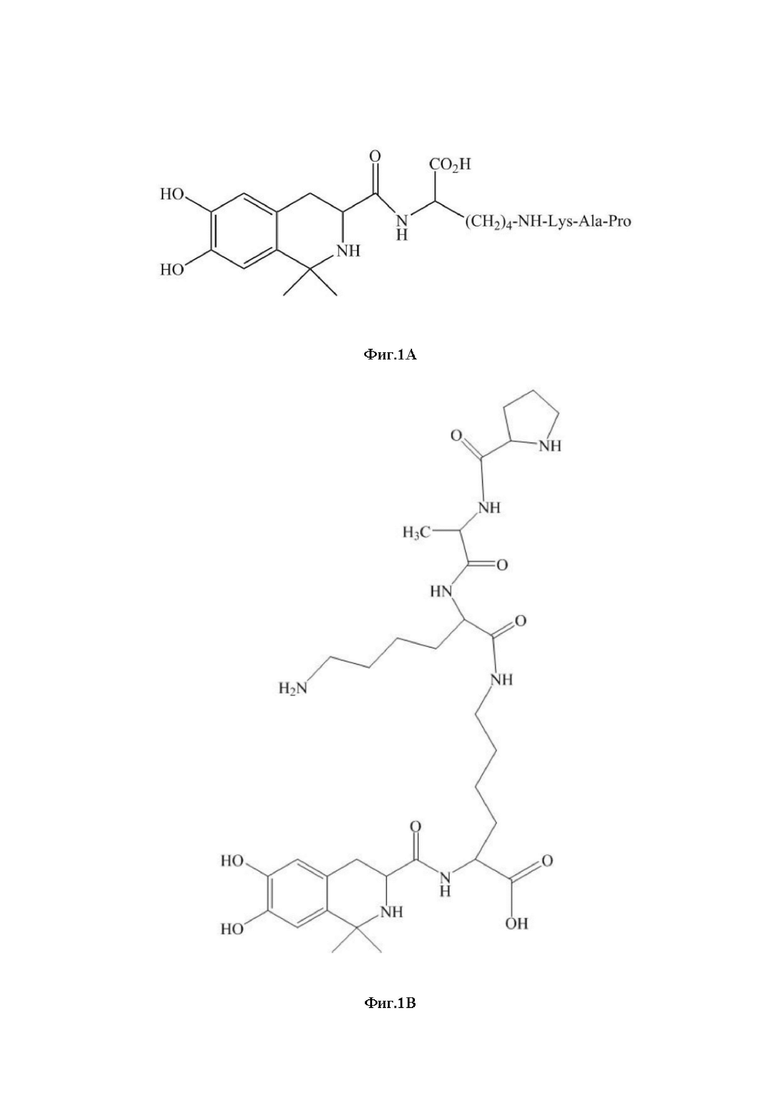
На фиг. 1А показана химическая структура DC009.
На фиг. 1 В показана химическая структура DC009 с подробным представлением NH-Lys-Ala-Pro.
Подробное раскрытие настоящего изобретения
В настоящем документе раскрыта фармацевтическая композиция, содержащая DC009 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. DC009 также может быть обозначен с помощью аббревиатуры LT3001, с химическим названием 38-6,7-дигидрокси-1,1-диметил-1,2,3,4- тетрагидро-изохинолин-3-aцил-Lys(Pro-Ala-Lys) или L-Лизин, Н6-(L-пролил-L-аланил-L-лизил)-Н2-[[(3S)-1,2,3,4-тетрагидро-6,7-дигидрокси-1,1-диметил-3-изохинолинил]карбонил] (CAS RN: 1639303-73-3). Структура DC009 показана на фиг. 1А, амидная связь между фрагментом связывания лизина и пептидом Pro-Ala-Lys показана на фиг. 1B. DC009 представляет собой бинарный конъюгат, который может быть образован посредством связывания тромболитического пептида (Pro-Ala-Lys) и соединения тетрагидроизохинолина, имеющего две С1-4 алкильные группы, через фрагмент связывания лизина. Получение соединения DC009 раскрыто в Примере 63 в публикации заявки на патент США №2016-0083423, которая включена в настоящий документ посредством ссылки. Фармацевтически приемлемая соль DC009 включает любые соли, которые являются фармацевтически приемлемыми, например, хлористоводородную соль, т.е. L-лизин,N6-(L-пролил-L-аланил-L-лизил)-Н2-[[(3S)-1,2,3,4-тетрагидро-6,7-дигидрокси-1,1-диметил-3-изохинолинил]карбонил]-гидрохлорид (1:3) (CAS RN: 2419930-71-3).
Термин «фармацевтически приемлемый» означает биологически или фармакологически совместимый для применения in vivo у животных или людей. Согласнонекоторым вариантам осуществления «фармацевтически приемлемый» означает одобренный регулирующим органом федерального правительства или правительства штата или указанный в Фармакопее США или другой общепризнанной фармакопее для применения у животных и, более конкретно, у людей.
Как правило, фармацевтические композиции получают путем однородного и тесного соединения активного ингредиента с жидким носителем или тонкоизмельченным твердым носителем или и с тем, и с другим, а затем, при необходимости, придания продукту желаемой формы. В фармацевтическую композицию активное целевое соединение включают в количестве, достаточном для получения желаемого эффекта на процесс или состояние заболевания. Соответственно, согласно некоторым вариантам осуществления фармацевтические композиции согласно настоящему изобретению охватывают любую композицию, полученную посредством смешивания от 0,1 до 50% активного ингредиента с фармацевтически приемлемым носителем. Согласно другим вариантам осуществления фармацевтические композиции согласно настоящему изобретению охватывают любую композицию, полученную посредством смешивания 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% активного ингредиента с фармацевтически приемлемым носителем. Согласно определенным вариантам осуществления фармацевтические композиции согласно настоящему изобретению охватывают любую композицию, полученную посредством смешивания 0,2%-5% активного ингредиента с фармацевтически приемлемым носителем. Согласно другим вариантам осуществления фармацевтические композиции согласно настоящему изобретению охватывают любую композицию, полученную посредством смешивания от 0,5% до 5% активного ингредиента с фармацевтически приемлемым носителем.
Фармацевтически приемлемые носители, которые представляют собой неактивные ингредиенты, могут быть выбраны специалистом в данной области техники, используя стандартные критерии. Фармацевтически приемлемые носители включают без ограничения, неводные основные растворы, суспензии, эмульсии, микроэмульсии, мицеллярные растворы, гели и мази. Фармацевтически приемлемые носители также могут содержать ингредиенты, которые включают без ограничения солевые и водные растворы электролитов, ионные и неионные осмотические агенты, такие как хлорид натрия, хлорид калия, глицерин и декстрозу, средства, регулирующие значение рН, и буферы, такие как соли гидроксида, фосфата, цитрата, ацетата, бората и троламина, антиоксиданты, такие как соли, кислоты и/или основания бисульфита, сульфита, метабисульфита, тиосульфита, аскорбиновой кислоты, ацетилцистеина, цистеина, глутатиона, бутилированногогидроксианизола, бутилированного гидрокситолуола, токоферолов и аскорбилпальмитата, поверхностно-активные вещества, такие как лецитин, фосфолипиды, включая без ограничения фосфатидилхолин, фосфатидилэтаноламин и фосфатидилинозитол, полоксамеры и плоксамины, полисорбаты, такие как полисорбат 80, полисорбат 60 и полисорбат 20, поливинилы, такие как поливиниловый спирт и повидон, производные целлюлозы, такие как метилцеллюлоза, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза и гидроксипропилметилцеллюлоза и их соли, производные нефти, такие как минеральное масло и белый вазелин, жиры, такие как ланолин, арахисовое масло, пальмовое масло, соевое масло, моно-, ди- и триглицериды, полимеры акриловой кислоты, такие как карбоксиполиметиленовый гель и гидрофобно модифицированный сшитый акрилатный сополимер, полисахариды и гликозаминогликаны, такие как гиалуронат натрия. Такие фармацевтически приемлемые носители могут быть защищены от бактериального заражения с применением хорошо известных консервантов включая без ограничения хлорид бензалкония, этилендиаминтетрауксусную кислоту и ее соли, хлорид бензетония, хлоргексидин, хлорбутанол, метилпарабен, тимерозал и фенилэтиловый спирт, или могут быть составлены в виде состава без консерванта для либо однократного, либо многократного применения.
Согласно некоторым вариантам осуществления фармацевтическая композиция содержит DC009 и фармацевтически приемлемый носитель, где композиция имеет рН<7 или рН<6,5. Согласно некоторым вариантам осуществления композиция имеет рН приблизительно рН1-рН 6. Согласно некоторым вариантам осуществления композиция имеет рН приблизительно рН2-рН5,5. Согласно некоторым вариантам осуществления композиция имеет рН приблизительно рН3-рН6. Согласно некоторым вариантам осуществления композиция имеет рН приблизительно рН3,5-рН5,5. Согласно некоторым вариантам осуществления композиция имеет рН приблизительно рН3,5, рН4, рН4,5, рН5 или рН5,5. Согласно некоторым вариантам осуществления композиция имеет рН приблизительно 4,5.
В контексте настоящего изобретения «приблизительно» относится к ±5% от указанного значения.
Согласно некоторым вариантам осуществления фармацевтическая композиция содержит DC009 и фармацевтически приемлемое вспомогательное вещество, где фармацевтически приемлемое вспомогательное вещество представляет собой дисахарид или сахарный спирт.
Согласно некоторым вариантам осуществления сахарный спирт представляет собой маннит, сорбит, этиленгликоль, глицерин, эритрит, треитол, арабит, ксилит, рибит, галактит, фуцит, идит, инозит, волемит, изомальт, мальтит или лактит. Согласно некоторым вариантам осуществления сахарный спирт представляет собой арабит, ксилит, рибит, маннит, сорбит, галактит, фуцит, идит или инозит. Согласно некоторым вариантам осуществления сахарный спирт представляет собой арабит, ксилит, рибит, маннит, сорбит, галактит, фуцит, идит или инозит. Сахарный спирт предпочтительно представляет собой маннит или сорбит.
Согласно некоторым вариантам осуществления дисахаридом является сахароза, лактоза, трегалоза (β,β-трегалоза, α,β-трегалоза), лактулоза, мальтоза, целлобиоза, хитобиоза, койибиоза, нигероза, софороза, ламинарибиоза, гентиобиоза, тураноза, мальтулоза, палатиноза, гентиобиулоза, маннобиоза, мелибиоза, мелибиулоза, рутиноза, рутинулоза или ксилобиоза. Согласно некоторым вариантам осуществления дисахаридом является сахароза, лактулоза, лактоза, трегалоза, целлобиоза или хитобиоза. Предпочтительным дисахаридом является сахароза, лактоза или трегалоза.
Согласно настоящему изобретению массовое соотношение DC009 и фармацевтически приемлемого вспомогательного вещества (Соотношение ВС009/вспомогательное вещество) может быть выражено как либо, например, 9:1, либо 9. Например, соотношение ВС009/вспомогательное вещество, выраженное как 0,5:1, представляет собой то же самое что и соотношение ВС009/вспомогательное вещество, выраженное как 0,5. Диапазон соотношений ОС009/вспомогательное вещество может быть выражен как 1:1 9:1, например.
Согласно некоторым вариантам осуществления фармацевтическая композиция содержит DC009 и фармацевтически приемлемое вспомогательное вещество, где фармацевтически приемлемое вспомогательное вещество представляет собой маннит, сорбит, сахарозу, лактозу или трегалозу, и где массовое соотношение DC009 и фармацевтически приемлемого вспомогательного вещества составляет 1:1-1:9. Если соотношение ниже 1:1, объем является слишком маленьким для лиофилизации, а если соотношение выше 1:9, осмолярность является слишком высокой для внутривенного введения.
Согласно некоторым вариантам осуществления соотношение DC009 и фармацевтически приемлемого вспомогательного вещества составляет 1:9. Согласно одному варианту осуществления фармацевтическая композиция содержит приблизительно 1% DC009 и приблизительно 9% фармацевтически приемлемоговспомогательного вещества. Например, фармацевтически приемлемое вспомогательное вещество представляет собой сахарозу, лактозу, сорбит или трегалозу.
Согласно некоторым вариантам осуществления фармацевтическая композиция содержит DC009 и фармацевтически приемлемое вспомогательное вещество, где фармацевтически приемлемое вспомогательное вещество представляет собой маннит, и массовое соотношение DC009 и маннита составляет 1:1-1:7, предпочтительно 1: -1:5. Например, массовое соотношение DC009 и маннита представляет собой приблизительно 1:1, 1:1,3, 1:3,8 или 1:5. Согласно различным вариантам осуществления массовое соотношение DC009 и маннита составляет 1:5. Согласно одному варианту осуществления фармацевтическая композиция содержит приблизительно 1% DC009 и приблизительно 5% маннита.
Согласно различным вариантам осуществления соотношение DC009 и фармацевтически приемлемого вспомогательного вещества составляет приблизительно 1:3,8. Согласно одному варианту осуществления фармацевтическая композиция содержит приблизительно 1% DC009 и приблизительно 3,8% маннита. Согласно одному варианту осуществления фармацевтическая композиция содержит приблизительно 4% DC009 и приблизительно 14,8% маннита.
Согласно различным вариантам осуществления соотношение DC009 и фармацевтически приемлемого вспомогательного вещества составляет приблизительно 1:1,3. Согласно некоторым вариантам осуществления фармацевтическая композиция содержит приблизительно 2% DC009 и приблизительно 2,6% маннита.
Согласно некоторым вариантам осуществления фармацевтическая композиция содержит приблизительно 1% DC009 и приблизительно 3,8% маннита, и где композиция имеет значение рН, равное приблизительно рН3,5-рН5,5, более предпочтительно композиция имеет значение рН, равное приблизительно рН4,5.
Согласно некоторым вариантам осуществления фармацевтическая композиция содержит приблизительно 2% DC009 и приблизительно 2,6% маннита, и где композиция имеет значение рН, равное приблизительно рН3,5-рН5,5, более предпочтительно композиция имеет рН приблизительно 4,5.
Следующие примеры дополнительно иллюстрируют настоящее изобретение. Эти примеры предназначены только для иллюстрации настоящего изобретения и не должны рассматриваться как ограничивающие.
Примеры
Пример 1. Получение и определение чистоты DC009
DC009 получали согласно заявке на выдачу патента США №2016-0083423. Конечный продукт многократно промывали DCM, THF и этиловым простым эфиром несколько раз для повышения чистоты конечного продукта. Концентрацию и чистоту DC009 в растворе определяли с помощью ВЭЖХ при следующих условиях.
Колонка: колонка с алкиловой обращенно-фазовой связанной фазой
Подвижная фаза (MP): MPA: 0,1 об.% TFA в воде DI/MPB: 0,1 об.% TFA в ацетонитриле
Длина волны обнаружения: 214 и 280 нм
Температура колонки: 20-25°С
Температура образца: 10-15°С
Объем впрыска: 10-20 мкл
Градиент: MPA и MPB
В примерах 2-6 стабильность каждого состава показана как «выявление вещества при анализе» или «относительная чистота». Образцы в каждый момент времени анализировали посредством ВЭЖХ, как описано выше. Для «выявления вещества при анализе» значение в % вычисляли путем деления концентрации DC009 в момент времени на концентрацию DC009 при Т=0. Для «относительной чистоты» значение в % вычисляли по (% площади пика DC009 при Tn /% площади пика DC009 при Т0)*100%.
Пример 2. Стабильность составов в растворах с различным значением рН
Получали семь составов, которые перечислены в таблице 1, содержащих 10 мг/мл DC009, DC009 растворяли в каждом буфере и доводили до указанного значения рН с помощью
NaOH и HCl.


Эти составы хранили при 40°С и 60°С до оценки выявления вещества при анализе и общего содержания примесей. Внешний вид и стабильность при каждом условии хранения приведены в Таблице 2 и Таблице 3. Осадок не наблюдали ни в одном из образцов. 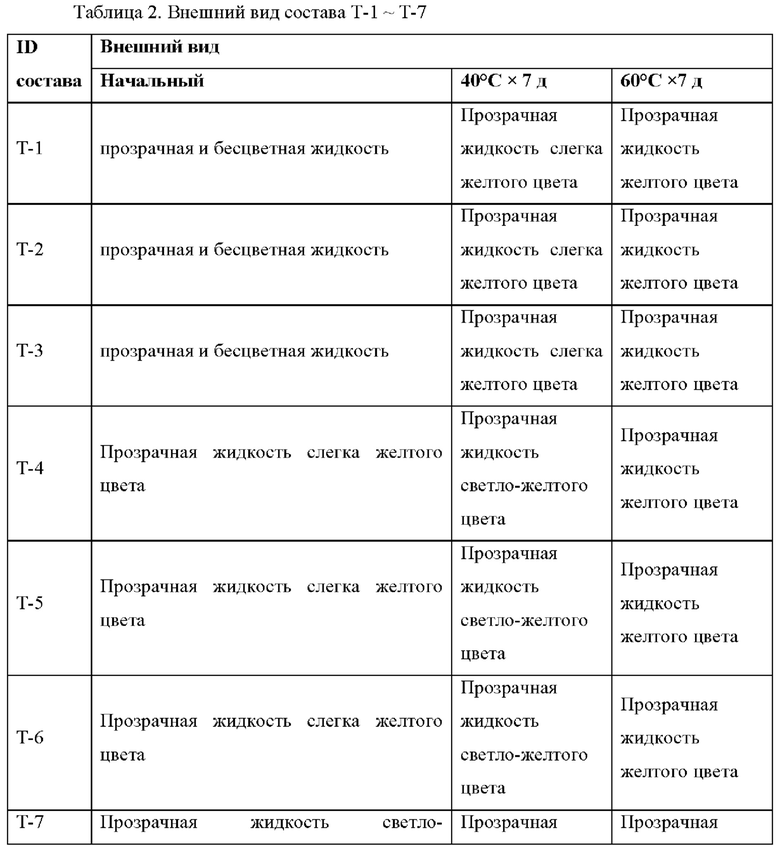

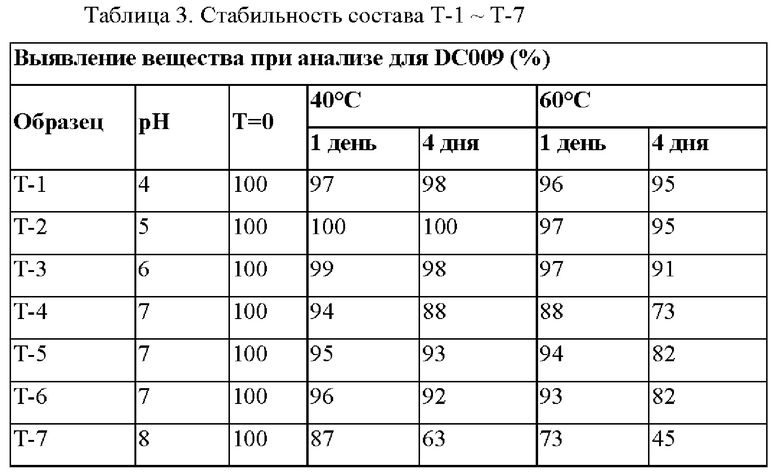
В ускоренном исследовании выявление вещества при анализе для Т-1 (рН4) и Т-2 (рН5) составило≥98% на 4-й день при 40°С и 95% при 60°С. Выявление вещества при анализе для Т-1 и Т-2 на 7-й день составляло 95% и 96% при 40°С и 90% при 60°С (данные не представлены). Так как выявление вещества при анализе для составов при рН7-8 (Т-4 - Т-7) падало ниже 90% после хранения при 60°С в течение 4 дней, это указывает на значительный рост % примесей. Эти данные подтверждают, что DC009 был стабилен в кислотных условиях и был очень стабилен при рН от 4 до 5. 5 мМ ацетат натрия является достаточным для поддержания стабильного значения рН между рН4 и рН5 для раствора DC-009 при 10 мг/мл.
Пример 3. Стабильность составов в растворах с различным значением рН
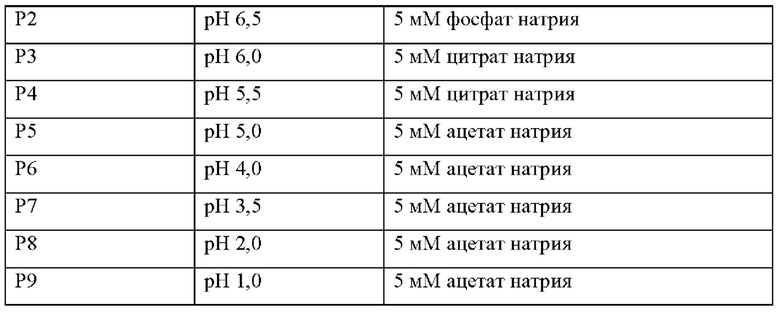
В ходе другого независимого эксперимента получали 9 составов, которые перечислены в таблице 4, содержащих 10 мг/мл DC009, DC009 растворяли в каждом буфере и доводили до указанного значения рН с помощью NaOH и HCl. 
Эти составы хранили при 60°С для оценки стабильности образца при различных значениях рН. Относительная чистота DC009 в общем составе приведена в Таблице 5, чистота DC009 определена как 100% при Т=0. Данные свидетельствуют о том, что DC009 был стабилен во всех кислотных условиях (рН<7) и сохранял чистоту>95% в течение 10 дней при 60°С.После хранения в течение одного месяца при 60°С (день 38) DC009 был стабилен при от рН1 до рН6 и сохранял чистоту>86%. Наилучшая стабильность была показана при рН 2,0-5,5. 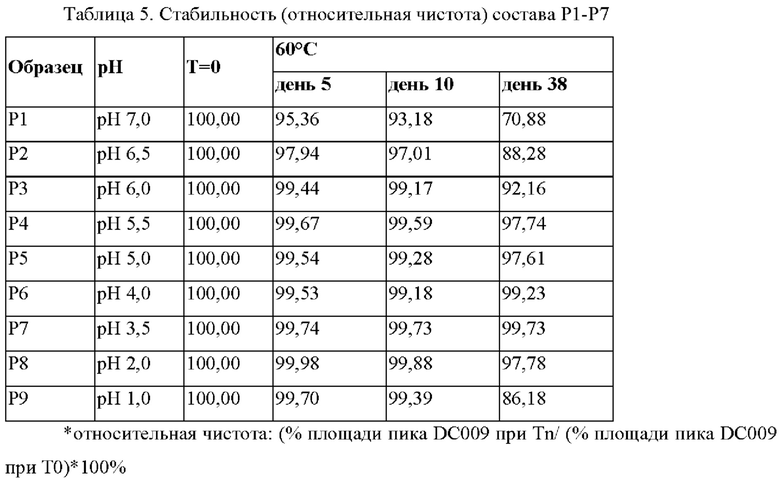
Пример 4 А. Стабильность состава с различными вспомогательными веществами
Получали шесть составов, которые приведены в Таблице 6 и содержали 10 мг/мл DC009 и различные количества вспомогательных веществ (в мг/г), значение рН каждого состава доводили до рН4,5 с помощью NaOH и HCl. Эти составы хранили при 40°С и 60°С до оценки выявления вещества при анализе и общего содержания примесей. Данные по стабильности приведены в таблице 7.
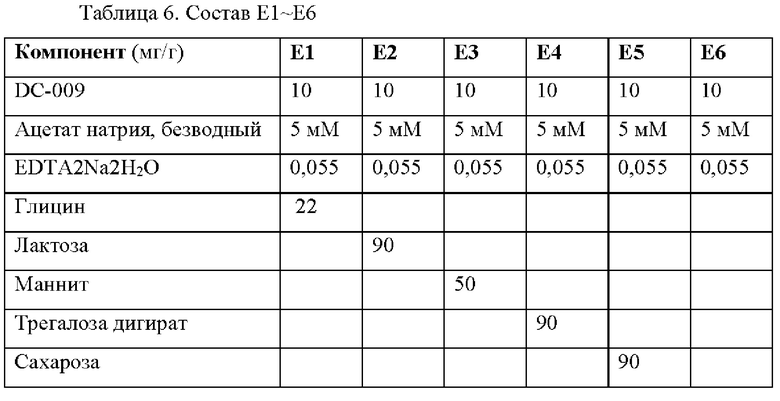
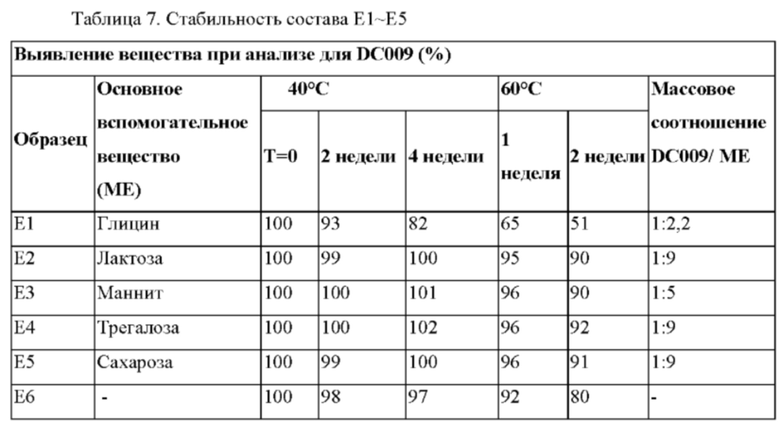
В ускоренном исследовании стабильности выявление вещества при анализе для Е2-Е5 составило≥90% через 2 недели при 60°С (таблица 7). Вспомогательное веществоглицин E1 значительно снизило стабильность по сравнению с контролем Е6, тогда как маннит, трегалоза, сахароза и лактоза улучшали стабильность по сравнению с контролем Е6.
Пример 4 В. Стабильность состава с различными вспомогательными веществами
В ходе отдельного эксперимента тестировали различные вспомогательные вещества, перечисленные в Таблице 8, в отношении эффекта стабилизации DC009. Для состава S1-S10 получали 10 мг/мл DC009 в 5 мМ ацетат-натриевом буфере, концентрация каждого вспомогательного вещества составляла 3,8%, а значение рН составов доводили до рН4,5. Эти составы хранили при 60°С в течение двух недель. Относительная чистота DC009 всего состава приведена в Таблице 8, чистота DC009 определена как 100% при Т=0. Чистота S1 и S3 составляла>80% через 2 недели при 60°С.Результаты показывают, что маннит и сорбит обеспечивают более хорошую стабильность, чем другие вспомогательные вещества.
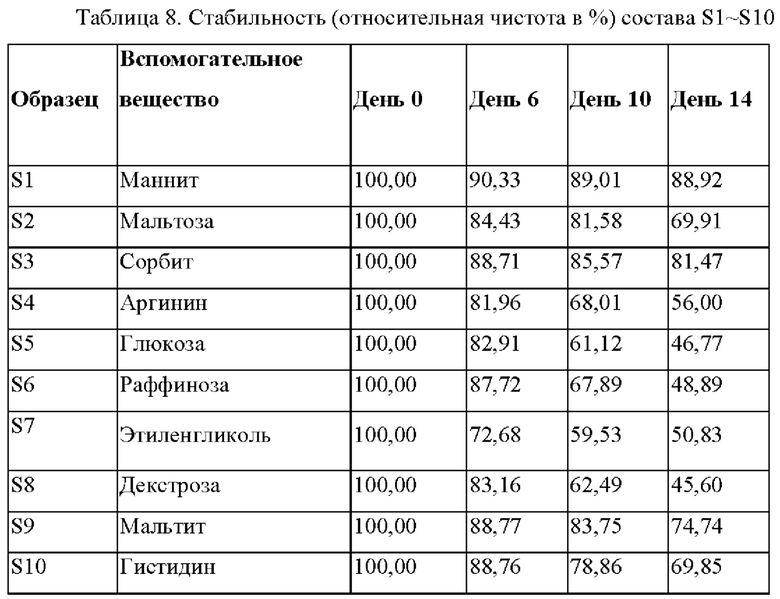
Пример 5. Стабильность составов, содержащих маннит
Получали четыре состава, которые приведены в Таблице 9 и содержали 10 мг/мл DC009, значение рН каждого состава доводили до рН4,5 с помощью NaOH и HCl. М1-М3содержали 50 мг/г D-маннита, а М4 не содержал D-маннит. Эти составы хранили при 40°С и 60°С до оценки выявления вещества при анализе. Данные по стабильности при каждом условии хранения приведены в таблице 10.
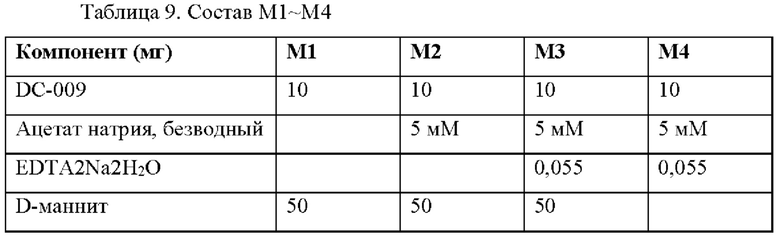
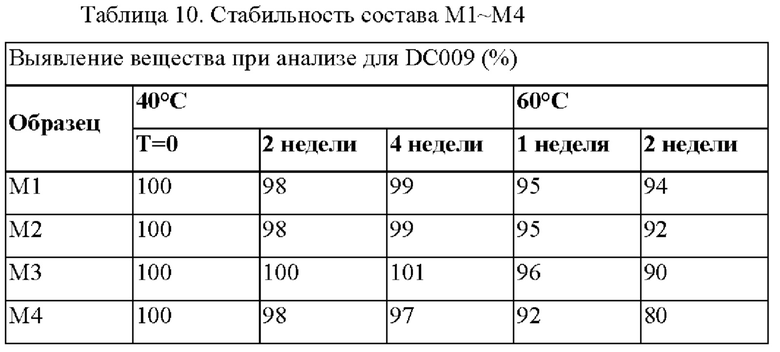
В ускоренном исследовании стабильности выявление вещества при анализе для М1-М3 составляло≥90 через 2 недели при 60°С.Данные свидетельствуют о том, что добавление маннита повышает стабильность состава по сравнению с составом М4 без маннита.
Пример 6. Исследование стабильности состава для лиофилизированного состава
Получали два состава, которые приведены в Таблице 11. Каждый состав лиофилизировали в лиофилизаторе и хранили при 40°С и 60°С до оценки выявления вещества при анализе. Данные по стабильности при каждом условии хранения приведены в таблице 12.
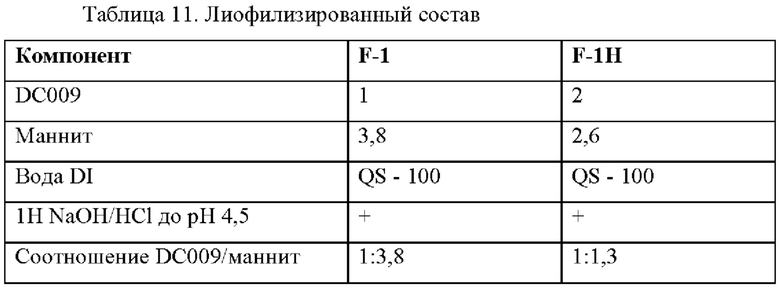
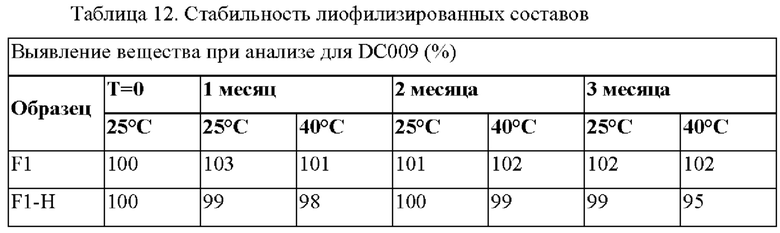
Два стабильных лиофилизированных состава для внутривенного введения в виде раствора (F-1 и F-1H) были разработаны для DC009 при концентрациях 10 мг/мл и 20 мг/мл, соответственно. На основании проведенных исследований на стабильность F-1 и F-1Н были физически и химически стабильны при 25°С и 40°С в течение 3 месяцев. Лиофилизированные составы могут быть восстановлены физиологическим раствором перед внутривенным введением.
Настоящее изобретение, а также образ и способ его получения и применения настоящим описаны в таких полных, ясных, кратких и точных терминах, что любой специалист в области техники, к которой оно относится, может получить и использовать то же изобретение. Следует понимать, что вышеизложенное описывает предпочтительные варианты осуществления настоящего изобретения, в которые могут быть внесены модификации без отклонения от объема настоящего изобретения, изложенного в формуле изобретения. С целью точного раскрытия и заявления объекта настоящего изобретения, следующая формула изобретения завершает описание изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВЫ С АДЕНОАССОЦИИРОВАННЫМ ВИРУСОМ | 2017 |
|
RU2769196C2 |
| Способ получения лиофилизата бортезомиба и фармацевтическая композиция, содержащая бортезомиб в форме стабильного лиофилизованного продукта, полученная указанным способом | 2018 |
|
RU2696854C1 |
| Способ получения лиофилизата бортезомиба и фармацевтическая композиция, содержащая бортезомиб в форме стабильного лиофилизованного продукта, полученная указанным способом | 2017 |
|
RU2659160C1 |
| Композиция, содержащая высококонцентрированный ингибитор альфа-1-протеиназы, и способ ее приготовления | 2019 |
|
RU2813136C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ БИОФАРМАЦЕВТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2011 |
|
RU2587056C2 |
| СОСТАВЫ АНАЛОГОВ ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-2 (GLP-2) | 2019 |
|
RU2833459C2 |
| ЛИПОПЕПТИДНЫЕ КОМПОЗИЦИИ И РОДСТВЕННЫЕ СПОСОБЫ | 2010 |
|
RU2607526C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ, ВКЛЮЧАЮЩИЕ КАНГРЕЛОР ВЫСОКОЙ ЧИСТОТЫ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2015 |
|
RU2733409C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПЛАЗМИНОГЕН, И ЕЕ ПРИМЕНЕНИЕ | 2015 |
|
RU2711989C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ, СОЛИ И ПОЛИМОРФЫ ТРАНСНОРСЕРТРАЛИНА И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2578956C2 |
Группа изобретений относится к области фармацевтики и медицины. 1 объект представляет собой фармацевтическую композицию, содержащую (а) соединение, имеющее формулу 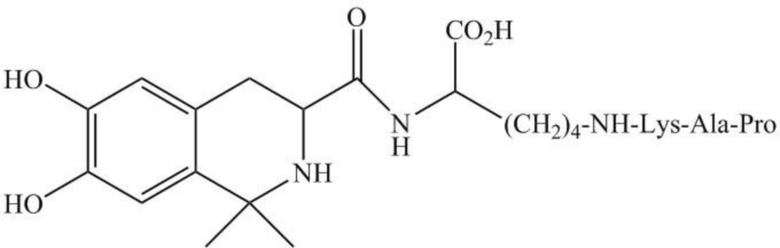 , или его фармацевтически приемлемую соль, и (b) фармацевтически приемлемое вспомогательное вещество, где фармацевтически приемлемое вспомогательное вещество представляет собой маннит, сорбит, сахарозу, лактозу или трегалозу, где композиция имеет значение рН, равное приблизительно рН 2 - рН 5,5 и массовое соотношение соединения и фармацевтически приемлемого вспомогательного вещества составляет приблизительно от 1:1 до 1:9. 2 объект – лиофилизированную фармацевтическую композицию, содержащую (а) вышеуказанное соединение или его фармацевтически приемлемую соль и (b) маннит, где массовое соотношение соединения и маннита составляет приблизительно от 1:1,3 до 1:3,8, и рН фармацевтической композиции имеет значение, равное приблизительно 4,5 после восстановления физиологическим раствором до концентрации от 10 до 20 мг/мл. Технический результат заключается в стабильности фармацевтической композиции. 2 н. и 12 з.п. ф-лы, 1 ил., 12 табл., 6 пр.
, или его фармацевтически приемлемую соль, и (b) фармацевтически приемлемое вспомогательное вещество, где фармацевтически приемлемое вспомогательное вещество представляет собой маннит, сорбит, сахарозу, лактозу или трегалозу, где композиция имеет значение рН, равное приблизительно рН 2 - рН 5,5 и массовое соотношение соединения и фармацевтически приемлемого вспомогательного вещества составляет приблизительно от 1:1 до 1:9. 2 объект – лиофилизированную фармацевтическую композицию, содержащую (а) вышеуказанное соединение или его фармацевтически приемлемую соль и (b) маннит, где массовое соотношение соединения и маннита составляет приблизительно от 1:1,3 до 1:3,8, и рН фармацевтической композиции имеет значение, равное приблизительно 4,5 после восстановления физиологическим раствором до концентрации от 10 до 20 мг/мл. Технический результат заключается в стабильности фармацевтической композиции. 2 н. и 12 з.п. ф-лы, 1 ил., 12 табл., 6 пр.
1. Фармацевтическая композиция, содержащая
(а) соединение, имеющее следующую формулу, или его фармацевтически приемлемую соль:
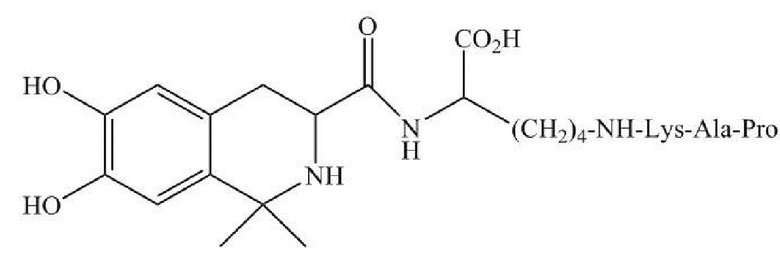 ,
,
и (b) фармацевтически приемлемое вспомогательное вещество, где фармацевтически приемлемое вспомогательное вещество представляет собой маннит, сорбит, сахарозу, лактозу или трегалозу, где композиция имеет значение рН, равное приблизительно рН 2 - рН 5,5 и массовое соотношение соединения и фармацевтически приемлемого вспомогательного вещества составляет приблизительно от 1:1 до 1:9.
2. Фармацевтическая композиция по п. 1, где фармацевтически приемлемое вспомогательное вещество представляет собой маннит.
3. Фармацевтическая композиция по п. 2, где композиция имеет значение pH, равное приблизительно pH 3,5 - pH 5,5.
4. Фармацевтическая композиция по п. 2, где композиция имеет значение pH, равное приблизительно pH 4,5.
5. Фармацевтическая композиция по п. 2, где фармацевтически приемлемая соль представляет собой хлористоводородную соль.
6. Фармацевтическая композиция по п. 1, где композиция имеет значение pH, равное приблизительно pH 3,5 - pH 5,5.
7. Фармацевтическая композиция по п. 1, где композиция имеет значение pH, равное приблизительно pH 4,5.
8. Фармацевтическая композиция по п. 1, где фармацевтически приемлемая соль представляет собой хлористоводородную соль.
9. Фармацевтическая композиция по п. 1, где массовое соотношение соединения и фармацевтически приемлемого вспомогательного вещества составляет приблизительно от 1:1,3 до 1:5.
10. Фармацевтическая композиция по п. 1, где фармацевтически приемлемое вспомогательное вещество представляет собой сорбит.
11. Фармацевтическая композиция по п. 1, где фармацевтически приемлемое вспомогательное вещество представляет собой сахарозу.
12. Фармацевтическая композиция по п. 1, где фармацевтически приемлемое вспомогательное вещество представляет собой лактозу.
13. Фармацевтическая композиция по п. 1, где фармацевтически приемлемое вспомогательное вещество представляет собой трегалозу.
14. Лиофилизированная фармацевтическая композиция, содержащая
(а) соединение, имеющее следующую формулу, или его фармацевтически приемлемую соль:
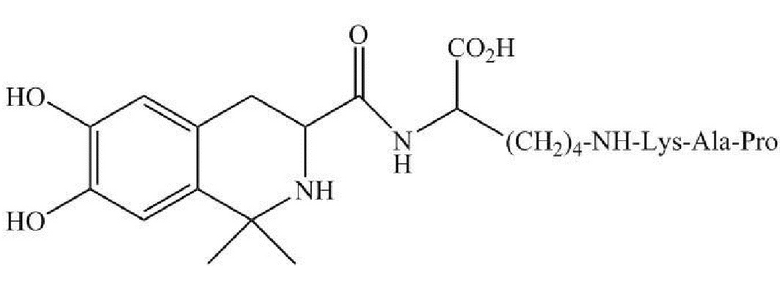 ,
,
и (b) маннит, где массовое соотношение соединения и маннита составляет приблизительно от 1:1,3 до 1:3,8, и рН фармацевтической композиции имеет значение, равное приблизительно 4,5 после восстановления физиологическим раствором до концентрации от 10 до 20 мг/мл.
| НОВЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ТРОЙНОЙ АКТИВНОСТЬЮ, ТРОМБОЛИЗИСНОЙ, АНТИТРОМБОТИЧЕСКОЙ И ЗАХВАТА РАДИКАЛОВ, И ИХ СИНТЕЗ, НАНОСТРУКТУРЫ И ПРИМЕНЕНИЕ | 2014 |
|
RU2660901C2 |
| YEH S | |||
| W | |||
| et al | |||
| Study of a novel small molecule, LT3001, in a thromboembolic stroke model in non-human primates // Journal of Stroke and Cerebrovascular Diseases | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| - Vol | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| - No | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| - P | |||
| Цементная прямоугольная ребристая черепица и пресс для ее изготовления | 1923 |
|
SU897A1 |
| WO 2015177057 A1, 26.11.2015 | |||
| US 9283267 B2, 15.03.2016. | |||
Авторы
Даты
2024-09-02—Публикация
2020-09-24—Подача