где R - R., X,y,flH Ac имеют указан ные значения; Rg имеет значения те же, что и Rfi, кроме значения атом водорода,
деацетилируют в основной бреде и полученный защищенный кеталь общей формулы
,COOQ
° 5vAA/
.А
-сКбО
RA
где R - Rg, Х,Уи.(1 , имеют указанные
значения,
посла, необязательного гидролиза для удаления Яд-(низшего) алкила окисляют в апротонном растворителе с по,мощью соединений хрома (VI) и от полученного 7-оксопроизводного общей Формулы
сооа
г
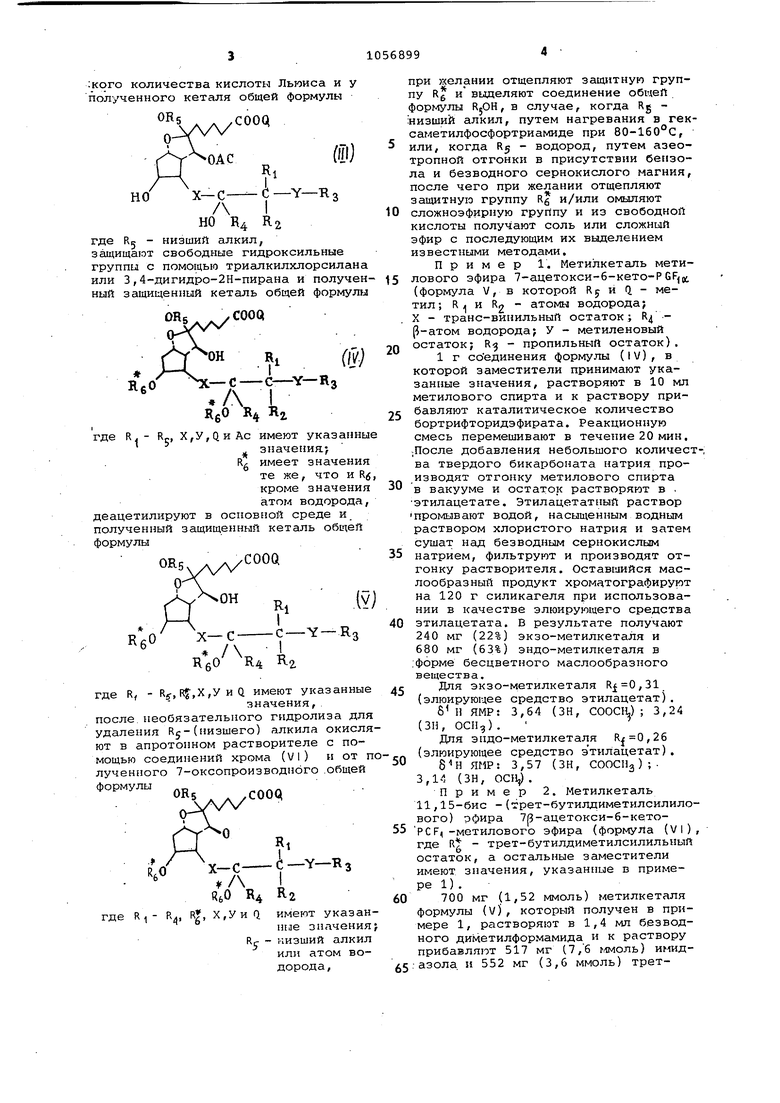
где R;. - Rg, X,VH О имеют указанные
значения; RC - низгаий алкил или
атом водорода,
при желании отщепляют защитную группу Rg и вьаделяют соединение общей формулы RjOH в случае, когда Rg низший алкил, :путем нагревания в гексаметилфосфортриамиде при 80160°С или, когда Rj - водород, путе азеотропной отгонки в присутствии бензола и безводного сернокислого магния, после чего при желании отщепляют згицитпую группу R и/или омыляют сложноэфирную группу и из свободной кислоты получают соль или сложный эфир с последу1мдим их выделением.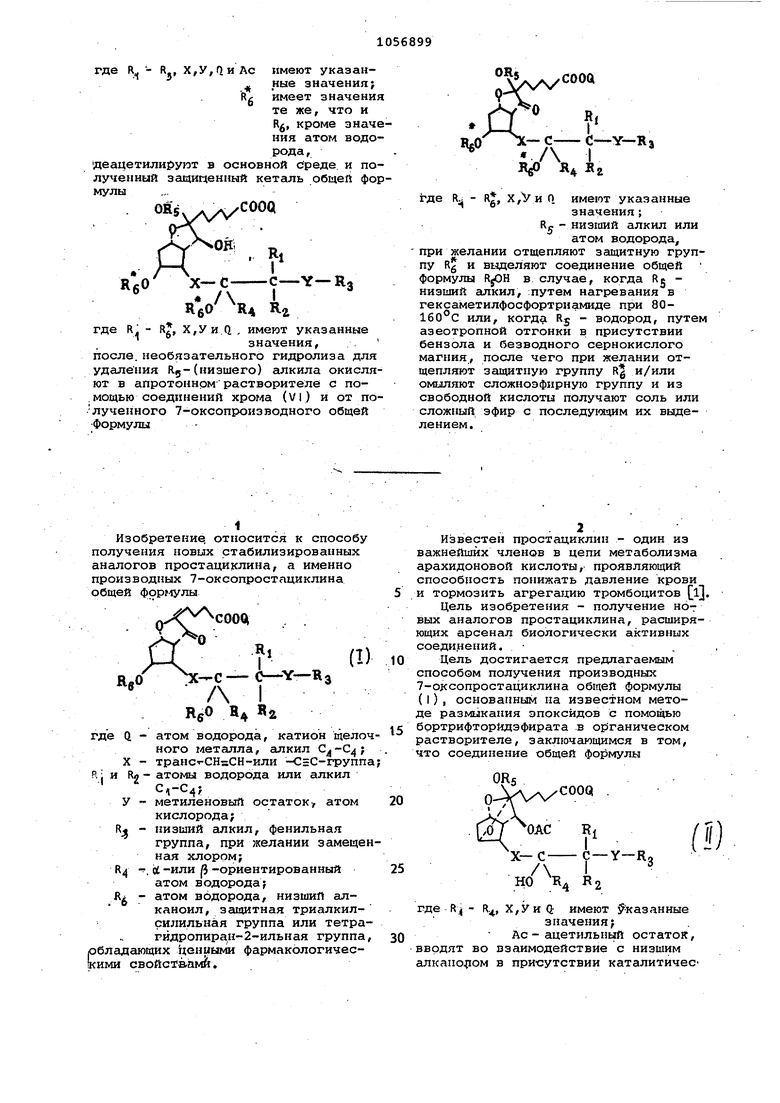




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных 4-оксо @ | 1982 |
|
SU1128834A3 |
| Способ получения 4-тиа-или 4-сульфинил- @ производных | 1981 |
|
SU1053746A3 |
| Способ получения производных 7-оксо-простациклина или их солей | 1985 |
|
SU1376939A3 |
| Способ получения оптически активных или рацемических 17-аза-производных простагландинов пгф | 1978 |
|
SU730297A3 |
| Способ получения производных 2,3,4-тринор- @ -интер-фениленпростагландина | 1982 |
|
SU1138020A3 |
| Способ получения рацемических или оптически активных полупростаноидгликозидов или -тиогликозидов | 1978 |
|
SU890973A3 |
| Способ получения замещенных ксилита или гексита | 1980 |
|
SU1075975A3 |
| Способ получения оптически активных или рацемических сложноэфирных производных хризантемовой кислоты | 1979 |
|
SU1088661A3 |
| Способ получения конденсированных производных пиримидина в виде рацематов или оптических изомеров | 1978 |
|
SU1181546A3 |
| Производные дульцита или ксилита,обладающие цитостатическим действием | 1980 |
|
SU979315A1 |
СПОСОБ ПОЛУЧЛ тЫ ПРОИЗВОДНЫХ 7-ОКСОПРОСТЛЦИКЛИНЛ общей форглулы COOQ с-V-Кз RfiO R«0 Кд В; -атом водорода, катион щегде Q лочного металла, алкил , -транс-СН ен или -С С групX па; и атомы водорода или алкил -метилеповиП остаток, атом у R-, кислорода; , - низглий алкил, фенильная группа, при желании замещен пая хлором; R ос-или (Ь -ориентированный атом водорода; Rg - атом водорода, низший алканоил, защитная триалкилсилильнал группа или тетрагидропира11-2-ильная группа;, отличающийся тем, что соединение общей формулы COOQl где R.,У и() имеют указанные . значения; СП Ас - ацетильный остаток, вводят во взаимодействие с низшим алкановом,в присутствии каталитичес:кого количества- кислоты Льюиса и у полученного кеталя общей формулы ОЗААХ ° « СП «1 i- О5 00 HD X-Сно Ni i;o ;о .еде Rfi - низгшй алкил, защищают свободные гидроксильные группьГс помощью трИсШкилхлЬрсилана или 3,4-диг1одро-2Н-пирана и полученный защйщенныД кеталь общей формулы f OHHI /-чI ЛбО в.о Кд к.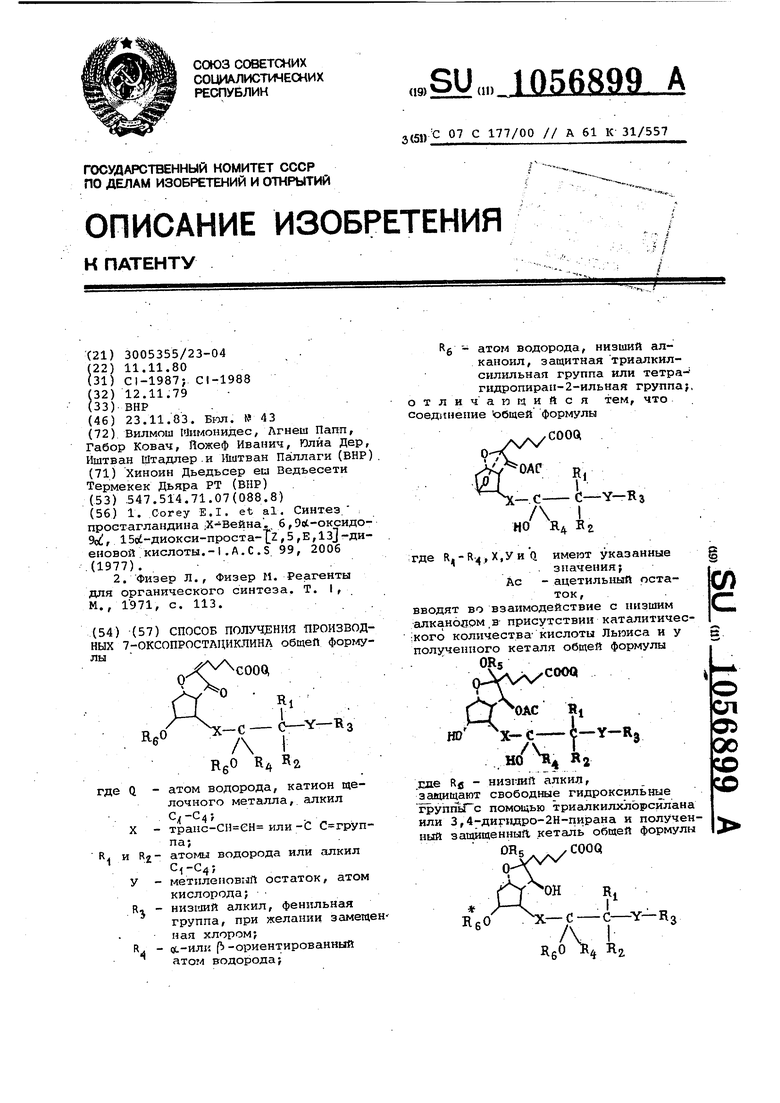

Изобретение, относится к способу
получения новых стабилизированных аналогов простациклина, а именно производных 7-оксопростпциклина общей форгчулы
COOQi
А:
R,
i-Y-
Ъсс -
R.O
л
«2
RfiO Н
и атом водорода, катион щелочного металла, гшкил транст-СН СН-или - Г С-группа;
X R; и Rn - атомы водорода или алкил
г- .
У - метиленовый остатоку атом
кислорода; R - низший алкил, фенильная
группа, при желании замещенная хлором; 4 ИЛИ I -ориентированный
атом водорода;
Rt - атом водорода, низший алканоил, защитная триалкилсилильная группа или тетрагйдропиран-2-ильная группа, обладающих ценными фармакологическими свойсТв-ами.
Известен простациклин - один из важнейших членов в цепи метаболизма арахидоновой кислоты , проявляющий способность понижать давление крови и тормозить агрегацию тромбоцитов ij
Цель изобретения - получение новых аналогов простациклина, расширяющих арсенал биологически активных соеди.нений.
Цель достигается предлагаемым способом получения производных 7-оксопростациклина общей формулы (I), основанным на известном методе размыкания эпоксйдов с помощью бортрифторйдэфирата в оЕ)ганическом растворителе, заключготщимся в том, что соединение общей формулы
(I)
у-R.
где R - R., Х,УиО: имеют «азанные
значения;
Ас - ацетильный остаток, вводят во взаимодействие с низшим алкапо ом в присутствии каталитичес:кого количества кислоты Льюиса и у полученного кеталя общей формулы -Y-Б.. / НО К4 где Rg - низший алкил, защищают свободные гидроксильные группы с помощью триалкилхлорсилан или 3,4-дигидро-2Н-пирана и получе ный защищенный кеталь общей формул ДЧн R, оу с-с-Y-КЗ 4 г RgO где R.- RC Х,У,С1иАс имеют указанн значе шя R имеет значени те же, что и кроме значени атом водород деацетилируют в основной среде и полученный защищенный кеталь обще формулы OR5.A/ 0-Л. ГЛ 1 i R.C ЯсО R4 % где R, - R5-,Rj,X,y и Q имеют указанны значения, после необязательного гидролиза д удаления Rj-(низшего) алкила окис ют в апротонном растворителе с по мощью соединений хрома (VI) и от лученного 7-оксопроизводнбго .обще Wv КбО 4 где R,- Rx, R, Х,Уи1 имеют указа ные значени Rr- - низший алки или атом во дорода, при желании отщепляют защитную группу R и выделяют соединение общей формулы RjOH, в случае, когда Rg низший алкил, путем нагревания в гексаметилфосфортриамиде при eO-lGO C, или, когда Rj - водород, путем азеотропной отгонки в присутствии бензола и безводного сернокислого магния, после чего при желании отщепляют защитную группу f( и/или омыляют сложноэфирную группу и из свободной кислоты получают соль или сложный эфир с последующим их вьщелением известными методами. Пример 1. Метилкеталь метилового эфира 7-ацетокси-6-кето-Р6Рл (формула V, в которой Rj и Q. - метил; R ;| и R2 - атомы водорода X - транс-винильный остаток; R4 р-атом водорода; У - метиленовый остаток; R - пропильный остаток), 1 г соединения формулы (IV), в которой заместители принимают указанные значения, растворяют в 10 мл метилового спирта и к раствору прибавляют каталитическое количество бортрифторидэфирата. Реакционную смесь перемешивают в течение 20 мин, ;После добавления небольшого количества твердого бикарбоната натрия производят отгонку метилового спирта в вакууме и остаток растворяют в . этилацетате, Этилацетатншй раствор промывают водой, насыщенным водным раствором хлористого натрия и затем сушат над безводным сернокислым натрием, фильтруют и производят отгонку растворителя. Оставшийся маслообразный продукт хроматографируют на 120 г силикагеля при использовании в качестве элюирующего средства этилацетата, В результате получают 240 мг (22%) экзо-метилкеталя и 680 мг (63%) эндо-метилкеталя в .форме бесцветного маслообразного вещества. Для экзо-метилкеталя ,31 (элюирующее средство этилацетат). S II ЯМР: 3,64 (ЗН, СООСЮ ; 3,24 (ЗН, ОСПз). Для эпдо-метилкеталя ,26 (элюирующее средство этилацетат) , ЯМР: 3,57 (ЗН, СООСИд);3,14 (ЗН, ОСН, Пример 2. Метилкеталь 11,15-бис -(трет-бутилдиметилсилилового) эфира 7р-ацетокси-6-кеторсРЧ-метилового эфира (формула (VI), где R| - трет-бутилдиметилсилильный остаток, а остальные заместители имеют значения, указанЕше в примере 1). 700 мг (1,52 ммоль) метилкеталя формулы (v), который получен в примере 1, растворяют в 1,4 мл безводного диметилформамида и к раствору прибавляют 517 мг (7,6 JMOль) имидазола. и 552 мг (3,6 ммоль) третбутилдиметилхлорсилана. Реакционную смесь перемеишвают в течение 4 ч при SS-IO C и затем выливают в 30 мл воды. Водный раствор экстрагируют три раза 50 мл дихлорметана. Объеди ненные дихлорметановые экстракты промывают насьлченным водным раствором хлористого натрия, сушат над безводным сернокислым натрием, после чего отгоняют растворитель. Оставншйся маслообразный продукт хроматографируют на 120 г силикагеля, причем элюирование производят смесь гексана и этилацетата в соотношении 8:1. В результате получают 788 мг (75%) целевого соединения в форме бесцветного маслообразного вещества ,42 (элюирующее средство сме гексана и этилацетата в соотношении 7:1). SH ЯМР: 2,05 (ЗН, ОЛс); 0,88 (бН , трет-бутильный остаток). Пример 3. Метилкеталь 11, 15-бис-(трет-бутилдиметилсилилового эфира 7 -окси-б-кето-РGF -метилового эфира, (формула (II), в которой заместители имеют значения, указанные в примере 2). 200 мг (0,29 ммоль) силилового эфира формулы (VI), полученного в соответствии с примером 2, растворяют в 2 мл метилового спирта и к раствору прибавляют каталитическое количество свежекальцинированного углекислого калия. Реакционную смес перемешивают в течение 1ч при ком|Натной температуре. Затем производят отго.нку растворителя в вакууме, и остаток растворяют в этилацетате. Полученный раствор промывают водой и насыщенным водным раствором хлористого натрия и сушат над без водным сернокислым натрием. Фильтру ют и отгоняют от раствора растворитель. Оставшийся маслообразный продукт хроматографируют на 20 г силикагеля, причем в качестве элюирующего средства применяют смесь гекса на и этилацетата (4:1). В результат получают 150 мг (80%) продукта в форме бесцветного маслообразного вещества.. ,5 (элюирующее смес гексана и этилацетата в соотношении 4:1). ИК спектр (пленка):3350 см (ОН) Пример 4. Полукеталь 11, 15-бис-(трет-бутилдиметилсилилового эфира 7р-окси-б-кето-РС,(-метиловог эфира (формула ( I I), где R - атом водорода, остальные заместители име ют значения, указанные в примере 2) 00мг (0,29 ммоль) силилового эфира формулы (VI), полученного в соответствии с примером 2, растворя ют в 2 МП метилового спирта и к при готовленному, рартвору прибавляют 50 мг евежекальцинированного углеки лого калия. Реакционную смесь перемешивают в течение 48 ч при комнатной температуре, после чего производят обработку по методике примера 3. Неочищенный продукт хроматографируют Eia 20 г силикагеля, причем элюирование производят смесью гексана и этилацетата (2:1). В результате получают 113 мг (60%) продукта в форме бесцветного маслообразного вещества. ,I (элюирующее средство .смесь гексана и этилацетата в соотношении 4:1). ЯМР: 3,67 (ЗН, COOCHj) . Пример 5. Метилкеталь Ц, 15-бис-(трет-бутилдиметилсилилового) эфира 7-оксо-б-кето-гР GF,j -метилового эфира (формула (VI), где R - метильный радикал, остальные заместители имеют значения, указанные в примере 2) . 75 мг (0,11 ммоль) соединения Формулы (II), полученного в соответствии с примером 3, растворяют в 0,7 мл диклорметана и к раствору прибавляют 63 мг (0,29 ммоль) хлорхромата пиридиния. .Реакционную смесь обрабатывают натрийацетатным буферным раствором и затем в течение 5 ч.перемешивают при комнатной температуре. Затем реакционную смесь - фильтруют, промывают дихлорметаном и объединенные фазы упаривают. Остаток хроматографируют на 10 г силикагеля при применении в качестве элюирующего средства смеси гексана и. гексилацетата (12:1). В результате получают 56 мг (75%) продукта в форме бесцветного маслообразного вещества. ,59 (элюирующее средство смесь гексана и этилацетата в соотношении 7:1). ИК-спектр (пленка): 1735 (), 100-1250 (О-С-О). Пример 6. Полукеталь 11, 15-бис-(трет-бутилдиметилсилилового) эфира 7-оксо-6кето--РСР 5(-метилового . эфира (формула (VI), где Rr - атом водорода, остальные заместители имеют значения, указанные в примере 2), 50 мг 0,08 ммоль силилового эфира формулы (IV), полученного в соответствии с примером 4 (R5 обозначает атом водорода), растворяют в 0,5 мл дихлорметана и к приготовленному раствору прибавляют 45 мг (0,21 ммоль) хлоркарбоната пиридиния. Реакционную смесь в течение 6 ч перемешивают при комнатной температуре. Затем реакционную смесь обрабатывают по методике примера 5, после чего неочищенный продукт хроматографируют на 10 г силикагеля при применении в качестве элюирующего средства смеси этилацетата и гексана (1:1). В результате получают 37 мг (75%) целевого соединения
в форме бесцветного маслообразного вещества.
R,0,55 (элюирующее средство .смесь этилацетата и гексача в соотношении 1:1).
ИК-спектр (пленка):3300 (ОН), 1730 см ().
Пример 7. Метилкеталь 11, 15-бис-(тетрагидропиран-2-илового) эфира 7(}-ацетокси-6-кето-РСРд -метилового эфира (формула (IV), где Rj - тетрагидрого1ран-2-ильный остаток, остальные заместители имеют значения, указанные в примере 1).
570 мг (1,24 ммоль) соединения формулы (III), полученного в соответствии с примером 1, растворяют в 5 мл безводного дихлорметана и к приготовлен юг раствору прибавляют 1,13 мл (12,4 ммоль) безводного 3,4-дигидро-2Н-пирана и катапити- ческое количество паратолуолсульфокислоты. Реакционную смесь перемешивают в течение 10.мин при комнатной температуре, после чего ее разбавляют 50 мл этилацетата. Этилацетатный раствор промывают насыщенным водным раствором кислого-углекислого натрия, водой и насыщенным раствором хлористого натрия, сушат над сернокислым натрием, фильтруют, после чего производят отгонку растворителя. В результате получают 831 мг неочищенного продукта в форме окрашенного в светло-желтый, цвет маслообразного вещества.
R,0,55 (элюирующее средство
смесь бензола и этилацетата в соотношении 1:1)..
ИК-спектр (пленка): 1740 (), .1000-1200 (0-СН-О) .
Полученный продуктбез дополнительной очистки применяют для осу-. ществления посйледующей реакции.
Пример 8. Метилкеталь 11,
15-бис-(тетрагидропиран-2-илового) эфира 7р-окси-б-кето-Р GF -метилового эфира (формула (V), где за;Местители имеют значения, указан ные в примере 7).
831 мг (1,52 ммоль) соединения формулы (IV), полученного в примере 7 ,. растворяют в 8 мл метилового спирта и к приготовленному раствору прибавляют каталитическое количеств свежекальцинированного углекислого калия. Реакционную смесь перемешива в течение 1 ч при комнатной температуре и затем обрабатывают по методике примера 3. Полученный в виде остатка маслообразный продукт хроматографируют на 40 г силикагеля, причем в качестве элюирующего средства применяют смесь бензола и этилацета (1:1). В результате получают 417 мг
(65%) целевого соединения в форме бесцветного маслообразного вещества.
,35 (элюирующее средство смес бензола и этилацетата в соотношении 1:1).
ИК-спектр (пленка): 3350 (ОН), 1735 (СаЮ), 1000-1200 см- О-СН-О) .
Пример 9. Метилкеталь 11. 15-бис-(тетрагидропиран-2-илового) эфи-ра 7-оксо-б-кето-Р GF i -метиловог.о эфира (формула (Vl), где заместители имеют значения, указанные в примере 7) .
344 мг (0,59 ммоль) соединения формулы (V), полученного в соответствии с примером 8, растворяют в 3,5 мл дихлорметана и к приготовленному раствору прибавляют 254 мг (1,18 ммоль) хлорхромата пиридиния. Реакционную смесь обрабатывают натрийацетатным буферным раствором и затем в течение 5 ч перемешивают при комнатной температуре. Непосредственно после этого реакционную смесь обрабатывают по методике примера 5. Неочищенный продукт хроматографируют на 30 г силикагеля при применении в качестве элюирующего средства смеси бензола и этилацетата (1:1). В результате получают 275 мг (80%). целевого соединения в виде бесцветного маслообразного вещества.
,57 (элюирующее средство смесь бензола и этилацетата в соотношении 1:1),
ИК-спектр (пленка): 1730-174.0 (С«0), 1000-1200 СМ- (0-СН-О).
Пример 10. Метилкеталь 7-оксо-б-кето-Р GF jj-метилового эфира (формула (VI), в которой Rg - атом водорода, остальные заместители имеют значения, указанные в примере 1).
194 мг (0,33 ммоль) метилкеталя, полученного в соответствии с примером 9 и отвечающего формуле (IV), где R - тетрагидропиранильный остаток, а другие заместители имеют значения, указанные для целевого продукта, растворяют в 10 мл метилового спирта и к приготовленному раствору прибавляют каталитическое количество паратолуолсульфокислоты. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре, после чего в вакууме производят отгонку растворителя. Остаток растворяют в этилацетате, этилацетаный раствор промывают насыщенным (Раствором кислого углекислого натри водой и затем водным раствором хлористого натрия, сушат над сернокислым натрием, фильтруют и затем производят отгонку растворителя.
Оставшийся маслообразный продукт хроматографируют на 15 г силикагеля причем в качестве элюирующего средсва применяют смесь (2:1.) бензола и этплацетата. В результате получают 117 мг (85%) целевого соединения в форме бесцветного маслообразного вещества. R.0,34 (элюирующее средство эти ацетат) , &Н ЯМР (СНСеа):3,67 (СООСНП, ЗД7 (ОСН,). ИК- спектр (пленка) : 3350 (ОН) , 1735 см- (). . Пример 11. Метиловый эфир 7-оксопростациклина (формула (I), где Q - метильныП радикал; R ij и Rj атомы водорода; X - транс-винильный остаток; RjT-p -атом водорода; У - ме тиленовый остаток; R - пропильный радикал). . 20 мг (0,31 ммоль) соединения формулы (VI), полученного в соответ ствии с примером 5 (Rj обозначает метильный радикал; К - диметил-трет бутилсилильный остаток, остальные заместители имеют значения, указанные для целевого продукта), растворяют в 5 мл гексаметилтриамида фосфорной кислоты. Реакционную смесь перемешивают р течение 3 ч при 1501бО С и затем выливают в 18 мл воды Водную фазу экстрагируют 3x15 мл эти ацетатом и объединенные этилацетатные экстракты промывают насыщенным раствором хлорисТого натрия, сушат над безводным сернокислым натрием, фильтруют и затем производят отгонку растворителя. Полученные в виде остатка 250 мг продукта растворяют в 5 мл тетрагидрофурана и после добавления двух эквивалентов фторида тетрабутиламмония смесь перемешивают в течение 3 ч при комнатной температуре. Затем производят отгон ку растворителя в вакууме и получен ный остаток растворяют в этилацетате. Этилацетатный раствор промывают водой, насыщенным водньм раствором хлористого натрия, сушат над безводным сернокислым натрием, фильтру ют и затем производят отгонку растворителя. Полученное в виде остатка маслообразное вещество хроматографируют на 10 г силикагеля этилацетатом. В результате получают 62 мг (50%) целевого соединения в форме бесцветного маслообразного вещества R 0,4 4 (элюирующее средство этилацетат). S1 Н ЯМР:5,37 (1Н, t, 0-С-СН-) ; 3,76 (ЗН, S, -СООСН.). Пример 12. Метиловый эфир 7-оксопростациклина. 200 мг (0,31 ммоль) полученного в соответствии с примером 6 соединения общей формулы (VI), где Ry атом водорода; R| - диметил-третбутилсилильный остаток, остальные заместители имрют значения, указанные в примере 11, в 30 мл безводного бензола нагревают в течение 2 ч при температуре кипения смеси в экстракторе Сокслета в присутствии безводного сернокислого магния. Органическую фазу промывают водой и затем насыщенным водным раствором хлористого натрия, после чего сушат над безводным сернокислым натрием, фильтруют и отгоняют растворитель, Неочищенный продукт обрабатывают в тетрагидрофуране двумя эквивалентами фторида тетрабутиламмония и реакционную смесь обрабатывают по методике примера 11. Затем смесь хроматографируют на 10 г силикагеля этилацетатом. В результате получают 52 мг (45%) целевого соединения в форме бесцветного маслообразного вещества. Продукт имеет физические константы, указанные в примере 11. Пример 13. Метиловый эфир 7-оксопростациклина. 90 мг (0,215 ммоль) полученного в примере 10 метилкеталя 7-оксо-бкето-РСР| -метилового эфира (формула (VI), где R - атом водорода) растворяют в 0,8 мл гексаметилтриамида фосфорной кислоты и смесь перемешивают в течение 2 ч при 140-150®С. Затем реакционную смесь обрабатывают по методике примера 11. Полученный в виде остатка маслообразный продукт хроматографирУют. на 10 г силикагеля этилацетатом. В результате получают 40 мг (74%) целевого соединения в форме бесцветного маслообразного вещества. Продукт имеет физические константы, указанные в примере 11. Пример 14. 11,15-Диацетат метилового эфира 7-оксопростациклина (формула (I), где Q - метильный радикал ; R л и R - атомы водорода; R4 -| -атом водорода; X - транс-виниловый остаток; У-метиленовый остаток). 100 мг 11,15-диацетата метилкеталя 7-оксо-6-кето-Р СР.-метилового эфира растворяют в 3 мл -гексаметилтриамида фосфорной кислоты и в присутствии 0,05 мл ангидрида уксусной кислоты раствор перемешивают в течение 2 ч при SO-IOO C. Затем реакционную смесь обрабатывают по методике примера 11. Неочищенный продукт хроматографируют на 15 г силикагеля смесью этилацетата и гексана (1:1). В результате получают 70 мг (72%) продукта в форме бесцветного маслообразного вещества. Rz-0,65 (элюирующее средство смесь этилацетата и гексана в соотношении 1:1). Пример 15. Метиловый эфир 16,16-диметил-7-оксопростациклина (формула (I), где R и R2 - метильные радикалы; остальные заместители
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Corey ЕЛ | |||
| et al | |||
| Синтез/ i прост агл аи дин а jX-Вейна | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
1983-11-23—Публикация
1980-11-11—Подача