1- ..,
Изобретение относится к способу получения новых имидазохинолиновьк соединений или их солей, обладакщих фармакологическими свойствами, которые позволяют использовать их в качестве ингибиторов фосфодиэстеразы, антиагрегаторов тромбоцитов крови и/или кардиотонических агентов.
1470192
Цель изобретения - синтез новых производных ряда имидазохинолинов, кторые обладают биологической активностью, превосходящей активность структурного аналога - анагрелида (6,7-дшшор-т1,5-дигидроимидазо(2,1- h)xинaзoлин-2(ЗH)-oн).
Пример 1. Получение имида- зо(4,5-Ь)хинолин-2-тионов.
А. 1,З-дигидро-6-(трифторметил)- 2Н-имидазо(4,5-Ь)хинолии-2-тион (R, 6-СРз, ).,
Стадия 1. 1,1-Диметш1этш1-J 2-C( оксо-2-тиоксо-4 имйдазолидинилиден) метил 3-5-(трифторметил)-фенил J-кар- бамат.
Смесь 1 о 1 диметилэтил- 2-формю1- 5- (трифторметкл) -фенил --карбамата (20 г, 60 ммоль) и 2-тиогидантоина (8,02 г 60 ммоль), этанола (60 мл) воды (60 мл) и морфолина (6 мл) нагревают на паровой бане. Спустя 90 мин смесь охлаждают, оставляют стоять в течение ночи, осадок от- фильтровьшают и сушат в вакууме.
Получают 1,1-диметил - 1:2-(5-окс 2-тиоксо-4-имидазолидинилидён)-мети 5-(трифторметил)-фенил J-карбамат (20,65 г, 77%), т.ил. 216 С (разл„
Вьгчислено, %: С .49,60; Н 4,16; N 10,85; S 8,27. ,
; C.H FiNgOgS
Найдено, %: С 49,56; Н 4,10; N 10,92; S 7,96.
Стадия 2. 5- 2-Амино-4-(трифтометил) -фенил 3-метиле1 -2-тиоксо-4-и дазолидинон.
Трифторуксусную кислоту (90 мл) добавляют к смеси 1,1-диметилэтш1- 2-(5-оксо-2-тиоксо-4 имидазолидин лиден)-метил -5-(трифторметил)-фен карбамата (18 г, 46 ммоль) и анизола (36 г, 0,,3 моль). При растворен растворитель упаривается, остаток кристаллизуется из смеси этанола (65 мл) и хлороформа (135 мл).
Получают 5-l 2-aминo-4-(тpифтop мeтил)-фeнилЗ-мeтшIeнi-2-тиoкco-4- имидaзoлидинoн (9,85 г, 73%), т.пл
240° С.
N
Вычислено, %: С 45,99; Н 2,81; 14,53.
C,,H,,.F3N30S
%: С 46,00; Н 2,81;
Найдено,
N 14,54.
Стадия 3. 1,З-Дигидро-6-(трифтометил ) -2Н-имидазо (4,5-.Ъ) хиноЛин-2ТИОНо
N
J Смесь 5 Ц2-амино-4-(трифторметил) -фенил J-метиленj-2-тиоксо-4-ими- дазолидинона (3,63 г, 12 ммоль), то- зипата пиридиния (1,8 г) и дифенкло- вого эфира (5,4 г) нагревают при 180 С в атмосфере аргона. Спустя 18 мин смесь охлаждают, добавляют хлороформ (60 мл), смесь нагревают с обратным холодильником. Спустя 30 мин твердое вещество отфильтровывают и растворяют в смеси воды (80 мл) и 10%ном растворе гидроокиси натрия (5 мл) при подогревании. При добавлении уксусной кислоты выпадает . тяжельй осадок, который отфильтровывают, промывают водой и сушат в вакууме.
Получают 1,З-дигидро-6-(трифторметил )-2Н-имидазо (4,5-Ь)ХИНОЛИН-2-ТИ- он (1,79 г, 52%), т.пл. вьше ,
Вьтислено, %: С 49,07; Н 2,25; 15,61.
N 5
0
5
0
С 48,92; Н 2,23;
N
0
5
Найдено, %: 15,58.
Б. 1,3-Дигидро-7,8-диметил-2Н-ими- дазо(4,5-Ь)хинолин-2-тион (R i R Rj 8-СНз получают аналогично А, заменив 2-амино-4-три- фторбензальдегид 2-амино-5,6-диме- тил-бензальдегидом.
Пример 2с 1,1-Диметилэтил- (2-формил-5-трифторметилфенил)гкарбамат.
А. 1,1-ДимeтшIЗTил- 5-(тpифтop- мeтил ) -фенил карбамат .
Смесь 3-аминобензотрифторида (16 г, 0,1 моль) с ди-трет-бутилди- карбонатом (32 г, 0,15 моль) и тет- рагидрофурана (ТГФ) (25 мл) перемешивают при комнатной температуре в течение 90 мин, а затем нагревают при температуре дефлегмации в течение 90 мин. Смесь разбавляют водой (10 мл), оставляют стоять в течение ночи и концентрируют в вакууме. Остаток растворяют в гексане (100 мл) при нагревании с обратным холодильником, обрабатьтают активированным углем, фильтруют и охлаждают до О С в течение 16 ч.
Получают 1,1-димeтилэтил- 5-(тpи- фтopмeтил)-фeнилJ-кapбaмaт (выход 75-80% после нескольких прогонов), т.пл. 75-76 с.
Вычислено, %: С 55,17; Н 5,40; N 5,36
С i,H ,4 iNO -j
Найдено , %:-t 55,13; Н 5,45; N 5,33.
В. 1,1-Диметилэтш1-(2-формил-5- трифторметилфенил)-карбамат-8-бутил- литий (15 мл) 1,45 М раствора в ТГФ (22 ммоль) добавляют по каплям к пе- реме1шваемому раствору 1,1-диметил- (трифторметил)-фенил3-карбаг мата (2,61 г, 10 ммоль) в сухом ТГФ (40 мл), поддерживаемому при -40°С .в атмосфере аргона. Спустя 40 мин добавляют Н,М-диметилформамид (1,15 мл, 15 ммоль) и смесь перемешивают при -40°С В течение 10 мин перед разбавлением диэтилрвым эфиром (30 мл). Смесь промывают.10%-ным раствором уксусной кислоты (30 мл) и насыщенным раствором хлористого натрия (30 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток хроматографируют на колонке из двуокиси кремния с использование гексана и этилацетата (95:5) в качестве элюента.
Получают 1,1-диметилэтил- 2-фор- мил-5-(трифторметил)фенилЗ-карбамат
выход 70-84%.
Вь числено, %: С 53,98; Н 4,87; N 4,84
Ci5Hi4F3N03
Найдено, %: С 53,67; Н 4,87; N 4,85.
Пример 2. 1,З-Дигидро-6- . (трифторметил)-2Н-имидазо(4,5-Ь)хиНОЛИН-2-ОНЫ.
А. 2-(Уетилтио)-6-(трифторметил)1Н-имидазо(4,5-Ь)-хинолин.
40
Суспензию 1,3-дигидро-6-(трнфтор- етил)-2Н-имидазо(4,5-Ь)хинолин-2- тиона (0,53 г, 2 ммоль) в метаноле (5 мл) обрабатывают 50%-ной водной гидроокисью натрия (0,18 г). Получен- 45 ный раствор, охлаждают на ледяной бане, добавляют метилиодид (0,3 г, 0,13 мл, 2,1 ммоль). Смесь перемешивалась в течение 90 мин перед фильтрованием. Твердое вещество промьгеают метанолом и сушат на воздухе. Получают 2-(метш1тио)-6-(трифтор- метил)-1Н-имидазо(4,5-Ъ)хинолин- (0,34 г, 61%), т.пл. вьше 270 С.
Вычислено, %: С 50,88; Н 2,85; N 14,83.
C.oHoFjNi
Найдено, %: С 50,50; Н 2,83; N 15,01.
55
50
ЯМР (ДМСО-dg) сС , ч.на-млн: 2,81 (ЗН, с., -СН); 7,70 (Ш, дв.д., 8,5 Гц, 2,Гц, ароматический Н орто кСРз); 8,29 (2Н, м., ароматический , Н); 8,46 (1Н, с., ароматический Н орто к N-C-SMe); 13,70 (1Н, широкий с., NH).
Б. 1,3-Дигидpo-6-(тpифтopмeтил)- 2Н-имидазо(4,5-Ь)хинолин-2-он.
Смесь 2-(метш1Тио)-6-(трифторме- тип)-1Н-имидазо(4,5-Ь)хинапина (1,77 г, 6 ммоль), уксусной кислоты (25 мл) и 3 Н. раствора соляной кис- ЛОТЫ (25 мл) нагревают на паровой бане в течение 4 ч. Раствор разбав- ляют горячей водой (250 мл), охлаж- .дают и фильтруют. Фильтрат концентрируют, получаа еще один сбор продук- та. Твердые вещества смешивают с уксусной кислотой (25 мл) и 3 н. раствором соляной кислоты (25 мл). Смесь нагревают на паровой бане в течение ночи, разбавляют горячей водой (250 мл) и охлаждают. Твердое вещество собирают и сушат в вакууме.
Получают 1,3-днгидpo-6-( мeтил)-2H-имидaзo(4,5-b)xинoлин-2- oн (1/38 г, 83%), т.пл. выше 250 С. Вьиислено, %: С 52,18; Н 2,39;
N 16,60.
,
N
5
0
5 С iiH FjiMj
Найдено, %: С 52,04; Н 2,43; 16,64.
Аналогично примеру 1 получают соединения по примерам 3-26.
П р и м е р 3. 8-Хлор-1,3-дигид- ро-2Н-имидазо(4,5-Ь)хинолин-2-он в виде твердого вещества.
Кристаллизацией из метанола получают гидратированный 8-хлор--1,3-ди- гидpo-2H-имидaso(4,5-b)xинoлин-2-oн,
т.пл. -7360 С. .
Вычислено, %: С 52,24; Н 2,82; 18,98; С1 16,01; 0,81. С1оНьС1НзО 0,1 Найдено, %: С 54,18; Н 2,93; 18,93; С1 1.5,76; Н,0 0,75. ЯМР (ДМСО-а); f, ч.на млн: 7,44- 7,65 (2Н, м.); 7,69 (1Н, с.); 7,80 (1Н, дв. д., 3 Гц, 6 Гц); 11,18 (1Н, широкий с.); 11,70 (1Н, широкий с).
П р и м е р 4. 7-Фтор-1,3-дигид- ро-2Н-имидазо-(4,5-Ь) хинолин-2-он. 55 Добавлением дихлорметана осаждают 7-фтор-1,3- дигидро-2Н-имидазо- (4,5-Ъ)хинолйн-2-он в виде дихлор- ..метандиметилсульфоксидного сольвата гидрата, т,шт. 7360 С.
N
N
50
Вычислено, %: С 56,72; Н 3,19; N Н,,0 1,68
СбНйГЫзО.О,2 H.jO.0,05 CHjCl 0,05 CxHiOS
Найдено, %: С 57,01; Н 3,09; N 19.24: Н«0 1,66.
ЯМР (ДМСО-dg); cf, ч.на млн;2,60
О
К (ппфокий с., CHjSCH.3.); 5,75 (с.,
,У; 7,20-7,95 (4Н, м.); 11,30 (2Н, широкий с.).
Пример 5. 8-Метил-1,3-дигид- po-2H-и идaзo(4,5-b)xинoлиц-2-oн,
При добавлении простого эфира образуется остаток в ви,це гидрата 8-метил-1,3-дигидро-2Н-имидазо(4,5-Ь) хинолнн-2-она, т.пл. 350-355°С (разл.
Вьгчислено, %: С 54,60; Н 4,46; N 17,37; С1 -14,61; Н,0 2,61
C,H9N/)-HCl 0,35
Найдено, %: С 54,30; И 4,15; N 17,49; С1 14,54; 0,38
ЯМР (ДМСО-d); ч.на млн: (ЗН, с.); 7,35 (1Н, д., 8 Гц); 7,54 (1Н, д., 8 Гц),; 7,80 (1Н, с.); 7,83 (1Н, д., 8 Гц); 9,72 (1Н, широкий с. 11,70 (1Н, широкий с.).
П р и м е р 6. 7-Метил-1,3-дигид- ро-2Н-имидазо(4,5-Ь)хинолин-2-он.
Светло-коричневое твердое вещество отфильтровывают и растворяют в 10%-нон хлористом водороде в метаноле. Добавлением простого эфира осаждают 7-метил-1,3-дигидpo-2H-имидa- зo(4,5-b)xинoлин-2-oнa в виде гидра:- та гидрохлорида, т.пл,, .
Вьгчислено, %: С 54,81; Н 4,43; N 17,48; С1 14,71; HiO 2,24
С i HgNjO-HCl -0,3 HjO
Найдено, %: С 55,15; Н 4,56; N 17,16; С1 14,03; 0,69.
ЯМР (flMCO-d); с, ч. на млн.: 2,45 (ЗН, с.); 7,44 (1Н, д., 8 Гц); 7,75 (2Н, с.); 7,90 (1Н, д., 8 Гц); 11,00 (1Н, широкий с.); 11,62 (1Н, широкий с.).
Пример 7. 7-Хлор-1,3-дигид- ро-2Н-имидазо(4,5-Ь)хинолин-2-он.
Добавлением дихлорметана получают гидратированный 7-хлор-1,3-дигидро- 2Н-имидазо(4,5-Ь)хинолин-2-он, т.пл. 7360°С.
Вычислено, %: С 54,24; Н 2,82} N 18,98; С1 16,01; Н-гО 0,81,
C,,H ClNjO 0,1 Hop
Найдено, %: С 54,36; Н 2,83; N 18,88; С1 15,29; H-iO 0,52.
(AMCO-dg); сГ, чона млн: 7,46 (1Н, дв.д., 2 Гц, 9 Гц) 7,59 (1Н, синглет); 7,79 (1Н, д., 9 Гц); 7,99 (1Н, д., 2 Гц); 11,10 (1Н, широкий с.); 11,50 (1Н, широкий с.).
Пример 8. 1,3-Дигидро-6,7- диметш1-2Н-имидазо(4,5-Ь)хинолин- 2-ч)н.
Кристаллизацией из метанола получают 1,З-дигидро-6,7-диметил-2Н-ими- дазо(4,5-Ь)хинолин-2-он в виде гидрата гидрохпорида, т.пл. 360°С.
Вычислено, %: С 57,10; Н 16,65; N 16,65; НгО 1,07
HCl- 0,15 НгО Найдено, %: С 57,04; Н 5,01; N 16,57; HjO 1,02.
ЯМР (ДМСО-d); с , ч.на млн:. 2,36 (ЗН, с.); 2,39 (ЗН, с.); 7,70 (ЗН,с.).
Пример 9. 1,3-Дигидpo-7,8- димeтил-2H-имидaзo (4 ,5-Ь)хинолин-2- он.
Нерастворимое коричневое твердое вещество суспендируют в кипящем ме- о-аноле и фильтруют.
Получают 1,3-дигидpo-7,8-димeтшI- 2H-имидaзo(4,5-b)xинoлин-2-oн в виде гидрата гидрохлорида, т.пл. 360 С, Вычислено, %: С 56,90; Н 4,93;
N 16,59; 1,42
,,N30 HCl.0,2 HjO
Найдено, %; С 57,01; Н 4,89; N 16,33; 1,07.
5 ЯМР (ДМСО-dt) (СГзСО Н), с/, ч.на млн: 2,41 (ЗН, с.); 2,52 (ЗН, с.); 7,59 (2Н, АН кв., 9 Гц); 7,89 (1Н, с.); 11,50 (ЗН, широкий с.).
Б. Гидрат 1,3-дигидpo-7,8-димe- 0 тил-2Н-имидазо(4,5-Ь)хинолин-2-она.
Вещество суспендируют в кипящем метаноле (2л). Порциями добавляют йод (38,7 г, 0,15 моль) в течение 30 мин. Нагревание с обратным холодильником продолжают в течение дополнительных Ю мин, смесь концентрируют до объема приблизительно 400 мл и добавляют раствор тиосульфата натрия (60 г) и карбоната натрия (60 г) в воде (600 мл). Осадок собирают, промывают водой и метанолом и затем растворяют с водой (500 мл). Растертое твердое вещество собирают, суспендируют в кипящем 5 метаноле (200 мл), охлаждают и фильтруют.
Получают гидратированный 1,3-ди- гидро-7,8-диметил-2Н-имидазо(4,5-Ь)- ХИНОЛИН-2-ОН (88%), т.пл. .
5
0
Вычислено, %: С 66,47; Н 5,30; N 19,38, Н,0 1,66
С .гH 11ЙэО 0 2 H.,0
Найдено, %: С 66,14; Н 5,12; N 19,32; HiO 1,0;
ЯМР (JH-lCO-d), f, ч.на млн: 2,41 (ЗН, с.); 2,49 (ЗН, с.); 7,45 (2Н, АВ кв., 9 Гц); 7,62 (1Н, с.); 10,90 (1Н, с.); 11,30 (1Н, широкий с.).
Пример 10. 1,3-ДИГИДРО.-7- 5слор-6-метил-2Н-имидазо (4,5-Ь)хино- ЛИН-2-ОН, Т.Ш1. 360 С.
Вычислено, %: С 56,55; Н 3,45; N 17,98; С1 15,17.
С iHgClNjO
Найдено, %: С 56,34; Н 3,42; N 17,71; С1 14,83.
ЯМР (ЛМСО-d j) , cf , ч.на млн: (ЗН, с.); 7,55 (1Н, с.); 7,72 (1Н, с.); 7,98 (1Н, с.).
Пример 11. 1,3-Дигидро-8- метокси-2Н-имидазо(4,5-Ь)хинолин-2- он в виде гидрата (91%), т.пл. 300°С.
Вычислено, %: С 60,13; Н 4,36; N 19,13; Н-гО 2,05 С i,H5N30i-0,25
Найдено, %: С 59,85; П 4,12; N 18,78; 1,26.
ЯМР (ЛМСЬ-d), f, ч. на млн: ,3,97 (ЗН, с.); 6,88 (1Н, дв.д., 4 Гц, 5 Гц); 7,35-7,50 (2Н, м.);
ЧАи,, - ,
7,71 (1Н, с.); 10,98 (1Н, широкий с.), N 14,3S
Пример 14. 7-Метокси-1,3- дигидро-2Н-имидазо(4,5-Ь)хинолин- 2-он получают перекристаллизацией из водного диметилформамида, т.пл. .
Вычислено, %: С 61,39; Н 4,22; N 19,53,
C HgNjOj
10 Найдено, %: С 61,21; Н 4,27; N 19,53.
ЯМР (JIMCO-d(,), сС, ч. на млн: 3,79 (ЗН, с.); 7,10 (1Н, дв.д.; 3 Гц, 9 Гц); 7,28 (1Н, д., 3 Гц); 7,48 (1Н, 15 с.); 7,65 (1Н, д. 9 Гц); 10,90 (1Н, широкий с.); 11,32 (1Н, широкий с.). Пример 15. 1,3-дигидро-6,7- дкметокси-2Н-имидазо(4,5-Ъ)хинолин- 2-он в виде белого порошка, т.пл. 20 у 320°С.
Вычислено, %: С 58,77; Н 4,52; N 17,13.
С,Н,Оэ
Найдено, %: С 58,38; Н 4,55; 25 N 17,09.
ЯМР (JIMCG-d), f, ч. на млн: 3,88 (6Н, с.); 7,20 (1Н, с.); 7,30 (1Н, .. с.);- 7,49 (1Н, с.); 10,50-11,50 (2Н, широкий с.).
30 Пример 16. 7-Бром-1,3-дигид- ро-6,8-диметил-2Н-имидазо(4,5-Ь)хино- ЛИН-2-ОН, т.пл. 300°С,
Вычислено, %: С 49,34; Н 3,45;
11,45 (1Н, широкий с.).
Пример 12. 1,З-Дигидро-8- хлор-7-метил-2Н-имидазо(4,5-Ь)хино- ПИН-2-ОН в виде гидрата (55%), т.пл 7360 С.
Вычислено, %: С 55,69; И 3,57; N 17,71; 1,52.
С „HgClNaO 0,2
Найдено, %: С 54,61; Н 3,47; N 17,11; Н,0 1,43
35
Найдено, %: С 49,27; Н 3,50; N 14,42.
ЯМР (CFj,CO,H), cf, ч. на млн: 2,76 40 (ЗН, с.); 2,98 (ЗН, с.); 7,81.
Пример 17. Кислотно-аддитивные соли предлагаемых соединений могут быть получены с помощью подкисле- ния остаточного вещества в подходящем
ЯМР (ДМСО-dj, сГ, ч.на млн: 2,50 45 Растворителе. Например, обработкой
лиг . &- , ,„ „ т q Оо тртг ягипГ)О-2Н-ИМШ
(ЗН, С.); 7,57 (2Н, АБ кв., 8 Гц);
UH с ;; / / v.n, . ..., . ....8-метил-1,3,9,9а-тетрагидро-2Н-имида7 69 (1Н с ); 11,10 (1Н, широкийс.);зо(4,5-Ь)хинолин-2-она иодом и раст-.
1 60 (1Н, с.).ворением нерастворимого продукта в
пример 13. 7-Хлор-1,3-Дигид-10%-ном мет.анольном растворе хлорисро-6,8-диметил-2Н-имидазо(4,5-Ь)хино-50 о водорода с последующим Добавлеi w U , 1 м . о -.„.. „,,т,1т1лплтч-1 оАыпя гtnпVЧЯЮT ХЛОО
ЛИН-2-ОН, т.пл. .
Вычислено, %: С 58,19; Н 4,07; N 16,97.
С 72 loClNjOНайдено, %: С 57,92; Н 4,10; . N 17,03.
ЯМР (CFjCO H), tf, ч.на млн: 2,73 (ЗН, с.); 2,93 (ЗН, с,); 7,84 (1Н, с.); 8,90 (1Н, с.).
нием диэтилового эфира получают хлор- гидрат 8-метил-1,3-дигидpo-2H-имидa- зo,(4,5-b)xинoлин-2-oн(72%) , т.пл. ЗбО-ЗбЗ С.
55 Вычислено, %: С 56,06; Н 4,28; N 17,83,.
С НС1
Найдено, %: С 55,95; Н 4,24; N 17,65.
/ТО
470192 О
Пример 14. 7-Метокси-1,3- дигидро-2Н-имидазо(4,5-Ь)хинолин- 2-он получают перекристаллизацией из водного диметилформамида, т.пл. .
Вычислено, %: С 61,39; Н 4,22; N 19,53,
C HgNjOj
10 Найдено, %: С 61,21; Н 4,27; N 19,53.
ЯМР (JIMCO-d(,), сС, ч. на млн: 3,79 (ЗН, с.); 7,10 (1Н, дв.д.; 3 Гц, 9 Гц); 7,28 (1Н, д., 3 Гц); 7,48 (1Н, 15 с.); 7,65 (1Н, д. 9 Гц); 10,90 (1Н, широкий с.); 11,32 (1Н, широкий с.). Пример 15. 1,3-дигидро-6,7- дкметокси-2Н-имидазо(4,5-Ъ)хинолин- 2-он в виде белого порошка, т.пл. 20 у 320°С.
Вычислено, %: С 58,77; Н 4,52; N 17,13.
С,Н,Оэ
Найдено, %: С 58,38; Н 4,55; 25 N 17,09.
ЯМР (JIMCG-d), f, ч. на млн: 3,88 (6Н, с.); 7,20 (1Н, с.); 7,30 (1Н, .. с.);- 7,49 (1Н, с.); 10,50-11,50 (2Н, широкий с.).
30 Пример 16. 7-Бром-1,3-дигид- ро-6,8-диметил-2Н-имидазо(4,5-Ь)хино- ЛИН-2-ОН, т.пл. 300°С,
Вычислено, %: С 49,34; Н 3,45;
N 14,3S
Найдено, %: С 49,27; Н 3,50; N 14,42.
ЯМР (CFj,CO,H), cf, ч. на млн: 2,76 40 (ЗН, с.); 2,98 (ЗН, с.); 7,81.
Пример 17. Кислотно-аддитивные соли предлагаемых соединений могут быть получены с помощью подкисле- ния остаточного вещества в подходящем
45 Растворителе. Например, обработкой
50 о водорода с последующим Добавле-.„.. „,,т,1т1лплтч-1 оАыпя гtnпVЧЯЮT ХЛОО
нием диэтилового эфира получают хлор- гидрат 8-метил-1,3-дигидpo-2H-имидa- зo,(4,5-b)xинoлин-2-oн(72%) , т.пл. ЗбО-ЗбЗ С.
55 Вычислено, %: С 56,06; Н 4,28; N 17,83,.
С НС1
Найдено, %: С 55,95; Н 4,24; N 17,65.
11
12
1А70192
ЯМР (даСО-df), сГ , чГна млн: 2,63 Найденс , %: С 57,11; Н 4,75; (ЗН, с.); 7,33 (1Н, д., 8 Гц); 7,50 N 16,57.
((1Н, т., Гц); 7,76 (1Н, с.); 7,82 ЯМР (flMCO-d), , ч.на млн: 2,66 - -. -- зн, с., ароматический CHj); 3,41
&Vy f у .J.- г f у 7
Ч1Н, д., 8 Гц); 11,60 (1Н, с.), 11,90 (2Н, широкий с.).
Пример 18. 7-Бром-1,3-дигид- ро-2Н-имидазо(4,5-Ь)хинолин-2-он, т.пл. выше .
Вычислено, % С 45,49; Н 2,30; N 15,92., ,
CioHgBrNjO,
Найдено, %: С 45,69$ Н 2,42; N 15,85.
ЯМР (ДМСО-d), сГ, ч.на млн: 7,61 (1Н, дв.д., 9 Гц, 2 Гц, ароматический Н); 7,62 (1Н, с.); 7,71 (1Н, д., 9 Гц); 8,15 (1Н, д., 2 Гц).
П.р и м е р 19о 1,3-дигидро-7- (1-метилэтокси)-2Н имидазо(4,5-Ь)- ХИНОЛИН-2-ОН, т.пло выше 320 С.
Вычислено, %: С 64,19; Н 5,39; N 17,27..
.C,,,Hi,
Найдено, %: С 64,31,-; Н 5,40; N 17,11.
5ШР (.mCO-d () f f t ч„ на млн: 1,35
(6Н, д., 5,5 Гц, ); 4,68 (1Н,
СИ 3
м., ОСН); 7,16 (1Н, д., 9 Гц, ароматический Н орто по отношению к О- ); 7,35 (1Н, с.); 7,59 1Н, с., ароматический Н орто к NCO); 7,76 (1Н, д., 9 Гц, ароматический Н орто к -0-); 11,04 (1Н, широкий с., NH); 11,45 (1Н, широкий с., Ш).
Пример 20. 1,3-Дигидро-6,7, 8-триметокси-2Н-имидазо(4,5-Ь)хино- ЛИН-2-ОН, т.пл. выше 320 С,
Вычислено, %: С 56,73; Н 4,76; N 15,27.
С зН1эНэ04
Найдено %: С 56,90; Н 4,73; N 15,20.
ЯМР (ДМСО-d), f, ч.на млн: 3,83 (ЗН, с. ОСНз); 3,90 (ЗН, с., ОСНз); 3,95 (ЗН, с., ОСНз); 7,08 (1Н, с., ароматический Н орто к OCHj); 7,51 (1Н, с., ароматический Н орто к NCO); 10,89 (1Н, с., NH); 11,42 (1Н, с,
NH).
Пример 21. 1,З Дигидро-1,8- диметил-2Н-имидазо(4,5-Ь)хинолин- 2-он, т.пл. 340-341 0 (разл.)о
Вьиислено., %: С 57,31; Н 4,89; N 16,71,,
С.,Н „Np-HCl- 0,1 НгО
(ЗН с. N-СНз); 7,29 (1Н д., 7 Гц ароматический Н орто к СНз); 7,45 (1Н, т., ароматический Н мета к СН 7,71 (1Н, д., 7 Гц, ароматический 10 Н пара к CHj); 7,87 (1Н, с., аромат ческий Н орто к NHCO).
Пример 22. 1,3-Лигидро-1,7 диметил-2Н-имидазо(4,5-Ь)хинолин- 2-он, т.пл. вьшзе . 15 Вычислено, %: С 67,36; Н 5,22; N 19,63.
С гН uNjO 0,04 Найдено, %: С 67,04; Н 5,21; N 19,64.
20 ЯМР (7IMCO dj), rf , ч. на млн: 2,46 (ЗН, с., ароматический СНj); 3,35 (ЗН, с., N-СНз); 7,35 (1Н, д., 7 Гц, ароматический Н орто к СНэ); 7,62 (1Н, с., ароматический Н); 25 7,65 (tH, с., ароматический Н); 7,7 (1Н, д., 7 Гц, ароматический Н мета к CHj)o
Пример 23. 1,3-дигидро-7- метокси-1-метил-2Н-имидаз о(4,5-Ь)хи 30 НОЛИН-2-ОН, т.пл. вьш1е 31 .
Вычислено, %: С 62,77 ; Н 4,85; N 18,30; 0,157.. С i,H,,N504-0,02 Н,0 Найдено, %: С,62,43; Н 4,85; 35 N 18,14; Н,0 0,094.
ЯМР (AMCO-d), f, ч, на млн: 3,3 (ЗН, Се, NCHj); 3,86 (ЗН, с., ОСН) 7,18 (1Н, д., 9 Гц, ароматический Н орто к ОСНэ); 7,30 (1Н, с., арома 40 тический Н орто к ОСНз); 7,66 (1Н, с., ароматический Н с. орто к ШСО) 7,71 (1Н, д., 9 Гц, ароматический Н мета к OCHj).
Пример 24. 1,3-дигидро-1,7 45 8-триметил-2Н-имидазо(4,5-Ь)хинолин 2-он, т.пл. вьш1е 300°С (кристаллизо вано из диметилацетамида).
Вычислено, %: С 68,70; Н 5,77; N 18,49.
°
Найдено, %: С 68,36; Н 5,78; N 18,46.
ЯМР (даСО-dj), Г, ч. на млн: 2,4 ,, (ЗН, с., СНз); 2,55 (ЗН, с., СН j); 3,39 (ЗН, с., N-CH); 7,34 (1Н, д., 8,5 Гц, ароматический Н орто к CIlj) 7,57 (1Н, д., 8,5 Гц, ароматический Н мета к СН s); 7,86 (1Н, с., аромат
12
ЯМР (flMCO-d), , ч.на млн: 2,66 зн, с., ароматический CHj); 3,41
(ЗН с. N-СНз); 7,29 (1Н д., 7 Гц, ароматический Н орто к СНз); 7,45 (1Н, т., ароматический Н мета к СН); 7,71 (1Н, д., 7 Гц, ароматический Н пара к CHj); 7,87 (1Н, с., ароматический Н орто к NHCO).
Пример 22. 1,3-Лигидро-1,7- диметил-2Н-имидазо(4,5-Ь)хинолин- 2-он, т.пл. вьшзе . 5 Вычислено, %: С 67,36; Н 5,22; N 19,63.
С гН uNjO 0,04 Найдено, %: С 67,04; Н 5,21; N 19,64.
0 ЯМР (7IMCO dj), rf , ч. на млн: 2,46 (ЗН, с., ароматический СНj); 3,35 (ЗН, с., N-СНз); 7,35 (1Н, д., 7 Гц, ароматический Н орто к СНэ); 7,62 (1Н, с., ароматический Н); 5 7,65 (tH, с., ароматический Н); 7,70 (1Н, д., 7 Гц, ароматический Н мета к CHj)o
Пример 23. 1,3-дигидро-7- метокси-1-метил-2Н-имидаз о(4,5-Ь)хи- 0 НОЛИН-2-ОН, т.пл. вьш1е 31 .
Вычислено, %: С 62,77 ; Н 4,85; N 18,30; 0,157.. С i,H,,N504-0,02 Н,0 Найдено, %: С,62,43; Н 4,85; 5 N 18,14; Н,0 0,094.
ЯМР (AMCO-d), f, ч, на млн: 3,34 (ЗН, Се, NCHj); 3,86 (ЗН, с., ОСН); 7,18 (1Н, д., 9 Гц, ароматический Н орто к ОСНэ); 7,30 (1Н, с., арома- 0 тический Н орто к ОСНз); 7,66 (1Н, с., ароматический Н с. орто к ШСО); 7,71 (1Н, д., 9 Гц, ароматический Н мета к OCHj).
Пример 24. 1,3-дигидро-1,7, 45 8-триметил-2Н-имидазо(4,5-Ь)хинолин- 2-он, т.пл. вьш1е 300°С (кристаллизовано из диметилацетамида).
Вычислено, %: С 68,70; Н 5,77; N 18,49.
°
Найдено, %: С 68,36; Н 5,78; N 18,46.
ЯМР (даСО-dj), Г, ч. на млн: 2,42 ,, (ЗН, с., СНз); 2,55 (ЗН, с., СН j); 3,39 (ЗН, с., N-CH); 7,34 (1Н, д., 8,5 Гц, ароматический Н орто к CIlj); 7,57 (1Н, д., 8,5 Гц, ароматический Н мета к СН s); 7,86 (1Н, с., аромати13 . 1470192 ческий Н орто к NCO); 11,62 (1Н, с.,
NH).
Пример 25. 1,3-Дигидро-7,8- диметил-2Н-имидазо(4,5-Ь)хинолин- 2-он-получают кристаллизацией из диметилацетамида (53,4 г, 65%),т.пл.
выше .
С 67,59; Н 5,20;
14
Вычислено, N 19,71.
С,Н ,,КэО
Найдено, %: С 67,20; Н 5,20; N 19,51.
ЯМР (ДМСО-а), сГ, ч.на млн: 2,41 (ЗН, с., СНз); 2,48 (ЗН, с., СН,); 7.31 (1Н, д., 8 Гц, ароматический Н); 7,55 (1Н, д., 8 Гц, ароматический Н); 7,61 (1Н, с., ароматический Н).
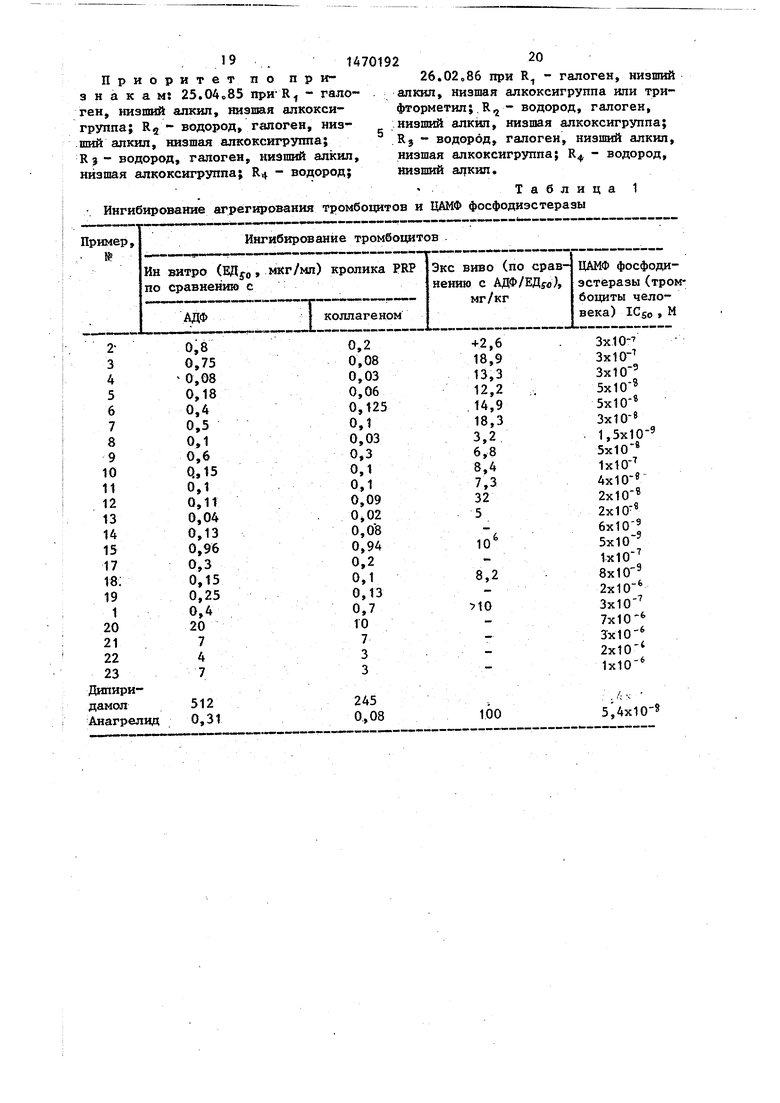
Пример 26. 1,З-дигидро-7Для оценки активности, ин витро различных соединений в отношении ин- гибирования аденозиндифосфата (АДФ) и агрегирования тромбоцитов, вызван ного коллагеном, используют известный метод измерения агрегирования.
Плазму, богатую тромбоцитами (PRP), отделяют от смеси крови кролика и
Q лимонной кислоты (3,8%). Для индуцирования используют АДФ с конечной концентрацией 0,5 мкг/мл или 0,05 мл суспензии коллагена, полученной по известной методике. Различные испыту15 емые соединения растворяют в диметил- сульфоксиде (ДМСО) так, чтобы 5 мкл, добавленных к плазме, богатой тромбоцитами, давали необходимую концентрацию. Проделывают контрольные опыты
Пример, о. I, « - - ... этокси-2Н-имидазо(4,5-Ь)хинолин-2-он, 20 с носителем и сравнивают с опытами
rt.,«Апгчиттгт оыотэaHHr rrv тч ПОРЯТО
агрегирования, вызванного в богатой тромбоцитами плазме, содержащей различные концентрации испытуемых соединений. Получают кривые ответной реак- 25 ции на дозу и вычисляют величины эффективной концентрации (ЕД5о)« В Д ном опыте величины для дипирида- мола - используемого в клиниках ан- титромбогенного агента, составляют
т.пл. вьше 320 С.
Вычислено, %: С 62,88; Н 4,84; N 18,33,
С iiN зО 7
Найдено, %: С 62,68; Н 4,92; N 18,16.
ЯМР (ДМСО-а,), , ч. на млн: 1,36 (ЗН, т., 7 Гц, ОСН.СНз); 4,04 (2Н,
Г; гГаРом ;ич;::иГн о Г; о1)Г ЗО аол;Г5Г2 мкг/. по сравнению с ЛДФ 7;08 (;н Д.. 2,6 Гц, ароматический « 245 мкг/мл по сравнению с колла- Н орто к GEt); 7,26 (1Н, с., ароматический Н орто к NCO); 7,64 (1Н, д., 9 Гц, ароматический Н мета к OEt).
Предлагаемые соединения или их 35 фармацевтически приемлемые соли обладают фармакологическими свойствами, поскольку являются ингибиторами фос- фодиастёразы, антиагрегаторами тромгеном. В табл. 1 приведены результаты для различных исследуемых соединений.
Ингибирование агрегирования тромбоцитов при оральном введении: (метод экс вино).
Агрегометрия проводится ин витро на пробах плазмы, богатой тромбоци;;Г„™Г-„ро™ кард„о.он™еск„- „ - ;,Гд::Пс,.Ге: IIZT.НИИ или носителя. Активность определяют через 2 ч после введения лекарства орально в различных дозах через
ми агентами, в качестве которых селективно усиливают сокращение миокарда, т.е. при лечении или профилактике сердечных состояний, таких как
кр сеопечных состоянии, лсч - - - -- „,,
.ал.„а, „едос.а;о,оо.ь, ког- « зонд J™--- - ;«„ °
да необходима положительная инотроп- ная активность), увеличивают силу сокращения, чрезмерно не увеличивая сердечный ритм. Кроме того, соединения обладают антиметастазньм потенциалом в результате способности ин- гибировать тромбо:щты.
Фармакологические свойства предлагаемых соединений показаны с помощью обычных биологических испытаний ин витро и ин виво.
Ингибирование ин витро агрегирования тромбоцитов. I
плюс несколько капель Твин-20. Активность лекарства выражается в вице
ЕД
50
(доза, необходимая для ингиби- рования вызванного агрегирования на СП 50%), вычисленной по результатам, полученным на группах из 10 животных, подвергнутых лечению различными дозами испытуемого сое лнения,в сравне- нии с отдельными контрольными грг п..,. рами, ээ
В данном опыте величина ЕД ди- пиридамола составляет 100 мг/кг, а анагрелида 4,9,мг/кг. Результаты
14
Для оценки активности, ин витро различных соединений в отношении ин- гибирования аденозиндифосфата (АДФ) и агрегирования тромбоцитов, вызванного коллагеном, используют известный метод измерения агрегирования.
Плазму, богатую тромбоцитами (PRP), отделяют от смеси крови кролика и
лимонной кислоты (3,8%). Для индуцирования используют АДФ с конечной концентрацией 0,5 мкг/мл или 0,05 мл суспензии коллагена, полученной по известной методике. Различные испытуемые соединения растворяют в диметил- сульфоксиде (ДМСО) так, чтобы 5 мкл, добавленных к плазме, богатой тромбоцитами, давали необходимую концентрацию. Проделывают контрольные опыты
« - - ... с носителем и сравнивают с опытами
« - - ... 0 с носителем и сравнивают с опытами
.,«Апгчиттгт оыотэaHHr rrv тч ПОРЯТО
агрегирования, вызванного в богатой тромбоцитами плазме, содержащей различные концентрации испытуемых соединений. Получают кривые ответной реак- 25 ции на дозу и вычисляют величины эффективной концентрации (ЕД5о)« В Д ном опыте величины для дипирида- мола - используемого в клиниках ан- титромбогенного агента, составляют
ЗО аол;Г5Г2 мкг/. по сравнению с ЛДФ « 245 мкг/мл по сравнению с колла-
аол;Г5Г2 мкг/. по сравнению с ЛДФ « 245 мкг/мл по сравнению с колла-
геном. В табл. 1 приведены результаты для различных исследуемых соединений.
Ингибирование агрегирования тромбоцитов при оральном введении: (метод экс вино).
Агрегометрия проводится ин витро на пробах плазмы, богатой тромбоционд J™--- - ;«„ °
люс несколько капель Твин-20. Активность лекарства выражается в вице
ЕД
50
(доза, необходимая для ингиби- рования вызванного агрегирования на 50%), вычисленной по результатам, полученным на группах из 10 животных, подвергнутых лечению различными дозами испытуемого сое лнения,в сравне- нии с отдельными контрольными грг прами,
В данном опыте величина ЕД ди- пиридамола составляет 100 мг/кг, а анагрелида 4,9,мг/кг. Результаты
для предлагаемых соединений приведены в табл. 1.
Ингибирование циклической АМФ фосфодиастеразы (ФДЕ).
Данный анализ осуществляется известным способом.
Меченный тритием циклический аде- нозин-монофосфат (ЦАМФ) инкубируется с ФДЕ - ферментом, полученным из тромбоцитов человека, который превращает часть ЦАМФ в 5 АМФ в пробирках для культуры. Данная реакция заканчивается путем погружения пробирок в кипящую водяную баню, после чего их помещают на лед и в каждую пробирку добавляют аликвоту змеиного яда. Данная реакция при еще одном инкубировании превращает 5 АМФ в аденозин, Дпя связьгоания остающегося циклического АМФ добавляют ионообменную смолу. Пробирки центрифугируют для осаждения смолы, а часть прозрачного плавающего сверху слоя (который содержит радиоактивный аденозин) просчитывают в жидкостно-сцинтшгпяционном счетчике, Актийность ингибирования ЦАМФ фосфодиастеразы испытуемого
фодиастеразы. Оценивается способность лекарств увеличивать силу сокращения предсердия. Получают кривые ответных реакций на дозы испытуемых соединений. Результаты даны в виде проце нта от контрольного значения пропанола.
При необходимости можно анализировать хронотропную ответную реакцию правого предсердия, которое бьется самопроизвольно Результаты приведены в таблице 2.
Инотропная активность ин виво.
Данное испытание проводится на африканских хорьках следукивдм об- ,разом.
Голодных анестезированных хорьков оборудуют приборами дря исследования гемодинамических параметров, а также 0 силы сокращения правого желудочка (ССШК) с использованием незамкнутой тензометрической арки. Лекарства назначают интрадуоденально в виде растворов в ДМСО (1 мл или менее). 5 Действие на силу сокращения миокарда и другие параметры контролируют в течение 60 мин после введения лекарства. Изменения силы сокращения после введения лекарства выражаются в виде
5










агента определяется с помощью предва- Q процентного изменения по сравнению
рительного инкубирования ФДЕ с испытуемым агентом. В результате получают значения ответной реакции на дозу. Активность испытуемого агента привос контролем до введения дозы препарата.
В данном испытании милринон дает при дозе 3 мг/кг увеличение силы со
В данном испытании милринон дает при дозе 3 мг/кг увеличение силы со-
дится в виде молярной (М) концентра- , кращения правого желудочка 52%. Ре-. .
ции агента ингибирующей 50%-ной активности ФДЕ (ICjo). В данном опыте значение IC, миллион - известного инотропного агента, составляет 2x10 моль.
Результаты для предлагаемых соединений приведены в табл,1.
Инотропная активность ин витро.
Основной анализ представляет собой модификацию анализа, описанного Андерсоном.
Морских свинок умерщ;вляют путем шейного смещения и быстро открывают сердце. На левое предсердие налагают соединительные швы из шелковой нити, затем предсердия удаляют и крепят в тканевых ваннах, где их стимулируют электротоком. После начального периода равновесия предсердия обрабатывают пр опанолом в концентрации 10 М. Это подавляет их нативную силу сокращения и делает их более . чувствительными к позитивным ино- тропным воздействием ингибиторов фосзультаты для предлагаемых соединений приведены в табл. 2.
Для ингибирования фосфодиастера-, зы и агрегирования тромбоцитов кро- 40 ви, а также для увеличения инотроп- ной активности наиболее приемлемы следуюп5ие из предлагаемых соединений:
7-Фтор-1,3-дигидро-2Н-имидазо- 45 (4,5-Ь)хинолин-2-он-;
8-Метил-1,3-дигидро-2Н-имидазо- (4,5-Ь)ХИНОЛИН-2-ОН;
1,3-Дигидро-7,8-диметил-2Н-имида- зо(4,5-Ь)ХИНОЛИН-2-ОН;
1,3-Дигидро-8-хлор-7-метил-2Н-ими- дазо(4,5-Ь)ХИНОЛИН-2-ОН;
8-Метил-1,3,9,9a-тeтpaгидpo-2H- имидa 30 ( 4 , 5-Ь ) ХИНОЛИН-2-ОН .
Дозировка соединений зависит от gg формы назначения для приема, ко-нкрет- ного выбранного соединения, субъекта, подлежсодего лечению, и желаемого эффекта. Эффективные дозы для животных колеблются от 0,5 до 30 мг/кг веса
50
с контролем до введения дозы препарата.
В данном испытании милринон дает при дозе 3 мг/кг увеличение силы со-
кращения правого желудочка 52%. Ре-. .
кращения правого желудочка 52%. Ре-. .
зультаты для предлагаемых соединений приведены в табл. 2.
Для ингибирования фосфодиастера-, зы и агрегирования тромбоцитов кро- ви, а также для увеличения инотроп- ной активности наиболее приемлемы следуюп5ие из предлагаемых соединений:
7-Фтор-1,3-дигидро-2Н-имидазо- (4,5-Ь)хинолин-2-он-;
8-Метил-1,3-дигидро-2Н-имидазо- (4,5-Ь)ХИНОЛИН-2-ОН;
1,3-Дигидро-7,8-диметил-2Н-имида- зо(4,5-Ь)ХИНОЛИН-2-ОН;
1,3-Дигидро-8-хлор-7-метил-2Н-ими- дазо(4,5-Ь)ХИНОЛИН-2-ОН;
8-Метил-1,3,9,9a-тeтpaгидpo-2H- имидa 30 ( 4 , 5-Ь ) ХИНОЛИН-2-ОН .
Дозировка соединений зависит от формы назначения для приема, ко-нкрет- ного выбранного соединения, субъекта, подлежсодего лечению, и желаемого эффекта. Эффективные дозы для животных колеблются от 0,5 до 30 мг/кг веса
17
25
30
ела при оральном приеме и от .0,05 о 10 мг/кг веса тела при парэнтераль- ом приеме (подкожная, внутримьшеч- ая и внутривенная инъекции). Эффек- ивная дозированная единица для чеовека колеблется от О,1 до 30 мг (предпочтительно от 0,5 до 20 мг) от дного до трех раз в день. В соответ- ствии с общепринятой клинической прак-ю тикой назначают для приема дозу, начительно меньшую, чем доза эффективная, затем ее можно постепенно увеличивать до достижения желаемого
эффекта. 5
Подходящими дозированными формами для орального применения являются таблетки, диспергируемые порошки, гранулы, капсулы, сиропы и эликсиры. Примерами парэнтеральных форм являют- 20 1СЯ растворы, суспензии, дисперсии, эмульсии и др. Композиции для орального применения могут содержать одну или более общепринятых вспомогательных добавок, таких как подслащивающие, вкусовые, красящие, консервирующие или предохраняющие агенты, для придания композиции подходящего фармацевтического вида. Таблетки могут содержать активный ингредиент в смеси с обычными фармацевтически приемлемыми эксципиентами, включающими инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза и тальк, гранулирующие и дезинтег- рирующие агенты, такие как крахмал и альгиновая кислота, связующие агенты, такие как крахмал, желатин и ка- медо акации, и смазывающие агенты, такие как стеарат магния, стеариновая кислота и тальк. Таблетки могут быть непокрытыми или покрыты ш с помощью известных способов для отсрочки дезинтеграции и абсорбции в желудочно-кишечном тракте и обеспе- . чения замедленного действия на протяжении длительного периода. Суспен- ivST сиропы и эликсиры также могут :содержать активный ингредиент в смеси с любым из общепринятьк эксщшиен- ,Q тов, используемых для приготовления композиций, таких как суспендир1тощие агенты (например, метилцеллюлоза, трагакант и альгинат натрия), смачивающие агенты (например, лецитин), юлиоксиэтиленстеарат; и предохранители, такие как этил-п-оксибензоат. Капсулы могут содержать один активный ингредиент или в смеси с твердьм
ин ка ка м п и
в
40
5
192
18
ю
инертным разбавителем, таким как карбонат кальция, фосфат и каолин. Инъецируемые; композиции могут содержать соответствующие диспергирующие или смачивающие агенты и суспендирующие агенты.
Формула из
обретения
Способ получения имидазохинолино- ых соединений общей формулы
о
N R4-галоген, низший алкил, низший алкокси или трифтор- метил;
-водород, галоген, низший алкил, низший алкокси;
-водород, галоген, низший алкил, низший алкокси;
R - водород, низший алкил, или их фармацевтически приемлемых солей, отличающийся тем, что тиосоединение общей формулы
де R,
R.
R,
где К,-К4Имеют указанные значения, подвергают алкилированию соединением формулы
RsX,
где R.S - низший алкил;
X - удаляемая группа, такая как галоген,
и полученное алкилированное тиосоединение общей формулы
H-l-VW-TJ /
Кз
R4
я,,имеют указаннью значения.
TfTTO К Л f rli. «-- -
ки приемлемой соли.
Приоритетно признакам; 25.04с85 при-R - галоген, низший алкил, низшая алкокси- группа; R - водород, галоген, низший алкил, низшая алкоксигруппа; ЕЗ - водород, галоген, низший алкил, низшая алкоксигруппа; R4 водород;
Таблица 1 Ингибирование агрегирования тромбохщтов и ЦАМФ фосфодиэстеразы
21
1470192
Таблица 2 Инотропная активность
Ин витро (морские свинки, предсердия)
- +
++
+
О ++++
о
+
о о
++
-6 ± 6 25 ± 3 27 + 2 -8 ± 1
2 ±
-12 ± 2
-х
24 18
2 13
.17 ± 9
21 ± 3
/V
р и м е ч а н и е. Активность и - чительная при + - ЗОХ-ное
чение при Jf величение при М; -н+ - ое увеличение при 10 -Ю м, - 50%-ное увеличение при ниже
,
«
8+6 при 10 мг/кг. 2 при 10 мг/кг, 12±12 при 10 мг/кг. 14±3 при 10 мг/кг. 30+5 при 0,3 мг/кг.
Редактор Л. Пчолинская Техред М.Моргентал
Заказ 1369/59 Тираж 352 Подписное Государственного комитета по изобретениям и открытиям при ГКНТ СССР 113035, Москва, Ж-35, Раушская наб., д. /:
-Йздат1 ьск1й комбинат Патент, г.Ужгород, ул. Гагарина,101
Производственно
22
Ин виво (африканские хорьки), % изменения ССПЖ (3 мг/кг, введенная доза)
-6 ± 6 25 ± 3 27 + 2 -8 ± 1
2 ±
-12 ± 2
-х
24 18
2 13
Корректор Л. Пипипенко
Авторы
Даты
1989-03-30—Публикация
1987-02-27—Подача