Изобретение относится к новому биологически активному соединению циклическому аналогу ангиотензина, обладающему способностью ингибировать прессорное и миотропное деиствие ангиотензина, и может найти применение в медицине,
Известны ингибиторы ангиотензина, например, саралазин и его аналоги. Однако они не находят применения, поскольку имеют относительно высокую собственную прессорную активность (Oj5-l,5% от прессорного эффекта ангиотензина), а иногда даже после введения очень низких доз вызывают ртительное, опасное для жизни повышения кровяного давления, в некоторы случаях даже свьгаге 300 мм рт.ст. -NH-(CH2)5 CO-Asn-Ar0-Val-Tyrобладаюш,им способностью ингибировать прессорное и миотропное действие ангиотензина.
Описываемый циклический аналог ангиотензина синтезируют, замыкая в цикл линейный предшественник посредством амидной связи между аминогруппой -аминокапроновой кислоты и у карбоксильной группой глютаминовок кислоты в положении 8. Описываемый циклический аналог ангиотензина - цикле- С А kin , Збе -ангиотензин синтезируют по схеме, представленной на чертеже.
Пример. Для синтеза цикло : Akk , ),oee,i-QEu - ангиотензина 11 использовали аминокислоты и их производные фирмы Реанал. Все аминокислоты имеют L -конфигурацию. Все температуры плавления, определяемые в открытых капиллярах, приведены без „поправок. Индивидуальност всех полученных соединений контролировали тонкослойной хроматографией на силикагелевых пластинках марки Мерк. Приведены хроматографические подвижности R в следующих системах:
А - хлороформ:этилацетат : этиловый спирт : уксусная кислота вода (85 : 8 : 5 : 2 : 0,25);
Б - хлороформ : метиловый спирт: уксусная кислота (85:10:5);
В - хлороформ : этиловый спирт : н-бутиловый спирт : этилацетат : вода (10:6:4:3:1);
Известны циклические аналоги ангиотензина, являющиеся ближайшими структурными аналогами описываемого соединения -Гдез-Аэр, цикле- -N - ангиотензин II и дез-Asp , иикло-/-К1 -Огц%( Phe ,qeij) «( ангиотензин II. Однако они, как и другие известные циклические аналоги, не обладают антагонистическими свойствами по отношению к ангиотензину.
Цель изобретение - расширение арсенала средств воздействия на живой организм.
(
Поставленная цель достигается описываемым циклическим аналогом ангиотензина формулы (I)
Г - хлороформ : этиловый спирт : изо-пропиловый спирт; этилацетат : вода (10:6:4:3:1); Д - н-бутиловый спирт : уксусная кислота : вода (4:1:1); Е - этилацетат : н-бутиловый
спирт : уксусная кислота : вода (2:1:1:1);
Ж - этилацетат : пиридин : уксусная кислота : вода (5:3:1:2); 3 -. н-бутиловый спирт : пиридин : вода : уксусная кислота (15:10:12:3);
И - н-бутиловый спирт : пиридин : уксусная кислота : вода (4:1:1:2);
К - н-бутиловый спирт : пиридин : вода : уксусная кислота (48:20:5:24),
а также электрофоретическая подвижность по отношению к гистидину . на бумаге FN - 15 в 5 н.(рН 1,4) уксусной кислоте. Для всех соединений данные элементарного анализа удрвлетворительно соответствовали вычисленным значениям содержания С, Н, N. Анализ аминокислотного состава вьтолняли на приборе Liguimat III, ФРГ.
1 . Метиловый эфир трет-.бутилоксикарбонил-N -бензил-гистидил-про- лина (3).
X охлажденному до 0°С раствору 34,5 г (0, I ммоль) трет-бутилоксикарбонил-К -бензил-гистидина (1) и 13,5 г (0,1 ммоль) 1-гидроксибензотриазола в 200 мл диметилформамида (ДМФА) приливают раствор 20,6 г le-H{s-PrO-Qtu 3 (0,1 ммоль) дициклогекснлкарбодиимид в 60 мл ДМФА, вьщерживают 1 ч при (-2)-(+2)°С и добавляют охлажденный до 2°С раствор метилового эфира про лина, приготовленный добавлением 13,8 мл (0,1 ммоль) триэтиламина к охлажденному до раствору 16,6 г (0,1 ммоль) гидрохлорида метилового эфира пролина (2) в 50 мл ДМФА (выпавший осадок хлористого три этиламмония отфильтровывают). Реакционную смесь выдерживают 24 час при 4°С, осадок (дициклогексилмочевина) отфильтровывают и маточ ник упаривают в вакууме. Остаток рас творяют в 300 мл этилацетата и промы вают последовательно 5%-ным бикарбонатом калия, водой, 5%-ным бисульфатом натрия, водой, высушивают над NajSO /KgSO и упаривают досуха в вакууме. Полученное масло растирают с эфиром и высушивают в вакууме над . Выход: 41 г (90%); Ец- 0,65 (рН 1,9); Rf 0,7 (В); R f . 0,9 (Ж) Rf 0,42 (Д). 2, Днгидрохлорид метилового эфира N -бензил-гистидил-пролина (5 ). . К раствору 41 г (0,1 ммоль) метиЛ9ВОГО эфира трет-бутилоксикарбонилN -бензил-гистидил-пролина (3) в 200 мл уксусной кислоты, добавляют 87,5 мл (0,35 ммоль) 4 н.раствора соляной кислоты в уксусной кислоте. Выдерживают при 30 мин. Упаривают в вакууме. Остаток растирают с эфиром, отфильтровывают и высушивают в вакууме над P,jOg,/KOH. Выход: 37,4 г (97%); т.пл. 8082c;EHi5 (рН 1,9); Rf 0,28 .(В); Rf О,16 (Д); Rf 0,64 (Ж). Найдено, % С 53,67; Н 6,2; N 13,0 C|,H,,N40,-21101. Вычислено, 53,00; Н 6,1; N 13,05.. 3. Метиловый эфир,трет-бутилоксикарбонил-изолейцил-N -бензил-гистидил-пролина (6) . К охлажденному до О С раствору 19,9 г (86 ммоль) трет-бутилоксикарбонил-изолейцина (4) и 11,62 г (86 ммоль) 1-гидроксибензотриазола в 150 мл метиленхлорида приливают раствор 17,74 г (86 ммоль) дициклогексилкарбодиимида в 100 мл метиленхлорида, выдерживают 1 ч при (-2)(+2) С, добавляют охлажденный ро 0°С раствор метилового э(ЬираМ бензил-гистидил-пролина (.5), приго6товленный добавлением 23,74 мл (172 ммоль) триэтиламина к охлажденному до -10°Г раствору 37 г (86 ммоль) (5) в 150 мл метилеяхлорида (осадок хлористого триэтиламмония отфильтровывают). Реакционную смесь выдерживают 24 ч при , осадок (дициклогексил мочевина) отфильтровывают, фильтрат промывают последовательно 5%-ным бикарбонатом калия, водой, 5%-ным бисульфатом натрия, водой, высушивают над Na2SO /MgS04 и упаривают досуха в вакууме. Остаток растирают с гексаном, осадок отфильтровывают, Высушивают в вакууме над . Выход: 43,6 г (89%) 0,57 (рН 1,9); R 0,74 (В); R 0,91 (Ж); R 0,42 (Д). . Метиловый эфир трет-бутилоксикарбонил-0-бензил-тирозил-изолейцилК -бензил-гистидил-пролина (9). К охлажденному до раствору 23 г (42 ммоль) дигидрохлорида метилового эфира изолейцил-М -бензилгистидил-пролина (8), полученному с 96% выходом удалением трет-бутилоксикарбонил-группы из соединения б) согласно методике 2, в 100 мл при перемешивании добавляют 11,6. мл (84 ммоль) триэтиламина, осадок хло ристого триэтиламмония отфильтровывают и к фильтрату добавляют раствор 20,7 г (42 ммоль) нитрофенилового эфира трет-бутилоксикарбонил-0бензил-тирозина (7) в 100 мл ДМФА. Выдерживают при комнатной температуре 48. ч. ДМФА отгоняют в вакууме, остаток растворяют в этилацетате и промьтают последовательно 5%-ным бикарбонатом калия, водой, 5%-ным бикарбонатом натрия, водой, высушивают над Na2S04/MgS04, упаривают и растирают с эфиром. Выход: 31,4 г (90%); т.пл. 848бС;Ец. 0,58 (рН 1,9); R 0,56 (R); R 0,6I(A); R 0,88 (В); R 0,62 (Д). Найдено,%: С 66,6; Н 6,97; N 9,99. C.H eNeOg. Вычислено,: С 67,13; Н 7,1; N 10,21. 5.Дигидрохлорид метилового эЛираО-бензил-тирозил-изолейпил-М -бензил-гистидил-пролина. Получают согласно методике 2. Выход 95%; т.пл. 88-90°С; В ц 0,8 (рН 1,9); Ri 0,54 (В); Ri 0,89 (Ж).
Найдено,%: С 61,05; И 6,47; N 10,11. ,.2НС1.
Вычислено,: С 61,87; Н 6,59; N 10,56. 6. Метиловьш эфир трет-бутилокси карбонил-валил-0-бензил-тирозилизолейцил-W -бенэил-гистидил-пролина (12). К охлажденному до 0°С раствору 15 г (18 ммоль) дихлоргид-. ратд метилового э ира-0-бензил-тиpoзил-изoлeйцил-N -бeнзил-гиcтидилпролина (11) в 60 мл ДОФА добавляют 6,5 мл (38 ммоль) диизопропилзтиламина, перемешивают 5 мин, добавляют 5,7 г (26 ммоль) пентафторЛени лового эфира трет-бутилоксикарбонил валина в 20 мл ДМФА и выдерживают 48 ч при . Реакционную смесь вы ливают в 400 мл насьттенного раствора хлористого натрия. Выпавший осадок отфильтровывают, промывают водой и высушивают в вакууме над Р.О /FOH, промывают эфиром, высушивают в вакууме над . Выход: 17 г (98%); т.ил. 176178С; Ri 0,39 (Б); t 0,71 (В); Ri 0,65 (Г); 0,55 (рН 1,9). 7, Гидразид трет-бутилоксикарбонил-валил-0-бензил-тирозил-изолейтгил- N -бензил-гистидил-пролина (14). К раствору 16,5 г метилового эфи ра трет-бутилоксикарбонил-вялил-0бензил-тирозил-изолейцил-N -бензилгистидил-пролина в150 мл ДМФА добапляют 150 мл 50%-ного раствора гидразина в ДМФА, выдерживают при комнатной температуре 64 ч, вьтиваю в 100 мл насьш1енного раствора хлори того натрия, осадок отфильтровывают промывают водой и высушивают в вакууме над P O /KOll. Выход: 14,84 г (90%); т.пл.183185°С;Ец,., 54 (рН 1,9); R 0,48 (В); R 0,12 (Д) . Найдено,%: С 64,97; Н 7,12; N 13,41. C.oFft.. 15ычислено,%: С 65,13; Н 7,32; N13,66. 8, И -Нитробензиловый эфир третбутилоксикарбонил-валил-0-бензилтирозил-изолейцил- N -бензил-гистидил-пролил глутаминовой кислоты (l6 К охлажденному до -20°Г раствору 9,22 г (К) ммоль) гидразида третбутилоксикарбоиил-валил-0-бензилтиpoзиJ изoлe inил-N -бензил-гистидил-пролина (14) в 90 мл добавляют 10 мл (40 ммоль) 4 н.раствора соляной кислоты в этилацетате, 1,15 мл (10 ммоль) трет-бутилнитрита в 10 мл ДМФА и выдерживают 30 мин при-20С и 10 мин при -5 С, Реакционную смесь охлаждают до -35°С и прибавляют Ьхлажденный до раствор 5,52 мл (40 ммоль) триэтиламина в 10 мл ДМФА и при -20°С раствор ot - п нитробензилового эфира глутаминовой кислоты (15), приготовленный добавлением 1,38 мл (0 ммоль) триэтиламина к охлажденному до 0 С раствору 3,2 г (10 ммоль) хлоргидрата нитробензилового эфира глутаминовой кислоты в 10 мл ДМФА (осадок хлористого триэтиламмония отфильтровывают) . Выдерживают при +4 С 24 ч,.ДМФА упаривают в вакууме, остаток растирают водой и фильтруют. Высушивают в вакууме над Р205/КОН. Выход: 9,25 г (79%); т.пл. 15515бг,,Ец,-5 0,49 (рН 1,9); R 0,88 (В); Ri 0,68 (Д). 9. Дигидрохлорид oi -ц-нитробензилового эфира валил-0-бензил-тирозилизолейцил-М -бензил-гистидил-пролил лутаминовой кислоты (18). Получают согласно методике 2 изci-Vi-нитробензилового эфира трет-бутилоксикарбонил-валил-0-бензил-тирозил-изолейцил- -гистидил-пролилглутаминовой кислот1- (16). Выход: 96% ; т.пл. 162-164 С; ЕН„ 0,58 (рН 1,9); Rj 0,62 (Г); Rf 0,73 (Е); Rf 0,66 (И). 10,91 -П-нитробензиловый эфир трет-бутилоксикарбонил-аспарагинил№-нитроаргинил7валил-0-бензил-тирозил-изолейцил-М -бензил-гистидилпролил-глутаминовой кислоты (19), К охлажденному до раствору 0,23 г (5,3 ммоль) трет-бутилоксикарбонил-аспарагинил-N -нитрсадгинина (17) и 0,14 г (10,6 ммоль) 1-гидроксибензотриазола в 25 мл ДМФА приливают раствор 0,09 г (4,4 ммоль) дициклогексилкарбодиимида в 5 мл ДМФА, вьщерживают 1 ч при (-2)-0°С и добавляют раствор аминокомпоненты, приготовленный добавлением 0,15 мл (8,8 ммоль) ди-изопропилэтиламина к охлажденному до 0°С раствору 0,5 г (4,4 ммоль) ди-хлоргидрата (18) в 40 мл . Реакционную смесь выдерживают при+4 С 48 ч,отфильтровывают осадок дицикломочевт1ны и фильтрат 7 выливают в смесь , состоящую из 200 мл н сьпценного раствора хлористого натрия и 30 мл насьш1енного раствора бикарбоната натрия. Осадок отфильтровывают и промывают водой. Очищают высокоэффективной хроматографией на силикагеле в системе Б, Р.ыход: 0,47 г (72%); т.пл, 205207 ; Ri 0,37 (В); R 0,57 (Д), Найдено,%: С 57,74; К 6,41; N 15,39, С72Н,М|бО„ . Вычислено,%: С 58,13; Н 6,37; N 15,06. 11, Дигидрохлорид « -п нитробензилового эфира acпapaгинил-N -нитp аргинил-валил-0-бензил-тирозил-изолейцил-бензил-гистидил-пролил-глутаминовой кислоты (21), Получают согласно методике 2 из соединения (19), Выход: 95%; т.пл, 76-180С; EHJ, 0,5 (рН 1,9); Rf 0,63 (Ж); Rf 0,66 (3. I 2, оС-и-Нитробензиловый эфир тре бутилоксикарбонил-6-аминокапрониласпарагинил-N -нитроаргинил-валил-0 бензил-тирозил-изолейцил-N -бензилгистидил-пролил-глутаминовой кислоты (22, К охлаж,ценному до О С 0,4 г (0,3 ммоль) соединению (21) в 20 мл ДМФА добавляют 0,15 мл (0,9 ммоль) диизопропилэтиламина и 0,18 г (0,45 ммоль) пентафторфенилового . эфира трет-бутилоксикарбонил-6-аминокапроновой кислоты (20) в 5 мл ДМФА, Выдерживают при комнатной тем пературе 48 ч, ДМФА отгоняют в вакууме, остаток растирают эфиром. Оч щают на силикагеле. в системе В,. Выход: 0,24 г (,54,5%); R . 0,35 (В); RI 0,8 (К); 13, у-Пентафторфениловый,ot-п-ни робензиловый эфир трет-бутил-оксикарбонил- -аминокапронил-аспарагинил-М -нитроаргинил-валил-О-бензилтирозил-изолейцил-N -бензил-гистидил-пролил-глутаминовой кислоты (23 . К раствору 0,24 г (0,15 ммоль) соединения (22) в 20 мл ДМФА добавляют 0,17 г (0,23 ммоль) комплекса Ф в 5 мл ДМФА и перемешивают при . 48 ч. Отфильтровывают дициклогексилмочевину и ДМФА упаривают в вакууме, остаток растирают эфиром и высушивают над P Oj/KOH, . Выход: 0,23 г (88,4%); Rf 0,55( Rf 0,52 (Д); R( « 0,77 (3), 6о 14. у - Пентафторфениловый, оС - г нитробензилопый эфир -аминокапронил-. аспарагинил- N -нитроаргинил-валил0-бензил-тирозил-изолейцил-Ч -бен- . зил-гистидил-пролил-глутаминовой кислоты (24). Получают согласно методике 2 из соединения (23). Выход: 937; Ri 0,58 (E);Rf 0,62 (Ж); R.t 0,47 (И), 1 5, oi -П-нитробензиловьш эфир иикло-( -аминокапронил-аспарагинил-N нитроаргинил-валил-0-бензйл-тирозилизолейцил- -бензил-гистидил-пролилY гутаминил) (24), 0,21 г (0,12 ммоль) соединения (24) растворяют в 10 мл ДМФА, добавляют 300 мл диоксана и при добавляют 0,012 мл (0,35 ммоль) . диизопропилэтиламина в 100 мл диоксана, перемешивают при 20 С 48 ч, упаривают в вакууме, остаток растирают эфиром, Очит,ают на силикагеле в системе В. Выход: 0,018 г (10%); R 0,35 (В); Rf 0,41 (Д);Я 0,87 (3), 16, Цикло- -(-/)К ,), ангиотензин II, К раствору 0,018 г (0,012 ммоль) соединения (24) в 5 мл смеси метанол-уксусная кислота-вода (5:1:1) прибавляют паладиевую чернь и гидрируют 24 ч. Катализатор отфильтровывают, фильтрат упаривают, к остатку добавляют 5 мл этанола и упаривают. Остаток промывают 2 мл этанола, осадок отфильтровывают. Полученный продукт растворяют в 5 мл воды и лиофилизуют, Выход: 0,011 г (73,3%);Rf .0,4 Ж Rf 0,45 (3); Ri 0,3 (К), Аминокислотный состав: Akk-0,98; A5h- l,14;Aro- l,02;Vo(e-0,91; Tijr -l,04;3Ee-l,0; His-l|09; Pro -1,2 Qeu - 1,12, Исследована биологическая активность циклического аналога ангиотензина в опытах in vivo и in vitro, В опытах in vivo определяют влияние соединения (1 ) на артериальное давление крыс. Эксперименты проводят на белых крысах обоего пола массой 180-200 г, наркотизированных уретаном (1,25 г/кг. Вещества вводят в бедренную вену в виде инъекций в объеме 0,1 мл/200 г в дозах 0,5500 мкг/кг. Артериальное давление регистрируют из общей сонной артерии с помошью ртутного манометра на закопченной ленте кимографа.
9
Установлено, что соедиттение (I.) обладает весьма низкой прессорной активностью - 0,0)% от эс|х 1екта ангиотензина, Вреденис отдельных доз (I) 50 мкг/кг перед применением ангиотензинамида в-дозах 0,5 и 5 мкг/кг вызывает уменьшение прессорного эффекта последнего соответственно на 17,9+1 и 17+4,6%, Перемешение ответной кривой ангиотензина в сторону высших концентраций в присутствии (I) указывает на конкурентный антагонизм действий. Увеличение дозы (I) до 500 мкг на 1 кг вызывает понижение прессорного эффекта ангиотензина в дозе 5 мкг на 1 кг на 41,4+11,9%. Таким образом, соединение (Г) показывает зависящий от дозы антагонистический эффект.
Определение миотропной активност проведено в опытах на изолированной восходящей ободочной китке крыс. Изотонические сокращения регистрировали в определенном режиме температуре (32 с)и аэрации. Коммулятивные кривые конпентрация-эгЬ4 ект с последутп им вычислением параметров р А и р Г)2 характеризующих антагонис1ические свойства соединения (I.), регистрировали на модифицированном приборе ВИ6-5МА. Соединение исследовано в диапазоне концентраций
..о-5
6779610
В опытах in vitro установлено, что циклический аналог ангиотензина (I )обладает как конкурентным анта- гонизмом (перемегоения куммулятивной
5 кривой концентрация-эффект (КККЭ) ангиотензина вправо} -рА 6,66 при концентрации (1) 10 М и pPj 5,83 при 10 М, так и неконкурентным антагонизмом /понижение по максимуму
10 с изменением угла наклона КККЭ ангиотензина) -pAj 6,59 при концентрации (Г) 10МирЛ)г 5,28 при 10 М.
г Р V
Острую ТОКСИЧНОСТЬ ЦИКЛО- 1 -8
15 (А К-АЧП , QCu) ангиотензина изучают в опытах на белых мышах массой 18-20 г при внутривенном введении.
При дозах 10-200 мг/кг токсичес20 кого эффекта не наблюдают. Введение исследуемого соединения в дозах от 300 до 450 мг/кг вызывает паралич задних конечностей, затрудненное дыхание и летальный исход в зависи25 мости от дозы через 1-4 мин. У животных, ос в живых, токсические явления полностью устраняются по истечении суток. Значение Щ составляет 360СЗОО-432)мг/кг. Таким об30 разом, летальная доза в 720 раз превосходит дозу, при которой наблюдается явный антагонистический эффект соединения в отношении прессорной реакции ангиотензина (5 мкг/кг).




| название | год | авторы | номер документа |
|---|---|---|---|
| Гептапептид,обладающий способностью ингибировать миотропное действие брадикинина | 1982 |
|
SU1083560A1 |
| "Октапептид,облобладающий способностьюСпЕцифичЕСКи иНгибиРОВАТь пРЕССОРНый эффЕКТи МиОТРОпНОЕ дЕйСТВиЕ АНгиОТЕНзиНА п4 | 1977 |
|
SU687794A1 |
| Октапептид,обладающий способностью специфически ингибировать прессорный эффект и миотропное действие ангиотензина 11 | 1980 |
|
SU891648A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДАНТОИЛ1-ВАЛИЛ5-АНГИОТЕНЗИНА П | 1970 |
|
SU258314A1 |
| СПОСОБ ПОЛУЧЕНИЯ БУСЕРЕЛИНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2010 |
|
RU2442791C1 |
| Способ получения пептидов с последовательностью актг-человека,содержащих в -конечном положении аминооксикислоту | 1973 |
|
SU490284A3 |
| СПОСОБ ПОЛУЧЕНИЯ НОНАПЕПТИДЭТИЛАМИДА | 1995 |
|
RU2086561C1 |
| Способ получения полипептидов или их солей | 1977 |
|
SU910116A3 |
| Циклический аналог энкефалина, обладающий пролонгированной анальгетической активностью | 1981 |
|
SU1048702A1 |
| Циклический октапептид,обладающий гипотензивной активностью и устройство к действию карбоксипептидаз | 1983 |
|
SU1114020A1 |
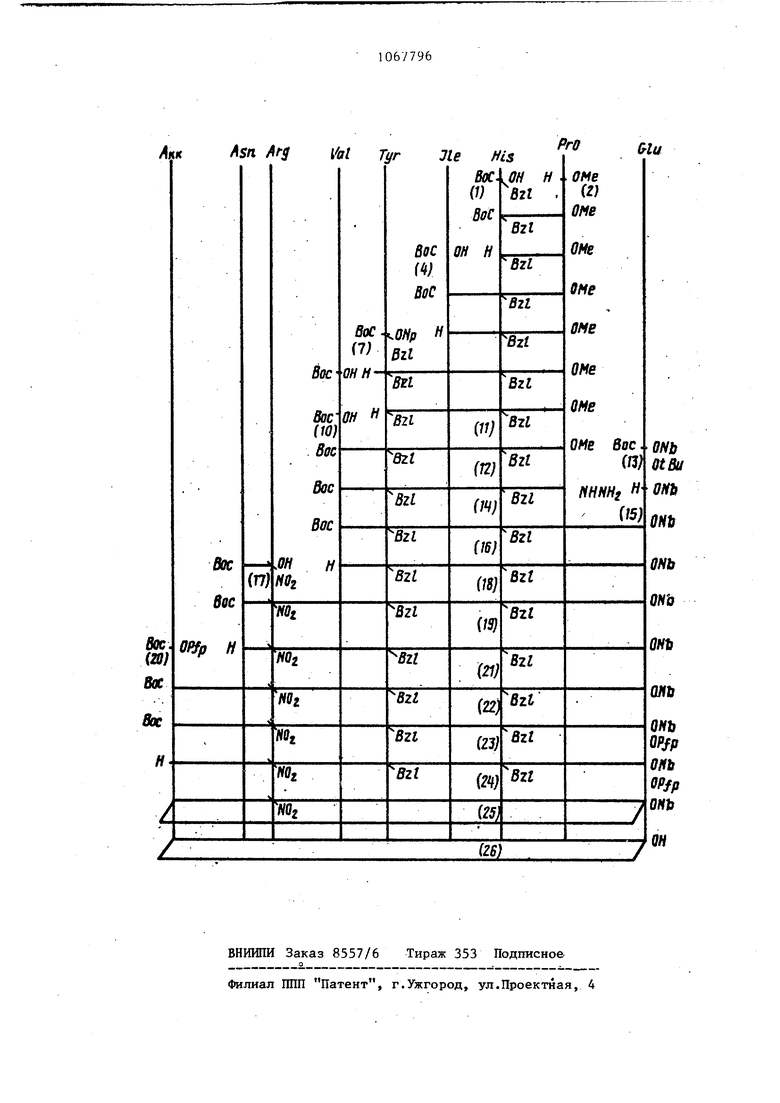
Циклический аналог ангиотензина формулы -Tyr-ne-His- rO-GIU
| Anderson G.H., Streeten D.H.P Dala Kos T.G | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Res., 1977, 40, 243 | |||
| KeimM.S,, Drayer S.I., Case D | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Enge | |||
| J .Med., 1976, 295, 117-5 | |||
| Вегнер Р.Э., Чипенс Г.И., Гринштейне И.В., Мышлякова Н.В., Афанасьева Г.А., Восекална И.А | |||
| Синтез линейных и циклических аналогов ангиотензина, модифицированных в положении 1 и 5.- Биоорганическая химия, № 7, 325, 1981. | |||
Авторы
Даты
1986-01-15—Публикация
1981-10-30—Подача