Изобретение относится к новому биологически активному соединению циклическому аналогу энкефалина, обладающему пролонгированной анальгетической активностью, которое может найти применение в медицине.
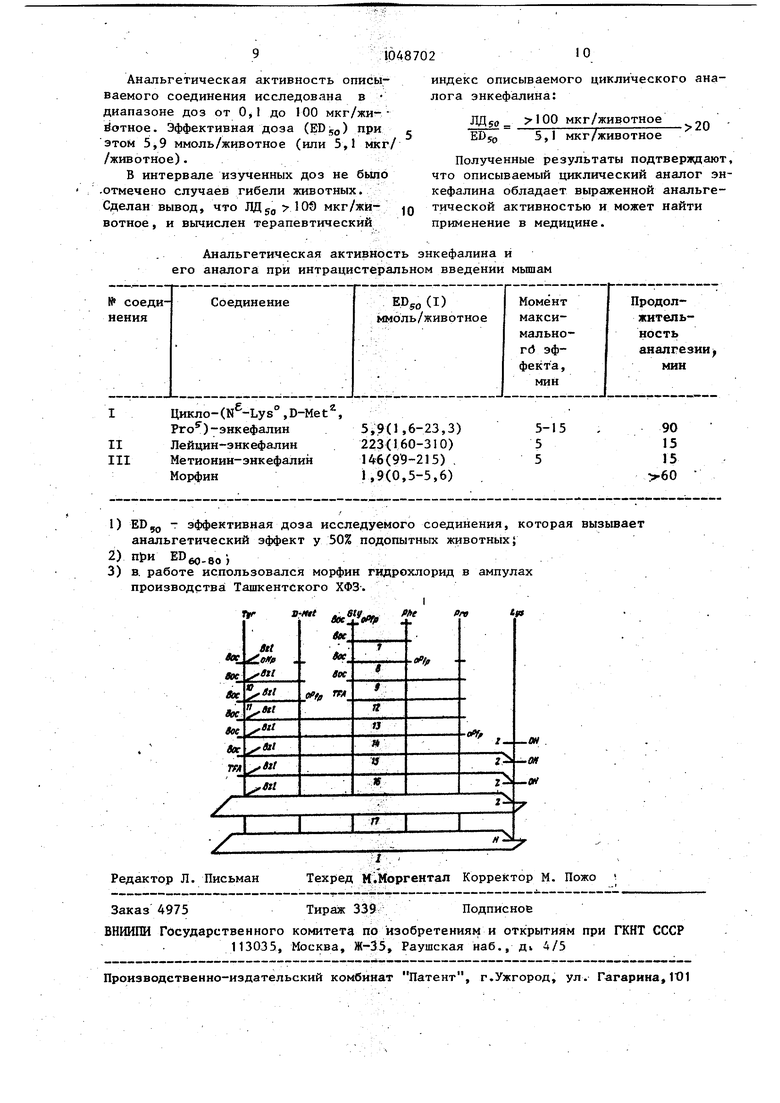
Известны природные метионин- и лейцин - энкефалины (HTyf-Gly-ClyPhe-Met-OH- и HTyr-Gly-Gly-Phe-LeuОН соответственно), проявляющие морфиноподобную активность в опытах на специфических моделях опиатного рецептора, а также подавляющие стереоспецифическое связывание с рецептором опиатного антагониста налоксона в гомогенйтах мозга., Однако метионин- и лейцин- энкефа лины обладают слабой и кратковременной(5-15 мин) анальгезией при внутрижелудковом введении в мозг мыши. Известны близкие структурные аналоги описываемых соединений - циклические аналоги энкефалина, включающи в цикл 18 атомных группировок формул pCHrCO-Tyr-Wa-Gly-Phe-Mel I--I NHCHf- CHf Tyr-Ola- My-Phe - Mel Однако эти соединения показьшаю полное отсутствие специфической активностиiэнкефалина. Цель изобретения - расширение арсенала средств воздействия на живой организм. Поставленная цель достигается описываемым циклическим аналогом энкефалина формулы NHj- СН- СО Т9Г (1у -Phe - РгоCHrCHz-CHg-CHrNHобладающим пролонгированной анальгетической активностью. Цикло- , D-Met, Pro/ энкефалин (I) синтезирован известны ми методами пептидной химии в растворе согласно приведенной схеме с использованием активированных эфиров трет-бутилоксикарбониламинокислот, S-аминофункцию лизина защищают бензнлоксикарбонильной группой гидроксил тирозина - бензильньм радикалом. На чертеже приведена схема синте за. Пример. Для синтеза аналог энкефалина (I) и :пользуют аминокислоты и их производные фирмы Reanal (Венгрия). Все аминокислоты, кроме D-Метионина, имеют L-конфигурацию. Температуру плавления веществ определяли, в капилляре (без коррекции) .Индивидуальность промежуточных соединений контролировали с помощью тех на пластинках Silufol (ЧССР) в следующих системах растворителей: хлороформ - этанол-- уксусная кислот (АсОН), 85:10:5 (А), н-бутанол-пиридин-АсОН-Н О, 15:10:3:6 (В), н-бу.танол-АсОН-Н40, 4:1:1 (С). Аналоги энкефалина хроматографируют на пластинках фирмы Merck в системах: хлороформ -метанол - АсОН-Н О , 30:20:4:6 (D), 60:18:2:3 (Е), н-бутанол-пиридин-АсОН-Н-0, 15:12:3:10 (F). Удельное оптическое вращение пептидов измеряют на поляриметре Perkin Elmer 141 М (ФРГ). Кислотный гидролиз проводят при 120с в течение 24 ч. Аминокислотный- состав определяют на анализаторе Jeol-3.) Для всех соединений данные элементного анализа удовлетворительно совпадают с вычисленным содержанием С, Н, N. По данным аминокислотного анализа для гексапептидов полученудовлетворительный аминокислотньй состав . -бутилоксикарбонйл-глицил-L-фенилаланин (7). 6,60 г (40 ммоль) L-фенилаланина растворяют в 40 мл 1 н. раствора гидроокиси натрия, добавляют 3-,44 г бикарбоната натрия, 50 мл диметилформамида (ДМФА) и 16,94 г (40 ммоль) пентахлорфенилового эфира трет-бутилоксикарбонил-глицина, растворенного в 20 мл .ДМФА. Смесь перемешивают в течение нескольких часов. После завершения реакции (хроматографический контроль) реакционнуюмассу разбавляют этилацетатом и водой (до разделения слоев), охлащхают до и подкисляют 0,5 н. соляной кислотой до рН 3. Этилацетатный слой отделяют, водную фазу экcтpaгиpyюt повторно. Объединенный этилацетатный слой промьшают водой, насьщенным раствором хлористого натрия и сушат над безводным сульфатом натрия. Кристаллический остаток, полученный после отгонки растворителя, перекристаллйзовывают из эtилaцeтaтa с небольшой добавкой петролейного эфира. Выход дипептида (7) 11.,4 г. (88%), Т.пл. 133-1354, 15,7° (с 1, ДМФА); Rf 0,73 (А),- Rf 0,80 (D). . Н-третбутнлоксикарбонил-глицил-L-фенилаланил-пролин (9). 3,22 г (10 ммоль) дипептида (7) растворяют в 10 мл этилацетата, охлаждают до и при перемешивании добавляют 2,02 г (11 ммоль) пентафторфенола и 2,26 г (11 ммоль) дициклогексилкарбодиимида (ДСС), растворенных в этилацетате. Через 2 ч смесь охлаждают до -10°С, выпавшую дициклогексилмочевину отфильтровывают, растворитель отгоняют, маслообразный остаток растирают с гексаном до затвердения. Получают 4,4 г пектафторфенилового эфира дипептида (8)i Rf,« 0,85 (А) . 1,03 г (9 ммоль) L-пролина раств ряют в 16 мл ДМФА и при перемешиваНИИ добавляют 1,26 мл (9 ммоль) три этиламин в 2 мл ДМФА и 4,4 г (9 1Ф1оль пентафторфенилового эфира дипептида (8), растворенного в 4 мл ДМФА. Реак ционную массу перемешивают несколько часов, ДМФА отгоняют при , остаток растворяют в этилацетате и обрабатьшают аналогично соединению (7). Продукт, полученный после отгонки растворителя, хроматографируют на колонке с силикагелем в системе: хло роформ - гексан - EtOH 10:4:1. Соответствующие фракции объединяют, растворитель отгоняют, сушат в вакууме. Выход 3,3 г (87%) трипептида(5); - 31,1°(с 1,ДМФА); Rf 0,77 С) К-трет-бутилоксийарбонил-О-бензил -Ъ-тирозил-В-метионин (10). К 2,09 г (14 ммоль) D-метионина. прибавляют 28 мл 0,5 н. раствора гид роокиси натрия, перемешивают, затем .прибавляют 1,18 .(14 ммоль) бикарбоната натрия, 20 мл ДМФА и 6,89 г. (14 ммоль) нитрофенилового эфира N-трет-бутилоксикарбонил-О-бензил-Ь-тирозина, растворенног,о в 30 мл ДМФА. После завершения реакции .(около 48 ч) реакционную массу обрабатывают и вьщеляют продукт (10) аналогично соединению (7). Прсле перекристаллизации из смеси этилацетата и гексана получают 4,8 г (68%) дипептида (10)i т.пл. 129-132 С, io. о 2,0 (с 1, даФА) Rf 0,72 (А) N-трет-бутилоксикарбонил-О-бензил Ъ-тирозил-В-метионил-глицил-Ь-фенилаланил-Ъг-пролин (13) 3,52 г (7 ммоль) дипептида (10) растворяют в 20 мл этилацетата с небольшой добавкой ДМФА, охлаждают до и при перемешивании добавляют ,1,41 г (7,7 ммоль) пентафторфенола и 1,58 г (7,7 ммоль) ДСС, растворен ных в этилацетате. После окончания реакции дициклогексилмочевину отфиль ровьшают, растворитель отгоняют, кристаллический остаток растирают с гексаном. Ползгчают 4,1 г пентафтор026фенилового эфира дипептида (11); Rf 0,94 (А). 2,34 г (5,6 ммоль) трипептида (9) растворяют в 15 мл. 70%-кого раствора трифторуксусной кислоты (TFA) в дихлорметане и выдерживают 30 мин. Растворитель отгоняют, остаток растирают с эфиром, отфильтровывают. промывают эфиром на фильтре и сушат в вакууме над гидроокисью калия. По-. лучают 2,3 г (94%) трифторадетата (12);Rf 0,67 (D) 2,3 г (5,3 ммоль) трифторацетата (12) растворяют в 15 мл ДМФА и при перемешивании и охлаждении до 0°С добавляют 1,1 :мл (10,6 ммоль) N-метилморфолина в 2 мл ДМФА- и 3,5 г (5,3 ммоль) пентафторфенилового эфира дипейтида (11), растворенного в 10 мл ДМФА. Реакционную массу пере- . мешивают несколько часов и после завершения реакции обрабатьшают аналогично соединению (7) . Продукт, полученный посЛе отгонки растворителя, очищают на колонке с силикагелем. Элюирование проводят в системе: хлороформ - этанол - этилацетат - АсОНН О 285:5:8:2:0,25. Соответствующие фракции собирают, упаривают и сушат в вакууме. Выход 2,1 г (49%) пентапептида (13); М - 10,4(с 1, ДМФА);К 0,51 (А); Rf, 0,72 (F, Merck). N-трет-бутйлоксикарбонил-О-бензил-Ь-тирозил-В-метилнил- лицил-Ь--фенилаланил-Ь-пролил-Ы -.(N- бензилоксикарбонил)-Ь-лизин (15). 2,09 г (2,6 ммоль) защищенного пентапептида (13) растворяют в 20 мл ДМФА, охлаждают до 0°С и при переме-, шивании добавляют 0,53 г (2,9 ммоль) пент торфенола, 0,59 г (2,9 ммоль) ДСС, растворенных в ДМФА. По-завершении реакции дициклогексилмочевину, отфильтровывают, растворитель отго-. няют, остаток растирают с гексаном. Получают активированный эфир пентапептида (14); Rf 0,67 (А). -х 0,78 г (2,6 ммоль) К -бензилоксикарбонил-L-лизина растворяют в 5,2 мл 0,5 н. гидроокиси натрия, добавляют О,22 г (2,6 ммоль) бикарбоната нат10 мл ДМФА и активированный рия, :птида (14) в ДМФА. Mej эфир пентапептида (14) в ДМФА. Через 48 ч реакционную массу расслаивают между этилацетатом и 5%-ным раствором бисульфата калия. Этилацета ный слой
отделяют, водную фазу экстрагируют повторно. Объединенный этилацетат промывают водой, насыщенным раствором NaCl, сушат над безводным сульфатом натрия. Продукт, полученный после отгонки этилацетата, хроматографируют аналогично соединению (13) Выходе 1,54 г (57%) гексапептида
(15), ш - 14,1 (с 1, даФА);
Rf 0,69 (В)
Цикло /N(N -бензилоксикарбонил)-Ь-лизил-О-бензил-Ь-тирозил-В-метионил-глицил-Ъ-фенилалнил-Ь-пролил/(17).
0,5 г (0,5 ммоль) гексапептида (15) растворяют в 2 мл 70%-ного раствора ТМ в дихлорметане и вьщерживают в течение 30 мин. Растворитель отгоняют, остаток растирают с эфиром и сушат в вакууме. Получают г (94%) трифторацетата гексапептида (16); Rf 0,5 (Е, Merck)} Rf 0,1 (А).
0,4 (0,37 ммоль) трифторацетата гексапептида (16) растворяют в 400 мл очищенного ДМФА, охлаждают до -20с, прибавляют триэтйламин до рН 7,2 и медленно прибавляют 0,11 мл (0,5 ммоль) дифенилфосфорилазида в 50 мл ДМФА. Раствор перемешивают в течение 7 дней, периодически добавляют триэтйламин, поддерживая рН около 7. По окончании циклизации растворитель отгоняют при , к остатку прибавляют 1-2 мл этилацетата Нерастворившийс-я осадок отфильтровывают и хроматографируют на колонке с сйликагелем в системе хлороформ метанол - АсОН 85:10:5.
Выход: 145 мг (40%) циклогексапептида (17); ,2 (с 0,5, ..АсОН), Rf 0,60 А, Merck).
Цйкло- (N -1,-лизил-о6-тирозил-В-метионил-глицил-Ъ енилаланил-Ь-пролил) (I).
К раствору 60 мл (0,063 ммоль) соединения (16) в 5 мл метанола и 2 мл АсОН добавляют палладиевую чернь, 0,5 мл воды и гидрируют в течение 4 дней. Катализатор отфильтровьша1от, фшштрат упаривают досуха остаток растирают с эфиром, отфильтровьшают, сушат в вакууме над гидроокисью калия. Полученньй продукт очищают на КМ-целлюлозе (СМ-32 фирмы Whatman) в аммоний-ацетатном буфере(градиентное элюирование). Соответствующие фракции собирают и лиофилизуют.
Выход; 35 мг (76%) циклогексапептида энкефалина (I); /oi/ +25,7° (с 0,33, 0,2 н. АсОН); Rf 0,52 (Д, Merck), Rf 0,48 (В, Merck).
Проведены биологические испытания аналога описываемого энкефалина ЦИКЛО (N -Lys-DMet -Pro )-энкефалина
Биологическую активность описьтаемого аналога энкефалина (1) исследуют в опытах in vivo. Анальгетическую активность определяют по методу Heda Н. В работе бьши использованы беспородные мьши-самцы массой 20 г, Исследуемое вещество, растворенное в стерильном физиологическом растворе, вводят при помощи 1-образной иглы в cisterna magna мозга неанестезированным мышам в количестве 10 мкг. Исследовался диапазон доз от 0,1 до 100 мкг/животное. Контрольным животным вводят 10 мкг стерильного физиологического раствора. Каждая экспериментальная группа состоит из 10 мышей. Анальгетический эффект соединения оценивают по тесту tail pinch при помощи артериального зажима, накладьшаемого на основание хвоста.Определение болевой реакции проводят через 5,15,30,60 и 9.0 мин после введения и затем каждые 30 мин до исчезновения анальгетической реакции.
Результаты выражают альтернативным методом (процент мьшгей, показавших анальгетическую реакцию). При вычислении EDjQ используют метод Литчфилда и Уилкоксона. Анальгетическая ак- тивность и продолжительность действия соединений приведены в таблице.
Цикло-(, , Pro)- энкефалйн обладает выраженной анальгетической активностью. Максимальный эффект наблюдается на 5-15 мин после введения. Анальгетическая активность нового аналога (I) значительно превышает активность природных энкефалинов (II и III) и сопоставима по величине и продолжительности действия с анальгетическим эффектом морфина. Характерной особенностью является зчительная пролонгация анапьгетического эффекта. Продолжительность аналгезии при EDgQ.gp составляет 90 мин. Доза 100 мкг/животное вызьшает аналь гетический эффект продолжительностью 2,5 ч (у энкефалинов 15 мин)«
Анальгетическая активность описываемого соединения исследована в диапазоне доз от OJ до 100 мкг/жи-йотное. Эффективная доза (EDjo) при этом 5,9 ммоль/животное (или 5,1 мкг /животное).
В интервале изученных доз не было -отмечено случаев гибели животных. Сделан вывод, что Щдд 109 нкг/жйвотное, и вычислен терапевтический
Анальгетическая активность энкефалина и его аналога при интрацистеральном введении мышам
индекс описываемого циклического аналога энкефалина:
100 мкг/животное
.20
5,1 мкг/животное
Полученные результаты подтверлздают, что описываемый циклический аналог энкефалина обладает выраженной анальгетической активностью и может найти применение в медицине.




Циклический аналог энкефалина формулы NHj- СН-СО-Туг -DMet- (ly -Phe -Рго И CHrCHrCHf-CHrNH- обладающий пролонгированной анальгетической активностью. г 1 00 О ю
1)EDjg - эффективная доза исследуемого соединения, которая вызывает анальгетический эффект у 50% подопытных животных}
2)при EDgo.eo-,
3)в. работе использовался морфин гидрохлорид в ампулах производства Ташкентского ХФЗ.
5г
tft
Дг
| Hughes J.; Smith T.W., Kuster- | |||
| litz H.W.,Fotergill L.A..Morgan B.A., Morris R.H.Identification of two related pentapeptides from the brain with p6tent opiate agonist activity, Nature, 1975, 25g | |||
| c | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПУСКА В ХОД АВИАЦИОННЫХ МОТОРОВ | 1924 |
|
SU577A1 |
| Buescher H.H., Hill R.S., Roemer D | |||
| Cardinaux F., Closse A., Hauser D., Pless J | |||
| Evidence for analgesic ac-tivity of enkephalin in the maise | |||
| Nature, 1976, 261, c | |||
| Самоцентрирующийся лабиринтовый сальник | 1925 |
|
SU423A1 |
| Hudson D., | |||
| Sharpe R., Szelke M | |||
| : Methionine encephalin and isosteric analogues,Int | |||
| J.Pept | |||
| Protein Res., 1980, l C.122 | |||
| Heda H., Amano H., Shiomi H., Takagi H | |||
| Comparison of the analgesic effects of various opioid peptides by a newly devised intra,cisternal injection technique in consious mice, Eur | |||
| J | |||
| Pharmacol, 1976, 56, c | |||
| САННЫЙ ВЕЛОСИПЕД С ВЕДУЩИМ КОЛЕСОМ, СНАБЖЕННЫМ ШИПАМИ | 1921 |
|
SU265A1 |
Авторы
Даты
1989-08-30—Публикация
1981-10-16—Подача