2.Способ по п. 1, о т л и ч а ю щ и и с я тем, что используют 0,01 М трис-НС буферный раствор, содержащий 2-5 мМ .
3.Способ по пп/ 1 и 2, отличающийся тем, что в качестве фермента используют пируваткиназу,
в качестве субстрата - смесь 0,250,5 мМ фосфоенолпирувата, 0,250,5 ММ аденозиндифосфата и процесс ведут в присутствии ферментного электрода с глюкозооксидазной и гексокинаэной мембранами.
4,- Способ по пп. 1 и 2, о т л ич а ющ и йся тем, что в качестве
фермента используют ацетаткиназу, в качестве субстрата - смесь 0,51,0 мМ ацетатфосфата, 0,25-0,5 мМ аденозиндифосфата и 0,1 мМ глюкозы и процесс ведут в присутствии фер-ментного электрода с глюкозооксидазной и гексокиназной мембранами.
5. Способ по пп. 1 и 2, о т л ичающийся тем, что в качестве фермента используют гексокиназу, в качестве субстрата - смесь 0,25 мМ аденозинтрифосфата и 0,1 мМ глюкозы и процесс ведут в присутствии ферментного электрода с глюкозооксидазной мембраной.




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения концентрации физиологически активных веществ | 1981 |
|
SU1035498A1 |
| Способ количественного определения адениновых нуклеотидов | 1985 |
|
SU1317027A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ИОНОВ КАЛИЯ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 1988 |
|
RU2054674C1 |
| Способ приготовления инкубационной среды для потенциометрического определения активности @ -АТФ-азы | 1982 |
|
SU1133534A1 |
| Способ получения полиадениловой и полиинозиновой кислот | 1987 |
|
SU1470738A1 |
| ФЕРМЕНТАТИВНЫЙ СИНТЕЗ 4’-ЭТИНИЛНУКЛЕОЗИДНЫХ АНАЛОГОВ | 2019 |
|
RU2816846C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ДЫХАТЕЛЬНОГО КОНТРОЛЯ У ПОПУЛЯЦИИ БАКТЕРИЙ | 2003 |
|
RU2247780C2 |
| Способ определения аденозинтрифосфорной кислоты в крови | 1978 |
|
SU905787A1 |
| Способ оценки стресс-устойчивости животных | 1979 |
|
SU782781A1 |
| Способ определения дозы вакцины | 1982 |
|
SU1175438A1 |

1
Изобретение относится к электрохимичес5ким методам анализа, к способам измерения или испытания, использующим ферменты, конкретно оксидоредуктазу и трансферазу, и может быть использовано для обнаружения киназ в растворах и для определения их активности.
Известен колориметрический способ определения активности ацетаткиназы С13 , включающий обработку исследуемого образца раствором, содержащим 3,2 MCHjCOOK, 1 М трис-НСО,рН которого 7,4, 1 М MqCBi , 3,5 М КОН, 28% н: НС1, 01 М АТФ (нэтриева соль нейтрализована с НСВ.), 1,25% FeCli в1 н: НС1 (2 rFeClj 6Hjp в 100 /л 1 н.НСЕ) ,10% CCUjjCOOH. цвет получают, добавляя 4 мл FeCSj, оптическую плотность измеряют при 540.нм. Активность ацетаткиназы вычисляют из формулы
D. 38,7 А/мг (мл)
МГсмЛ
Ь
-полученная оптичесгдекая плотность при 540 нм;
38,7
-коэффициент;
: . t
-время инкубации
-количество фермента
Е МТ (ГЛА в мг или мл, внесенного в реакционную среду.
Однако в этом способе необходимо применять, только прозрачные, неокрашенные образцы, аппаратура колориметрического определения дорогая, необходимо использовать много реагентов. Кроме, того, метод не обладает достаточной селективностью
° Наиболее близким к предлагаемому является биолюминесцентный способ определения активности ферментов,
синтезирующих или разлагающих АТФ, включающий взаимодействие фермента с субстратом в буферном растворе,.измерение интенсивности биолюминесценции с 5 последующим определением активности фермента в зависимости от интенсивности биолюминесценции с псадощью калибровочного fрафика.
В качестве буфера обычно испольQ зуют 0,02 М трис-.ацетатный буфер, рН 7, 75, содержащий 2 мМ ЭДТА, в качестве фермента - люциферазу, а а качестве субстрата - люцифе рин С21 н 3.
5 Однако в известней способе применяется дорогостоящая аппаратура, так как концентрацию люциферина определяют спектрофотометром, а интенсивность биолюминесценции измеряют на
,-. сконструированной в лаборатории установке, содержащей кюветное отделение с дорогостоющими кюветами.
Цель изобретения - упрощение процесса.
Поставленная цель достигается тем, что согласно способу определения активности ферментов, синтезирующих или разлагающих аденозинтрифосфат, включающему взаимодействие фермента с субстратом в буферном
0 растворе к регистрацию измерения одного из параметров системы с последующим определением активности фермента в зависимости от величины измеряемого параметра с помощью
5 калибровочного графика, при взаимодействии фермента с субстрате осуществляют электролиз реакционной смеси в присутствии фepмeнtныx электродов на основе глюкозооксидазной
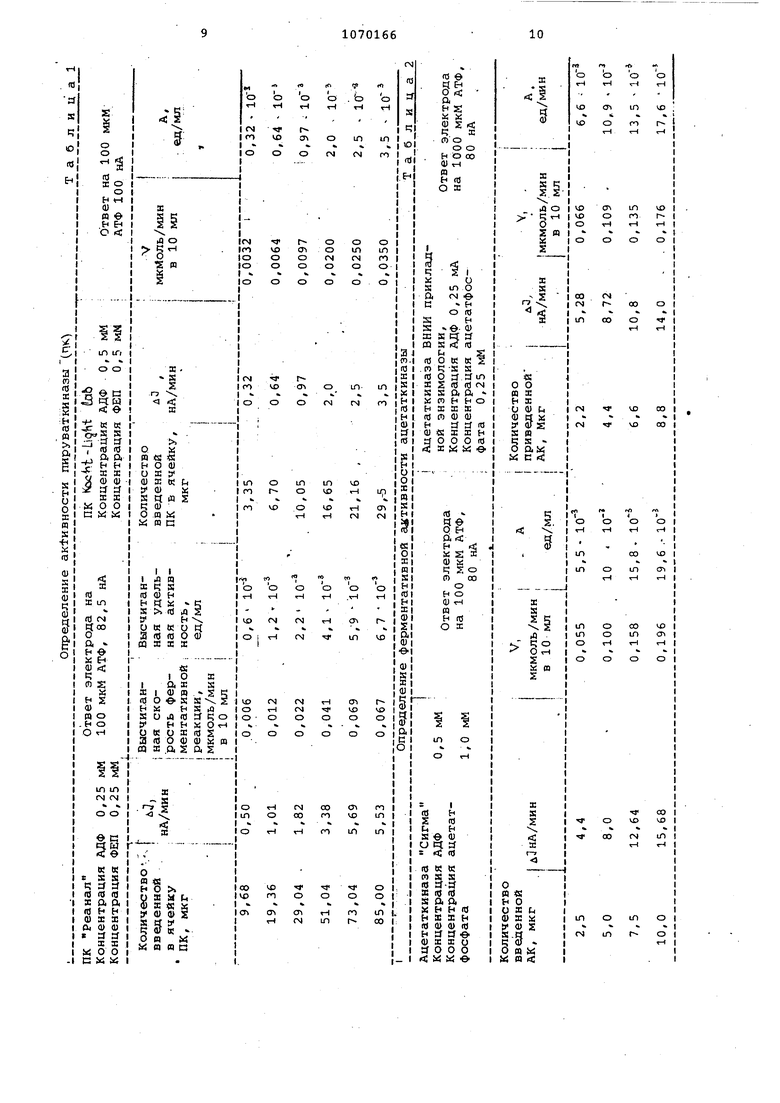
0 и глюкозооксидазной и гексокиназной мембран: и в присутствии глюкозы и аденозиндифосфата или гщенозинтрифосфата и по уменьшению анодного тока определяют активность фермента.. в качестве буфера используют0,01 М трис-НС буферный раствор, содержащий 2-5 мМ . В качестве фермента используют пируваткиназу или гщетаткиназу в качестве субстрата смесь 6,25 - 0,5 мИ фосфоенолпирувата или 0,5-1,0 мМ ацетатфосфата, 0,25-0,5 мМ аденозйндифосфата и 0,1 мМ глюкозы и процесс веду в присутствии ферментиого электрода с глюкозооксидазной и гексокина ной мембранами. В качестве фермента может быть также использована гексокиназа, в качестве субстрата используют смесь 0,25 мМ аденозиитрифосфата и 0,1 мМ глюкозы и процесс ведут в присутствии ферментного эле.к трода с глюкозооксидазной мембраной На чертеже дан калибровочный график зависимости ферментативной реакции от концентрации. Способ включает операции погружения электрода с глюкозооксидазной и гексокиназной или глюкозооксидазной мембранами в термостатируемый буферный раствор , и раствор субстратов, проведения электролиза при котором регистрируют стационар ный ток, вводят раствор ферментов, регистрируют уменьшение тока при 0,6 - 0,7 В относительно Ад/АлС1 электрода в течение 4-10 , после чего расчитывают ферментативную активность исходя из тангенса угла наклона кинетической кривой уменьшения тока в первые 4-5 мин. Калиб рование электрода проводят после трех определений активности. Способ основан на использовании ферментных электродов. Для определения активности ферментов, разлагающих аденозинтрифос фат,- например гексокиназы, используют глюкозный электрод, принципиальная схема изготовления которого известна С31 . Он состоит из тепло вого корпуса, в который вмонтирова ны платиновый анод и A j/Aqce электрод сравнения. Анод покрыт двумя мембранами: ферментной глюкозоокси дазной и внешней диализной. Внутре нее пространство заполнено гелеобразным электролитом. Для определения ферментов, синтезирующих аденозинтрифосфат, напр мер пируваткиназы и ацетаткиназы, используют АТФ чувствительный элек трод. Последний изготавливают такж по известной схеме С31, только ано покрывают тремя мембрангими: глюкоз оксидазной, капроновой сеткой, пор которой заполнены суспензией гексо киназы, и внешней диализной. Способ определения основан на следующих ферментативных превращен ях. 166 Под действием глюкозооксидазы окисляется глюкоза, образовывается , а электрохимическое окисление последнего при +0,6 В относительно электрода сравнения (насыщенный )f генерирует анодный ток: глюкозооксидаза tf fX J f ffMfJ,l. глюкоза -fOj -6- глюконолактон + . При наличии гексокиназы и адейозинтрифосфата параллельно протекает фосфорилирование глюкозы с образованием аденозиндифосфата АТФ глюк оза.+ АТФ :ексоки5аза глюкозо-б-фрсфат + АДФ. Изменение концентрации глюкозы в отсутствии и при наличии в системе АТФ обуславливает разность в значениях .величин анодного тока.. Угол кинетической кривой отражает скорость ферментативной киназной реакции (разложение или образование АТФ) . ПируваткиНаза при наличии в среде своих субстратов - фосфоенолпирувата и аденозиндифосфата катализирует реакцию М} ФЕП + АДФ -- - пируват + АТФ, , скорость которой пропорциональна активности фермента, выраженной в ед/мл. Из экспериментально получаемой величины скорости уменьшения тока ( д let, нА/мин 1 и ответа АТФ чувствительного электрода на стандартную концентрацию АТФ (0,1 мМ) вычисляется скорость ферментативной реакции (скорость образования АТФ мкмоль/минЧ и удельная активность пируваткиназы в ячейке. Из построенного калибровочного графика Г(концентрация фермента - скорость ферментативной реакции можно высчитать определяемую активность ферментного препарата (Е/мг белка . Ацетаткиназная реакция аналогична пируваткиназной, только в качестве донора фосфатной группы выступает ацетатфосфат. Определение ферментативной активности аналогично. Для определения ферментативной активности .гексокиназы используется значение ответа л1(нА) глюкозного электрода на 0,1 мМ глюкозы. При определении активности в регисционную смесь вводят фермент с активностью в определенном интервалепируваткиназы (.0,32- 6;6 10 ед/мл; ацетаткиназа (.5,5- 19,6 «10ед/мл; Гексокиназа (4,3- 23,4) . 10 ед/мл. Активность вычисляется из данны .эксперимента, т.е. из угла наклона кинетической кривой изменения тока Это связано с тем, что в данных ин тервалах активности фе я ентов набл даются прямолинейные зависимости скорости ферментативной реакции от концентрации . Поэтому опр деление активности возможно только тогда, когда активность исследуемы кинаэ находится в указанных интерв лах. Для этого исследуемые ферментны растворы в необходимых случаях раз бавляют до нужной концентрации, обеспечивающей соответствующую активность. Преимуществом предлагаемого спо соба является значительное упрощение процесса по сравнению с извест .ным, так как он основан на использовании более простого оборудовани не ±ребует дефицитной импортной ап паратуры, кроме того, обеспечивает возможность автоматизации процесса что расширяет его технологические возможности. Пример. Определение ферментативной активности -пируваткиназы Реанал. В ячейку помещают 0,01 М трис-HCIZ буфер, .2 мМ , 0,25 мМ АДФ и 0,25 мМ фосфоенолпирувата. В полученный раствор при 25°С погружают ферментный электрод с глюкозооксидазной и гексокиназной.мем -ранами, подключенный к полярографу1Р-7 с самописцем. Затем добавляют 0,1 мМ глюкозы. Общий объем pacTBOjja в ячейке составляет 10 мл Начинается ферментативное окисление глюкозы с последующим электрохимическим окислением на Pt выделяю щегося потенциале 0,6-0,7. В относительно насыщенного электро да сравнения и генерацией анодного тока глюкоза + OSL - глюконола тон + Hg О2 , - О + 2Н + 2е Записывают стационарный ток в течение 1 мин. Вводят 9,68 мкг исследуемого фермента - пируваткиназы (ПК1 . Последняя при наличии в среде субстратов - аденозиндифосфа та САДФ) и фосфоенолпирувата ФЕП катализирует реакцию пируват + АТФ ФЕП + АДФ скорость которой пропорциональна активности исследуемого фермента. С появлением в растворе аденозинтрифосфата САТФ) начинается реакци фосфорилирования глюкозы глюкоза + АТФ -.глюкозо-6фосфат + АДФ. Следоват.ельно уменьшается концентрация глюкозы в растворе и уменьшается анодный ток, Самописец регистрирует скорость уменьшения анодного тока в течение 4 мин, которая составляет 0,5 нА/мин (дЗ) . Аналогично измеряют л о при других концентрациях фермента ПК, чтобы получить статистически достоверную величину определяемой активности (19,36 29,04; 51,04; 73,04; 85,0-, 99,5- и 120,0 мкг в 10 мл раствора Полученные величины дО приведены в табл. 1. Для вычисления скорости ферментативной реакции устанавливают еще величину уменьшения тока при использовании стандартного раствора, содержащего 100 мкМ АТФ в 1 л Сответ электрода на 100 ). Затем вычисляют скорость ферментативной реакции,, которую выражают в мкмоль/мин в объеме ячейки 10 мл,, удельную активность фермента в 1 мл, которую выражают в ед/мл, и удельную активность фермента ПК (Е/мг белка). Расчеты величин скорости ферментативной реакции 100 мкМ - 8,5 НА X - 0,5 нА/мин ..«i,.«.«.« X 0,6 мкМ/мин 1.В 1 л) ОТаким путем получают скорость реакции в объеме 1 л. Отсюда следует, что скорость реакции в объеме 10 мл 0,6- 10 мкмоль/мин, а удельная активность ПК в 1 мл. - 0,6 Х10 ед/мл. Аналогично вычисляют эти параметры для других концентраций ПК, которые приведены в табл. 1. Расчеты удельной активности фермента ПК в Е/мг белка. Строится калибровочный график зависимости ферментативной реакции от концентрации (см.чертеж. Видно, что за пределами указанного интервала значений активности (. концентрации фермента) изменение скорости ферментативной реакции больше не фиксируется (на графике послейние две точки). Поэтому эти концентрации пе могут быть учтены при расчете определяемого параметра. Для расчета активности фермента из тангенса угла наклона берут любые две точки калибровочной кривой, полученной в интервале концентраций 9,68 - 85,0 мкг в 10 мл раствора. 15-IО мкмоль/мин А- -toy 2-10 0,75 Е/мг белка.
Аналогично, исходя из других концентраций и величин скорости ферментативной реакции , получают следующие активности: 0,62, 0/75, 0,80 и 0,78. Средняя достоверная величина, полученная при использовании пяти концентраций, составляет 0,71 Е/мг белка (.что совпадает с величиной, вычисленной из тангенса угла наклона калибровочной кривой).
П р и м е р 2. Определение ферментативной активности пируваткиназы Kucbt- Sob
Ферментативный электрод с глюкозооксидазной и гексокиназной мембраной погружают Е 0,01 М трис-НСС с 2 мМ MqSO буфер,в качестве субстрата берут 0,5 мМ АДФ и 0,5 мМ фосфоенолпирувата, 0,1 мМ глюкозы при . Записывают стационарный ток в течение 1 мин, вводят, раствор 0,32 10 ед/мл пируваткиназы, после чего записывают уменьшение анодного тока в течение 4 мин из-за продуцирования в системе АТФ.
Активность пируваткиназы вычисляют аналогично примеру 1.
Экпериментальные данные приведены в табл. 1.
П р и ме р 3.Определение ферментатиной активности ацетаткиназы Сигма.
Ферментативный электрод с глюкозоооксидазной и гексокиназной мембранами погружают в 0,01 М трис-HCtf с 4 мМ McjdO буфер, в качестве субстрата применяют 0,5 мМ АДФ и 1,0 мМ ацетатфосфата, о , 1 мМ глюкозы при . Записывают стационарный ток в течение 1 мин, вводят раствор 5, 5 10 .ед/мл ацетаткиназы, после чего записывают уменьшение анодного тока в течение 4 мин из-за продуцирования в системе АТФ.
Активность ацетаткиназы вычисляют аналогично примеру 1.
Экспериментальные данные приведе ны в табл. 2.
П р и м е р 4. Определение фермеятативной активности ацетаткиназы ВНИИ прикладной энзимолбгии.
Ферментативный электрод с глюкозооксидазной и гексокиназной мембра нами погружают в 0,01 М трис-HCf с 4 мМ буфер, в качестве субстрта применяют 6,25 мМ АДФ и 0,5 мМ ацетатфосфата, о,1 мМ глюкозы при 25°С. Записывают стационарный ток в течение 1 мин, вводят раствор
6,6 10 ед/мл ацетаткиназы, после чего записывают уменьшение анодного тока в течение 4 мин из-за продуцирования в системе АТФ,
Активность ацетаткиназы вычисляют аналогично примеру 1.
Экспериментальные данные приведены в табл. 2.
П р и м е р 5. Определение ферментативной активности гексокиназы
Ферментативный -электрод с глюкозооксидазной мембраной погружают в 0,01 М трис-НСг с 5 мМ буфер, в качестве субстрата применяют 0,25 мМ АТФ и 0,1 мМ глюкозы при . Записывают стационарный ток в течение 1 мин, вводят раствор 4,3 10 ед/Мл гексокиназы, после чего записывают уменьшение анодного тока в течение 4 мин, которое имеет место из-за фосфорилирования глюкоз АТФ, катализируемого гексокиназой.
Активность гексокиназы вычисляют аналогично примеру 1.
Экспериментальные данные приведены в табл. 3.
Из табл. 3 видна линейнаязависимости скорости уменьшения концентрации АТФ от количества введенной гексокиназы.
По сравнению с известным предлагаел«й способ определения активности ферментов, синтезирующих или разлагающих АТФ, является простым, так как отсутствует необходимость выделения люциферазы и использования специальной люминесцентной аппаратуры, которая не выпускается в нашей стране. При этом значительно ускоряется процесс определения, так как отсутствуют операции предварительной обработки образцов и приготовления реагентов.
Кроме того, расширяются технологические возможности определения, так как процесс определения можно проводить непрерывно, например, в ходе биосинтеза ферментов, определение легко автоматизировать. При одной заправке электрода гексокиназной в течение трех дней можно проанализировать около 1000 образцов. Перемонтаж электрода занимает около 20 мин, а в случае измерения активности гексокиназы, где используется ферментативная глюкозооксидазная мембрана, электрод можно использовать в течение трех месяцев .
11
Определение активности гексокинаэы СГК)
в 10 мл
Удельная активнсють
4,3v 10 7,5-10 10, А, ед/мл
12 1070166Т .а С л и ц а 3
14Д.10 23,4.10
Авторы
Даты
1984-01-30—Публикация
1982-03-12—Подача