Изобретение относится к биохимии 3 частности к способам извлечения ферментов (энзимов), и может быть использовано для получения препарат ного средства в клинической и экспе риментальной медицине, а также в фа макологической промьш ле11ности. Известен способ выделения миелопероксидазы из лейкоцитов крови млекопитающих путем экстракции детергентом или раствором с высокой ионной силой с последующей очисткой Данньпч способом можно получить значительное количество лишь ксеногенного, т.е. вьщеленного из тов крови животных препарата, что существенно ограничивает сферу его использования 5 в частности, в лечеб ной практике. Для получения пригодной для клинического использования миелопероксидазы из лейкоцитов человека требуется заготовить большие ко1П1чества необходимой для пере ливания больным и дорогостоящей донорской кровт. Кроме того, содер жание миелопероксидазы в зрелых кле ках миелоидного ряд.а - гранулоцитах периферической крови значительно ниже, чем в мололь х клечках этого ря,ча, особенности н промиело и тах Наиболее близок к предлагаемому по технической сущности и достигаемому результату способ выделения ми лопероксидазы из клеток костного мозга человека - кос-т 1о-мозговой взвеси путем гемолиза )ритро и тов гипотоническим расплюоо - 0523%-ны раствором NaCl, (ггдс.поьия .мейкопито выделения :игзосомальной гЬракции из лейкоцитов ди|}1ференциа.чьным це} трифугированием, кстрагиропания из не фермента 6/:-ньм рас-творс м NaCl в фосфатном буфере (j) 7,0) с последующим диализом :-)кгт1)акта, очисткой миелогтероксидазы ионообменной хроматогра(1)ией на колонке с Ц1;ЛК-Сефадексом Л-50 (ур1и1} ове иенной 0,1 М фосфатным буфером, рН 7,0) и на колонке с КМ-пеллюлозо1 (уравновешенн 0,05 М фосфатным буфс-ром, рН 7,0) и гельфильтрацией (об1лчно на ко.чонке сефадексом С-100, уравнонешениой О,t М фосфатн1да буфером, рН 7,0, с 0 1 М NaCl 2 Недостатками известного способа являются невысокие выход и активность выделяемого фермента, а также многостадийность способа. В частности, как видно из таблицы, из 2,0 10 клеток удается вьщелить из экстракта 4,3 мг миелопероксидазы (16%). Известный способ выделения миелопероксидазы предусматривает использование в качестве исходного сырья взвесь из свежезаготовленного кост}ioro мозга человека, что обусловливает необходимость немедленного начала процесса выделения миелопероксилазы, так как хране1 ие костномозговой взвеси при положительных температурах приводит к гибели лейкоцитов и разрушению содержащейся в них миелопероксидазы (замораживание костно-мозговой взвеси нри отсутствии криоконсервантов исключается из-за деструкции клеток) , а гакже получение ли11и. небольших количеств препарата из-за отсутствия возможиост:. одновременной заготовки исходного сьфья - костного мозга от большого числа лоноров или трупов скоро тостижно умерших людей. Применение этого способа для выделения NH e;ioпероксидазы из клеток криоконсерви зованного-jCTHOio мозга невозможно поскольку Г присутствии криоконсервантов не уд,ается осуществить фракционирование клеток и солевую экстракп.ию. Наряду с этим способ не гара1ггируСт ДцОстаточный вьгход, миелопероксидазы из-за зиачите:1Ы1ых потерь фермента в процессе гипотонического лизиса эритроцитов (сопровождающегося разрушением части лейкоцитов) и при выделении ;п-1зосомальной фракции в ходе ди хреренциального центри(1)угирования (нотеря фермента до 70%). Указанньп : способ выделения миелопероксидазы много стадийный (6 этa нов) включает наряду с этапом получе :ия субклеточной (лизосональной) фракции длительный диализ солевого экстракта (20 ч) , малоэф(|)ективный этап очистки миелопероксидазы из диализата ионообменной хроматографией на ДЕЛЕ-Сефадексе А-50 (очистка в 1,2 раза), ионообменную хромотографию на КМ-целлюлозе и гельфильтрацию на Сефадаксе С-100. того, пооПученный препарат миелопероксидазы характеризуется низкой удельной активностью около 1800 ед./мг белка, что является следствием воздействия неблагоприят ных факторов (например, протеолитич ких ферментов) в результате длительного ведения процесса. Цель изобретения - повышение вых да иактивности миелопероксидазы, а также упрощение процесса выделени Поставленная цель достигается тем, что согласно способу вьщеления миелопероксидазы из клеток костного мозга человека путем гемолиза эритр цитов солевым раствором, отделения лейкоцитов и экстрагирования фермен та с последующей ионообменной хроматографической очисткой и гельфильтрацией, используют сырье в криоконсервированном виде, для гемо лиза эритроцитов используют изотони ческий раствор , а для экстрагирования фермента - раствор катион ного детергента (обычно цетилтримет аммонийбромид с концентрацией в рас воре 1-2%), хроматографическую очис ку осуществляют на катионообменном сефадаксе, содержащем группу -0-СзН - ЗОз -. Экстрагирование фермента, его очистку и гельфильтрацию проводят в водном растворе CHjCOONa и NaCl. Использование в качестве источника получения миелопероксидазы криоконсервированного костного мозга человека обеспечивает значигельное расширение сырьевой базы для получения фермента, так как кри консервирование костного мозга при ультранизких температурах (, жидкий азот) позволяет избежать деструкции клеток и создать долгосрочно хранящийся запас морфо-функционально полноценных миелокариоцитов, т.е. накопить исходное сырье в неограниченном количестве. Упрощение способа получения миелопероксидазы из лейкоцитов чело века благодаря присутствию в костно мозговой суспензии экстрацеллюлярных криоконсервантов, близких к мё,м бранным структурам клеток способст,вует.удалению балластного мембранного материала и упрощает последующую очистку миелопероксидазы, что в дальнейшем сказывается на сохранени активности фермента. Осуществле 1ие в соответствии с пред.пагаемым способом гемолиза эрит цитов в суспензии клеток костного мозга изотоническим раствором NH(C1 обеспечивает более щадящие условия для клеток миелоидного ряда, не вызывая в отличие от гипотонического раствора NaCl значительного лизиса лейкоцитов, в особенности их незрелых форм, содержащих повышенные количества миелопероксидазы, и, следовательно потери фермента уже на первых этапах его вьщеления. Для реализации предлагаемого способа, кроме цетилтриметиламмонийбромида, могут быть использованы и другие типы катионовых детергентов, поскольку в них заключены аналогичные свойства: дезинтеграция мембранного материала, осаждение в составе мицелл мембран и отрицательно заряженных молекул (белков, нуклеиновых кислот, гликозаминогликанов), а также преимущественная солюбилизация катионовых белков путем вытеснения их катионовым детергентом из комплексов с отрицательно заряженным материалом. Детергент в отличие от применяемого в известном способе солевого экстрагента позволяет вести экстракцию миелопероксидазы непосредственно из лейкоцитов (миелокариоцитов), а не из предварительно выделенной из них субклеточной (лизосомальной) фракции. Это обеспечивает значительное упрощение процесса выделения миелопероксидазы по сравнению с известным способом, так как позволяет исключить, из процесса два этапа: дифференциальное центрифугирование, необходимое для выделения лизосомальнойфракции и многочасовой диализ экстракта перед ионообменной хроматографией, тем самым влияя на выход и активность фермента. Наряду с этим цетилтриметиламмонийбромид позволяет осуществлять экстракцию в присутствии криоконсервантов, исключающих солевую экстракцию вследствие образования желеобразного несуспендируемого осадка. В качестве сорбента при хроматографической очи1,:тке используют SP-Ceфадекса С-50 из-за наличия у него как наиболее сильной, так и наиболее экспонированной (длинной) связывающей группировки -O-CjHg - S0,j-, что позволяет вести очистку миелопероксидазы при тех же условиях (рП 6,0),
чтс и экстракцию фермеита, а следозгталъио, всю процедуру на всех 3 г а п а X выделен и я м н е л о п е р о к с и д а з ь i единьп- раствором (СН СООМа с; NaCl в HjO), что существенно упрощает процесс, а также способствует сокращению числа стадий и сохранекто активности фермента.
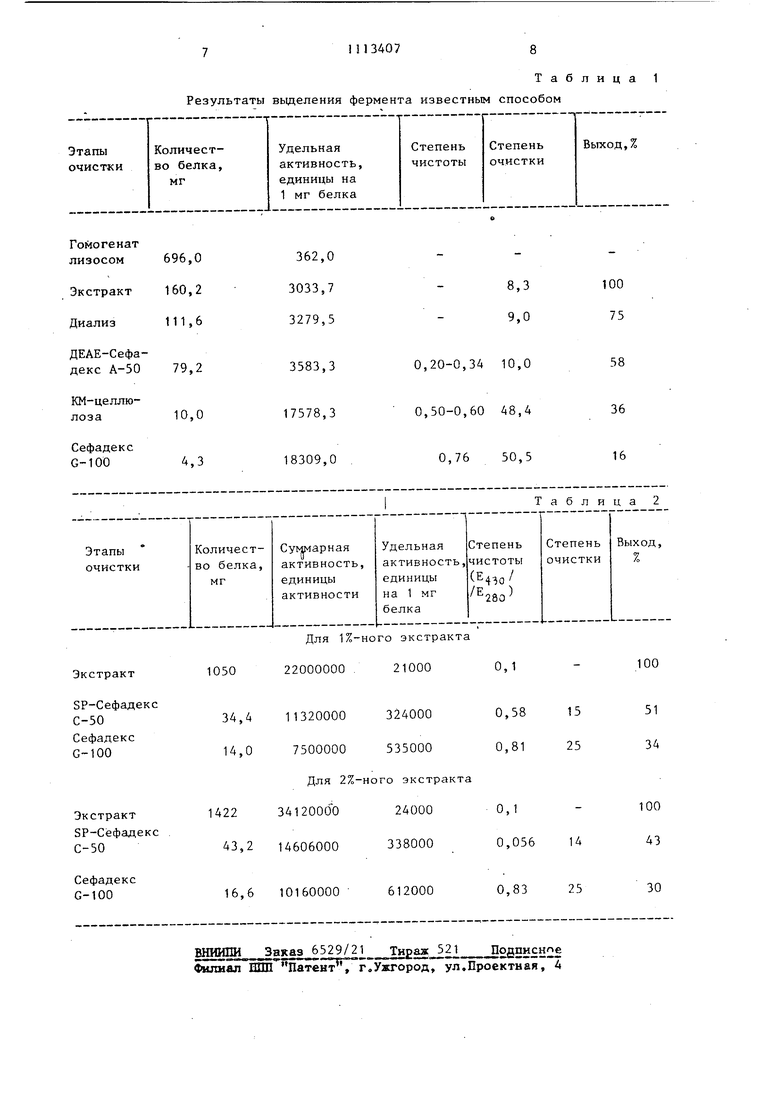
Предлагаемый способ позволяет сократить число стадий процесса с выделением фермента в большем количестве (14-1656 мг) и с большей активностью (500000-600000 ед/мг белка).
Общая продолжительность процесса с о с т а в Ji я е т 28-32 ч „
П ри м е р. Клеточ11; е элементы раз1Чороженного к р но кон сервировав нот костного мозга человека осаждают центрифугированием при 600с в тече ние 15 мин, Надосадочную жидкость удг) а осадок клеток обрабатызают 0, водн1 п-.1 раствором NH; С1 (при соотношении обьемов раствор - осадок 10:1) Миелокариоциты осаждают при 600 в течение 5 мин (общее время экспозиции клеток Е растворе NH.(1 не должно превышат
руют в 1-2%-iiOM растворе цетилтриме- 5 тиламмонийбромида (приготовленном на 0,1 М CHj COONa в 0,1 М NaCI) при соотношении обьемов 1:1. Лля гомогенизации клеток использ от гомогенизатор типа Лаунса ( стч кло-стекло),4а Гомогеиат перемешивают на иуттельаппарате в течение 12-14 ч, и центрифугируют 60 мин при 5000 5 5 и надосадочную жидкость (красно-бурый раствор..
содержащий 5-7% пероксилазной актив- 5 ностн, определяемой, главт1ым образом, примесью гемоглобина) ,,удал.Юг. Осадок гомогенизируют в 1-2%-ном растворе цетилтриметипаммонийбромида (приготов ленном на 0,1 М СН. COONa в 0,1 М NaCljjQ и центрифугируют при течение 60 мин. Эту прс5цел1уру (гомогснизания с центрифугиропанием) повторяют четыре раза, пос.пе чего oeaj oK удаляют.
а надосадочьи1е жидкости (зеленого цвта) объединяют и центрифугируют при 100000 9 60 MtiH. Полученный зеленый раствор (экстракт) наносят на колонну (2,5x8 см)5 заполненную SP-Ce фадексом и уравновешенную 0,1 М СП,, COONa в 0,1 М NaCl, Адсорбированный на колоЕ1ке материал (темно-зеленого цвета) промывают М CHjCOONa в 0,2 М MaCl, Объем промывной жидкости составляет 3- объема колонки 1,выход балластного материала с колонки регистрируют епектрофотометрически при 280 и 230 им) , Адсорбированную на колонке миелоперокси,дазу е1 И1Х1ают раствором О, 1 М СН.COONa в 0,28 М NaCl, Выход фер1чента с колонки регистрируют спектрофотометрически при 430 нм. МиелопеРрксидазу после ионообменной хроматографии подвергают дальнейшей очистке те.пьфильтрацией на колонке (2,5x60 см) 5 запо.п-генной Сефадексом G-100 и уравновешенной 0,1 М в 0,1 М NaCl. Фермент злюируют через колонку этим же раствором со скооост/)1о 25-30 мл/ч.
Постадийная характеристика пред.иагаемого способа по отдельным стадиям сведена в табл. 2,
Ферм(;нтативная активность миелопероксидазы, а также количество белка определяют аналогично извес иому способу.
Как видно из табл. 2, предлагаемым способом из 2,0x1 о клеток удается выделить Около 14-16,6 мг очиmeiiHoro конечного продукта, что в J-4 раза превышает количество миелопероксидазы, получаемой известным способом. Выделенн)1Й препарат миелопсроксидазы очищен в 25 раз, облад.ает удельной активностью 500000600000 ед/мг белка (т.е. фермент в Ю раз более активен, чем выделенHhiii И31зестньпм способом) и степенью чистоты (отиоление оптической плотности при волны А 430 нм к оптической плотности при Д 280 нм Е 1 „i-j - стандартный критерий чистоты миелопер оксидаз) равной 0,81-0,83. Выход фермента после коненого этапа очистки составляет 30-34% Результаты выделения фермента известным Таблица 1 способом


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выделения оксидазы @ -аминокислот из яда гюрзы | 1982 |
|
SU1055769A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТЕКТИВНОГО ГЛИКОПРОТЕИНА ВОЗБУДИТЕЛЯ МЕЛИОИДОЗА | 1996 |
|
RU2109520C1 |
| Способ выделения фактора роста нервной ткани из змеиного яда | 1982 |
|
SU1055732A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСИДАЗЫ | 1992 |
|
RU2031946C1 |
| Способ выделения полинуклеотидфосфорилазы | 1981 |
|
SU1076445A1 |
| Способ выделения урокиназы из биологических источников | 1983 |
|
SU1175965A1 |
| Способ получения карбоангидразы | 1981 |
|
SU955930A1 |
| Способ получения пероксидазы | 1982 |
|
SU1108102A1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТА ПЕРОКСИДАЗЫ ИЗ КОРНЕЙ ХРЕНА | 2007 |
|
RU2353652C1 |
| СПОСОБ ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ, ОЧИСТКИ И СТАБИЛИЗАЦИИ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА, ПРИГОДНОГО ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ, И ИММУНОБИОЛОГИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2004 |
|
RU2278870C2 |
1. СПОСОБ ВЬЩЕЛЕНИЯ ШЕЛОПЕРОКСИДАЗЫ из клеток костного мозга человека путем гемолиза эритроцитов солевым раствором, отделения лейкоцитов и экстрагирования фермента с последующей ионообменной хроматографической очисткой и гельфильтрациейд отличаю, щийся тем, что, с целью повышения -выхода и активности фермента и упрощения процесса, кспользуют сырье в криококсервированном виде, для гемолиза эритроцитов используют изотонический раствор , а для экстрагирования фермента - раствор катионного детергента„ хроматографическую очистку осуществляют на- катионообкенном сефадексе; содержащем группу -O-CjH, - SO,-. 2.Способ по п. 1, отличаюш и и с я тем, что Е качестЕге катионного детергента используют цетилтриметиламмонийбромид с концентрацией в растворе 1-2%. 3.Способ по пп. 1 и 2, отличающийся тем, что экстрагирование фермента, его очистку и гельфильтрацию проводят в водном растворе CH COONa и NaCl.
Для 1%-ного экстракта 22000000 21000 О,1
1050
Экстракт
Таблица 2
100
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Matheson N,R,, Wong P,S, Travis V, Isolation and properties of human neutrophil myeloperoxidase Biochemistry, 1981, Vol | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Шафран М.Г, Выделение и некоторые свойства миелопероксидазы костного мозга человека.- Вопросы медицинской химии, 1979, № 2, с | |||
| Подъемник для выгрузки и нагрузки барж сплавными бревнами, дровами и т.п. | 1919 |
|
SU149A1 |
Авторы
Даты
1984-09-15—Публикация
1983-01-06—Подача