б
- log Of. J
Фиг 1
Изобретение относится к аналити ческой химии и может найти применение в электрохимическом производстве, автоматизации химико-технологических процессов, металлургии и других отраслях,промышленности.
Известен кристаллический электрод с мембраной из сульфида серебра и сульфида меди, который характеризуется линейной областью электродной функции to - г-ион ,, угловым коэффи15иентом около 25 мВ/де и пределом чувствительности порядка 10 г-ион/л l.
Недостатками этого электрода являют ся сильное влияние ионов водорода на чувствительность к трехвалентному железу и необходимость поддержания кислотности анализируемого раствора при рН 2.
Известен кристаллический электрод на основе теллуридов меди и серебра, с помощью которого определяют ионы железа (III) в концентрационной области от до 10 г-ион/л 2 .
Недостаток, этого электрода - небольшой срок службы.
Наиболее близким по технической сущности X предлагаемому является состав мембраны халькогенидного стеклянного электрода для определения ионов железа (НО, содержащий селен, мембрана которого состоит из стекла состава Се дЗЦ-Зе,, в которое заедено от 1,3 до 2,0 ато% железа. Данный электрод позволяет определять Fe (HI) в концентрационной области от 10 до 10 г-нон/л с крутизной электродной функции порядка 60 мВ/дек. З . Недостатками известного электрода
на основе стекла указанного состава являются невысокая воспроизводимость потенциала, ограниченная рабочая область рН и значительное время установления потенциала. I
Цель изобретения - расширение рабочего диапазона рН, улучшение воспроизводимости потенциалов, уменьшение времени отклика.
Поставленная цель достигается тем, что состав мембраны халькогенидного стеклянного электрода для определения ионов железа (lit), со- держащий селен, Дополнительно включгиот медь, серебро, мьпиьяк и теллто при следующем соотношении компонентов, в ат.%:
Медь 5-25
Серебро 5-20
Мышьяк 30-50
Селен 20-49
Теллур 5-27
.. Указанные концентрационные пределы определяются как положением области стеклообразоваиия в системе медь - серебро - мышьяк - селен теллур, так и электродными характеристиками стекол.
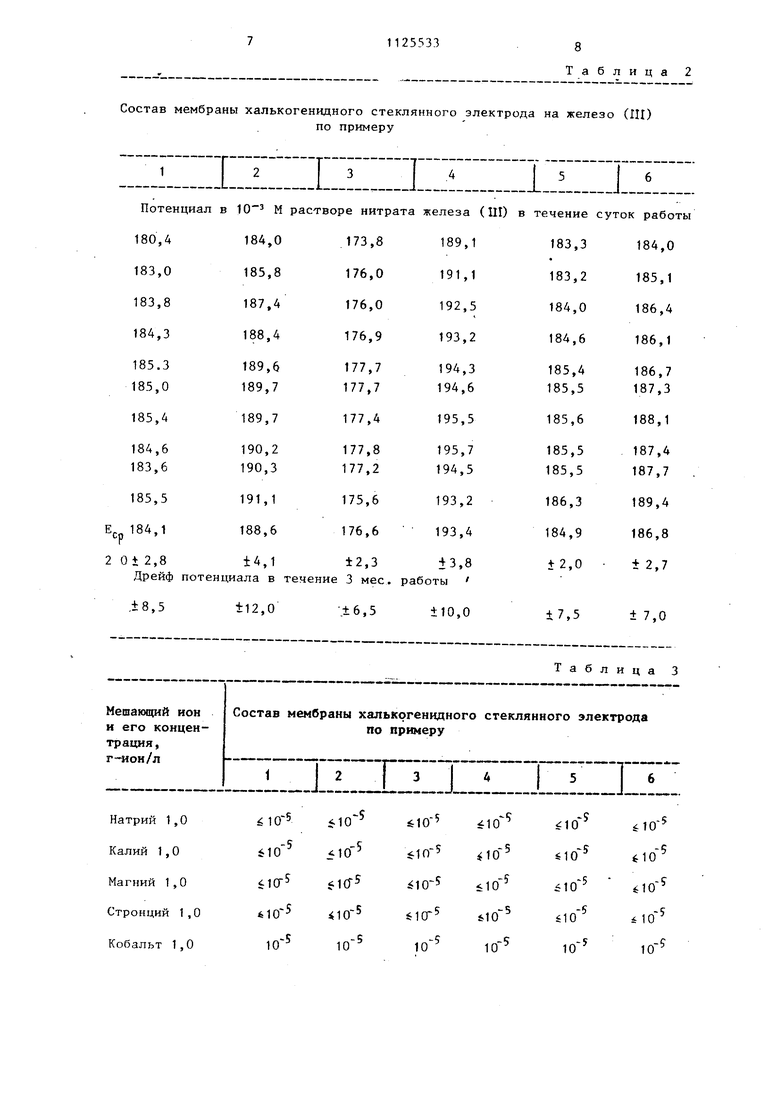
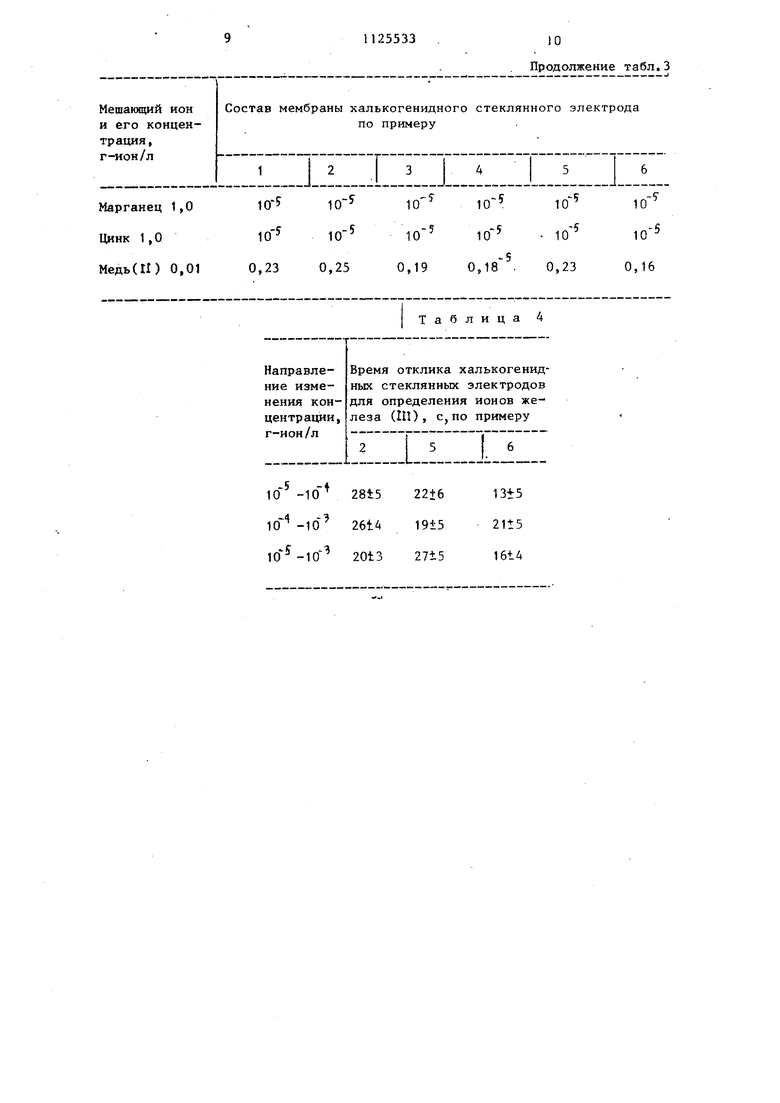
На фиг.f представлена зависимость ЭДС электрохимической ячейки с халькогенидным стеклянным электродом от логарифма активности ионов железа (ПО в 1 М HNO J на фиг.2 хронопотенциометрическая зависимость халькогенидного электрода при увелячении концентрации ионов в 100 раз о
Стеклообразные селенгады мышьяка с добавками меди и серебра обладают высокой химической устойчивостью, а медьселективные электроды на их основе характеризуются стабильными электродными свойствами в кислых и агрессив ых средах. Добавки теллура к халькогенидной стеклянной мембрне увеличивают чувствительность электродов к трехвалентному железу и повьплают воспроизводимость потенциалов в растворах железа (1П).
Однородные стекла получаются по следую1чим разрезам: Mi.-(),.tJ-Mu(,5),,J , где М Cu+Ag,, X Se+Te. Сплавы, содержащие более 30 ат,% . металла (меди+серебра) или более 27 теллура, являются стеклокристаллическими и отличаются неустойчивьми электродными свойствами. Стекла., содержащие менее 5 ач.% меди серебра Ш1И теллура, характеризуются невысокой воспроизводимостью потенциалов, особенно в концентрированных растворах железа (П1)
Стекла с указанными концентрационными соотношениями компонентов обладают оптимальньгми свойствами для их использования в качестве мембран халькогенидкых стеклянных электродов на железо (1Г1).
Пример 1. Для получения 3 г стекла состава ,.Te2j. берут 0,104 г меди5 0,177 г серебра, 0,886 г мьдиьяка, 0,700 г селена: 1,132 г теллура и помещают в кварцевую ампулу, которую откачивают до остаточного давления воздуха 3 10 Па, и проводят синтез при 1200 в течение 10 ч. Охлаждение осущест вляют посредством закалки расплава в воде со льдом. Пример 2. Стекло состава CujAp:,As,Se,..Te5 синтезируют аналогично примеру 1, но для получения 3 г стекла берут 0,118 г меди; 0,201 г серебра; .1,004 г мышьякаJ 1,440 г селена и 0,237 г теллура. П-р и м е р 3. Стекло состава AgsA-SitSei les синтезируют анало гично примеру 1, но для получения 3 г стекла берут 0,578 г меди{ 0,196 г серебраi г мьшьяка; 0,575 г селена и 0,697 г теллура. Пример 4. Стекло состава CujAg As Se Tej- синтезируют анало гично примеру 1, но для получения 3 г стекла берут 0,112 г меди; 0,760 г серебра, 0,792 г мышьяка 1,112 г селена и 0,225 г теллура. Пример 5. Стекло состава CujApi Asy-SejgTeK, синтезируют аналогично примеру 1, но для получения 3 г стекла берут 0,116 г меди, 0,196 г серебра, 1,363 г мьппьяка; 0,862 г селена и 0,464 г теллура. П р. и м е р 6. Стекло состава jASj.jSe оТе., синтезируют аналогично примеру 1, но для получения 3 г стекла берут 0,290 г меди; 0,489 г серебра; 1,018 г мьшья ка,0,856 г селена и 0,347 г теллура. Слитки стекол разрезают на плос :копараллельные диски толщиной 25 мм. Полученные таким образом мем браны полируют с одной стороны на пасте ГОИ до зеркального блеска, а ha другую поверхность мембраны термическим испарением в вакууме наносят слой серебра, к которому проводящим серебряным клеем (конта толом) приклеивают медный проводник. Место склейки заливают эпокси ным компаундом и высушивают. Приго товленную мембрану с твердым внутр ним токоотводом вклеивают в поливи нилхлоридный корпус электрода эпок сидным компаундом. Для измерения электродных харак теристик применяют следукзщую электрохимическую ячейку: . , КС1 . ., „.,... иссле- ., , Ag, AgCl 1 М KNO. М A насы- 3дуещенныи334 где М - мембрана из халькогенидного стекла. Калибровочные растворы в концентрационной области от 10 до 10 ион железа (ДГ) дек. готовят из нитратажелеза (Пг) в 0,1, 1 или 3 М азотной кислоте. Растворы с концентрацией ионов трехвалентного железа от 10 до 10 г-ион/л готовят непосредственно перед измерениями в измерительной ячейке добавлением к известному объему азотной кислоты небольших количества концентрированных растворов нитрата железа (ПГ). Для измерения коэффициентов селективности используют метод смешанных растворов,, при котором концентрацию мешающего иона поддерживают постоянной (чаще всего 1 г-ион/л), а концентрацию ионов железа (Ш) изменяют от 10 до 10 г-ион/л. Исследуемые растворы подкисляют азотной кисло-. той до рН 1, чтобы избежать гидролиза нитрата железа (111) . Измерения ЭДС электрохимической ячейки осуществляют с помощью цифровых вольтметров или иономеров. Для перемешива- . ния растворов используют магнитную мешалку. На фиг.1 показана характерная зависимость ЭДС электрохимической ячейки с халькогенидным стеклянным электродом от логарифма активности ионов Железа (ИГ) в 1 М азотной кислоте, на фиг.2 - хронопотенциометрическая зависимость халькогенидного стеклянного электрода. Все исследуемые электроды обладают аналогичной электродной функдней, т.е. характеризуются пределом чувствительности к ионам трехвалентного железа на уровне 10 г-ион/л и переменным угловым коэффициентом электродной функции. В табл. 1 приведен предел обнаруения ионов железа (П1) с помощью халькогенидных стеклянных электродов в 0,1, 1 и 3 М азотной кислоте. Из табл. 1 видно, что чувствительость электродов в 3 М азотной кисоте порядка 10 г-ион/л, т,е. на орядок меньше, чем в 0,1 и 1 М азотной кислоте. Хотя электродная функция халькогенидных стеклянных электродов не вляется линейной (ее крутизна в заисимости от концентрации желе;-а(111) вeличивaeтcя от 15-17 мВ/дек. между
нитрата железа (.ГИ) до 50 мВ/дек. между 10 и Ю М нитрата трехвалентного железа, предлагаемые халькогенидные стеклянные электроды обладают устойчивыми и воспроизводимьми значениями потенциала во всей исследуемой области концентраций железа (1ГГ) .
В табл.2приведена воспроизводимость потенциала злектродов в гечение суток работь при многократных измерениях в Ю М растворе нитрата железа (lit) при рН 1 и в течение 3 мес.
Из табл.2 видно, что воспроизводимость потенциала предлагаемых злектродов не хужеt 4,1 мВ/сут. В среднем воспроизводимость потенциала полученных халькогенидных стеклянных электродов в 3-6 раз лучше воспроизводимости потенциала у прототипа .
Средний дрейф потенциала злектродов за это время составляет 8,5 мВ
Полученные электроды позволяют проводить прямое потенциометрическо определение ионов железа (111) в кислых средах, вплоть до 3 М азотной кислоты (табл,1). Следует однако отметить, что в 3 М азотной кислоте чувствительность и стабильность потенциалов хуже.чем в менее кислых средах. В 1 М азотной кислоте электродные характеристики не отличаются от таковьгк в М азотной кислоте.
Коэффициенты селективности халькогенидных стеклянных электродов приведены в табл.3.
Из табл. 3 видно, что определению ионов железа (III) не мешают 10 -кратные избытки щелочных,щелочноз мельных и большинства двухзарядных катионов. Коэффициент селективности
К ионам меди (И) составляет величину порядка 0,2.
Таким образом, предлагаемые халькогенидные стеклянные электроды в 5 раз более селективны к ионам железа (It), чем к ионам меди (П). В случае кристаллического электрода на основе сульфидов меди и серебра (I) ситуация обратная, так как коэффициент селективности к ионам меди (It ) равен 6 ,
Характерная хронопотенциометрическая зависимость халькогенидного стеклянного электрода при увеличении концентрации ионов железа (Щ) в 100 раз показана на фиг.2. Найденные величины времени отклика представлены в табл. 4. Из фиг.2 и табл.4 видно, что время отклика предлагаемы стеклянных электродов не превьпнает 30 с как и при изменении концентрации ионов железа (ПО на два порядка, так и в низких концентрациях нитрата железа (1П) () .
Таким образом, предлагаемые составы мембран .яалькогенидных стеклянных электродов на железо (П1) позволяют проводить прямое потенциометрическое определение трехвалентного /келеза з 1 М азотной кислоте, т.е. в 10 раз более кислой среде по сравнению с известными составами.
Предлагаемые халькогенидные стеклянные мембраны характеризуются также в 3-6 раз лучшей воспроизводимостью потенциала и значительно меньшим временем отклика (30 с) в разбавленных растворах железа (П1) и при изменении концентрации ионов трехвалентного железа на двп порядка по сравнению с прототипом, время отклика которого в аналогичных условиях составляет 10-60 мин.
Таблица 1 Состав мембраны халькогенидного стеклянного по примеру
EIZIZZ
L.L..J. Таблица 2 - электрода на железо (III)


| название | год | авторы | номер документа |
|---|---|---|---|
| Состав мембраны халькогенидного стеклянного электрода для определения ионов меди (п) | 1983 |
|
SU1100553A1 |
| Состав халькогенидной стеклянной мембраны электрода для определения ионов свинца | 1983 |
|
SU1075135A1 |
| Состав мембраны стеклянного электрода для определения активности ионов серебра (его варианты) | 1981 |
|
SU996926A1 |
| Состав мембраны халькогенидного электрода для определения ионов кадмия | 1983 |
|
SU1125534A1 |
| Состав мембраны халькогенидного стеклянного электрода для определения активности ионов серебра | 1989 |
|
SU1718095A1 |
| Состав мембраны ионоселективного электрода для определения ионов ртути (II) | 1990 |
|
SU1718082A1 |
| Состав мембраны халькогенидного стеклянного электрода для определения ионов серебра | 1987 |
|
SU1506343A1 |
| Состав мембраны халькогенидного стеклянного электрода для определения ионов свинца | 1987 |
|
SU1497554A1 |
| Состав мембраны халькогенидного стеклянного электрода для определения ионов натрия | 1986 |
|
SU1402913A1 |
| Состав мембраны химического сенсора для определения концентрации ионов ртути в водных растворах | 2018 |
|
RU2712190C2 |
СОСТАВ MEbfBFAHH ХАЛЬКОГЕНИДнего СТЕКЛЯННОГО ЭЛЕКТРОДА ДЛЯ ОПРЕДЕЛЕНИЯ ИОНОВ ЖЕЛЕЗА (III) , содержащий селен, отличающийся тем, что, с целью расширения рабочего диапазона рН, улучшения воспроизводимости потенциалов и уменьшения времени отклика, в состав мембраны дополнительно введены медь, серебро, мышьяк и теллур при следующем соотношении компонентов,(ат.%): Медь 5-25 Серебро 5-20 Мышьяк 30-30 Селен 20-49 Телдур5-2-7 Т IND СД сд 00 00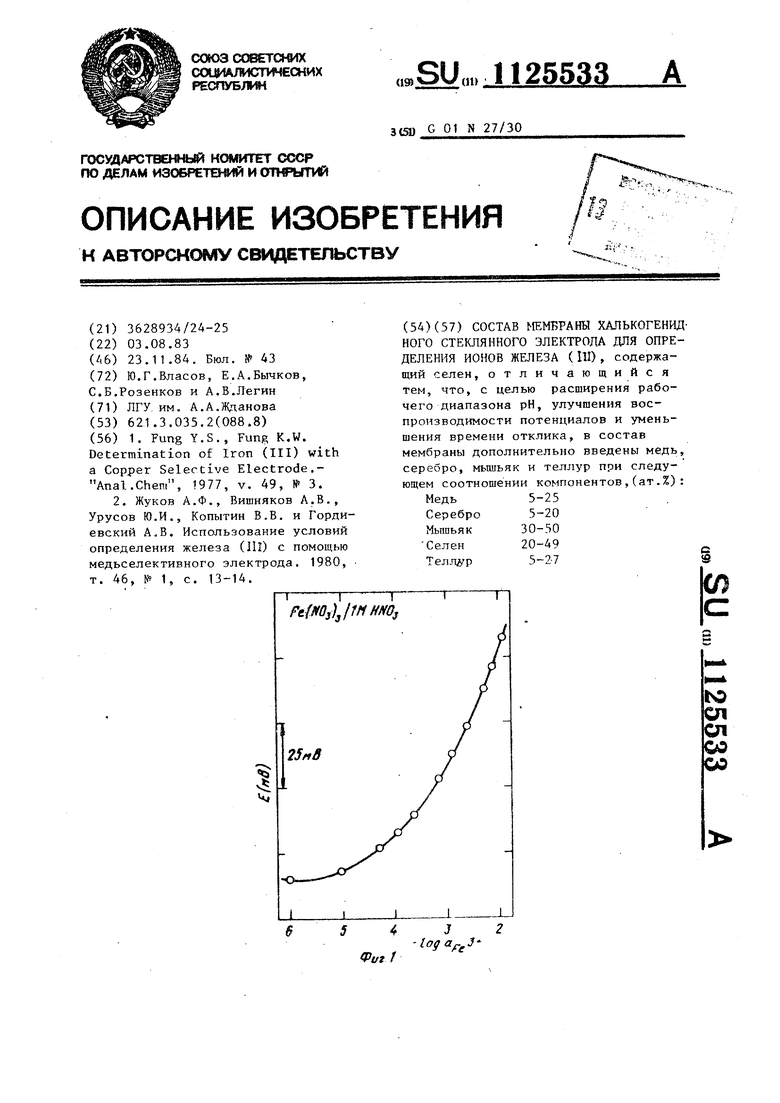
Дрейф потенциала в течение 3 мес. работы .±8,5 +12,0 -±6,5 110,0
Натрий 1,0 Калий 1,О Магний 1,О Стронций 1 ,0 Кобальт 1,0
±7,5
± 7,0
Таблица 3
1125533
JO Продолжение табл.3
PefNO)
JI1L
r П1Г
20c
t(c) Фиг 2
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Fung Y.S., Fung K,W | |||
| Determination of Iron (III) with a Copper Selective Electrode..Ghent, 1977, v | |||
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Жуков А.Ф., Вишняков A.В., Урусов Ю.И., Копытин В.В | |||
| и Гордиевский А.В | |||
| Использование условий определения железа (III) с помощью медьселективного электрода | |||
| Способ получения фтористых солей | 1914 |
|
SU1980A1 |
| Способ изготовления звездочек для французской бороны-катка | 1922 |
|
SU46A1 |
| Насос | 1917 |
|
SU13A1 |
| т FttflOs Jlf HNO, | |||
Авторы
Даты
1984-11-23—Публикация
1983-08-03—Подача