ся при этом соединение выделяют или непосредственно обрабатывают
145927
агентом, отщепляющим Н-На1, таким как трйэтиламин или триэтаноламин.





| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения N-замещенных производных азиридин-2-карбоновой кислоты или натриевой соли кислоты | 1985 |
|
SU1431676A3 |
| Способ получения производных фенилацетонитрила или гидратов, или дигидратов их оксалатов, или цитратов | 1985 |
|
SU1508956A3 |
| Способ получения пирролобензимидазолов,или их таутомеров,или их физиологически совместимых солей неорганических кислот | 1986 |
|
SU1470191A3 |
| Способ получения производных азиридина | 1977 |
|
SU673167A3 |
| Способ получения производных эфиров 1-азиридин-карбоновых кислот | 1977 |
|
SU751322A3 |
| Способ получения производных 2-аммонийэтилфосфатов | 1983 |
|
SU1376948A3 |
| 4-АМИНОПИРИДИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2126388C1 |
| ПРОИЗВОДНЫЕ КУМАРИНА, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ PLA-ИНГИБИТОРОВ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1994 |
|
RU2133745C1 |
| ЦИКЛОГЕКСАНОЛНИТРАТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1991 |
|
RU2106339C1 |
| Способ получения производных дифосфоновой кислоты | 1989 |
|
SU1823875A3 |
СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ 2-ЦИАНАЗЙРИДИНОВ общей формулы -CN R 47 N R где RI водород или метилу R неразветвленный или разветвленньй С -С..-алкил, аллил, 2-метилмеркаптобензил7 3,4-диметоксибензил5 4-ме- тилбензил, 3-этоксикарбоншт-2-метилбензил, 4 гидроксибензил, трифторметилбензил, 2-хлоя1 ензил, 5-ме тил-2-нитробензил, циклопропил, 2-метоксиэтил, 2,2-диметоксиэтил, феноксиэтил, 2-гидроксиэтил, 2,2-дкхлорэтил, 2-хлорэтил, циклогекс-1-эннлметил, 2-тенил 2-фурилметил, 2-ме.тилаллил,. 1-адамантил, фенил, Су-С -алкоксикарбонилэтшт, С -Cj -алкоксикарбонилметил, тетрагидропиран-4-ил, 5-метоксикарбонил-2-тенил, 5-метоксикарбонил-2-фурфурил, 2-бутенил, 5-метилпиримидин-4-ил-метил, 2-гидрокси-6-метилпиридин- -З-ил, метил-1,6-диметил-2-оксопиридин-З-ил, метил- -2-метокси 6-метилпиридин- 3-ил, метил-2,5-диметилпиридин-4-ил, метил-4-метил- С тиазол-2-ил-метил, 2-проп-инилтетрагидрофурфурил, /Л 3-метил-меркаптопропил, 2- j, -метилсульфонилэтил, цинна Сшш мил, 3-бутИНИЛ, 2-НОрборНШ1, ;:; пиримидин-2-ил-метил, 5-карбокси-2-тенил или 5-карбокси-2-фурфурил, отличающийся тем, что 4 .оединение общей формулы сл со го HQh RI-CH-C-CN ч1 Hall L где R, - имеет указанные значения; Hat и Halj - хлор или бром; L - водород или вместе с Hat имеют валентную связь подвергают взаимодействию с амином общей формулы 1 имеет указанные значения, и образовавшее-

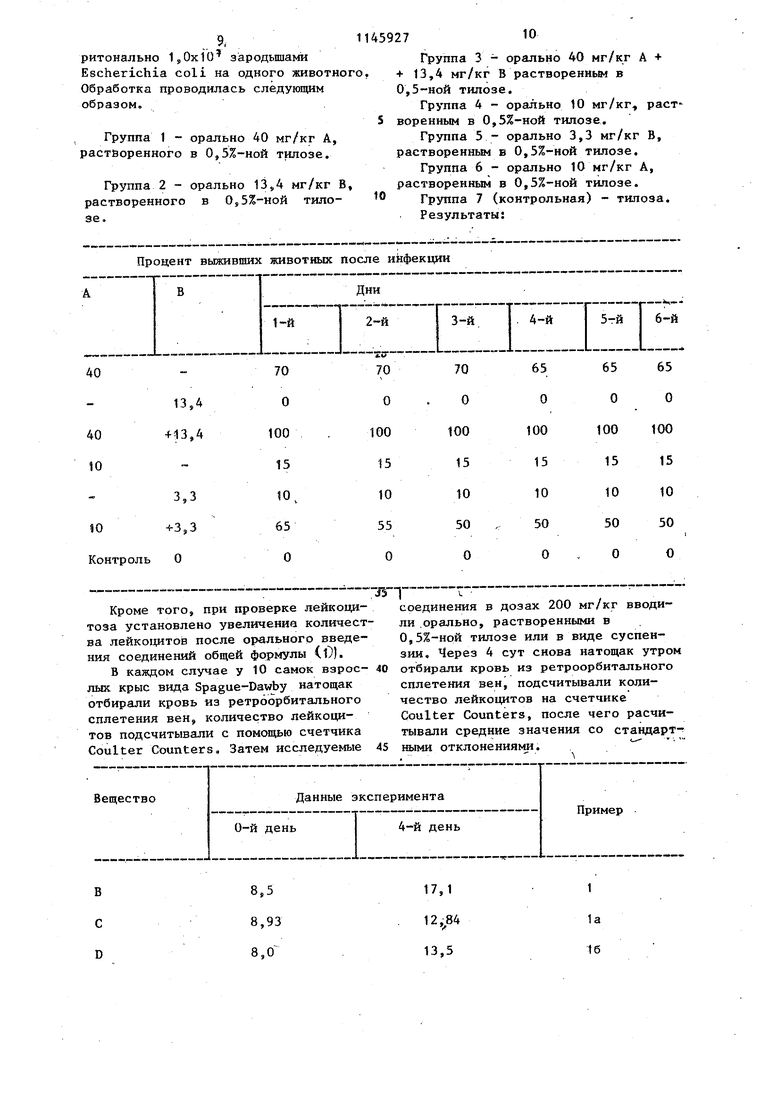
Изобретение относится к получению новых N-замещенных производных 2 -цианазйридинов, обладаюпщх иммуно;тимулирующей .активностью. Известен способ пблучения Ы-замеценных 2-цианазиридина взаимодействием. Например 5 253-дибромпропионит-рилЯ; бензиламина и триэтила1-1ина l, Цель изобретения - разработка на основе известного метода способа получения новых соединений, обладающих ценными фармакологическими свойствами,. Поставленная цель достигается согласно способу получения Н-заьаещеннь1х производных 2 цианазиридинов общей формулы Ч :где R R водород или метил-/ неразветвленный или разветвленный С,-С алкил5 аллил, 2-метилмеркаптобензил, 3 54-диметоксибензил5 4 метилбензил, 3-этоксикар бонил--2 метилбензил5 4гидроксибевзил,, трифторметилбензи.п, 2-хлорбен зил.,5-метил-2-нитробензил5 циклопропил, 2 метокси этил 2;2-диметоксиэтил5 , феноксиэтил 2-гидрокси-этил, 2,2-дихлорэтил, 2-хлорэтилэ циклогекс 1™ энилметил, 2-тенил5 2--фури метил, 2-метилаллил, мантил, фенил, С -С --алкок сикарбонилэтил, ,,ал коксикарбонилметш ;. тетрагидропиран-4-ил, 5--метокси карбонил-2-рвнил, 5-метокси карб-онил-2-фурфурил5 2-бу- тениЛ; 5 метилпиримидин 4 -ил-метил, 2 -грщрркси-6-ме. тилггарпдин-3-ил, метил-1,6- -диметил-2-оксо-пиридин-З-илг метил-2-метокси 6-метилпиридин-3-ил, метил-2,5-диметилпиридин-4-ил, метил. -4-метилтиазол-2-ил-метш1, 2-пропИнилтетрагидрофурфурйЛг 3-метил-меркаптопропил, 2-тметилсульфонилэтил, циннамил, З-бутинил, 2-норборнил, пиримидин-2-ил-метил, 5-карбокси-2-тенил и 5-карбокси-2-фурфурил, заключающемуся в том, что соединение общей формулы BH-CH-C-CN I Hall L где К., - имеет указанные значения; ttat и Hatj - хлор или I. - водород или вместе с Hat означает валентную связь, подвергают взаимодействию с амином общей формулы К-Шг , где R - имеет указанные значения, и образовавшееся при этом соединение вьщеляют Или непосредственно . обрабатывают отщепляющим Н-НаС агентом, таким как трйэтиламин или триэтаноламин. Пример 1. 1-Аллил-2-цианазиридин,, К 2-бромакрилнитрила в 250 мл толуола при по каплям добавляют постоянно помешивая, раствор 28,5 г аллиламина и 51 г триэЬияамина в 250 мл толуола. Затем в течение 3 сут при.комнатной температуре проводится перемешивание, фильтрование, выпаривание фильтрата, перевод остатка, в эфир, экстрагирование в ледяной разбавленной соляной кислоте, промывание в ледяной воде до нейтральной реакции и пропускание полученного раствора через 400 г дезактивированной окиси алюминия. .После выпаривания осуществляется Двойная дистилляция. Выход 28,6 , т/ кип. а ЗЗ-ЗЗ С. Аналогичным образом путем обработки 2-бромакрилнитрилом с сортветствукицими аминами и последующей очистки над силикатовым гелем и/или через колонку с дезактивированным окислом алюминия получают следующие соединения: з) 2-1щан-1-(2-гидроксиэтил)-азиридин, маслянистый продукт, выход 31, и) 3-(2-цианазиридин)-1-ил-этиловый эфяр пропионовой кислоты, т. кип. 0, , выход 33% (растворитель диоксан); л) 2-циан-1-(4-гидроксибензил)-азиридии, т. тек. il2-114C, выход 37% (растворитель - этанол); м) S-2- (+)-2-циан-1-азиридин3-мети ловый эфир пропионовой кислоты, т. тек. 88-91 с из диизопропилового эфира, rotj + 99,4 с 1 (метанол) i ;н) 2-циан-1-(циклогекс-1-енилметш1) -азиридин т. кип. ЮЗ-ЮЗ С, выход 42,9%, о) 2-цйан-1-(2-тенил)-азиридин5 т. кип. , 90-92 С, выход 20% (продолжительность реакции 10 сут)j п) 2-циан-1-(2-фурилметил)-азиридин т.кип. . 0 100-101С, выход 8,1% (продолжительность реакции 10 сут) р) 2-циан-1-(2-метилаллил)-азиридин т. кип. 9 36-38 0, выход 16,4%, с) 1-(1адамантил)-2-цианазиридин т. тек. 62-64 С. выход 31,8% (растворитель - диоксан). Пример 2. 1-трет-Бутил-2-цианаэиридин. 6,0 г 2-бром-3-трет-бутиламинопропионитрил-гидробромида (полученного путем обработки 2,3-дибромпропионитрила с трет-бутиламином, т. тек, 188-190с) растворяют в 30 метанола и нагревают с 23 г триэтаиоламина в течение 4 ч с обратным оттокон. Затем полученный раствор, упаривают, нейтрализуют 2 н. серной кислотой, экстрагируют эфиро Полученную эфирную фракцию сушат и вьшаривают. Затем она подвергается дистилляции. Выход 1,,3%, т. кип. Д2 32-34°С т. тек. 33-54 С Аналогичным образом получают путем обработки: а)2-бром-З-п-пентиламино-пропионитрил-гидрохлорида (полученного обработкой 2,3-дибромпропионитрила-п-пентил-амином, т.тек. 133-133С) триэтаноламином 2-циан-t-п-пентилазиридин, т. кип. (, выход 43%. , б)2-бром-3-(карботоксиметиламино)пропионитрил-гидрохлйрида (полученного цутем обработки 2,3-дибромпропионитрила глицинэтилэфиром т. тек. 70-75°С) триэтаноламином 2-циан-1-азиридин-этиловый эфир уксусной кислоты т, кип. о 88-90 С, вькод 34%; в)2-бром-З- (1-карбометоксиметил)-аминоЗ-пропионитрила (полученного путем обработки.2,3-дибромпропионитрила 1-аланинметилэфиром, маслянистое вещество) триэтиламнном S-2- С(+)-2-циан-1-азиридииЗ-метиловый эфир пропионовой кислоты, т. тек. 88-91°С, из диизопропнлового эфира, + 99,4°С, с 1 (метанол) , Пример 3. 1-Аллил-2-циан-3-метилазиридин. 13,4 г кротонитрила при комнатной температуре обрабатывают в течение 2 ч 32 г брома, затем раствор до обесцвечивания нагревают до , растворяют в 100 мл эфира, охл 1ждают до , добавляют по каплям 20.2г триэтиламина в 30 мл эфира и охлаждают в течение часа ппи при постоянном помешивании. К суспензии при добавляют смесь 20,2- триэтиламина и 11,4 г аллиламина в 100 мл эфира и оставляют на 4 сут при помешивании. Осадок отсасывают, промывают эфиром, и просушенный эфирный раствор пропускают через 230 г дезактивированного окисла алюминия, Затем производится выпаривание и фракционирование. Вькод 10.3.г 42,2%. Т. кип. o,i55-37 C. Пример 4. 1-Бензилазиридин-2-этиловьп1 эфир карбоновой кислоты. К 52 г ЭТ1ШОВОГО эфира 2,3-дибромпропионовой кислоты в 230 мл толуола при помешивании при доб-авляют 33,3 мл триэтиламина и через 2ч раствор 21,4 бензиламина в 230 мл толуола, затем в течение 3сут перемешивают при комнатной температуре. Неоднократно экстрагиpyioT суспензию водой, сушат органическую фазу, подвергают ее выпари ванию, растворяют остаток в эфире и пропускают раствор через 400 г дезактивированного окисла алюминия Затем производится вьтаривание и, фракционирование. Выход 30,7% 75% Т. тек 98-101°С, Аналогичным образом путем обработки получают этиловый эфир 2,3-ди бромпропионовой кислоты; а)с метиламином 1-метилазиридин -2-этиловый эфир карбоновой кислоты т. КПП, 70-72°С, выход 40%, б)с аллиламином 1-аллилазиридин -2-этиловый эфир карбоновой кислоты .т. кип. 9 -Э2с,, выход 24%, Пример 5, Аналогично приме ру 1 путем обработки 2-бромакрилнит рила получают: а)с 2 метилмеркаптобензиламином 2-циан-1-(2-метилмеркаптобензил)-азиридин, маслянистьй продукт, выход 54%; б)с 354-диметоксибензиламином 2-циан-1(354-диметоксибензил)-азири дин, маслянистьм продукт, выход. в)с 4-метилбензиламином 2-циан -1-(4-метилбензил)-азиридин, т, кип. (,pg1 13-115°С, выход 23%. г)с циклопропиламином 2-циан-1 -циклопропил-азиридин т. кип. выход 22%, д)с 2-метил-З-карбэтокси-бензи амином 2-циан 1-(2-метил-3-карбэто си-бензил)-азиридин5 т. кип. 0,01 , т. тек. 40-43°С, выход 20% от теоретич. в) с 2-хлорэтиламиногидрохлоридом 1-(2-хлорэтил)-2-циан-азиридин (растворитель - диоксан), т.кип, , 74°С, выход 5,1%. ж)с 4-аминотетрагидропираном 1-(4-тетрагидропиранил)2-циан-азир дин) ( растворитель - диоксан), т. тек. 74-76°С, выход 13,2%, з)с 2-метоксиэтиламином 2-циан -1-(2-метокси-этил)-азиридин, т. кип. g., выход 17,5%. и) с 2-феноксиэтиламином 2-циан -1-(2-фенокси-этил)-азиридин, т. кип. 005 , выход 38,8%. П р и м ер 6. Аналогично примеру 1 получают путем обработки 2-бр(.)м-лкрилнитрила. я} с З-метоксикарбонил-2-тенил tii Ui,4 . 11,11.:н-1-( S-метокси-карбо76нил-2-тенил)-азиридин, т, тек. 51 54 С, выход 49%, б)с 5-метоксикарбонил-2-фурфуриламином 2-циан-1-(5-метоксикарбонил-2-фурфурил)-азиридин, т. тек. 8689 С, выход 46%, в)с 2,2-дихлорэтиламином-2-циан-1-(2, 2-дих:лорэтил)-а зиридин, т. кип. 0,1 94-95С, выход 16%, г)с бут-2-ениламином 1-(бут-2-енил)-2-цианазиридин, т„кип. , выход 70%, д) с 5-метилпиримидин-4-ил-метиламином 2-циан-1-(5-метилпиримидин-4-ил-метил)-азиридин, т,тек. 8892°С (из изопропанола), выход 56%. ё) с 2-гидрокси-6-метилпиримидин-3-ил-метиламином-2-11.иан-1- |(2-гид- рокси-6-метилпиримидин-3-ш1)-метилЗ-азиридин, т. тек. 187-190С (из воды), выход 47%, ж)с аминоацетальдегиддиметилацеталем 2-циан-1-(2,2-диметокси-1-этил)-азиридин, т. кип. ( 9092 С, выход 70%-,з)с 1,6-димeтил-2-oкco-пиpидин-3-ил-мeт шaминoм-2- иaн-1- L(I 6-димeтил-2-oкco-пиpидин-3-ил)-мeтилЗ- -aзиpидин5 То тек. 82-84 С, выход 78%. и) с 2-метокси-6-метилпиридин-3-ил-метиламином-2-циан-1-(2-метокси-6-метилпиридин-З-ил)метил -азиридин, т. тек. 70-73 0 (из изопропанола), выход 69%, к) с 2,5-диметил-пиримидин-4-илметиламином-2-циан-1- Ц2,5-диметил- пиримидин-4-ид)-метил -азиридин, т.тек. 88-92 С (из.изопропила), выход 82%; л) ч 4-метилтиазол-2-ил-метиламином-2-циан-1-(4-метилтиазол-2-ил-метил)-азиридин, т. тек. JS-TS C, выход 21%; м)- с проп-2-ил-амином-2-циан-1-(проп-2-икил)-азиридин, т. кип. о., , выход 28%,н) с тетрагидрофурфуриламином 2-циан-1-тетрагид,рофурфурил-азиридин, т. кип, , выход 20%, о) с 3-трифторметилбензиламином 2-циан-1-(3-трифторметил)-азиридин, т. кип. , выход 31%. п) с 3-метилмеркаптопропиламином 2-циан-1-(3-метилмеркаптопропил )-азиридин, т. кип. д 110С, выход 18%; р) с 2-метилсульфонилэтиламияом 2-циан-1-(2-метилсульфоннлэтил)-азиридин, маслянистое вещество, выход 47%, с) с фенетиламином 2-циан-1-фене тил-азиридин, т. кип. „ 122-124 С, выход 18%, т) с циннамлламином 1-циннамил-2-цианазиридин, т. кип. 138-14О С, выход 13%; у) с бут-3-иниламином-1-(бут-3-инил)-2-цианазиридин, т.кип. , выход 68%, ф) с 2-норбониламином 2-циан-1(2-норбонил)азиридин, т. кип 84 , выход 20%, х) с хлорбензиламином 1-(2-хлорбензил)-2-цианазиридин, т. тек. 5557 С (из изопропанола), выход 36%; ч) с пиримидин-1-2-илметиламином 2-циан-1-(пиримидин-2-ил-метил)-азиридин, т. тек. 72-76°С (из изопропанола), выход 33%, ш) с 5-метил-2-нитробензиламином -2-циан-1-(5-метил-2-нитробензш1)-азиридин, т. тек. 95-96°С (из изопропанола), выход 41%, щ) с К-(-)-аланинметилэфиром К-(-)-2-(Ь-)-2-циан-1-азиридин-метиловый эфир пропионовой кислоты, т. тек. -9р-91С (из диизопропилово го эфира), выход 12% - - 99,1 (с 1; в метаноле) . Пример 7. L-(-)-i-(L) -(-Фенилэтил)-азиридин-2-этиловый эфир карбоновой кислоты и D-(+)-1,-(Ь-)-(-фенилэтил)-азиридин-2-этиловый эфир карбоновой кислоты. К 26 Г этилового эфира 2,3 дибромпропионовой кислоты в 60 мл эта нола добавляют при помешивании 15 г триэтаноламина в 20 мл этанола и че рез 1 ч одновременно раствор 12,1 г Ь-(-)-феннлэтиламина в 20 мл этанола и раствор 15 г триэтаноламина в 20 мл этанола. Суспензия перемешивается в течение 12 ч при комнатной температуре, отсасывается, филь рат подвергается выпариванию, а остаток пропускается через колонку с силикагелем и делится на диастереомеры (алюант - смесь эфира и лигрои нй - 2:1). Выход Ь,Ь-изомеров - 39%, маслянистое вещество, Jjj -90°, (с «IB этаноле). Выход D,D-H30MepoB - 47%, маслянистое вещество - 53,2° (с 1 в этаноле). Аналогичным способом посредством обработки этилового эфира 2,3- ;ибромпропионовой кислоты П-(+)-фенилэтил-амином получают: а)Ь-(-)-1-(П-)+(-фенилэтил)-азиридин-этиловый эфир 2-карбоновой кислоты, маслянистое вещество, выход 39%, roiJi,- 57,9 (с 1 в этаноле); б)В-(+)-1-(В-)+(-фенилэтил)-азиридин-этиловый эфир 2-карбоновой кислоты, маслянис- ое вещество, выход 39%, 0 + 89,7(с 1 в этаноле) . Внутривенное введение f-карбамоил-2-цианозиридина у крыс обусловлива- ет сильный подъем лейкоцитов и лимфоцитов, тогда как количество эритроцитов остается почти без изменений 2, наблюдается значительное увеличение клеток печени, вырабатывающих антитела; По этой причине этот продукт используется в качестве иммуностимулирующего терапевтического средства при бактериальных и вирусных инфекциях. Незначительная стабильность данного вещества в растворах и неполная действенность при оральных применениях является недостатками данного препа- рат.а. По этой причине была поставлена задача подбора или разработки такого иммуностимулирующего терапевтического средства, которое при равной или более повышенной действенности и малой токсичности не обладало бы побочными действиями, было.бы более стабильным и более простым при оральном применении. Полученные указанным способом соединения обладают иммуностимулирующим действием. Для доказательства иммуностимулирующего действия (исследовано влияние острой инфекции Escherichia coli (108) у мышей с помощью иммуностимулятора из соединений общей формулы (1) (например 1-аллил-2-цианазиридина (В), при одновременной выдаче субтерапевтических доз хдорамфеникола (А). Условия эксперимента: в каждом случае 20 самок мышей MMRI (25-30 г) в течение дня инфицировали интрапе..9- 1
ритонально IjOxio зародышами Escherichia coli на одного животного Обработка проводилась следующим образом.
Группа 1 - орально 40 мг/кг А, растйоренного в 0,5%-ной тилозе.
Группа 2 - орально 13,4 мг/кг В, растворенного в 055%-ной тилозе.
Процент выживших животных после инфекции
70 О
13,4 -(-13,4
100
15
3,3
10,
65 -3,3
О
троль О
Кроме того, при проверке лейкоцитоза установлено увеличении количества лейкоцитов после орального введения соединений общей формулы (.1)).
В каждом случае у 10 самок взрослых крыс вида Spague-Dawby натощак отбирали кровь яз ретроорбитального сплетения вен, количество лейкоцитов подсчитывали с помощью счетчика Coulter Counters. Затем исследуемые
14592710
Группа 3 - орально 40 мг/кг А + f 13,4 мг/кг В растворенньм в О,5-ной тилозе.
Группа 4 - орально 10 мг/кг, рас 5 воренным в 0,5%-ной тилозе.
Группа 5 - орально 3,3 мг/кг В, растворенным Б 0,5%-ной тилозе.
Группа 6 - орально 10 мг/кг А, растворенным в 0,5%-ной тилозе.
Группа 7 (контрольная) - тилоза.
Результаты;
65 О
65 О
65 О
70 О
100
100
100
0
15
15
15
15
10
10
10
10
50
50
50
50
О
О
О
О
соединения в дозах 200 мг/кг вводили .орально, растворенными в 0,5%-ной тилозе или в виде суспензии. Через 4 сут снова натощак утром
отбирали кровь из ретроорбитального сплетения вен, подсчитывали количество лейкоцитов на счетчике Coulter Counters, после чего расчитывали средние значения со стандарт-г
отклонениями.с-- .
хлор4 1феникол5
1-аллил-2-цианазиридин,
2-ци9Н-1-метилазирндин|
2-циаи-1-й- пропилаэиридин
1-бензнл-2-цианазиридин,
3-(27Цианазиридин-1-ил)-акролеин-,
Продолжение таблицы
1311459271
G - 3-(2--1дианазиридин-1-ил)этиловый эфир акриловой кислоты;
Н -1-фенил-1-(2-карбамош1азиридин-1-ил) 2-цианэтилен
1 - 2-циан 1 изопропилазиридин
1 2-циам-1(2 тенил)-азиридин,
К - 2 1щан-1-(2 метилаллил)- азиридин5
L 1-(2-хлорэтил)-2-цианазиридин$
М - 2-циан--1-(3-Трифторметилбензил)азиридин5
N - 2 циан-1-(5-карбокси)-2-фурфурил)азиридин
О 2- -циан 1-(5--метоксикарбонил-2-тенил)-азиридин;
Р 2-циан 1(252 дихлорэтш1)азиридин;
Q (бут 2--енил)2-щ1аназиридин5
R (5-метил-2 нитробензил)--азиридин;
S 1-(2 хлорбензил)-2-1дианазиридик;
Т 2 циан-1 -(5--мётилпиримидин--4-илнетил)-азиридин5
U-I, (-) (Ь)(фенилэтил)-азиридин;
V-D(+)-2 циан-t-(L-)-(фенилэтил)-азиридин;
W-L- (-) 2-циан--1 - (D-) + (-фенилэтил) -азйридин.
X - 2-циан-1-(пиримидин-1-илмети,п)азиридин5
Z - - L( 2 метокси-6-кетйлпири:4идин-3-ил) метил }-азиридин.
2-11ианазиридины, замещенные пособом в противоположность известным
азоту алкильнь ми группами обладают производным азиридина в Ames-mecme
слабыьда п6бочнь5ми действиями. Соеди- 25проявляют крайне слабые или почти
нения, полученные предлагаемым сгго--не проявляют мутагенные свойства.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Гундерманн и др, Chem | |||
| Вег, 105, 312. | |||
Авторы
Даты
1985-03-15—Публикация
1979-08-01—Подача