Изобретение относится к области органической химии и касается, в частности, способа получения циси/или транс-5-окси-З-замещенных ци логексанонов формулы л являющихся полупродуктами для получения замещенных циклоалканолов фор мулы Ш где К - Н, CHjPh,: которые используются в качестве анальгетиков. Цель изобретения - обеспечение возможности получения замещенных ци логексанолов, обладающих улучшенным анальгетическим действием. Пример 1. 7-Оксадицикло-С. 1.0 -А-С2-бензилокси-4-(1,1-диметнлгептил)-фенил }-2-гептанон. При 0°С в раствор 3,24 г (8,01 ммоль) 5- 2-бензилокси-4-(1, -диметилгептил)-фенил -2-циклогексе -1-она и 2,3 мл (24 ммоль) 30%-ной перекиси водорода в 80 мл метанола по каплям добавляют 0,66 мл (3,96 ммоль) 6 н.гидрата окиси натрия. Реакционную смесь перемешивают в течение 1 ч при , после чего ее выливают в 1000 мл насьпценного раствора хлористого натрия. Затем охлажденную таким образом реакционную смесь подвергают экстракционной обработке 500 мл диэтилового эфира, экстракт сушат над сульфатом магния отгоняют растворитель и получают 3,02 г сырого продукта. Этот сьфой продукт очищают хроматографической обработкой в колонке с 200 г силика геля, элюируя смесью 20%-ного диэти лового эфира с петролейным эфиром, в.результате чего в порядке элюиров ния получают 237 мг (7Х-ный. выход) цис-изомера, 1,72 г (51%-ный выход) смеси и 1,01 г (30%-ный выход) указанного транс-изомера.. В результате хроматографической обработки в колонке смешанной фракции на 300 г силикагеля с элюированием смеси 10%-ного диэтилового эфира с петролейным эфиром получают 34 мг (1%-ньй выход) цис-изомера и 1,56 г (46%-ный выход) указанного транс-изомера в виде маслоподобных продуктов. цис-Изомер. ИК-спектр (хлороформ), 1718, 1626, 1582. Масс-спектр (m/z) : 420 (М), 404, 335, 312, 206 и 91. , ПМР-спектр ( с) CDClj тетраметилсилан: 0,83 (м, концевой метил), 1,27 (с., гем-диметил), 2,0-2,5 (м), 2,9-3,7 (м), 5,15 (с., бензиловый метилен), 6,9 (м, арил-Н), 7,10 (g., J 8 Гц, арил-Н) и 7,41 (с., фенил-Н). транс-Изомер. ИК-спектр (хлороформ), 1718,. 1623, 1577. Масс-спектр (m/z): 420 (М), 404, 335, 329, 316, 257, 91. ПМР-спектр ( сА, CDClj , тетраметипсилоксан): 0,81 (м, концевой метил), 1,26 (с., гем-диметил), 2,0-2,8 (м), 3,3 (м), 3,4-4,0 (м), 5,13 (с., бензиловьй метилен),-6,9 (м, арил-Н), 7,07 (g., J 8 Гц, арил-Н) и. 7,41 (с., фенил-Н). Пример 2. 3- 2-Бвнзш1окси-4-(1,1-диметилгептил)-фенил -цис-5-оксициклогексанон. В раствор 277 мг (0,635 ммоль) цис-изомера 7-оксадицикло-С4.1.0 -4- 2-бензилокси-4-(1,1-диметилгептил)-фенилJ-2-гептанона в 20 мл 10%-го водного раствора тетрагвдрофурана добавляют 220 мг алюминиевой амальгамы (полученной промывкой сантиметровых полосок алюминиевой фольги по 15 с, каждым из следующих компонентов: 2 к.раствор гидрата окиси натрия, вода, 0,5%-Hi хлорид двухвалентной ртути, вода, 2 н.раствор гидрата окиси натрия, вода, 0,5%-ный хлорид двухвалентной ртути, вода, этанол и диэтнповый эфир). Реакционную смесь перевешивают в течение 3 ч 25°С и фильтруют через диатомовую землю, фильтрат выпаривают на роторном испарителе, а остаток растворяют в диэтиловом эфире, сушат над сульфатом магния и выпаривают. Остаток очищают хроматеграфической обработкой с применением двух силика гельных пластин размерами 20-20 -20 с элюируя диэтиловым эфиром, в результате чего получают 156 мг (58%-ный выход) указанного соединения в виде маслоподобного продукта. ИК-спектр (хлороформ) смЪ 359,7 354,6, 1718, 1612 и 1577. Масс-спектр (m/z): А22, 404, 337 331, 319, 313, 310. ПМР-спектр ( сЛ, CDClj , тетраметил силан), 0,81 (м., концевой метил), 1,22 (с., гем-диметил), 3,2 (м., бен З.ИЛОВЫЙ метин), 3,95 (м., карбиновый метин), 5,02 (м., бензиловый метилен 6,9 (мл, арил-Н), 7,03 (g, J 8 Гц арил-Н) и 7,38 (с., фенил-Н). Пример 3. 3-С2-Бензилокси-4-(1,1-диметилгептил)-фенил J-транс-5-оксициклотексанЬн. Как в примере 2 с использованием 1,47 г (3,5 ммоль) транс-изомера 7-оксадицикло-(4.1.0)-С2-бензилокси-4-(1,1-диметилгептил)-фенил 2-гепта нона получают 1,25 г (84%-ный выход) указанного соединения. Температура плавления 95 С (в пен тане).. ИК-спектр (хлороформ) .3636, 3448, 1724, 1726 и 1587. Масс-спектр (m/z): 422 (М), 404 337, 331, 319, 313 и 91. ПМР-спектр ( с, GDClj, тетраметил силан): 0,84 (м., концевой метил), 1,25 (с., гем-диметил), 2,15 (м.), 2,3-2,8 (м.), 3,9 (м., бенэнповый метин), 4,5 (м., карбоноловый метин) 5,12 (с., бензиловый метилен), 6,9 (м., арип-Н), 7,08 (g, J - 8 Гц, арил-Н) и 740 (с., фенил-Н). Пример 4. цис-3 2-Бензипокси-4-(1,1-диметилгептил)-фенил -транс-5-циклогексан-1,5-диол и транс ЕЗ- Ц1с-5-изомер. В охлажденный до ОС раствор 629 мг (1,49 ммоль) 3-(2-бензш1окси-4- (1,1 -диметш1гептш1)-феннп-транс7 -5-оксицшслогексанона в 50 мл метанола добавляют 1,22 г (32,1 ммоль) боргидрида натрия, перемешивают 30 мин при и выливают в смесь 500 мл насыценного раствора хлористо го натрия и 300 мп диэтипового эфира Эфирный слой промывают насыщенньм раствором хлористого натрия (2 « «500 мл), сушат над сульфатом нагния и выпаривают (вытяжной вентилятор) до образования маслоподобного остатка. Маслоподобный продукт очищают кроматографической обработкой в колонке с 200 г силикагеля, элюируя смесью пентана с дизтиловым зфиром в соотношении 2:1, и получают 385 мг (выход 61%) транс-5-изомера и 137 мг (выход 38%) транс-3, цис-4-изомера указанного соединения. цис-5-Изомер. Масс-спектр Cm/z): 424, 3002 (М, вычислено для С2 Н4оОз: -424, 2927). ПМР-спектр ( cf, CUClj , тетраметилсилан): 0,83 (с., концевой метил), 1,26 (с., гем-диметил), 4,25 (м., карбиноловый метин), 5,13 (с., бензиповый метилен), 6,9 (м., арил-Н), 7,12 (g, J 8 Гц) и 7,41 (м., фенил-Н). транс-5-Изомер. Масс-спектр (m/z): 424, 2992 (М, въ1числено для CjjH jjOj: 424, 2927, 339, 23t, 213 и 91. ПМР-спектр (еГ, CDClj тетраметилсилан): 0,83 (концевой метил), 1,25 (с., гем-диметил), 3,0-4,4 (м., ЗН), 5,10 (с.,- бензиловый метилен), 6,88 (g., J 2 Гц, арил-Н), 6,88 (g.g- 8 и 2 Гц, арил-Н), 7,10 (g., J 8 Гц, арил-Н) и 7,40 (м., фенил-Н). . Пример 5. цис-3-/2-Бензилокси-4-(1,1-диметилгептил)-фенил f-цис-5-циклогексан-1,5-диол и цис-З-транс-5-изомер. Как в примерах 4 и 3 203 мг (0,481 ммоль) 3-/2-бензиолокси-4-(1,1-днметипгептил)-фенил /-цис-5-оксициклогексанона получают 25 мг {12%-ный выход) цис-3, транс-5-изомера указанного соединения и 132 мг (65%-ный выход) указанного соединения. ЦИС-3-, цис-5-Изомер. Масс-спектр (m/z): 424, 2974 (М, ычислено для 424, 2927) 39,. 298, 231, 213 и 91. П р и м е р 6. цис-3-/4-(1,1-Диетнл гептил) -2 оксифенш1 /-ЦИС-5цшслогексан-1,5-диол. Смесь 132 мг (0,311 ммоль) цис3/2-бензилокси-4-(1,1-диметилгепил) -фенил /-цис-5-циклогексан-1,5диола с 300 мг ЗХ-ного палладия на гле и 50% воды в 10 мл этанола пеемешивают в атмосфере газообразного одорода в течение 45 мин при комнатной температуре, затем фильтруют через диатомовую землю и фильтрат выпаривают при пониженном давлении. После перекристаллизации твердого остатка из диизопропилового эфира получают 72 мг (выход 69%) указанного соединения. Температура плавления (в смеси дизтилового эфира с пентаном) Масс-спектр (m/z): 333, 2517 (Mt вычислено для ): 334, 2483), 298, 249, 231 и 213. ПМР-спектр ( сЛ« CDCl -тетраметилсилан): 0,83 (т., концевой метил), 2,24 (с., гем-диметил), 2,94 (м., бензнловый метин), 3,35, 3,11 (гидро сил), 3,47-3,97 (м., карбиноловые метины), 6,72 (м., аршт-Н) и 7,00 (g., J 8 Гц,арил-Н). Пример 7. ЦИС-3-/4-С1,1-Димeтилгeптил)-2-oкcифeнил /-транс- -циклогексан-1,5-диол. Как в примере 6 из 385 мг (0,908 ммоль) цис-3-/2-бензилоксн-4-(1,1-диметилгептил)-фенил/-транс -5-циклогексан-1,5-диола получают 162 мг (53%-ньй выход) указанного соединения. Температура плавления 170 С (дихлорметан). Масс-спектр (m/z): 334, 2513 (М вычислено для 334, 2483), 298, 249, 231 и 213. ПМР-спектр (100 МГц, CDCl , -ДМСО), сЛ: 0,81 (м., концевой ме тил), 1,23 (с., гем-д иметил), 3,38 (м., бензиповый метин), 3,9-4,3 (м. карбиноловые метины), 6,74 (м., арил-Н) и 7,00 (g., J 8 Гц, арилПример 8. транс-/2/4-(1,1-Диметилгептнп)-2-оксифенил /-цис-5-циклогексан-1,5-диол. Как в примере 6 из 237 мг (0,558 ммоль) транс-3-/2-бензилокси 354 4-(1,1-димстилгептил)-фенш1/-цнс-5-циклогексан-1,5-диола получают 107 мг (57%-ный выход) указанного соединения. Температура плавления 126-127 С (в смеси диэтилового эфира с пентаном) . Масс-спектр (m/z) : 334, 2503 (М, вычислено для 334, 2483), 316, 298, 249 и 231. МПР-спектр (100 МГц, CDCl, 1 -ДМСО), сГ: 0,83 (м., концевой метил), 1,24 (с., гем-диметил), 3,82 (м., бензиловый метин), 4,29 (м., карбиноловые метины), 6,86 (м., арил-Н) и 7,06 (g., J 8 Гц, арип-Н) Аналогично проводят дебензилирование соединений, полученных по,примеру 5. Анальгетические свойства указанных замещенных фенилциклогексанонов формулы И определяют в .ходе проведения испытаний с применением болевых раздражителей. Результаты представлены в таблице. Получение соединений общей формулы 2 предлагаемым способом позволяет получать фармакологически активные замещенные циклоалканолы.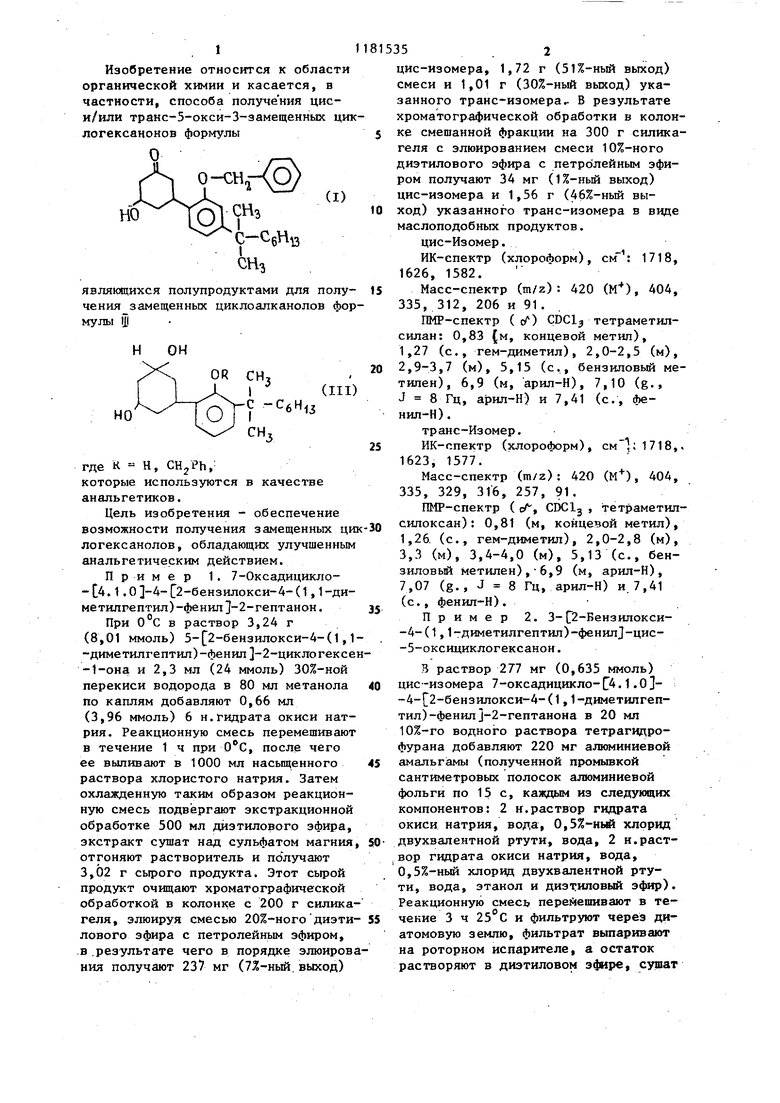


СПОСОБ ПОЛУЧЕНИЯ ЦИС- И/ИЛИ TPAHC-5-OKCH-3-3AMEaiEHHbIX ЦИКЛОГЕКСАНОНОВ формулы I отличающийся тем, что соединение формульт Ц СО С подвергают окислению перекисью водорода с последующим восстановлением полученного при этом эпоксида алюминиевой амальгамой. 00 ел со ел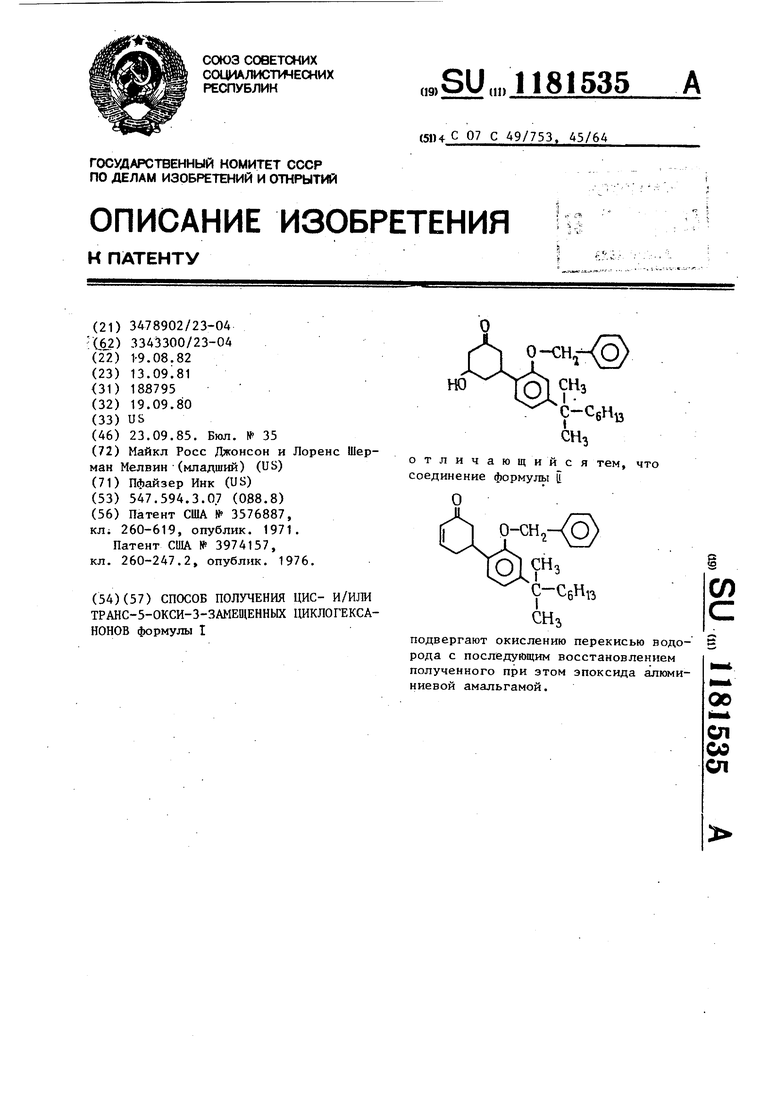
| Патент США № 3576887, кл; 260-619, опублик | |||
| Устройство станционной централизации и блокировочной сигнализации | 1915 |
|
SU1971A1 |
| Патент США № 3974157, кл | |||
| Прибор для периодического прерывания электрической цепи в случае ее перегрузки | 1921 |
|
SU260A1 |
| Планшайба для точной расточки лекал и выработок | 1922 |
|
SU1976A1 |
Авторы
Даты
1985-09-23—Публикация
1982-08-19—Подача