1 Изобретение относится к способу извлечения содержащей медь и цинк надокисной дисмутазы (НЕД) из водных растворов, содержащих указанный энзим совместно с сопутствующими протеинами. Надокисные дисмутазы представляют стэбой энзимы, каталитически воздействующие на дисмутацию надокисного радикала 0 до кислорода и перекиси водорода 207 2Н х- 11 - О Энзимы, обладающие этим свойством выделены из многочисленных различны организмов, Надокисные дисмутазы, содержащие медь и цинк в их активных участках обнаружены в цитоплазме эвкариотов. Эти энзимы представляют собой двумерные молекулы, которые проявляют высокую степень гомологии в свойственной им последовательности аминокислот lj . Другой класс надокисных дисмутаз содержащих железо или марганец в их |активных участках, обнаружен в прокариотах и эвкарлютной митохондрии. СледЬвательно, у этого класса имеет место большое сходство в составе аминокислот и Ц -оконечных аминокислот. Однако существенная гомология между двумя классами надокисных дксмутаз отсутствует. По-видимому функция Дисмутаз состоит в защите клеток аэробных организмов от токсических воздействий перекисного радикала, являющегося побочным продуктом реакции-кислорода в организме. Считают, что надокисный радикал вызьгаает различные воспалительные процессы в тканях и что он содействует появлению ревматоидных артритов. По этой причине предложено использовать надокисную дисмутазу для л чения воспалительных заболеваний и,в можно , ревматоидных артритов. Терапевтическое действие содержащей мед и цинк надокисной дисмутазы в отношении воспалительных заболеваний ус тановлено опытным путем. Таким обра зом, большое значение имеет разрабо ка способа измельчения содержащей медь и цинк надокисной дисмутазы в промьшшенком масштабе и с высоким выходом. . Среди содержащих медь и цинк надокисных дисмутаз в наибольшей степени изучен бычий энзим. Так, 4 известны полная последовательность аминокислот и рентгеновская структура этого энзима. Кроме того, проведены исследования разнообразными спектроскопическими способами. Содержащую медь и цинк надокисную дисмутазу, быков и других высших животных, извлекают, например, из органов и тканей, в особенности из печени, путем экстрагирования мелко изрубленной ткани холодным буферным раствором, а в случае крови путем гемолиза эритроцитов. После этого, в обоих случаях, из полученного раствора водорастворимых протеинов производят извлечение НЕД. Извлечение осуществляют, например, путем фракционированного осаждения органическими растворителями или сульфатом аммония, в произвольном случае - в сочетании с денатурацией лобильных по отношению к нагреванию протеинов, вызываемой нагреванием в присутствии ионов двухвалентных металлов, или хроматографией на диэтиламиноэтилцеллюлозе или на других ионообменньпс смолах. Низкомолекулярные загрязняющие примеси обычно удаляют из очищенного раствора путем диалига или подвергают такой раствор фильтрованию с помощью геля на геле декстрана. Известен способ очистки энзима посредством пропускания раствора эн-; Зима через буферный раствор, обладаю-щий ионной силой до 10 молярной концентрации, при рН 5,5-8, находящийся в колонне с ионообменной смолой, причем эта смола обладает группировками слабоосновного или слабокислотного характера, привлекающими ионы противоположной полярности. В качестве смолы может быть использована карбоксиметилцеллюлоза, однако этот продукт в интервале рН . 5,5-8 не обладает противоположной полярностью относительно НЕД 21. Известен двухфазный способ извлечения содержащей медь и цинк надокисной дисмутазы из дрожжей согласно которому полученную после замораживания и оттаивания плотную дрожжевую массу, перемешивают прцблизительно в таком же объеме смеси этанола с хлороформом в объемном соотношении 5:3 в течение нескольких часов при 25°С. Затем смесь центрифугируют, всплывший прозрачный слой смешивают с твердым вторичным кислым фосфатом калия (К,НРО), выделенную солью органическую фазу отделяют и осветляют центрифугированием. После этого осаждают протеины добавлением холодного ацетона, осадок повторно растворяют в холодном фосфатном буфере при рН 7,8 и очищают от имею щих коричневатый цвет примесей микрогранулированной диэтиламиноэтилцеллюлозой ДЕ-32. Светло-зеленый фильтрат диализуют относительно фос фатного буфера при-рН 7,8 и после осветления центрифугированием хрома тографируют на колонке, содержащей ДЕ-32 З. В результате обработки водных растворов протеина согласно известному способу или не удается получит достаточно чистмй продукт, или же процессы настолько сложны, что приводят к слишком малому выходу чисто го энзима. Цель изобретения - увеличение вы хода и повышение степени чистоты фермента. Для достижения цели согласно спо собу выделения надокисной дисмутазы из белковых растворов, включающему хромс-тографию ферментсодержащего белкового раствора на катионообменной смоле, хроматографию ферментсодержащего белкового раствора ведут при рН 4,7-5,0 на катионообменной смоле с той же полярностью, что и ,надокисная дисмутаза, причем в качестве катионообменной смолы исполь зуют карбоксиметилцеллюлозу или дек страны, содержащие карбоксиметильные или сульфопропильные группы, или агарозы, содержащие карбоксиметильные группы. Пример 1. Процесс согласно изобретению обеспечивает хорошее вьиеление НЕД из смеси с другими, имеющимися в наличии протеинами, в водных растворах, полученных из ука занных. различных сырьевых материалов, несмотря на то, что согласно теории монообменныё смолы проявляют сродство лишь к веществам, имеющим противоположную полярность. Таким образом, катионообменные смолы и НЕ могут иметь одну и ту же полярность в предлагаемом интервале рН. В качестве катионообменных смол могут быть использованы следующие: различные марки карбоксиметилцеллюлозы, в частности КМ-23 и КМ-52 (фирмы Ватман Лимитед, Великобритания) , карбоксиМетилцеллюлоза КМ- Сефацел (фирмы Фармациа Фаин Кеми-. келз АБ, Швеция), имеющий поперечные связи декстран, замещенный карбоксиметильными группами, под названием КМ-Сефадекс (фирмь: Фармация Фаин Ке шкелз АБ), имеющий поперечные связи декстран, замещенный сульфопропильными группами, под названием СП-Сефадекс (фирма Фармациа Фаин Кемикелз АБ), и имеющая поперечные связи агароза, замещенная карбоксиметильными группами, под названием КМ-Сефароза КЦ-6Б (фирма Фармация Фаин Кемикелз АБ). Хроматографирование раствора на катионообменной смоле может осуществляться периодически путем перемешивания гранулированного ионообмени- вающего продукта в растворе, однако более выгодно осуществлять эту операцию в колонне. Такая операция легко осуществима в условиях крупномасштабного производства и обеспечивает адсорбцию всего энзима на ионообменной смоле. После очистки раствора посредством ионообменной хроматографии, активные фракции продукта, отмытые из адсорбента, можно дополнительно очищать по известному способу фильтрования с применением геля или фракционированного спиртового осаддения, дополнительно подвергая очищенный продукт хроматографировачию один или несколько раз. Предпочтительно диализовать активные фракции против дистиллированной воды и концентрировать досуха, желательно путем высушивания вымораживанием. Пример 2. 2,5 л диэтилового эфира добавляют к 20 кг хлебопекарных дрожжей (Saccharotnyces cerevisial) и смесь оставляют на 30 мин при перемешивании. После дополнительного примерно 2-часового перемешивания при .С добавляют 20 л горячей воды, доводят рН до 7,5 и продолжают перемешивание 4 часа при 45°С. После дальнейшего 16-часового перемешивания, сопровождающегося постепенным снижением температуры до , доводят рН до 4,8 и суспензию осветляют центрифугированием при 2000-кратном значении G р течение 30 мин.
Для удаления соединений с низкой молекулярной массой полученную после центрифугирования жидкость пятикратно разбавляют буфером в виде 0,01 -Н раствора ацетата натрия при 4,8 и сокращают в объеме до 10л, применяя ультрафильтрование. Последнюю процедуру повторяют дважды
К концентрированному раствору добавляют 1 л микрогранулированной карбоксиметилцеллюлозы КМ-52 (фирма Ватман Лимитед), которая уравновешена с помощью 0,025 М раствора ацетата натрия в качестве буфера, и смесь перемешивают 1 ч. Карбоксиметилцеллюлозу собирают в колонну диаметром 30 см, промывают 10 л буфера Е виде 0,025 М раствора ацетата натрия при рН 4,8 и-переносят в колонну диаметром 10 см. В этой колонне осухцествляют отмывку из адсорбента раствором ацетата натрия при наличии линейного градиента концентрации (0,,200 М) при рН 4,8 в общем объеме 6 л. Скорость перемещения потока 400 мл/ч. Собирают фракции по 30 мл. Собранные активные фракции, имеющие интенсивно-красную окраску, объединяют и концентрируют посредством ультрафильтрования до проведения высушивания вымораживанием.
Пробу, полученную после высушивания вьпугораживанием, повторно растворяют в 50 мл 0,025 М раствора ацетата натрия, служащего буфером, при рН 4,8 и переносят в 5-40 см колонну с гелем декстрана (Сефадекс Г-50 Суперфайн, фирма Фармация Фаин Кемикелз АБ), уравновешенного относительно ацетатного буфера. Находящийся в колонне адсорбент отмывают 1 л 0,025 М раствора ацетата натрия при рН 4,8 и собирают фракции по 5 мл. Скорость движения потока составляет 110 МП/ч. В результате хроматографирования на геле зеленая, содержащая медь и цинк-, перекисная дисмутаза отделяется от красного гемипротеина, хотя обе полосы расположены очень близко.
Активные фракции объединяют и переносят в 510 см колонну, заполненную СМ-52 и уравновешенную 0,025 М раствором ацетата натрия при рН 4,7. Адсорбент, находящийся в колонне, отмьгоают при наличии линейного градиента изменения концентрации ацетата (0,025-- 0,200М) при рН 4,8. Применяют общий объем 1200 мл при скорости движения потока 200 мл/ч и собирают фракции по 6 мл. Активные фракции объединяют, диализуют относительно дистиллированной воды и высушивают вымораживанием.
Фильтрование с наличием геля можно повторить при проведения осаждени спиртом. Пробу, высушенную вымора- живанием, после периодически проведеной операции с СМ-52 растворяют в 100 мл буфера в виде 0,005 М раствора фосфата калия при рН 7,0 и постепенно добавляют 57 мл этанола. После 10-минутного центрифугирования при 13000 об/мин добавляют еще одну порцию 166 мл этанола к жидкости, полученной после центрифугирования. Осадок собирают центрифугированием при 13000 об/мин и повторно растворяют в 50 мл буфера в виде 0,025 М раствора ацетата натрия при рН 4,8. После этого пробу переносят в колонну с СМ-52, как описано вьше активные фракции диализуют против дистиллированной воды, затем высушивают вымораживанием.
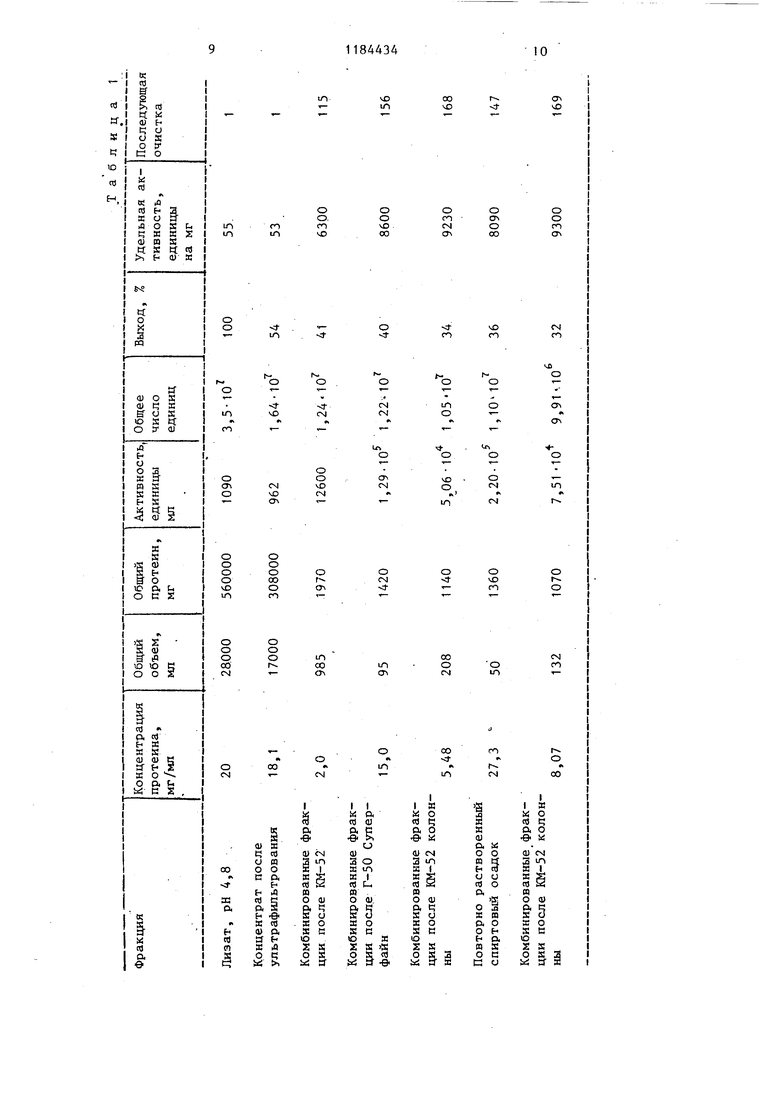
Результаты очистки даны в табл.1
Выход после фракционирования с применением КМ-52, что предусматривает 115-кратную степень очистки по отношению к концентрату после ультрафильтрования, составляет 75% от общего числа единиц в концентрате. Если катионообменное хроматографирование проводят таким же образом, но с применением других катионообменных смол получают следующие выхода НЕД, %: .
КМ-5275
Км-2361
КМ-Сефадекс Г50 75 КМ-Сефароза КЛ-6Б 85 СП-Сефадекс64
Пример 3. Гемолиз и очистка гемоглобина.
7 л декантированной крови, которая уже содержит около 2 л плазмы и таким образом соответствует приблизительно 5 л уплотненных кровяных телец, смешивают с 7 л 96%-ного этанола при интенсивном перемешивании. Через 1 ч добавляют 15 л деионизированной воды и продолжают перемещивание еще 30 мин.
Суспензию центрифугируют на центрифуге с ксрзинкой, типа MSE, приблизительно при 2000 об/мин и полученную Плотную массу гемоглобина промывают .2 л воды до опустошения центрифуги. Получают 29,1 л выделенной на центрифуге жидкости.
Вьщеление углекислотной ангидразы.
Выделенную на центрифуге жидкость обрабатьшают на 1X12 см цилиндрической .матрице. Сефароза - глицилтирознназобензолсульфонамид. Углекислотнуто ангидразу отмьшают из адсорбента 0,2 М водным раствором тиоцианата калия, содержащим 0,05 моль трис -сульфата и имеющим рН 6,5.
Вьщелеине НЕД и каталазы.
Раствор, содержащий НЕД и каталазу, доводят до рН 4,75 с помощью 1 М уксусной кислоты и пропускают через 20 см колонну, заполненную плотным слоем 2 л КМ-23, который уравновешен в 20 мМ ацетатом натрия в качестве б5гфера, рН 4,8. Скорость движения потока приблизительно 15 л/ч. Затем ионообменник промьшают 15 л буфера в виде 20 мМ ацетата натрия, рН 4,8.
Отмьшку из адсорбента, находящегося в колонне, производят при линейном градиенте 3 л 1000 мМ и 3 л 200 мМ ацетата натрия и скорости движения потока 1,5 л/ч. НЕД отмьюают приблизительно при 150 мМ ацетате натрия.
Каталазу отмывают из адсорбента с помощью О,1 М раствора фосфата натрия в виде буфера.
Фракции, содержащие НЕД и каталазу, собирают раздельно и ультрафильтруют на мембране ДДС-600 в камере
ДЦС-МФ (фирма Де данкске Суккер Фаб рикер А/С).
Очистка НЕД..
Раствор НЕД диафильтруют с применением 10 мМ натрий-фосфатного буфера при рН 7,5 и дополнительно очищают хроматографией на ДЕ-52 колонне 58 см, уравновешенной 10 мМ натрийфосфатным буфером при рН 7,5. Колонку проявляют при линейном градиенте мл 10 мМ натрий-фосфатного буфера, рН 7,5 содержащего ,125 М хлорид натрия. Скорость движения потока 110 мл/ч. Собирают фракции по 10 МП.
Фракции, содержащие НЕД, объединяют. Удельная активность и адсорбционный спектр свидетельствуют о чистоте энзима.
Очистка каталазы.
Раствор каталазы после ультрафильрования очищают путем фракционирования сульфатом аммония.
Регенерация колонны КМ-23. После отмывки каталазы через колонку пропускают 3 л 0,5 М раствора гидрата окиси натрия, затем 3 л воды. Далее через колонку пропускают 3 л 0,5 М раствора хлористоводородной кислоты, после этого 3 л воды и 3 л натрийацетатного буфера при рН 4,8.
Колонну в заключение обрабатывают 20 мМ натрий-ацетатным буферо.м при рН 4,8 до тех пор, пока проводимость и рН жидкости, вымытой из адсорбента, не станут такими же, как у буфера. После этого колонка готова для употребления.
Результаты вьщеления и очистки НЕД, каталазы и углекислотной ангндразы из 5 л красных кровяных телец приведены в табл. 2.
г
O - О




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения внеклеточной перекисной дисмутазы человека | 1987 |
|
SU1779263A3 |
| Способ получения ферментированных спиртовых напитков | 1982 |
|
SU1303033A3 |
| Способ разделения белков крови | 1990 |
|
SU1837880A3 |
| Способ получения 6-аминопенициллановой кислоты | 1974 |
|
SU654170A3 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И ДРУГИЕ ИММУНОГЛОБУЛИНОВЫЕ ПРОДУКТЫ | 1999 |
|
RU2197500C2 |
| Способ выделения орготеина | 1972 |
|
SU513595A3 |
| ВСЕСОЮЗНАЯ !i ^ . *;.,,г;.;л vrViiWMFf'K^--':I ilA \ till • tit-' 1 i.Anss"t.tRi-*n I bHb.fl^OTSHA | 1971 |
|
SU300992A1 |
| Способ получения человеческого инсулина формулы I @ -Т @ -ОН или его производных | 1982 |
|
SU1554766A3 |
| СПОСОБ УВЕЛИЧЕНИЯ ЧИСЛА НЕЙТРОФИЛОВ У МЛЕКОПИТАЮЩЕГО ИЛИ ЧЕЛОВЕКА, СПОСОБ ЛЕЧЕНИЯ МИЕЛОИДНОЙ И МОНОЦИТОИДНОЙ ЛЕЙКЕМИИ У МЛЕКОПИТАЮЩИХ, СПОСОБ ИНДУЦИРОВАНИЯ СОЗРЕВАНИЯ НЕЗРЕЛЫХ МИЕЛОИДНЫХ ИЛИ МОНОЦИТОИРНЫХ КЛЕТОК У МЛЕКОПИТАЮЩИХ, СПОСОБ ОЧИСТКИ РАСТВОРА АКТИВНОГО ЧЕЛОВЕЧЕСКОГО ИНТЕРЛЕЙКИНА | 1990 |
|
RU2082756C1 |
| Способ получения гибридного интерферона типа @ 1/ @ 2 | 1987 |
|
SU1604164A3 |
СПОСОБ ВЫДЕЛЕНИЯ НАДОКИСНОЙ ДИСМУТАЗЫ ИЗ БЕЛКОВЫХ РАСТВОРОВ, включающий хроматографию ферментсодержащего белкового раствора на катионообменной смоле, отличающ и и с я тем, что, с целью увеличения выхода и повышения степени чнстоты фермента, хроматографию ферментсодержащего белкового раствора ведут при рН 4,7-5,0 на катионообменной смоле с той же полярностью, что и надокисная дисмутаза, причем в качестве катионообменной смолы используют карбоксиметипцеллкшозу или декстраны, содержапдае карбоксиметильные или сульфопропипьные группы, или агарозы, содержащие карбоксиО) метильные группы. С
о
о.
со ЧО
fo
1Л
о о
to
- о
ъ
CN
о о
см ю
VD CN
СТч
о о о
О г00
о
СУч
ГЛ
о о о г
LO
00 а
о а
О О го о со
OS
4D
CN
m
СО
о о
CJ
«
ел
+ о
о
C-J
ю
«ч
г
о
о I
ЧО tго
2
см
о
го
LO
7 л декантированной крови+7 л эта-:
14 иолаI
Добавление 15л воды
Центрифугиров ание и промывка 2
300 82 1,3 2
0,25
290 79
290 79 0,30
1600
100
11000
100
1400
87
Авторы
Даты
1985-10-07—Публикация
1980-05-16—Подача