Изобретение относится к новым логически активным соединениям - роксильным производным З -фторура общей формулы
О
i;
Rf
L К
где а) ,;
А,
б) R, R,,
5
3
НзС/ч Лснз
в) RJ-RI; . -HjC Y сн
г)R, Na, RI RS;0
обладающим противоопухолевой активностью, которые могут найти применение в биологии, и медицине.
Известен 5-фторурациЛд который применяется в настоящее время в онкологии при неоперабельных формах рака желудочно-кишечного тракта, рака легкого и яичников. Однако это соединение обладает высокой токсичностью, особенно сильно нарушает функци костного мозга и желудочно-кишечного тракта.
Другой аналог предлагаемого соединения - фторафур - малотоксичный продукт ( для мьшей 750 мг/кг), имеет довольно высокую активность в отношении солидных экспериментальных опухолей: саркомы 180, меланомы Гар- динга-Пасси, карциносаркомы Уокера 256, альвеолярного рака печени РС-1. В клинике препарат применяют при раке молочной железы, прямой кишки, толстого кишечника и раке желудка. этот препарат угнетает органы кроветворения и вызывает осложнения со стороны желудочно-кишечного тракта. Кроме того, у фторафура так же, как и у фторурацила отсутствуют парамагнитные свойства.
Цель изобретения - получение новых соединений, обладаюшд х противоопухолевой активностью, с парамагнитными свойствами.
Поставленная цель достигается предлагаемыми нитроксихшными производными 5-фторурацила общей формулы I, обладающими противоопухолевой активностью.
Предлагаемые соединения получают конденсацией otic -(триметилсилил)-5- -фторурацила (ll) с хлорангидридом 2,2,5,5-тетраметил-1-оксил-Д -пир- рОЛИн-3-к.арбоновой кислоты (ill) в среде инертного растворителя, например бензола, или без растворите10
30
45
50
ля при комнатной температуре или при слабом нагревании.
При взаимодействии соединения II с двумя молями соединения III происходит замещение обеих триметил- с шильных групп на пирролиноильные остатки R, и с выходом 74-77% образуется I.3-ди(2,2,5,5-тетраметил -1 -окО Ш-й -пиppoлин-3-oшl)-5-фтop- ypaцшI (l).
При взаимодействии хлорангидрида соединения III с избытком соединения II происходит селективное замещение одной триметилсилильной группы на
ацильный остаток R. После гидроли- т гческого отщепления оставшейся три- метилсилипьной группы получают с выходом 48-50% 1(2,2,5,5-тетраме- тил-1-оксил-Д -пирролин-3-оил)-5 -фторурацил {1б)
Натриевую соль 3-(2,2,5,5-тетра- метил-1-окси-й -пирролин-3-оил)-5- -фторурацила (1г) получают обработкой спиртового раствора дипирро- линоилфторурацила (l) эквивалентным количеством алкоголята натрия. При этом селективно отщепляется 1-пирро- линоильная группа, и с выходом 90- 96% образуется соль (ir), которую осаждают из спиртового раствора эфиром ,
3-(2,2,5,5-Тетраметил-1-оксил- -& -пирролин-3-оил)-5-фторурацил (IB) получают обработкой натриевой
35 соли (ir) эквивалентным количеством разбавленной кислоты, например НС1 или . Образующееся при этом соединение 1в экстрагируют эфиром iли хлороформом. Выход соединения
40 1В составляет 70-75%.
Строение полученных веществ однозначно подтверждается элементным анализом и методами ЭПР-, ИК-, электронной и масс-спектрометрии.
В ПК-спектрах пирролиноил-5-фтор- урацилов (I а, б, в) присутствует группа полос в области 1670-1760 , обусловленная колебаниями карбонильных групп урацила и пирролиноильных заместителей. В соответствии с числом карбонильных групп монопирролин- фторурацилы (1б-1г) содержат меньшее число карбонильных полос, чем дипир- ролигюилфторурацил. У натриевой соли (ir) карбонильные полосы урацила (1561 и 1673 ct-f ) сильно смещены в низкочастотную сторону в результате делокализации отрицательного заряда
аниона на карбонильные группу ураци- ла.
В ИК-спектрах всех веществ I (а-г присутствуют также полосы валентных колебаний связей пирролина и ура цила с частотой 1620-1625 , полосы валентных колебаний протонов метипьных групп пирролина (28003000 см- )
и Н-С С-групп пирролина -(
и урацила (3030-3100 см ). У моно- пирролиноилфторурацилов (l6, в) имеются также полосы группы N-H с частотой 3200 см .
Парамагнетизм полученных веществ подтверждается методом ЭПР. Спектры ЭПР разбавленных растворов монопир- ролиноилфторурацилов (Тб,в,г) состоя из трех линий, которые характерны для нитроксильных монорадикалов. Спектры ЭПР дипирролиноилфторурацила (l) состоят из девяти линий и харак- Херны для нитроксильных бирадикалов, у которых энергия обменного взаимодействия электронов ,8 а М . Кон- С гаты сверхтонкого взаимодействия а N и g-факторы полученных веществ (Та-г) характерны для нитроксильных радикалов пирролинового ряда.
Электронные спектры ацетонитриль- ных растворов пирролиноилфторураци- лов в области 12500-50000 см содержат четыре перекрывающихся полосы которые обусловлены поглощением роксильного пирролиноильного и ураци лового хромофоров. Интенсивнстсть эти полос у дипирролиноилфторурацила (l) в 1,5-2 раза выше, чем у моно- пирролиноилфторурацилов (1б,в). Электронные спектры водных растворов
МОНОПИррОЛИНОИЛфтОрураЦИЛОВ (1б,в)
и натриевой соли (ir) зависят от рН. При рН 3 они обусловлены в основном поглощением монопирролиноилурацилов, а при рН J11 - поглощением соответствующих анионов.
Электронные спектры 3-пирролино- илфторурацила (1в) и соответствующего ему аниона сильно отличаются по частоте и интенсивности полосы, связанной с поглощением урацилового хромофора. У соединения 1в эта полоса имеет частоту 41710 см , а у аниона - 33710 . Такое различие частот характерно для всех 3-за- мещенных урацилов и таким образом подтверждает строение соединений IB и 1г. Спектры 1-пирролиноилфтор- урацила (iST) и соответствующего ему
to
5
5 20
0 . i
Q
5
0 5
аниона близки друг другу, что -также типично для -замещенных урацилов.
В масс-спектрах пирролиноилфтор- урацилоБ присутствуют молекулярные ионы М , а также осколочные ионы, подтверждающие число и место присоединения пирролиноильных групп RJ к 5-фторурацилу (Fu). Так, в масс- спектре З-пирролиноил-5-фторурацила (IB) присутствуют осколочные ионы м/е 167 Н,и м/е 130 , а также осколочные ионы м/е 226 (R NHCONrl r и м/е 225 ИР ШТСОГШ свидетельствующие о присоединении 2,2,5,5- -тетраметил-1-оксил л -пирролинсиль- ной группы к атому Nj урацила. В масс-спектре дипирролиноилфторурацила (la) присутствует осколочный . ион м/е 296 , обусловленный отщеплением одной из двух групп от молекулярного иона М .
В отличие от 5-фторурацила пирро- линоилфторурацилы (I а-в) хорошо растворимы в органических растворителях: в спиртах, ацетоне, ацетонит- риле, диметилформамиде, диметил- сульфоксиде. Натриевая соль (ir) очень хорошо растворима в воде. Ее водные растворы имеют .щелочную реакцию. 3-Пирролиноилфторурацил (le)- плохо растворим в воде, но хорошо в водных растворах щелочей ши в буферных растворах при .
3-Пирролиноилфторурацил (1в) и соответствующий ему анион достаточно устойчивы к гидролизу. При комнатной температуре в интервале рН 3-1I соединение IB и соль соединения 1г не претерпевают заметного гидролитического расщепления в течение часа,
1-Пирролиноилфторурацил также хорошо растворим в водных растворах щелочей, однако быстро гидролизуется до фторурацила и 2,2,5,5-тетраме- тил-1 -оксил-Д -пирролин-3« карбоновой кислоты. Скорость гидролиза возрастает с увеличением рН среды.
Пример I. Получение 1,3-ди (2,2,5,5-тетраметил-1-оксил-Д -пир- ролин-З-оил)-5-фторурацила (la)..
К раствору 8,11 г хлорангидрида 2,2,5,5-тетраметил-1-оксил U -пирро- лин-З-карбоновой кислоты в 40 мл сухого бензола добавляют в атмосфере сухого азота 5,49 г tiC (триметил- си.п)-5-фторурацил-а. Оранжевые кристаллы дипирролиноилфторурацила от- фильтровьгвают, промывают небольшим
количеством бензола и гексана и сушат. Выход 6,8-7,1 г (74-77%). Оранжевые призмы (из толуола), т.пл. 195 198°С.
Найдено, %: С 57,4tO,3| Н 5,9tO,l N 12,110,1; F 3,7iO,3; м/е 462 . С„Нг, FN,06
Вычислено, %: С 57,14; Н 5,98; N 12, 11; F4J 1%, М 462, 4745.
ИК-спектр в СС14 , , см (, л/моль-см)S 1621/230/ С С. 1676/620/ 1705/1100/, 1729/800/, 1762/520/ , 2870/100/, 2935/220/, 2984/310/ 3030/80/, 3065/70/, 3095/90/; СН| в КВг 1625 1675, 1700, 1725, 1760 , 2870, 2935, 2980 СН 3052, 3064, 3090 СН.
ЭПР-спектры в толуоле, 25 , 5-10 М: 9 линий с соотношением амп- литуд 0,16 100:29:33:95:32:24:86 0.15. Расстояние боковьпс линий до центральной, в единицах а„: 0,41: :0,58; 1:2:2,3 ,00560±l . Ш а 14,18tO,04 Гс.
Электронный спектр в MeCN, (с см (е, л/моль.см); 26500±100 пл /8112/ 37400±100 пл /82001100/,
44560160 пл /209001200/, 470001100 /224001200/.
Масс-спектр: м/е (ион) J/J/ййкс 463 (M+i) /1,4/, 462 (м) /4,4/, 447 (М-СН,) /0,22/, 432 (М-NO)- /2,2/, 296 (RCOFU) /5,7/-, 28 (RCOFU-CH,) /О, 6/, 266 (RCOFU-NO) /4,7/, 167 (RCO) /16/, 152 (RCO- /16/, 139 (RCO-CO) , 137 (RCO-NO) /52/, 109 (RCO-NO-U) /100/, где R - 2,2,5,5-тeтpaмeтил- - -ОКСИЛ-Л -пирролинил и -урацил.
П p и м е p 2. Получение 1-(2,2, 5,5-тетрамети.п-1 -оксил-Д -пирролин- -3-оил)-5-фторурацила (Тб),.
К раствору 2,02 г хлорангкдрнда 2,2,5,5-тетраметил- -оксил-Д -пир- ролин-3-кар6оновой кислоты в 100 мл сухого бензола добавляют в атмосфер сухого азота 5,49 г (триметил- силил)-5-фторурацила.
Оранжево-красные кристаллы пирро линоилфторурацила отфильтровывают,, промывают бензолом, затем гексаном и сушат. Выход 1,4-1,5 г (48-50%).. Оранжево-красные иглы (из нитроме- тана), т.пл. 198-201°С.
Найдено, %: С 52,410,3; Н 5,10.t 10,05; N 13,8tO,2., м/е 296 C,,H,5FN,04
Вычислено, %: С 52,70; Н 5,10; К 14,18,,М 296, 2760.
ИК-спектр в MeCN, -5 , см (Е , л/моль-см): 1627 /ПО/ к , 1685 /330/, 1730 /1700/ , 2835/40, 2872 /52/,, 2946 /155/, 2983 /210/, СИ,; 3105 /140/ СН; 3225 /130/ NH, в вазелиновом масле: 1622 , 1672 1706, 1724, 1745 , 3055, 3095 СН 3152; 3195 Ш.
ЭПР-спектр в толуоле, 25 , 510 М:3 линии с соотношением амплитуд: 100:99:90; ,0056213 1 0 ; а,, 14,2510,03 Гс.
Электронный спектр в KeCN g, ,см (, л/моль-см): 26120450 пл /5011/, 37120150 пл /77001100/, 40700140 /10000±100/, 47030140 /134001200/, в водной 0,001 М НС1 &I84t8079700/, 47320180 /i14400/.
Пример 3. Получение натриевой соли 3-(2,2,5,5-тетраметил-1- -оксил-Д -пирролин-3-оил)-5-фтор- урацила (ir).
К 4,62 г дипирролиноилфторура- цила (la) приливают 10 мл 1-молярного раствора этилата натрия в абс. этаноле. Реакционную смесь перемешивают, затем добавляют 40 мл диэти- лового эфира. Выпавший желтый осадо соли (г) отфильтровывают, промьша- ют эфиром и сушат. Выход 2,85-3,05 (90-96%). Соль не имеет четкой температуры плавления, постепенно разлагается прИ 250-330°С.
Найдено, %: N 13,0; 0,2
С,- п,ф
Вычислено, %: N 13,20.
ИК-спектр в вазелиновом масле, 5, : 1620 , 1561 , 1673, . 1738 , 3070 СН.
Электронный спектр в водной 0,001 М (, л/моль-см 37400:50 пл /72001100/, 41700±40 /138001100/ 4671100 /121001100/, в водной 0,001 М NaOH: 33700130 /8100. ±100/ 44270150 /157001300/.
ЭПР-спектр в воде, 25, 5-10 М: линии с соотношением амплитуд: 100:101:;80; ,0051411 . 10 , а. 15,8810,05 Гс.
П р и м е р 4. Получение 3-(2,2, 5,5-тетраметил-1-оксил-i -пирролин- -3-ош1)-5-фторурацнла (1в).
К 1,59 г натриевой соли (ir) приливают 25 мл 0,2 Н. НС 1. Смесь перемешивают 10 мин и многократно экст7
рагируют хлороформом. Хлороформные вытяжки сушат , растворитель испаряют в вакууме, а остаток пере- кристаллизовьгоают из толуола. Пирро линоилфторурацил кристаллизуется в виде мелких желтых игл т. пл. 169- 171°С. Выход 1,04-1,11 г (70-75%). Найдено, %: С 52,610,2; Н 5,09± tO,05; N 14,310,1, F 6,44tO,005, м/е 296
С„ H,N,0,
Вычислено, %: С 52,70; Н 5,10; N 14,18; F 6,41; М 296,276.
ИК-спектр в MeCN, 5 , см (, л/моль-см): 1622 /180/ 1680 /1330/, 1723 /760/, 1754 /960/ 2877 /47/, 294 /130/, 2989 /190/ СН 3087/90/ СН; 3270 /140/; в КВг: 1620 1665, 1720, 1760 , 2840, 2940,, 2990 СН.; 3084 СН, 3210 NH.ЭПР-спектр в толуоле,25 j 5-1 OT М: 3 линии с соотношением амплитуд 100:99:90; ,00561±I, 10 ; а, 14.,-1510,01 Гс.
Электронный спектр в MeCNj axc (, л/моль.см): 25l40i20 /52,6± to,5/; 38190120 пл /85001200/; 42480120 /14000 500/ 47430160 /13200 600/, в водной 0,001 М НС1: 37410160 пл /72001100/ 41710±30 /139001100/, 46700170 /120001100/, в водной. 0,001 М ГГаОН 33710±30; /81601150/, 44270190 /15700 300/.
Масс-спектр, м/е ион (J/JMOIKC ) 297 (М-И) /7,1/, 296 , 282 (,) /26/, 281 (М-СН,) - /1,2/, 266 (М-МО) /12/, 226 (RCOraCONH) /0,44/, 225 (HRCONCONHj) /1,4/, 167 (RCO)- /42/, 152 (RCOCK,) /67/, 139 (RCO-CO) /16/, 137 (RCO-NO) /82/, 136 (ECO-HNO) /100/, 130 (Fu) /91/, 109 (RCO-NO-CO) /96/, где ,2,5,5-тетраметил-1-ОКСИЛ- -Л -пирролинил-3 и урацил.
Биологические испытания предлагаемых нитроксильных производных 5- -фторурацила.
Токсичность соединений определена в острых опытах при внутрибрюшинном введении препаратов и оценена по методу Бернса (по кривым накопления частот гибели животных в зависимости от дозы). Работу вели на мышах чистых линий. Определение противоопухолевой активности проводили на перевиваемых опухолях крыс и мьшей.
358648
Использованы следующие опухоли мьаией: лейк.емии L-1210, Р-388, лейкоз La,, меланома В-16, аденокарцио- нома 755 (Са 755) и опухоли крыс: 5 аритромиелоз Швеца, Карциносаркома Уокера (КСУ), карционома Герена.
Лейкемия L-1210 перевивается внут- рибрюшинно, 10 клеток в 0,2 мл асцитической жи;1,кости, препараты 10 вводили внутрибрюпшнно, ежедневно, начиная с 1-х суток, 5 раз.
Лейкемия Р-388. Перевивается внутрибрюшинно, 10 клеток в 0,2 мл асцита, препараты вводили внутри- 15 брюшинно ежедневно, начиная с I «-х суток, 5 раз.
Лейкоз La острый гемоцитобластоз, получен в 1955 г от облученной мьши. Перевивается внутрибрюшинно взвесью 20 опухолевых клеток (10 клеток). Препараты вводили внутрибрюшинно, первое введение через 3 ч после заражения, затем ежедневно 7 введений.
Солидные опухоли перевивали опухо- 5 левой взвесью в разведении физиологическим раствором 1:1 по весу и вводили подкожно. Препараты вводили внутрибрюшинно, начиная лечение через сутки после перевивки (для карциномы Q Герена - 7 суток), ежедневно 10 вв,е- дений.
Препараты вводились в эквитоксич- 1 ньгх или эквимолярных дозах. Описание условий проведения опытов, критерии оценки противоопухолевого действия и результаты по терапевтической активности приведены в таблице.
5
Критерием оценки противоопухоле- вой активности на моделях Р-388 и L-1210 является увеличение средней продолжительности жизни (УПЖ) опытных животных по сравнению с контрольными, %, которое вычисляют по фор- муле
УПЖ
к где Lp - время жизни животных в
опытной группе;
L| - время жизни животньк в контрольной группе без введения препарата. На модели лейкоза La критерием противоопухолевой активности явля- ется кинетический критерий /JK ) Д оп и JK удельные скорости роста опухоли селезенки в опыте и контроле соответственно.
Сравнительную оценку широт терапевтического действия проводят по химиотерапевтическим индексам
(для лейкемии L 1210)
ЛД,
Моо
je(для лейкемии Р-388)
чпхчоо
где ЛД . - доза, вызьшающая 10% гибели животныхJ
EД jnЖйO
иЕД,| - величины доз, увеличивающих продолжительность жизни животных на 60 и 100%. Результаты по ан- тилейкемической активности предлагамых соединений и взятых для сравнения фторафура и 5-фторурацила также приведены в табляце.
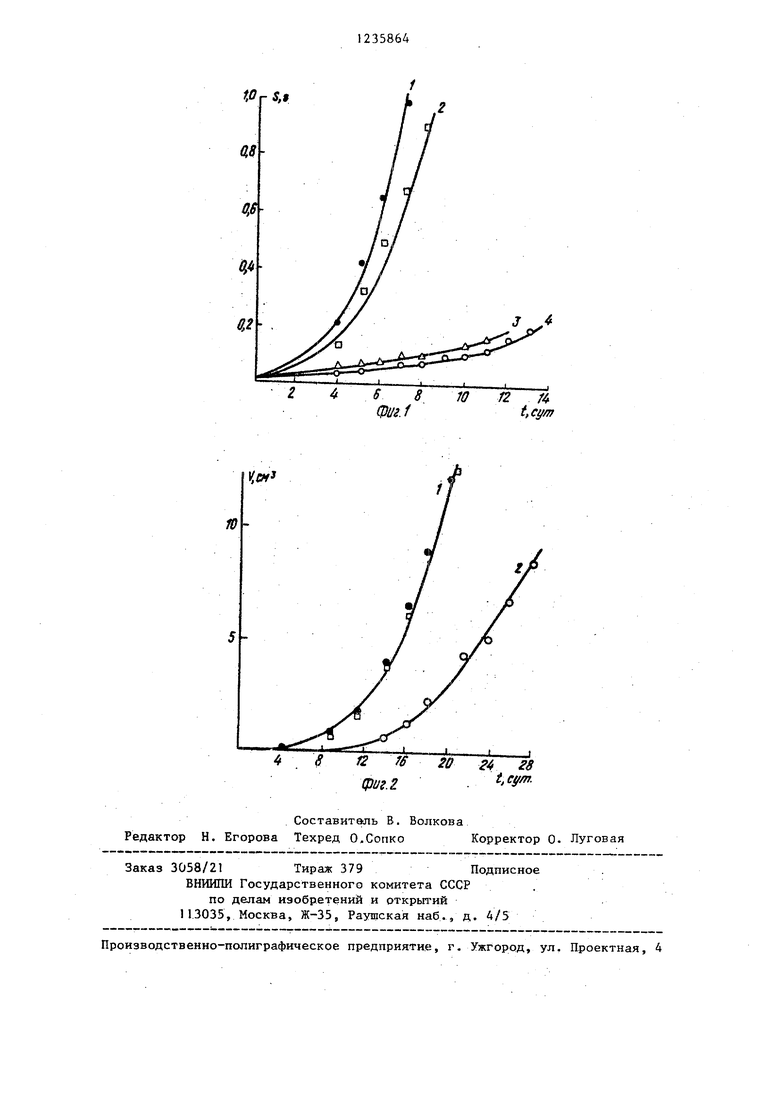
На фиг. 1 приведены кинетические кривые увеличений массы селезенки при лейкозе La: в контроле (1) и при действии эквимолйртшк (0,2 мМ) доз фторафура (2), 5-фтструрацила (З) и наиболее aicTSfSHoro нз предлагаемых соединений 1г (4).
Из наклонов кинетических тсривых увеличения веса селезенки следует, что наиболее эффективно тормозит рост лейкоза La препарат 1г. Его активность несколько вьше,активности 5-фторурацила и во много раз превосходит активность фторафура.
В качестве показателя противоопухолевой активности на солцдных опухолях используют процент торможе- ,ния Т увеличения объема опухоли по сравнению с контролем, который вычис ляют по формуле
т- iOO .(VK-VO)
v7
где У - средний объем отгухоли в контроле;
Oft
- Средний объем опухоли в опыте.
Испытания проведены на солидных опухолях: эритромиелоз Швеца, мела- нома В-16:(В-16), карционосаркома
Расстояние между линиями ЗПР- спектров Т (а-г) определяется величиной константы сверхтонгсого взаимодействия aN, которая зависит от вещества и полярности среды.
Характер спектра ЭПР пирролиноил
Уокера (КСУ) карционома Черена., аде-, урацилов I (а-г) зависит от враща.нокарцинома 755(Са-755).
На фиг.. 2 представлены кинетические кривые изменения объема опухоли Са-755 в контроле (1) и при действии наиболее активного из опи- сьшаемых соединений I г (2) и известного противоопухолевого препарата - фторафура.
55
тельной подвижности этих радикалов, поэтому по спектрам можно судить о вязкости системы, окружающей препар ты. Спектры ЭПР I (а-г), кроме того анизотропны, поэтому спектроскопия ЭПР позволяет также различать анизо тропный и изотропкьй характер окружающей препараты среды.
)
10
15
3586410
Как видно из фиг. 2, соединение 1г значительно тормозит увеличение объема опухоли (70% торможения), тогда как фторафур не проявляет прот1геоолухолевого действия.
Проведенные испытания показали, что противоопухолевая активность предлагаемых соединений I (а,б,в) при их скрининге оказалась несколько ниже, чем препаратов, взятых для сравнения, однако она определялась с использованием малых доз этих соединений. Об этом свидетельствуют высокие значения химиотера- певтических индексов, рассчитанных для увеличения продолжительности жизни на 40% (J ).
Таким образом, все предлагаемые соединения обладают противоопухолевой активностью, з гачительной широтой терапевтического действия и, кроме того, парамагнитными свойст - вами.
Парамагнетизм пирролиноилфторура- цилов I (а-г) обусловлен кеспарен- нымн электронами, которые локализованы, в основном, на атомах азота и кислорода нитроксильной группы. Наиболее универсальньм методом исследования парамагнитных веществ является метод электронного парамаг нитного резонанса (ЭПР), которьш дает информацию как о структуре веществ, так и о структуре их микроокружения.
20
25
30
Спектры ЭПР пирролиноилурацилов I (а-г) позволяют однозначно идентифицировать эти препараты в тканях, крови и вьщелениях организма, так как,они отличаются от спектров парамагнетиков , присутствующих в организме.
Расстояние между линиями ЗПР- спектров Т (а-г) определяется величиной константы сверхтонгсого взаимодействия aN, которая зависит от вещества и полярности среды.
Характер спектра ЭПР пирролиноил
тельной подвижности этих радикалов, поэтому по спектрам можно судить о вязкости системы, окружающей препараты. Спектры ЭПР I (а-г), кроме того, анизотропны, поэтому спектроскопия ЭПР позволяет также различать анизотропный и изотропкьй характер окружающей препараты среды.
11
Метод ЭПР позволяет не только надежно идентифицировать парамагнитны препараты I (а-г) и определять их локализацию в организме, но и с высокой точностью определять 1алые количества этих веществ. Метод ЭПР позволяет определять до 10 моль Обычно применяемые лечебные дозы для животных на 3 порядка больше этой концентрации.
64
12
Использование парамаглитных сое-. динений позволяет с помощью метода ЭПР определять их локализацию в организме, следить за накоплением их в органах, крови и выделениях организма. Все это значительно упрощает контроль лечебного процесса и позволяет проводить работы по выяснению механизма противоопухолевой активности веществ.
S 8, W / /4 Фиг.1t.cym





Нитроксильные производные 5- -фторурацила общей формулы гле а R,,; д б) R,-R,, R2-H; Н, в R,-H, R,R,;НгС If СНз г) R,-Na, обладающие противоопухолевой активностью. i (О
12 7S
фиг.2
го 24 28 t,ey/n.
Составитель В. Волкова Редактор Н. Егорова Техред О.Сопко Корректор О. Луговая
Заказ 3058/21 Тираж 379Подписное
ВНИИПИ Государственного комитета СССР .
по делам изобретений и открьп ий 1 13035, Москва, Ж-35, Раушская наб.,, д. 4/5
Производственно-полиграфическое предприятие , г, Ужгород, ул. Проектная, 4
| Dushinsky R., Pleven Е., Heidelberg С | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Ame r | |||
| Chem | |||
| See,, 1957, 79, p | |||
| СПОСОБ ОТЖИГА ЛИТОЙ СТАЛИ | 1924 |
|
SU4559A1 |
| Трап-подъемник для гидросамолетов | 1958 |
|
SU116839A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приспособление к индикатору для определения момента вспышки в двигателях | 1925 |
|
SU1969A1 |
Авторы
Даты
1986-06-07—Публикация
1983-03-11—Подача