Изобретение относится к способам получения новых производных 15-цикл алифатических производных 13,14-дид гидрокарбопростациклинов, а именно оптически активных или рацемических соединений общей формулы (I) СН(СН) -СООН где R, и один атом водорода, а другой гидроксил; В - циклопентил или цикло гексил, или их фармацевтически или ветеринарно приемлемых солей, обладгдащих ценными фармакологическими свойства ми. Цель изобретения - получение новых производных простациклинов, обладающих преимуществами в фармаколо гическом отношении перед известны природным аналогом - простациклином Пример 1 . К раствору диметоксиметилфосфоната (62 г) в тетрагидрофуране (500 мл), охлажденному до -70 С, добавляют бутиллитий (0,8 Моль) в н-гексане (460 мл), после чего вводят 0,25 М раствор метоксикарбонилциклогексана (35„5 г) ТГФ (1-50 мл). Реакционную смесь Ьхлаждают и вьщерживают прИ-УО С в течение 1 ч, после чего перемешивают при комнатной температуре в течение 3 ч, Раствор охлаждают до и затем обрабатьшают раствором уксусной кислоты (50 мл) в тетрагидрофуране (50 мл), фильтруют и упаривают досу ха. Остаток перераспределяют между водой и хлористым метиленом, органи ческую фазу промывают, сушат и пере гоняют в вакууме. После перегонки выделяют диметил-(2-циклогексш1-2-оксоэтил)-фосфонат (36,5 г, т. кип. 132-134°С 0,8 мм рт. ст.). Аналогичным методом, исходя из соответствующих мети ловых эфиров циклоалифатических кар боновых кислот, получают следзтлцие соединения: диметил-(2-циклопентил-2-оксоэтил)-фосфонат, диметил- 2-(3 -метилциклопентил)-2-оксоэтил -фосфонат, диметил- 2-(3 -этилциклопентил)-2-оксоэтил -фосфонат, диметил- 2-(3 -изопропилиден-циклопентил)-2-оксозтил -фосфонат, диметил-12-(4 -метилциклогексил)-2-оксоэтил -фосфонат, диметил- 2-(4 -изопропилиден-циклогексил)-2-оксозтил -фосфонат. Пример 2. К суспензии трифенилметилфосфониййодида (118,3 г) и трет-бутилата калия (68 г) в сухом толуоле (350 мл) добавляют при перемешивании фенокси-эфир 4-зтилциклогексанкарбоновой кислоты, поддерживая температуру около 40С. Затем реакционную смесь нагревают с обратным холодильником в течение 5 ч, охлаждают до комнатной температуры и обрабатывают водой при интенсивном перемешивании (120 мл). Органическую фазу промывают водой, после чего обрабатывают уксусной кислотой (80 мл) и раствором йодида калия (80 г) в воде (70 мл). К смеси добавляют при интенсивном перемешивании 70 мл н-гексана и отфильтровывают образовавшийся осадок, получая в результате 108 г триметил-2-оксо-2-(4 этилциклогексил)зтилфосфониййодида. К раствору этого соединения в воде (130 мл) добавляют несколько капель фенолфталеина, реакционную смесь обрабатывают при интенсивном перемешивании хлористым метиленом (130 мл) и 1н. раствором NaOH до достижения слабоосновной величины рН. Хлористый метилен отделяют, промывают водой, сушат и упаривают досуха. Остаток извлекают диэтиловым эфиром и н -гексаном (0:90), отфильтровывают его, получая в результате 4-этилциклогексилкарбонилметилентрифенилфосфоран. Аналогичным способом получают циклопентилкарбонилметилидентрифенилфосфоран. Пример 3. Раствор 3-оксо-3,3-этиле1-щиокси-6-экзоформил-7-эндогидрокси-7-(2 -тетрагидрбпиранил) бицикло 3,3,0 октана (6 г) в бензоле (20 мл) добавляют при перемешивании к суспензии натриевой соли диметил-(2-циклогексш1-2-оксоэтил)-фосфоната в бензоле. Указанную соль натрия предварительно получают в результате добавления раствора ф фоната (6,08 г) в бензоле (10 мл) к суспензии 80% NaOH (0,78 г) в бе золе (100 мл), Сочетание альдегида и фосфоната завершают в течение 15 мин, после .чего реакционную смесь промывают во дой, сушат и упаривают досуха, Остаток очищают методом хроматографии на колонке, получая в резуль тате 6 г-3-оксо-З,З-этилендиокси-6-экзо-(1 -транс-З-оксо-З -циклогексилпроп-1-енил)-7-эндоокси-7-(2 --тетрагидропиранилокси)бицикло 3, 0 октана. Пример 4, К раствору 3,3-этилeндиoкcи-3-oкco-6-экзoфop п л-7-эндоокси-7-(2 -тетрагидропиранилокси) бицикло 3,3, ОЛоктана (3 г) и бензола (30 мл) добавляют 1,01 моль, эквивалента 4-этилциклогексилкарбонилметилидентрифенилфрсфоранилида. Через 2 ч реакционную смесь абсорбируют на колонке с силикагелем и элюируют смесью н-гексана и этилацетата, получая 3-оксо-6-экзо- 1 -транс-З-оксо-3 -(А -этилциклогексил) проп-1-енил -7-эндо-7-(2 -тетрагидропиранилокси)бицикло 3,3,0 октан (2,36 г). Пример 5, Используя в описанном в примере А способе 3,3-этилендиокси-3-оксо-6-экзоформил-7-эндоокси-7-ацетат-бицикло 3,3,0 октан и циклопентилкарбонилметилидентрифенилфосфоран, получают 3-оксо-6-экзо-( -транс-З-оксо-3 -циклопентилпроп-1-енил)-7-эндоокси-7-аце тат-бицикло (3,3,0)октан, П р и м е р 6, Используя в описанном в примере 3 способе соответствующие фосфонаты, полученные согласно примеру I, получают следующие соединения: 3-оксо-З.З-этилидендиокси-6-эк ,г зо-(1-транс-З -оксо-3 -циклопентилпроп-1-енил)-7-ЭНДООКСИ-7-(2-тетра гидропиранилокси) бицикло (3,3,0) ок тан, 3-оксо-З,З-этилендиокси-6-экзо- Г -транс-З -оксо-З-1(3 -метил)-циклопентил проп-l-eнилl-7-эндooкcи-7-(2 -тетрагидропиранилокси)бицикло 3,3,0 октан, 3-оксо-З, З-этилендиок си-6-экзо- Г -транс-з-оксо-3-(З -этил)-цик лопентил проп-1-енил}-7-эндоокси804-7-(2 -тетрагидропиранилокси) бицикло 3,3,0 октан, 3-окс о-3,3-зтилендиокси-6-экзо- l -транс-З-оксо-З -(3 -изопропилиденциклопентил проп-1-енил|-7-эндоокси-7-(2 -тетрагидропиранилокси бицикло 3,3,0 октан, 3-оксо-З,З-этилендиокси-6-зкзо-|l -транс-З -оксо-3 -(4 -метил)-циклогексил проп-1-енил|-7-эндо-7-(2 -тетрагидропиранилокси)бицикло 3,3,0 октан, 3-оксо-З,З-этилендиокси-6-экзо-I Г-транс-З -оксо-3-(4 -изопропилиден)-циклогексил проп-1-енил)-7-эндоокси-7-(2 -тетрагидропиранилокси) бицикло 3,3,о октан. Пример 7, Раствор 3-оксо-3,3-этилендиокси-6-экзо-(1 -транс-З-оксо-3 -циклогексилпроп-1-енил)-7-ОКСИ-7-(2-тетрагидропиранилокси)бицикло (3,3,0)октана (4 г) в пиридине (40 мл) обрабатывают при перемешивании пиридингидротрибромидом (4,8г);з течение 2 ч1 Смесь разбавляют водным 30%-гым раствором NaH РО (250 мл) тщательно экстрагируют этилацетатом. Собранные органические фазы промывают водой, сушат и упариваЮТ досуха. После хроматографирования на колонке с двуокисью кремния (элюент-смесь н-гексана и этилацетата 70:30) получают 2,5 г 3-оксо-З,3-этилендиокси-6-зкзо (Г-транс-2 -бром-З -оксо-3 -циклогексилпроп-1 -енил)-7-окси-(2 -тетрагидропиранилокси) бицикло 3,3,0 октана, С использованием аналогичного способа получают следующие соединения: 3-оксо-З,З-этилендиокси-6-экзо-(Г -транс-2 -бром-З -оксо-З -циклопентилпроп-1-енил)-7-окси-(2 -тетрагидропиранолокси) бицикло 3,3,0 октан, 3-оксо-З,З-этилендиокси-6-экзо- Г-транс-2-бром-З-оксо-3 -(3 -метил)-циклопентил проп-1 -енил --7-ОКСИ-7-(2 -тетрагидропиранилокси) бицикло 3,3,о октан, 3-оксо-З, 3 -этилендиокси-6-:экзо-(Г -транс-2 -бром-3-оксо-3-(3-этил)-циклoпeнтил) проп-1 -енил|-7-окси-7-(2 -тетрагидропиранилокси)бицикло 3,3,0 октан, 3-оксо-З,З-этилендиокси-6-экзо-(Г -транс-2 -бром-З -оксо-З - (З -изопропилиден)циклопентил1проп-1 -енил1-7-окси-7-(2 -тетрагидр01Шранилокси)-бицикло 3,3,0 октан,
3-оксо-3,3-этилендйокси-6--экзо-{ -транс-2 -бром-З -оксо-3 - (4 -метил) циклогексил г1роп-Г -енил|-7--окси-7-(2 -тетрагидтэопиранилокси)бицикло 3,3,0 октанр
3-оксо-З,З-этилендиокси-6-экзо- - (Г -транс-2 -бром-З-оксо-З- (4 -этил)циклогексил проп-1 -енил}-7-окси-7-(2 -тетрагидропиранилокси)бицикло 3,3,0 октан,
3-оксо-З,З-этилендиокси-6-экзо-{Г -транс-2 -бром-З -оксо-З - (4 -изопропилиден)циклогексил проп-1-енил -7-окси-7-(2 -тетрагидропиранилокси)бицикло 3,3,0 -октан:, и 7-ацетатные производные указанных соединений.
Пример 8, К перемешиваемому раствору NaBH (0,75 мг) в метаноле (30 мл), охлажденному до -10°С, добавляют раствор 3-оксо-З,3-этилендиокси-6-экзо-(1 -транс-2 -бром-З -оксо-3 -циклогексилпроп-1 -енил)-7-окси-7-(2 -гетрагидропиранилокси) бицикле 3,3,0 октана (2,5 г) в метаноле (15 мл), По истечении 1 ч реакционную смесь разбавляют 30%-ным водным раствором NaH РО (200 мл) и экстрагируют этилацетатом. Органические фазы собирают, сушат и после упаривания растворителя в вакууме остаток извлекают ацетоном (20 мл). После добавления водного 1н, раствора щавелевой кислоты (20 мл) реакционную смесь нагревают при 40С в течение 15 ч. Затем ацето удаляют в вакууме и экстрагируют водную эмульсию этилацетатом, Органические экстракты собирают, промывают водой, сушат над сульфатом магния и упаривают растворитель. Остаток хроматографируют на силикагеле с использованием для элюирования смеси этилацетат: н-гексан 30:20, получая 3-оксо-6-экзо-( 1 --транс-2 -бром-З R-окси-З -циклогексилпроп-Г -енил)-7-эндоокси-бицикло 3,3,0 октан (0,48 г); 3-оксо-6-экзо-1-енил-7-эндоокси-бицикло 3,3,0 октан (0,48 г) и 3-оксо-6-экзо-(1-транс-2-бром-ЗR-окси-з -циклогексилпроп-Г -ешш)-7-эндоокси-бицикло 3,3,ОЬоктан (0,88 г).
Пример 9,С использованием в примере 8 способе с -бром-ct, л-ненасыщенных кетонов, полученньи в
примере 7, получают следующие бромаллильные спирты.
3-оксо-6-экзо-(1 -транс-2 -бром-З S-3 -циклопентилпроп- -енил)-7-эндоокси-бицикло 3,3,О1октан,
3-ОКСО-6-ЗКЗО- -транс-2 -бром-ЗS-окси-з- (З -метил) циклопентилТпроп-1 -енилj-7-эндо-бицикло 3,3,0 октан,
3-ОКСО-6-ЭКЗО- -транс-2 -бром-3 S-3 - (3 -этил)циклопентил -проп-l -енил -7-эндоокси-бицйкло 3,3,0 октан,
3-ОКСО-6-ЭКЗО-(l-транс-2 -бромI ( I
-3 S-3 -(3 -изопропилиден)-циклопетил проп- -енил)-7-эндо-окси-бицикло 3,3,о октан,
З-оксо-6-зкзо - t -транс-2 -бром-3 S-окси-З- (4 -метил)циклогексилпроп-1 -енилj-7-эндоокси-бицикло 3,3,0 октан,
3-ОКСО-6-ЭКЗО-{l -транс-2 -бром-3 S-окси-З - (4 -этил)циклогексил проп-1 -енш1|-7-эндоокси-бицикло 3,3,0 октан,
3-ОКСО-6-ЭКЗО- |Г -транс-2 -бром-3 S-окси-З - (4 -изопропилиден) циклогексил лроп-1 -енил}-7-эндоокси-бицикло 3,3,01-октан,
3-ОКСО-6-ЭКЗО-(Г -транс-2 -бром-3 S-окси-З-циклопентил-проп-i енил)-7-эндоокси-7-ацетат-бицикло 3,3,0 октан,
3-ОКСО-6-ЭКЗО-|Г -транс-2-бром-3 S-окси-З- (З -метил)-циклопентил проп-1 -енил -7-эндоркси-7-ацетат-бицикло {3,3,о октан,
3-ОКСО-6-ЭКЗО- 1 -транс-2 -бром-3 S-окси-З - (3 -этил)циклопентил проп-1 -енил -7-эндоокси-7-ацетат-бицикло 3,3,03-октан,
З-оксо-6-экзо - 1 -транс-2 -бром-3 S-окси-З- (3 -изопропилиден)-циклопентил проп-1 -енил1-7-эндоокси-7-ацетат-бицикло 3,3,0 октан,
3-оксо-6-экзо-(1 -транс-2-бром-З 8-окси-3 -циклогексил-проп-Г -енил)-7-эндоокси-7-ацетат-бицикло 3,3,0 октан,
3-ОКСО-6-ЭКЗО-J -транс-2-бром-3 -окси-3 - (4 -метил)-циклчгексил проп-1-енил -7-эндоокси-7-ацетат-бицикло ГЗ,3,0 -октан,
3-ОКСО-6-ЭКЗО- 1-транс-2-бром -3 S-окси-З - (4 -этил)циклогексил проп-1 -енил -7-эндоокси-7-ацетат-бицикле 3,3,0 -октан.
3-ОКСО-6-ЭКЗО- (l -транс-.2 -бром-ЗЗ-окси-З - (А -изопропилиден)циклогексил проп-1 -енилj-7-эндоокси-7-ацетат-бицикло 3,3,0 октан.
Пример 10, 4-Карбоксибутил- 5 трифенилфосфонийбромид (6,5 г) добавляют в атмосфере азота к смеси трет-бутилата калия (3,2 г) и диметилсульфоксида (32 мл), затем реакционную смесь обрабатывают раствором Ю 3-оксо-6-зкзо-(Г ттранс-2 -бром-3 циклогексил-3 S-оксипроп-1 -енил)-7-окси-бицикло 3,3,0 октана (0,88 г) в диметилсульфоксиде (3 мл), Через 3 ч реакционную смесь разбав- 5 ляют водой, подкисляют 2н, серной кислотой и экстрагируют диэтиловым . эфиром. Эфирную фазу экстрагируют 1н, водным раствором NaOH и собирают водные щелочные экстракты, под- 20 кисляют до рН 5 и экстрагируют смесью н -пентана и диэтилового эфира (20:80), Конечные органические экстракты собирают, промывают водой, сушат и упаривают досуха. Остаток 25 хроматографируют на силикагеле (элюент - диэтиловый эфир 100 мл и уксусная кислота 0,4 мл), получаяв результате:
5Z-lld, 153-диокси-9а-деокси-9а- зо -метилен-и)-пентанор-15-циклогексил-простацикл-5-ен-13-иновую кислоту (О,12 г), спектр ЯМР (CDClj),, м,д,: 5,27 (1Н, триплет)Н ; 4,17 (1Н, дублет) Н ; 4,00 (1Н, мульти- 35 плет) Н,;
5Е-11с. 158-диокси-9а-деокси-9а-метилен-схЬпентанор-15-циклогексил-простацикл-5-ен-13-иновую кислоту (0,18 г), спектр ЯМР (CDCl), В , 40 м,д,: 5,26 (2Н, триплет) 4,17 (1Н, дублет) Н ; 4,01 (Ш, мультиплет) Н,.
С использованием аналогичного способа получают следующие соеди- 5 нения:
5Е-11Ы, 153-диокси-9а-деокси-9а-метилен-а)-пентаиор-15-(4 -метил)-иклогексил-простацикл-5-ен-13-иноую кислоту, спектр ЯМР (CDC1 ), 50 , Ы.Ц.: 0,98, (ЗН, дублет); 3,99 (1Н, мультиплет); 4,19 (1Н, широкий ублет); 5,25 (1Н, мультиплет),
5Е-11о., 158-диокси-9а-деокси-9аетилен-а)-пентанор-15-(4 -этил)цик- j5 огексил -простацикл-5-ен-13-ионовую кислоту, спектр ЯМР (CDC1 ),о , м, д,: 0,91 (ЗН, дублет); 1,31 (2Н,
мультиплет); 3,95 (1Н, мультиплет); 4,21 (1Н, широкий дублет); 5,27 (1Н, мультиплет),
5Е-11о(, 155-диокси-9а-деокси-9а-метилен-и -пентанор-15- (4 -изопропилиден)циклогексил простацикл-5-ен-13-ионовую кислоту, спектр ЯМР (CDCli) 6, м,д,: 1,70 (6Н, синглет); 4,01 (1Н, мультиплет); 4,22 (1Н, широкий дублет); 5,27 (1Н, мультиплет),
5Z-1 1о(., 155-диокси-9а-деокси-9а-метилен- пентанор-15- (4 -метил)циклогексил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDC1 ),6 t м,д,: 0,98 (ЗН, дублет); 3,99 (Ш, мультиплет); 4,19 (1Н, широкий дублет); 5,26 (Ш, мультиплет),
5Z-nol., 155-диокси-9а-деокси-9а-метилен-и -пентанор-15-(4 -этил)циклогексил простацикл-5-ен-I3-иновую кислоту, спектр ЯМР (CDC1 ),§ , м,д,: 0,91 (ЗН, дублет); 1,31(2Н, мулътиштет); 3,95 (1Н, мультиплет); 4,21 (1Н, широкий дублет); 5,28 (1Н, мультиплет),
5Z-llci, 158-диокси-9а-деокси-9а-метилен-.О-пентанор-1 5- (4 -изопропилиден) циклогексил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDCl5),8 , м,д,: 1,70 (6Н, синглет) 4,01 (1Н, мультиплет); 2,22 (1Н, ш ирокий дублет); 5,28 (1Н, мультиплет)
Пример 11. 4-Карбоксибутилтрифенилфосфонийбромид (6,5 г) добавляют к смеси трет-бутИлата калия (3,2 г) и диметилсульфоксида (32 кп) в атмосфере азота, после чего смесь обрабатывают раствором З-оксо-6-эк30-(1 -транс-2 -бром-3-циклопентил-3 S-окси-проп-l -енилТ-7-окси-бицикло 3,3,01октана (О,84-г) в диметилсульфоксиде (3 мл).
Через 3 ч реакционную смесь разбавляют водой, подкисляют 2н, раствором серной кислоты и экстрагируют дизтиловым эфиром. Эфирную фазу экстрагируют 1н, водным раствором гидрата окиси натрия, собирают водные щелочные экстракты, подкисляют их до рН 5 и экстрагируют смесью Н-пентена и диэтилового эфира (20: :80), Конечные органические экстракты собирают, промывают водой и сушат и упаривают досуха.
Остаток, содержащий 5 (Z, Е)-1 1(У, 158-диокси-9а-деокси-9а-метилен-и)-пентанор-1 5-циклопентил-простацикл-5-ен-13-иновую кислоту, хроматеграфируют на силикагеле (элюент диэтиловый эфир 100 МП и уксусная кислота 0,4 мл), получая в результа те: 5Z-1, 153-диокси-9а-деокси-9а-метилен-иЬпентанор-15-циклопентил-простацикл-5-ен-13-иновую кислоту (0,10 г), ЯМР (CDClj), S, М.Д.: 3,93 (1Н, широкий мультигшет); 4,22 (Ш, широкий дублет); 4,55 (ЗН, широкий мультипле,т); 5,24 (1Н, мульти гшет) , 5Е-11о(, 158-диокси-9а-деокси-9а-метилен-а}-пентанор-15-циклопентил-простацикл-5-ен-13-иновую кислоту (0,17 г), спектр ЯМР (CDCl),, м.д.: 3,93 (1Н, широкий мультиплет) 4,22 (1Н, широкий дублет); 4,55 (ЗН, широкий мультиплет); 5,22 (Ш, мультиплет), Согласно аналогичной методике получают следующие соединения: 5Е-1 let, 158-диокси-9а-деокси-9а-метилен-(иЗ)-пентанор-15- (3 -метил циклопентил7простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDC1 ),S , М.Д.: 0,97 (ЗН, дублет); 3.97 (1Н, мультиплет); 4,20 (Ш, широкий дублет); 5,24 (1Н, мультиплет), 5Е-1 JoL, 53-диокси-9а-деоксн-9а-метилен-иЬпентанор-15- ((3 -этил)-циклопентил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDC1),6 М.Д.: 0,93 (ЗН, дублет); 1,33 (2Е. муль типлет); 3,94 (1Н, мультиплет) 4,17 (Ш, широкий дублет); 5,25 (Ш, мультиплет), 5Е-1 lot, 158-диокси-9а-деокси-9а-метйлен-и -пентанор-15- (3 -изопропилиден)-циклопентил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDClj), 8 , М.Д.: 1,70 (6Н, синглет); 4,03 (1Н, мультиплет); 4,, 22 (1Н, широкий дублет); 5,27 (IH,, мультиплет),5Z-1 lot, 158-диокси-9а-деокси-9а-метйлен-01)-пентанор-15- (3 -мёрил) -циклопентил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDClj)5j, М.Д.: 0,97 (ЗН, дублет); 3,97 (Ш, мультиплет); 4,20 (Ш, широкий дублет); 5,25 (1Н, мультиплет), 5Z-1Id, 158-диокси-9а-деокси-9а-метилен-и -пентанор-15- (3 -этил)-циклопентил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDC1 ),6 М.Д.: 0,93 (ЗН, дублет); 1,33 (2Н, мультиплет) ; 3,94 (Н, мультиплёт) 4,17 (1Н, широкий дублет); 5,26 (1Н, мультиплет), 5Z-lli, 155-диокси-9а-деокси-9аметилен- пентанор- 15- (3 -изопропи- лиден)-циклопентил простацикл-5-ен-13-HHOjByTO кислоту о спектр ЯМР (CDCi ),оС, М.Д.: 1,70 (6Н, синглет); 4,03 (1Н, мультиплет); 4,22 (1Н, широкий дублет); 5,28 (1Н, мультиплет) , Пример 12„ 4-Карбоксибутилтрифенилфосфонийбромид (6,5 г) добавляют в атмосфере азота к смеси трет-бутилата калия (3,2 г) и диметилсульфоксида (32 мл), затем смесь обрабатывают раствором (+)-3-оксо-6-экзс-(1 -транс-2 -бром-3 -циклопентил-3s-оксипроп-Г -енил)-7-окси-бицикло 3,3,0 октана (0,04 г) в диметилсульфоксиде (3 мп). Через 3 ч реакционную смесь разбавляют водой, подкисляют 2н, серной кислотой и экстрагируют диэтиловым эфиром. Эфирную фазу экстрагируют 1н, водным раствором гидрата окиси натрия, собирают водные шелочные экстракты, подкисляют до рН 5 и экстрагируют и -пентаном и диэтиловым эфиром (20:80). Конечные органические экстракты собирают,, промывают водой, сушат и упаривают досуха. Остаток, содержащий (+)-5(Z,E)1 lot, 158-диокси-9а-деокси-9а-метилен-с 3-пентанор-15-циклопентил-простацикл-5-ен-13-иновую кислоту, хроматографируют на силикагеле (элюент - диэтиловый эфир 100 мл и уксусная кислота 0,4 мл), получая в результате: (+)-5Z- 1о, 158-диокси-9а-деокси-9а-метилен-и)-пентанор-15-циклопентил-простацикл-5-ен- 13-иновую кислоту (0,11 г), спектр ЯМР (CDC1),S , М.Д.: 3,93 (Ш, широкий мультиплет); 4,22 (1Н, широкий дублет); 4,55 (ЗН, широкий мультиплет); 5,23 (1Н, мультиплет), (+) 5E-llri., 158-диокси-9а-деокси-9а-метилен-0| -пентанор-15-циклопентил-простацикл-5-ен-13-иновую кислоту (0,17 г), спектр ЯМР (CDC1),& , м.д,: 3,93 (1Н, широкий мультиплет); 4,22 (Ш, широкий дублет); 4,55 (ЗН, широкий мультиплет); 5,22 (Ш, мультиплет) . Согласно аналогичному способу получают следующие соединения: (+)5р-11о(, 1 55-диокси-9а-деокси-9а-метилен-(д)-пентанор-15- КЗ -метил)-циклопентил простацикл-5-ен-1 3 -иновую кислоту, спектр ЯМР (CDC1 ), 8, М.Д.: 0,97 (ЗН, дублет); 3,97 (1Н, мультиплет); й,20(1Н, широкий дублет); 5,24 (1Н, мультиплет), (+) 5Е-11Ы, 158-диокси-9а-деокси-9а-метилен-а)-пентанор-15-(3 -этил)-циклопентил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDCl),8 , м,д.: 0,93 (ЗН, дублет) 1,33 (2Н, мультиплет); 3,9А (1Н, мультиплет); 4,17 (1Н, широкий дублет); 5,25 (1Н, мультиплет); ( + ) 5Е-1 lot, 155-диокси-9а-деокси -9а-метилен-а пентанор-15(3 -изопропилиден)-циклопентенил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDCl),o, М.Д.: 1,70 (6Н, синглет); 4,03 (1Н, мультиплет); 4,22 (1Н, широкий дублет); 5,27 (Ш, мультиплет), (+) 5Z-llot, 53-диокси-9а-деркси-9а-метилен-а -пентанор-15- (3 -ме тил)-циклопентил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (СВС1з),(9 , М.Д.: 0,97 (ЗН, дублет) 3,97 (1Н, мультиплет); 4,20 (1Н, широкий дублет); 5,25 (1Н, мультиплет) , (+) 5Z-llot-, 153-диокси-9а-деокси -9а-метилен-а)-пентанор-15- (3 -этил -циклопентил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDC1 ),S , М.Д.: 0,93 (ЗН, дублет); ,33(2Н, мультиплет); 3,94 (1Н, мультиплет); 4,17 (Ш, широкий дублет); 5,26 flH мультиплет), (4-)5Z-lW, 155-диокси-9а-деокси-9аметилен-с -пентанор-15-(3 -изопропилиден)-циклопентил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDC1),6, М.Д.: 1,70 (6Н, синглет); 4,03 (1Н, мультиплет); 4,22 (1Н, широкий дублет); 5,28 (1Н, мультиплет), (+) 5Z-1 lol., 158-диокси-9а-деокси-9а-метилен-и)-пентанор-15-циклогексил-простацикл-5-ен-13-иновую кислоту (0,12 г), спектр ЯМР (CDC1),6 , м.д. : 5,27 (Ш, триплет) 4,17 (Ш, дублет) Н ; 4,00 (1Н, мультиплет) Н, , (+) 5Е-11Ы, 158-диокси-9а-деокси-9а-метилен-а -пентанор-15-циклогексил-простацикл-5-ен-13-иновую киспоту (0,18 г), спектр ЯМР (CDC1),S , 1 12 М.Д.: 5,26 (Н, триплет) Н ; 4,17 (1Н, дублет) Н ; 4,01 (1Н, мультиплет) Н,, (+) 5Е-1 lot, 158-диокси-9а-деокси-9а-метилен-иЬпентанор-15- (4 -метил )-циклогексил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDC1 ),й , М.Д.: 0,98 (ЗН,дублет); 3,99 (1Н, мультиплет); 4,19 (1Н, широкий дублет); 5,25 (IH, мультиплет), (+) , 155-диокси-9а-деокси-9а-метилен-а}-пентанор-15- (4 -этил)-циклогексил простацикл-5-ен-15-иновую кислоту, спектр ЯМР (CDC1 ),S , м.д.: 0,91 (ЗН, дублет); 1,31 (2Н, мультиплет); 3,95 (1Н, мультиплет); 4,21 (1Н, широкий дублет); 5,27 (Ш, мультиплет), ( + ) 5Е-1 lot, 155-диокси-9а-деокси-9а-метилен-1и)-пентанор-15- f(4 -изопропилиден)-циклогексилЗпростацикл-5-ен-13-иновую кислоту, спектр ЯМР (CDC1 ),, М.Д.; 1,70 (6Н, синглет); 4,01 (1Н, мультиплет); 4,22 (1Н, широкий дублет); 5,27 (1Н, мультиплет) , () 5Z-llo., 158-диокси-9а-деокси-9а-.метилен-и1-пентанор-15- (4 -метил )-циклогексил простацикл-5-ен-1 3иновую кислоту, спектр ЯМР (CDC1,), §, М.Д.: 0,98 (ЗН, дублет); 3,99 (1Н, мультиплет); 4,19 (Ш, широкий дублет); 5,26 (1Н, мультиплет), (+) 5Z-1 lot, 158-диокси-9а-деокси-9а,метилен-а)-пентанор-15- (4 -этил)-циклогексил простацикл-5-ен-I3-иновую кислоту, спектр ЯМР (CDC1 ),8 , М.Д.: 0,91 (ЗН, дублет); 1,31(2Н, мультиплет); 3,95 (Ш, мультиплет); 4,21 (1Н, широкий дублет); 5,28 (Ш, мультиплет), ( + ) 5Z-llci, 158-диокси-9а-деокси-9а-метилен-и)-пентанор- 15- (4 -изопропилиден)-циклогексил простацикл-5-ен-13-иновую кислоту, спектр ЯМР (СВС1з),§ , М.Д.: 1,70 (6Н, синглет); 4,01 (1Н, мультиплет); 4,22 (1Н, широкий дублет); 5,28 (1Н, мультйплет) . Пример 13. Сухой карбонат калия (0,26 г) добавляют к раствору 5Е-1 1о(, 155-диокси-9а-деокси-9а-метилен-а -пентанор-15- (циклопентил )-простацикл-5-ен-13-иновой кислоты (0,48 г) и йодистого метила (0,52 мп) в сухом диметилформамиде (3,2 мл). Смесь перемешивают в течение 4 ч при комнатной температуре, Органический материал отфильтровывают, а органический раствор разбавляют во- дои (20 мл) и тщательно экстрагируют диэтиловым эфиром, Эфирные экстракты собирают, промывают водой и упаривают, получая метиловый эфир 5Е-lid, 158-диокси-9а-деокси-9а-метилен-аЬпентанор-15-(циклопентил)-простацикл-5-ен-13-иновой кислоты (0,41 г), имеющий спектр ЯМР (CDC1, Б, м.д, : 3,55 (2Н, щирокий мзшьтиплет); 3,65(ЗН, синглет);з„93 (1Н широкий мультиплет); 4,22 (1Н, широкий дублет); 5,22 (1Н, мультиплет) Пример 14, Сухой карбонат калия (0,26 г) добавляют к раствору (+) 5E-lld, 153-диокси-9а-деокси-9а-метилен-а)-пентанор- 15-(циклопентил)-простацикл-5-ен-13-иновой кислоты (0,48 г) и йодистого метила (0,52 мл) в сухом диметилфорнамиде (3,2 мл). Смесь перемешивают при комнатной температуре в течение 4 ч. Органиче кие продукты отфильтровывают, органический раствор разбавляют водой (20 мл) и тщательно экстрагируют ди этиловым э(1иром. Эфирные экстракты собирают, промывают водой и упаривают, loлyчaя метиловый эфир ( + ) 5Е -1 loL, 153-диокси-9а-деокси-9а-метилен-оО-пентанор- 15- (циклопентил), -простацикл-5-ен-13-иновой кислоты (0,41 г), имеющий следующий ЯМРспектр (CDC1),8 , М.Д.: 3,55 (2Н, широкий мультиплет) ;3,65 (ЗН, синг лет); 3,93 (Ш, широкий мультиплет) 4,22 (1Н, широкий дублет); 5,22 (1Н мультиплет), Пример 15, Раствор (+) 5Е-1 Id, 158-диокси-9а-деокси-8а-метилен-оЬпентанор-15-диклопентил-простацикл-5-ен-13-иновой кислоты (0,60 г) в 5 МП этаноле обрабатываю стехиометрическим количеством 0,1 н водного раствора гидрата окиси натрия . Спирт удаляют в вакууме и водный раствор лиофнлизируют, получая в результате 0,62 г натриевой соли сухой (+)5Е-11о-, 155-диокси-9а-деокси-9 а-метилен-и -пентанор-15-циклопентил-простацикл-5-ен-13-иновойкислоты. Пример 16,. Раствор ( + ) 5Е-11Ы, 158-диокси-9а-деокси-9а-метилен-слЗ-пентанор-15-циклопентил-простацикл-5-ен-18-иновой кислоты (500 мкг) в этаноле (6 мл) стерили
зуют с помощью пропускания через фильтр, задерживающий бактерии. Порции по О,1 мл помещают в ампулы по
I мм, которые затем запаивают. Содержимое ампулы разбавляют 1 мл буферного раствора трис-ИС1, имеющего рН 8,6, с получением раствора, готового для введения путем инъекций.
Соединения общей формулы (I) проявляют высокую антиагрегационную и дисагрегационную активность по отношению к тромбоцитам, в весьма значительной мере инг ибируя, предотвращая и обращая в обратную сторону процесс агрегации тромбоцитов крови. В таблице приводятся данные, относящиеся к антиагрегационной активности по отношению к тромбоцитам, достигнутой при получении соединения (+) 5E-lld, 158-дигидрокси-9а-деокси-9а-метилен-и -пентанор-15-циклопентил-простацикл-5-ен-1-иновой кислоты и ее натриевой соли и 5Е-11Ы, 158-дигидрокси-9а-диокси-9а-метилен-схУ-пентанор-15-циклогексил-простацикл-5-ен-13-иновой кислоты, в сравнении с данными, полученными для соединения (+) 5Е, 13Е-11о, 158-дигидрокси-9а-деокси-9а-метилен-простацикл-J5, I 3-диеновой кислоты (Патент Великобритании № 2012265В), т,е. ( + ) 5Е-карбопростациклина. Соединение Ингибирующая концентрация, кг/мл (ИК-100) 5Е (+)-Карбопростациклин50 ( + )-11о(, 155-Дигидрокси-9 а-деокси-9 а-метилен-и)-пентанор- 15-циклопентил-простацикл-5-ен- 3-иновая кислота2,7 Метилен-иУ-пентанор-I5-циклогексил-простацикл-5-ен-13-иноваякислота12,5 ( + ) Ilot, 158-Дигидрокси-9а-деокси-9а-метилен-иЬпентанор-15-циклопентил-простацикл-5-ен-13-ионовой кислоты натриевая соль2,7 Значение ИК-100 представляет собой дозу соединения, которая осуществляет 100%-ное ингибирование аг регации тромбоцитов, индуцированное in vitro посредством 0,4 мкг/мл АДФ Б плазме, богатой Громбоцитами, взятой у морских свинок, Данные, пр веденные в таблице, получены соглас но следующей методике. Кровь отбирают из брюшинной аорты самцов бе лых морских свинок, которым не дают пищи в течение 16 ч, имеющим средни вес 450 г, после слабой эфирной ане стезии, используя в качестве антикоагунта 3,8%-ный раствор цитрата натрия в дистиллированной воде (1 раствора цитрата натрия и 9 ч, крови) . Плазму, богатую тромбоцитами, отбирают у каждого животного посред ством центрифугирования крови при скорости вращения 1000 об/мин в течение 8 мин. После проверки спонтан ной агрегации плазму, богатую тромбоцитами, которую находят пригодной для опыта, объединяют в одну партию и проводят подсчет тромбоцитов. При необходимости число тромбоцитов кор ректируют аутологической плазмой, бедной тромбоцитами (ПБеТ), с получением партии плазмы, богатой тромбоцитами (ПБоТ), содержащей 750000 тромбоцитов/мм. Агрегацию тромбоцитов исследуют с использованием агломерата Элви мод. 840, связанного с двухканальным самописцем Сервогор 2S тип RE-573. Реагенты вводят в агрегометр в следующем порядке: 0,4 мл ПБоТ, 0,80 мл солевого физиологического раствора и 0,01 мл раствора испытуемого соединения или растворителя. После инкубирования при 37°С в течение 5 мин к смеси добавляют агрегирующий агент (АДФ, 0,4 мкг/мл). Протекание агрегации наблюдается в течение 10 мин после введения агрегирующего агента (скорость перемешивания ПБоТ об/мин). Все разбавления испытуемого соединения испытывают на той же самой партии плазма, богатой тромбоцитами, собранной у 5-6 морских свинок. Приведенные в таблице данные свидетельствуют о том, что антиагрегационная активность предлагаемых соединений значительно выше активности противопос тавленного соединения. Высокая антиагрегационная и дисагрегационная активность, проявляемая соединениями общей формулы (I), предопределяет их использование для ингибирования агрегации тромбоцитов с целью уменьшения адгезионных явлений, для предотвращения образования сгустков крови, а также для растворения ранее образовавщихся сгустков. Антиагрегационная активность в отношении тромбоцитов связана также с релаксацией коронарных артерий. Так, соединения общей формулы (I) могут быть полезными, например, для предотвращения и лечения инфарктов миокарда и, в общем случае, при лечении и предотвращении тромбозов, при лечении заболеваний атеросклеротического типа, лечении артериосклероза и, в более общем случае, гиперлипидемии. Предлагаемые соединения обладают также некоторым вазодилаторным, т.е. понижающим давление, эффектом и могут быть полезными при лечении синдромов, вызываемых повышенным давлением. Хотя соединения общей формулы (I) имеют особое значение в качестве селективных антиагрегационных и/или дисагрегационных агентов и, кроме того, в качестве вазодилаторных, т.е. понижающих давление, агентов, их можно также использовать для лечения закупоривающих легочных заболеваний (например, бронхиальная астма) или можно использовать их активность в качестве противоязвенных и антисекреторных средств, они проявляют активность при бронходилатором тесте, на находящихся в сознании ли анестезированных морских свинах, предотвращая индуцируемые этаноом, стрессовым состоянием и АСА жеудочные язвы, а также индуцируемые ндометацином кишечные язвы, а также нгибируя выделение желудочного сока огласно способу Шея и др. (Gastronterology, 26, 906, 1954). В тех случаях, когда предлагаемые оединения используют в качестве аниагрегационных или дисагрегац{ оных средств, можно использовать разичные способы введения, которые бычно применяют для этой цели: пеорапьшле, внутривенные, подкожные, нутри1«в шечные. В экстренных случах предпочтительным способом введе171ния является внутривенный, причем дозы могут меняться в пределах от 0,005 до 10 мг/кг/сут для взрослого пациента. Точная даза зависит от состояния пациента, его веса, возраст и способа введения. Дозировки и спо собы введения предлагаемых соединен при использовании их в качестве пон жающих давление и вазодилаториых средств являются примерно теми же, что и в случае их использования в качестве антиагрегационных средств, При лечении таких заболеваний как закупорка легких (например, в случае бронхиальной астмы) предлагаемые соединения могут вводиться различными способами: перорально, в виде таблеток, капсул, таблеток с покрытием или в жидкой форме, в виде сиропов или капель, методом ингаляции, в виде аэрозолей или рас воров для распылителей, при noMoinji вдувания в порошкообразной форме. Дозы, имеющие величину 0,01-4 мг/г могут вводиться 1 - 4 раза в сутки из расчета на взрослого пациента, причем точное значение дозы зависит от возраста, веса и состояния пациецта, а также от способа введения. При использовании в качестве 0 противоастматических средств предлагаемые соединения могут применяться в комбинации с другими противоастматическими средствами, в частности с симпетикомиметическими лекарственными средствами, такими как теофилин и аминофиллин или в сочетании с кортикостероидами. При использовании в качестве противоязвенных средств и средств, препятствующих желудочной секреции, предлагаемые соединения могут вводиться, например, внутривенно вливанием или внутривенно, подкожно или внутримышечно путем инъекций; дозировка при внутривенном вливании 0,1 -.500 мкг/кг-мин. Общая суточная дозировка как в случае инъекции, так и в случае вливания составляет 0,1 - 20 мг/кг в зависимости от возраста, веса и состояния пациента, а также от способа введения. При аналогичном использовании соединений можно применять также пероральный и ректальный способы введения, Токсичность предлагаемых соединений является незначительной, так что они могут быть использованы в терапевтических целях с большой степенью безопасности.








| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 9-деокси-9а-метилен-изостеров ПГJ @ или их лактонов | 1980 |
|
SU1360582A3 |
| Способ получения 9-дезокси-9 @ -метиленизостеров @ или их лактонов или их солей | 1979 |
|
SU1053745A3 |
| Способ получения бициклических простагландинов или их солей | 1977 |
|
SU978725A3 |
| Способ получения производных простановой кислоты | 1973 |
|
SU648088A3 |
| Способ получения 11-дезокси-16арилокси- -тетранорпростагландинов или их солей | 1976 |
|
SU679134A3 |
| Способ получения производных карбациклина или их физиологически приемлемых солей | 1983 |
|
SU1145926A3 |
| Способ получения производных /5Е/-13,14,18,18,19,19-гексадегидро-3-окса-6а-карбапростагландина-1 @ или их солей | 1984 |
|
SU1384196A3 |
| Способ получения оптически активных или рацемических простагладинов | 1975 |
|
SU652889A3 |
| Способ получения производных карбациклинов или их аддитивно-основных солей трис-(оксиметил)-аминометана | 1983 |
|
SU1316555A3 |
| Способ получения производных пергидротиазепина или их кислотно-аддитивных фармацевтически приемлемых солей | 1985 |
|
SU1435151A3 |
Способ получения оптически активных или рацемических соединений общей формулы (CHj) -СООН СИ а другой - гидроксил; В - циклопентил или циклогексил, или их фармацевтически ветеринарно приемлемых солей, отличающийся тем, что соединение общей формулы О R. OR, (II) где В имеет указанное значение; атом водорода или тетраСО гидропиранильная группа; и R R один атом водорода, друRj имегой - группа OR,, ет указанные значения; У группа или , где Z - галоген; подвергают взаимодействию с реа ю гентом Виттига общей формулы (R)j-Р-СН-(СН,)з -СООН, (III) QO ОО где R - фенильная или низшая алкильная группа, и удаляют имеющиеии защитные тетрагидропиранильные группы, при необходимости омыляют полученное соединение общей формулы (I) с последующим выделением целевых продуктов в свободном виде или в виде СМ фармацевтически или ветеринарке приемлекых солей.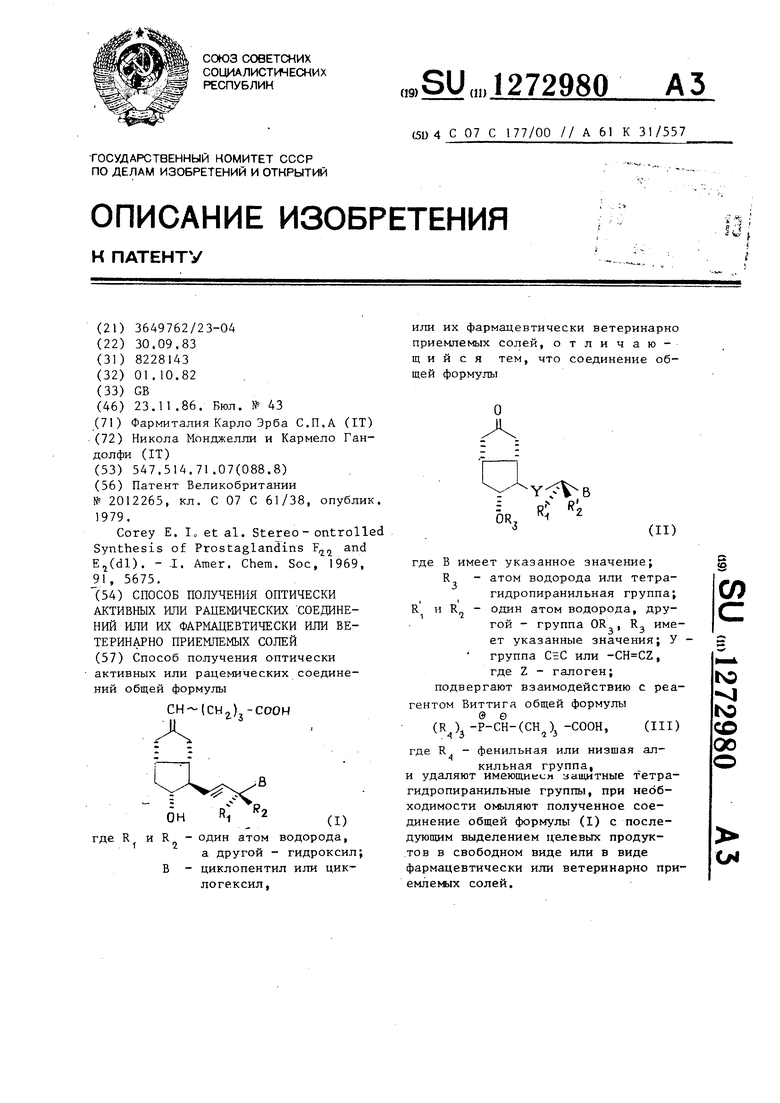

| СПОСОБ ЛЕЧЕНИЯ ОСТЕОХОНДРОПАТИИ ГОЛОВКИ БЕДРА У ДЕТЕЙ | 1990 |
|
RU2012265C1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
| Corey Е | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Stereo - ontrolled Synthesis of Prostaglandins F, and E(dl) | |||
| - -I | |||
| Araer | |||
| Cham | |||
| Soc, 1969, 91, 5675, | |||
Авторы
Даты
1986-11-23—Публикация
1983-09-30—Подача