1
Изобретение относится к электромиграционным методам фракционирования веществ биологического происхождения и предназначено для очистки биологических веществ, в основном белков, электрофорезом в фармакологии, биохимии, молекулярной биологии, сельском хозяйстве и других областях.
Цель изобретения - повышение степени очистки целевого продукта путе формирования разделительно буферной смеси из буферных растворов с определенным соотношением значений рН,
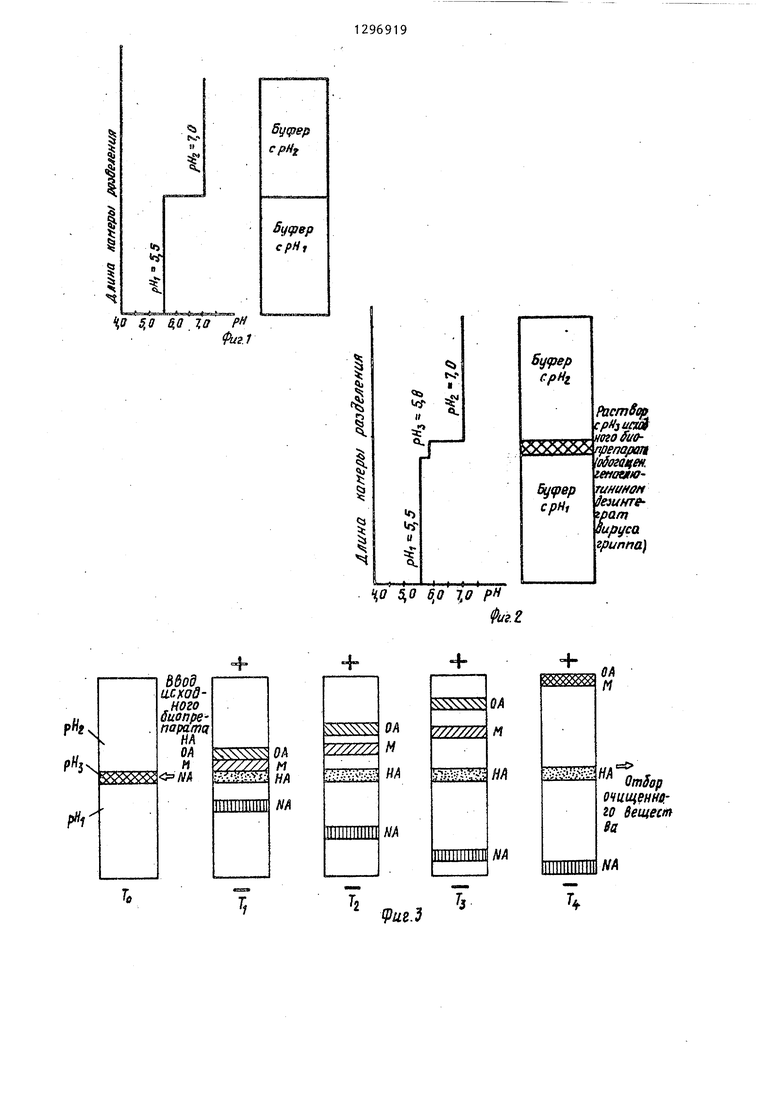
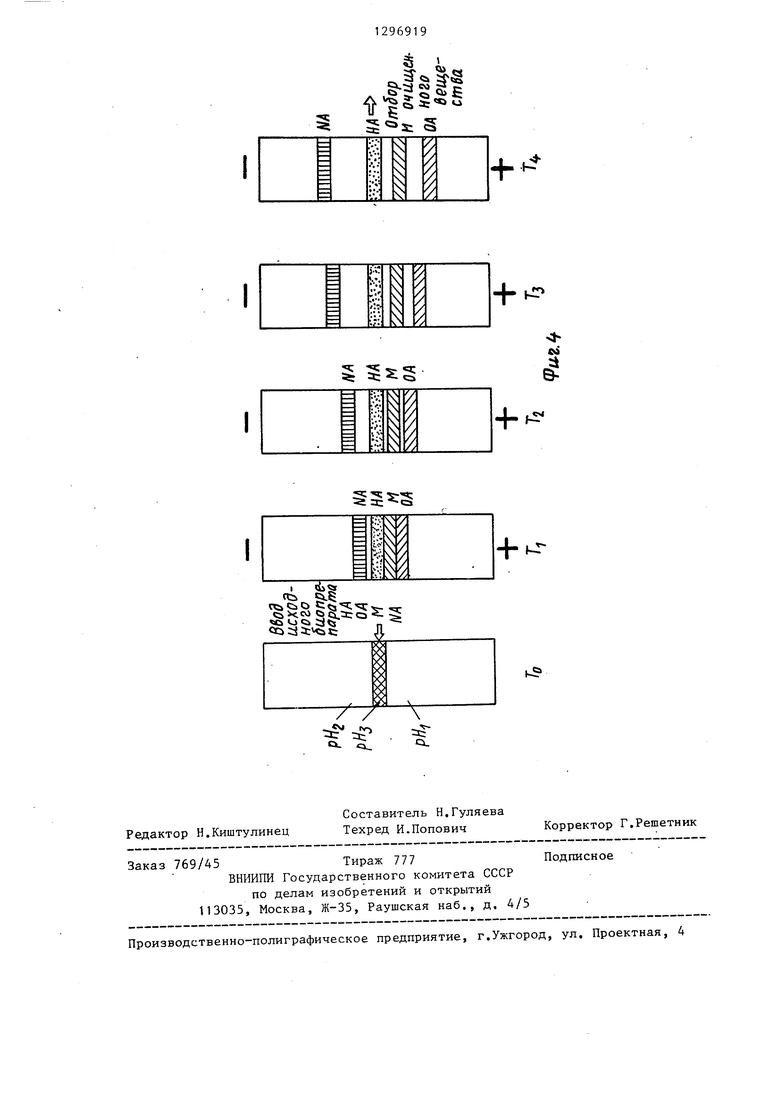
На фиг.1 показано распределение буферов в колонке до ввода биопрепарата; на фиг.2 - то же, после ввода биопрепарата; на фиг.З - процесс фореза при ориентации буфера с наименьшим рН к отрицательному полюсу а с наибольшим рН к положительному; на фиг.4 - то же, с наименьшим рН к положительному полюсу, а с наибольшим рН к отрицательному, где обозначено; НА - темагглютинин; ОА - овальбумин; М - белок Mj NA - нейтраминидаза; - различные моменты времени.
Способ осуществляется следующим образом.
Б электрофоретической (рабочей) камере формируют разделит(гльный буферный раствор в виде двух составляющих растворов с заданными значениями рН путем последовательного введения каждого раствора. Биопрепарат в растворе вводят между составляющими разделительного буферног раствора, при этом рН упомянутых сотавляющих разделительного буферного раствора и раствора биопрепарата берут с заданным соотношением
рН,рН,рН2; рН, pip, .pi.; ,pi,,
де рН, ,рН„ рН.,
Р1, рН составляющих разделительного буферного раствора; рН биопрепарата; величина изоточки выделяемого компонента биопрепарата; максимальная величина изоточки компонента. из группы примесных компонентов биопрепарата со значением, меньшим рН, ;
5
0
5
plj - минимальная величина
изоточки компонента из группы примесных компонентов биопрепарата со значением, большим рИ .
При этом составляющие разделительного буферного раствора ориентируют соответственно с минимальным рН к отрицательному электроду, с максимальным рН - к положительному электроду.
После введения разделительных буферных растворов и раствора биопрепарата на колонку подается напряжение. При этом на электрод со стороны буферного раствора с (т.е. более щелочного или менее кислотного, чем рН раствора биопрепарата) подается положительный заряд, а на электрод со стороны буферного раствора с (т.е. менее щелочного или более кислотного, чем рН раствора биопрепарата) подается отрицательный заряд. В этом случае находящийся в изоэлектрической точке компонент биопрепарата не имеет заряда и его частицы,-соответственно, не подвергаются электрофорезу. Примесные компоненты, частицы которых имеют положительный или отрицательный заряд, начинают двигаться к электродам противоположного знака и попадают в среду с рН, которая вызывает еще более
5 сильную диссоциацию их, т.е. увеличение соответствугацего заряда, что приводит к ускорению движения от места в сторону соответствующего электрода. Б результате в месте ввода ос0 тается только вьделяемый компонент биопрепарата, а все примесные компоненты, частицы которых имеют положительный или отрицательный заряд, удаляются в разделительные буферные
5 растворы. Отбор заданной фракции производится из зоны ввода биопр« парата.
П р и м е .р 1, Бьщеление гемаг- глютинина вируса гриппа Х/Ленинград/54 из обогащенного дезинтеграта, содер0 жащего помимо гемагглютинина также белковые примеси (овальбумин, глико- протеид-белок М и нейтраминидазу). Известные значения изоэлектрических точек этих белков составляют: гемаг5 глютинина р1„ 5,8, овальбумина
р1.| 4,5, белка М р1, 5,0, нейтра- минидазы р1 7,5. Готовят буферные растворы (например, трис-боратные) со следующими значениями рН: буфер
0
31
с рН, 5,5, т.е. со значением меньшим чем pig , но большим, чем plj и чтобы примесные белки эвальбумин и белок М имели подвижность, но не достигли изоточек (, р1, ); буфер с pHj 7,0, т.е. со значением большим чем pig, но меньшим, чем р, чтобы примесь нейтраминидазы имела подвижность, но не достигла изоточки (.pI).
Буфер с рН заправляется в нижнюю половину камеры разделения колонки. Затем верхняя половина камеры разделения заполняется буфером с рН.
Раствор исходного белкового пре- парата с гемагглютинином титруется, например, трис-боратом до величины рН,, равной значению изоточки гемаг- глютинина (т.е. рНз р,,- 5,8). После чего раствор с рН с препаратов вводится в камеру разделения в зону между буферами рН, и рН. Затем на колонку подается напряжзние постоянного тока. Молекулы всех белков в растворе приобретают поверхностный заряд, однако знак заряда (положительный или отрицательньй) за счет амфотерных свойств белков может быть тот или иной в зависимости от того, больше или меньше рН среды относи- тельно значения изоточки, а величина заряда тем больше, чем больше разница между значениями изоточки р1 данного белка и рН среды. В приведенном выше примере в исходной зоне введенного белкового препарата с рН,. заряд гемагглютинина равен нулю (так как pHj pig) овальбумин и белок М заряжаются отрицательно (так как , и pi ), а нейтраминида- за - положительно (так как ).
ТАким образом, для удаления из зоны неподвижного гемагглютинина сопутствующих белковых примесей, изоточки которых имеют значения- больше и меньше, чем у очищаемого белка, при формировании разделительной буферной системы в колонке составляющи этой системы взяты в соотношении ,рН,:рНjipH. При невыполнении этого соотношения не обеспечиваются услови неподвижности очищаемого в зоне ввод препарата при безостановочном движении всех примесных белков.
При ориентации более кислого буфера рН, к отрицательному электроду, а более щелочного pHg к положительному нейраминидаза двигается к от5
69
0
5 0
5
5
194
рицательному полюсу, а овальбумин и белок М - к положительному. Гемагглю- тинин остается неподвижным. На границах зоны рН,-с буферами рН, и рН происходит скачкообразное увеличение электрофоретических подвижностей примесных белков нейраминидазы, оваль- бумина и белка М, которые удаляются с повышенной скоростью от зоны гемагглютинина и собираются на концах камеры разделения.
После окончания процесса фореза производится отбор зоны рН,, которая содержит очищенный гемагглютинин.
В приведенном примере при обратной полярности электродов относительно буферов, т.е. при ориентации минимальным рН, к положительному электроду, а максимальным рН к отрицательному - миграция примесных белков овальбумина, белка М и нейраминидазы происходит в обратных направлениях. Гемагглютинин остается неподвижен. Однако на границах зоны pHj с буферами рН, и рН2 происходит скачкообразное уменьшение зарядов примесных белков и, соответственно, скачкообразное уменьшение их электрофоретических подвижностей и удаление этих белков от зоны гемагглютинина замедляется, а скорость движения белка М, имеющего значение изоточки pl| , очень близкое к изоточке pl, гемагглютинина (равный рН), незначительна, в данном примере соизмерима с диффузионным движением (размыканием) границ зоны рНд в стороны буферных растворов. При этом ввиду близости значений изоточек выделяемого белка и примесных белков в данном примере при обратной полярности электродов относительно буфе- ров (т.е. при ориентации рН к плюсу, а рН к минусу) снижается степень очистки белка гемагглютинина и увеличивается время процесса.
Пример 2. Выделение сывороточного альбумина человека из белковой смеси, содержащей патологические функции апюбумина и гемоглобина. Значения изоэлектрических точек этих белков составляют: нормального c iiBO- роточного альбумина (очищаемого) р1д 5,3, патологически измененных изомеров альбумина в диапазоне р1 4,0-4,1, изомеров гемоглобина в диапазоне р 7,0-7,3.
Готовят буферные растворы (например, трис-боратнополимерное) со свя-- эующими значениями рН: буфер с pH 4,8 (из условия, что и в примере 1 plg рН,р1,); буфер с рН 6,0 (также, как в примере 1, из условия pl , ).
Буфер с рН, заправляется в нижнюю половину колонки, с pHj в верхнюю половину, а раствор биопрепарата, оттитрованный (например, трис-боратом) до рН р1о 5,3, вводится в колонку мелиу буферами рН, и рН. Затем на
Пример 3, Выделение гемаггл тинина вируса гриппа штамма А2/Лени град/385 из дезинтеграта гельфильт- рационной очистки, содержаш;его поми мо гемагглютинина А2 также белковые
электроды колонки подается напряжение, В данном примере нормальный аль- примеси: овальбумин, гликопротеид - бумин не имеет заряда и остается не- белок М, нейраминидазу А2 и аланто- подвижным в зоне ввода (так как рН Патологические изомеры альбумина заряжаются отрицательно (так как ,), а изомеры гемо- глоСира положительно (так как ),
Такими образом, для обеспечения условий неподвижности очищаемого белка в зоне ввода, при непрерывном удалении от него нежелательных примесей, составляющие буферной системы взяты
20
25
исный гликопротеид. Значения изоточек этих белков составляют; гемаггл тинина А2 pig 7,1, овальбумина р1,. 4,5, белка М pl 5,0, нейра минидазы А2 plj 8,0, алантоисного гликопротеида р, 8,3,
Готовят буферные растворы (напри мер, трис-боратглицериновые) со сле дующими значениями рН: буфер с рН) 6,8 (из условия, что и в примере 1 ,р1); буфер с рН 7,3 (как и в примере 1 из условия
в соотношениях
pH,
30 Буфер с рН, заправляется в нижнюю половину колонки, с рЕ - в верхнюю половину, а раствор биопрепарата, оттитрованный (например, трис-боратом) до рН р1д 7,1, вводится
При ориентации более кислого буфера рН, к отрицательному полюсу, а более щелочного рНл к положительному
гемоглобин двигается к минусу, а па- 35 буферами рН, и рН. Затем на тологические изомеры альбумина - к плюсу. Но на границах зоны рН с буэлектроды колонки подается напряжение В данном примере гемагглютинин А2 не
. „ „ ,заряжен и остается неподвижен в зоне
ферами рН, и рН,, электросЬоретичес-/ „ ,
,; ввода (так как рН, р.,), овальбу- кие .подвижности всех примесных белков v и о- а.юиу
4П МИН и белок М заряжаются отрицатель- скачкообразно возрастают, соответст- ,, ,- ч
но (так как и р1, ) ,, а нейраминидаза А2 и алантоисный гликопротеид - положительно (так как и pl ),
45 Таким образом, для обеспечения условий, при которых выделяемый белок останется неподвижным, в стартовой зоне, а примесные белки различного заряда имеют электрофоретическую рН,- к плюсу, а рН к минусу) миграция 50 подвижность на всем пути миграции их примесных-.белков происходит в обрат- от стартовой :зоны до полюсов, сое- ных направлениях, но нормальный аль- тавляющие буферной системы взяты в бумин остается неподвижен-Чтак как соотношениях pH,. . При ори- его заряд равен нулю при рН plo) ентации минимальным рН, к отрица- При этом на границах зоны рН. с бу- 55 тельному электроду, а максимальным ферами pHj и рН, ввиду уменьшения рН к положительному движению при- зарядов примесных белков (так как месных белков: овальбумина и бел- значения рН растворов ближе к их ка М - происходит к плюсу, а нейра- р1), происходит скачкообразное умень- минидазы А2 и алантоисного гликопровенно, и скорости удаления от зоны ввода. Примесные белки собираются на К0:нцах1 камеры разделения, после чего производится отбор зоны рН, содержащей нормальный очищенньй альбумин,
В 2 при изменении полярности электродов относительно буферов рН, и рН (т.е. при ориентации
шение их подвижностей. Однако ввиду того, что значения изоточек примесей далеки от значения pl очищаемого белка, существенного снижения скоростей движения примесных белков не происходит, а лишь удлиняется время процесса без заметной потери качества отбираемой фракции нормального альбумина.
Пример 3, Выделение гемагглю тинина вируса гриппа штамма А2/Ленин- град/385 из дезинтеграта гельфильт- рационной очистки, содержаш;его помимо гемагглютинина А2 также белковые
примеси: овальбумин, гликопротеид - белок М, нейраминидазу А2 и аланто-
примеси: овальбумин, гликопротеид - белок М, нейраминидазу А2 и аланто-
исный гликопротеид. Значения изоточек этих белков составляют; гемагглютинина А2 pig 7,1, овальбумина р1,. 4,5, белка М pl 5,0, нейра- минидазы А2 plj 8,0, алантоисного гликопротеида р, 8,3,
Готовят буферные растворы (например, трис-боратглицериновые) со следующими значениями рН: буфер с рН) 6,8 (из условия, что и в примере 1 ,р1); буфер с рН 7,3 (как и в примере 1 из условия )
Буфер с рН, заправляется в нижнюю половину колонки, с рЕ - в верхнюю половину, а раствор биопрепарата, оттитрованный (например, трис-боратом) до рН р1д 7,1, вводится
теида - к минусу. Гемагглютинин А2 остается на месте. При миграции примесных белков из зоны ввода на границах зоны рН с буферами рН и pHj подвижности этих белков скачкообразно возрастают. В ходе процесса примесные белки с повышенной скоростью отходят к концам камеры разделения. По окончании процесса фореза производится отбор зоны рН, содержащий очищенный Гемагглютинин А2.
В примере 3 при изменении полярности электродов относительно буферов рН, и рН (т.е. при ориентации рН, к плюсу, а pHj к минусу) миграция белков примесей происходит в обратных направлениях, гемагглю- тинин А2 по прежнему остается на месте ввода (так как его заряд равен
нулю при рК plf,). Однако при миг- 20 левого продукта, при формировании рации примесей из зоны ввода рН на разделительной буферной смеси рН сос- границах зоны рН, с буферами рН, -тавляющих ее буферов устанавливают в и pHj происходит скачкообразное умень- соответствии со следующими соотноше- шение их подвижностей. При этом замедляется движение овал бумина, белка М, алантоисного гликопротеида, а ней- раминидаза А2 имеет незначительную
25
ниями
рН р
,pI,,
подвижность (ввиду близкости ее изо- точки с величиной изоточки р1о). В
результате по сравнению с первоначальной полярностью электродов процесс очистки от овальбумина, белка М и алантоисного гликопротеида происходит, но медленнее, а качество очистки от нейрамйнидазы А2 ухудшено вви ду того, что скорость ее движения оказывается соизмеримой с диффузионным движением (размыванием границ зоны рН в стороны буферных растворов). В данном случае этого примера по окончании процесса из зоны ввода отбирается Гемагглютинин А2, которьм хорошо очищен от примесных белков овальбумина, белка М и алантоисного гликопротеида, но значительно хуже очищен (чем при ориен тации рН к минусу, а pHj к плюсу) от нейраминида- зы А2. Однако, поскольку для практических целей присутствие гемагглю
нитина совместно с нейраминидазой яв- .ляется безвредным или дазе желательным (наприме{), для создания молекулярных вакцин и антисывороток), данный вариант ориентации полярности электродов и буферов в примере 3 является допустимым.
10 Формула изобретения
Способ вьщеления белковой фракции путем введения белкового препарата между буферными растворами разде- 15 лительной буферной смеси, состоящей из нескольких буферных растворов, с последующим электрофорезом, отличающийся тем, что, с целью повышения степени очистки це20 левого раздел -тавляю - соотве
25
ниями
ого продукта, при формиров делительной буферной смеси ляющих ее буферов устанавл тветствии со следующими со
рН р
,pI,,
0
5
где рН,, ,Р оР1«0
pI, 5
величины рН составляющих разделительной буферной смеси; величина рН раствора белкового препарата; величина изоэлектри- ческой точки компонента выделяемой фракции белкового препарата; максимальная величина изозлектрической точки компонента из примесных фракций белкового препарата со значением, меньшим минимальная величина изоэлектрической точки компонента из примесных фракций биопрепарата со значением, большим pH,j.
будзер cpHg
ib
Wl n
t
Sygiep cpHi
.
4,0 5,0 la pH
Фиг.1
4,0 5,0 6,0 IQ p
(иг.г
7,.
I (t:i cctiia:4afc jl
Редактор Н.Киштулинец
Составитель Н.Гуляева Техред И.Попович
Заказ 769/45Тираж 777Подписное
ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
e,,.e-
Производственно-полиграфическое предприятие, г.Ужгород, ул. Проектная, 4
Корректор Г.Решетник



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения нейраминидазных антигенов вируса гриппа птиц | 1988 |
|
SU1613489A1 |
| Способ получения конъюгатов гемагглютинина вируса гриппа с синтетическими полиэлектролитами | 1982 |
|
SU1115754A1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕНОВ ДЛЯ ВАКЦИНЫ ПРОТИВ ВИРУСОВ ГРИППА | 2005 |
|
RU2283139C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКТИНОВ, ОБЛАДАЮЩИХ ПРОТИВОКАНДИДНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2486241C1 |
| ЖИВАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2604414C2 |
| Штамм вируса гриппа А/Киев/3304/84, используемый для приготовления гриппозного диагностикума | 1987 |
|
SU1463758A1 |
| РЕКОМБИНАНТНАЯ НЕЙРАМИНИДАЗА ГРИППА ТИПА NA 2 (ВАРИАНТЫ) | 1995 |
|
RU2186111C2 |
| Вирусоподобная частица вируса гриппа и способ ее получения | 2018 |
|
RU2681439C1 |
| Способ получения четырехвалентной вакцины для профилактики гриппа | 2020 |
|
RU2754398C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИВАЛЕНТНОЙ ВАКЦИНЫ ОТ ГРИППА | 2018 |
|
RU2701953C1 |
Изобретение относится к методам фракционирования веществ биологического происхождения и позволяет повысить степень очистки целевого продукта. В электрофоретической камере формируют разделительный буферный раствор в виде двух составляющих растворов с заданными значениями рК, каждый раствор вводят последовательно i Биопрепарат вводят в раствор между составляющими разделительного буферного раствора, рН составляющих разделительного буферного раствора и биопрепарат берут с заданным соотношением: pHjipHj pHj; рН р1о; lo-ipHj pIj} , рН, , рН - рН составляющих разделительного буферного раствора; рН - рН биопрепарата; р - величина изоточ- ки вьщеляемого компонента биопрепарата; р1 - максимальная величина изоточки компонента из группы примесных компонентов биопрепарата со значением, меньшим рН,; р - минимальная величина изоэлектрической точки компонента из примесных фракций белкового препарата со значением, боль- шим рН. 4 ил. с € СЛ

| Гааль Э | |||
| и др | |||
| Электрофорез в разделении биологических макромолекул. | |||
| М.: Мир, 1982, с | |||
| Паровозный золотник (байпас) | 1921 |
|
SU153A1 |
Авторы
Даты
1987-03-15—Публикация
1984-10-29—Подача