Изобретение относится к биотехнологии и может быть использовано для производства гриппозной вакцины, которая может найти применение для профилактики гриппа среди населения с целью снижения риска заболевания и осложнений. Ежегодно эпидемия гриппа является серьезной проблемой для здоровья людей, и фармацевтические компании работают по ряду направлений научных проектов для создания новых гриппозных вакцин. Основные типы вакцин против гриппа, лицензированные для клинического использования, являются живыми или инактивированными. В настоящее время для профилактики гриппа в подавляющем большинстве стран применяются следующие инактивированные вакцины:
- цельновирионные вакцины содержат убитые корпускулярные (цельные) вирусы гриппа, они обеспечивают достаточный иммунный ответ, но их применение сопровождается повышенным риском побочных эффектов;
- расщепленные вакцины представляют собой смесь структурных компонентов вириона (поверхностных и внутренних), разъединенных с помощью различных детергентов;
- субъединичные вакцины содержат только поверхностные антигены гемагглютинин и нейраминидазу, эти вакцины являются наиболее безопасными. Однако эффективность гриппозных вакцин, содержащих очищенные белковые фрагменты вируса, обычно снижается из-за недостаточной иммуногенности.
Обширный опыт применения живых гриппозных вакцин в России, а также результаты многочисленных клинических испытаний в США и Азии показали, что они эффективны не только против сезонных штаммов вируса гриппа, но также дают высокий процент защиты и в отношении вновь возникающих вирусов гриппа. Хорошая протективная активность живых гриппозных вакцин объясняется тем, что препарат вводится интраназально, позволяя у вакцинированных индуцировать секреторный, местный, иммунный ответ, наряду с клеточным и гуморальным. Более чем за 30 лет использования накоплены многочисленные данные о профилактической и эпидемиологической эффективности вакцины у детей, также доказывающие ее биологическую безопасность и низкую реактогенность. Выпускаемая с 2005 года вакцина гриппозная аллантоисная живая лиофилизированная «Ультравак» используется для профилактики гриппа у всех возрастных групп, начиная с 3-х лет. Вакцина «Ультравак» защищена патентом РФ №2290205 от 13.09.2005 г.
Способ ее получения включает заражение куриных эмбрионов вакцинным штаммом вируса гриппа, отделение вируссодержащей аллантоисной жидкости, введение стабилизатора, стерилизующее фильтрование, розлив в ампулы и лиофилизацию. При этом стабилизатор содержит навески из сахарозы - 135 г, лактозы - 90 г, глутамата натрия - 15 г, триса - 5 г, натрия хлорида - 7,5 г, растворенные в 0,7 л стерильной дистиллированной воды и смешанные с 10%-ным раствором желатина в соотношении 3:1, а в процессе лиофилизации ампулы с вакциной выдерживают в течение 5 часов при температуре минус 36°С, причем первые 2 часа при атмосферном давлении (50±10) мм рт.ст., далее в течение 30 часов при температуре минус 16°С. После чего регулятор температуры отключают на 6 часов, а затем в течение 15 часов проводят досушивание при температуре плюс 28°С с последующим заполнением ампул инертным газом и их запайкой. Однако эта вакцина имеет ряд недостатков:
- частичная потеря специфической активности на стадии лиофилизации;
- присутствие в вакцине овальбумина и примесных белков;
- неудобство в использовании, связанное с растворением вакцины водой для инъекций;
- применение вакцины для профилактики гриппа у детей возможно только с 3- летнего возраста.
Задача изобретения - создание новой живой гриппозной вакцины в жидком виде, которая имела бы стабильную специфическую активность и являлась более очищенной от овальбумина и примесных белков по сравнению с вакциной «Ультравак» и могла бы сохранять свои качества в течение срока годности. Для решения этой задачи потребовалась проработка нескольких вариантов стабилизаторов и нескольких вариантов способов очистки.
Технический результат - получение гриппозной вакцины в жидком виде с более высокой степенью очистки от овальбумина и примесных белков, сохранение специфической активности вакцины при хранении.
Технический результат для первого пункта формулы изобретения достигается тем, что в живой вакцине для профилактики гриппа, включающей штаммы вируса гриппа подтипа H1N1, H3N2 и типа В и стабилизатор, в качестве стабилизатора используют комплекс, состоящий из желатина, соли динатриевой этилендиамин тетрауксусной кислоты и мальтозы, при следующем содержании в дозе 0,5 мл:
- штамм вируса гриппа подтипа H1N1 и H3N2 со специфической активностью не менее 106,9 ЭИД50;
- штамм вируса гриппа типа В со специфической активностью не менее 106,4 ЭИД50;
- желатин - 4,5-5,5 мг;
- соль динатриевая этилендиамин тетрауксусной кислоты - 0,045-0,055 мг;
- мальтоза - 0,45-0,55 мг.
Использование в качестве стабилизатора комплекса из желатина, соли динатриевой этилендиамин тетрауксусной кислоты и мальтозы позволило сохранить качество вакцины в жидком виде в течение срока использования, так как этот комплекс способствует репликации генома и репродукции других компонентов вируса гриппа.
Технический результат для второго пункта формулы изобретения достигается тем, что в способе получения живой вакцины для профилактики гриппа, содержащей штаммы вирусов гриппа подтипа H1N1 H3N2 и типа В, включающем культивирование вируса гриппа в развивающихся куриных эмбрионах, отделение вируссодержащей аллантоисной жидкости, осветление и стабилизацию, после отделения вируссодержащей аллантоисной жидкости в нее добавляют раствор протамина сульфата, далее осветленную вируссодержащую аллантоисную жидкость подвергают центрифугированию и предварительному фильтрованию, затем концентрируют, из концентрированной вируссодержащей аллантоисной жидкости удаляют овальбумин и примесные белки, а в качестве стабилизатора используют комплекс, состоящий из желатина, соли динатриевой этилендиамин тетрауксусной кислоты с мальтозой.
Причинно-следственный результат заключается в том, что в вируссодержащую аллантоисную жидкость добавляют раствор протамина сульфата, далее осветленную вируссодержащую аллантоисную жидкость подвергают центрифугированию и предварительному фильтрованию, затем концентрируют. Из концентрированной вируссодержащей аллантоисной жидкости удаляют методом гельфильтрации овальбумин и примесные белки, приводящие к аллергическим реакциям, что позволяет снизить противопоказания и побочные действия. Полученная таким способом вакцина повышает общую резистентность организма к вирусу гриппа. Высокая специфическая активность и нетоксичность для животных позволяют предположить более высокую иммуногенность и безопасность. Включение стадии обработки протамина сульфатом, центрифугирования, концентрирования вируссодержащей аллантоисной жидкости и гельфильтрационной очистки концентрированной вируссодержащей аллантоисной жидкости на препаративной стеклянной колонке, заполненной носителем МПС 2000, улучшает качество гриппозной вакцины за счет очистки от овальбумина и примесных белков.
Использование в качестве стабилизатора комплекса, состоящего из соли динатриевой этилендиамин тетрауксусной кислоты и мальтозы, позволяет сохранить специфическую активность вакцины и способствует стабильности в течение срока годности препарата.
Живая вакцина для профилактики гриппа содержит штаммы вируса гриппа подтипа H1N1, H3N2 и типа В и стабилизатор в виде комплекса, состоящего из желатина, соли динатриевой этилендиамин тетрауксусной кислоты и мальтозы.
В дозе 0,5 мл вакцины содержится:
- штамм вируса гриппа подтипа H1N1, H3N2 со специфической активностью не менее 106,9 ЭИД50;
- штамм вируса гриппа типа В со специфической активностью не менее 106,4 ЭИД50;
- стабилизатор: желатин + соль динатриевая этилендиамин тетрауксусной кислоты + мальтоза, при следующем соотношении:
- желатин - 4,5-5,5 мг;
- соль динатриевая этилендиамин тетрауксусной кислоты - 0,045-0,055 мг;
- мальтоза - 0,45-0,55 мг.
Композиция стабилизатора содержит: желатин в количестве 100 г/л, соль динатриевую этилендиамин тетрауксусной кислоты в количестве 10 г/л и мальтозу в количестве 100 г/л.
Способ получения вакцины осуществляют следующим образом.
Культивируют вирус гриппа в развивающихся куриных эмбрионах, отделяют вируссодержащую аллантоисную жидкость. В вируссодержащую аллантоисную жидкость добавляют раствор протамина сульфата 1%-ный до концентрации 0,01% и выдерживают при температуре (2-8)°С 12-24 часа. Затем разливают по 1,0 л в стерильные полимерные бутылки и закрывают крышками, центрифугируют в следующем режиме: 4500 об/мин в течение 30 мин при температуре (4±1)°С. Вируссодержащую аллантоисную жидкость, содержащую вирус гриппа, сливают в стерильную бутыль.
Предварительное фильтрование проводят через фильтр-капсулу диаметром пор от 0,8 до 3,0 мкм, которую подсоединяют между выходом из бутыли с объединенной вируссодержащей аллантоисной жидкостью и сифоном приемной бутыли через перистальтический насос.
Концентрирование проводят на установке микро- и ультрафильтрации с установленными кассетными модулями от 3 до 5 штук (в зависимости от объема очищенной вируссодержащей аллантоисной жидкости, поступающей на концентрирование, и скорости фильтрации в процессе эксплуатации фильтров).
Для проведения концентрирования используют кассетные модули с отсечением 100 кДа, предназначенные для работы с биологическими жидкостями. Установку и систему трубопроводов стерилизуют раствором формалина 3%-ным с экспозицией не менее 30 мин. Затем от формалина установку отмывают стерильной водой для инъекций. Для уравновешивания значения рН используют стерильный трис-буфер 0,05 М, рН (7,2±0,2). Вируссодержащую аллантоисную жидкость концентрируют до объема, равного 1/5 части объема носителя в колонке, но не более чем в 4 раза.
Гельфильтрация проводится на препаративной стеклянной колонке, заполненной носителем МПС 2000. Для стерилизации носителя МПС 2000 колонку заполняют раствором формалина 3%-ным с экспозицией не менее 30 мин, а затем промывают стерильной водой для инъекций. Для уравновешивания значения рН через носитель пропускают трис-буфера 0,05 М, рН (7,2±0,2). После этого к «входу» колонки через насос присоединяют бутыль с концентрированной вируссодержащей аллантоисной жидкостью в объеме 1/5 от объема носителя. После внесения раствора вирусного концентрата к «входу» колонки через насос присоединяют бутыль с трис-буфером 0,05 М. Отбор фракции в бутыль осуществляют с помощью UV детектора с проточной ячейкой.
Стерилизующее фильтрование фракции проводят через фильтр-капсулу диаметром пор 0,22 мкм, которую подсоединяют между выходом из бутыли с фракцией и сифоном приемной бутыли через перистальтический насос. В стерильную фракцию добавляют раствор желатина 10%-ный (подогретого до 37°С) до конечной концентрации его во фракции 1%.
Во фракцию с желатином добавляют остальные компоненты стабилизатора.
Соотношение компонентов стабилизатора:
подтип вируса гриппа H1N1 - 9,8 частей моновалента, раствор мальтозы 10% - 0,1 часть, раствор соли динатриевой этилендиамин тетрауксусной кислоты 1% - 0,1 часть;
подтип вируса гриппа H3N2 - 9,8 частей моновалента, раствор мальтозы 10% - 0,1 часть, раствор соли динатриевой этилендиамин тетрауксусной кислоты 1% - 0,1 часть;
тип вируса гриппа В - 9,8 частей моновалента, раствор мальтозы 10% - 0,1 часть, раствор соли динатриевой этилендиамин тетрауксусной кислоты 1% - 0,1 часть.
Подтверждением высокой степени очистки по данной технологии является низкое содержание овальбумина (OA) в вакцине в жидком виде по сравнению с вакциной «Ультравак®» (таблица №1).
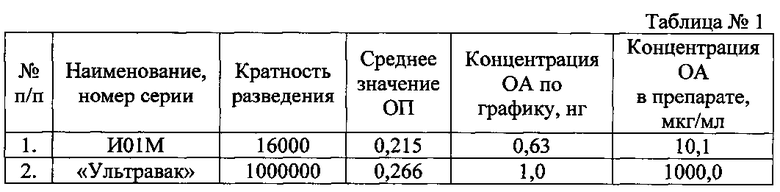
Примечание:
Серии И01М содержат стабилизатор 0,1% мальтозы с 0,01%-ным раствором соли динатриевой этилендиамин тетрауксусной кислоты и 1% желатина;
Предложенный способ получения вакцины позволяет уменьшить содержание овальбумина до 100 раз без снижения специфической активности.
Полученная вакцина стабильна в течение года, что подтверждается данными контроля специфической активности, приведенными в таблице №2.
Это позволяет проводить следующий этап разработки препарата - доклинические исследования.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА ГРИППА | 2009 |
|
RU2420314C1 |
| Способ получения четырехвалентной вакцины для профилактики гриппа | 2020 |
|
RU2754398C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА ГРИППА | 2003 |
|
RU2330885C2 |
| Способ получения инактивированной гриппозной вакцины | 1991 |
|
SU1822791A1 |
| ВАКЦИННЫЙ ШТАММ ВИРУСА ГРИППА А(Н3N2)-А/8/Perth/16/2009 ДЛЯ ПРОИЗВОДСТВА ИНАКТИВИРОВАННОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2010 |
|
RU2458124C2 |
| Способ получения микрокапсулированной формы живой культуральной вакцины против сезонного и пандемического гриппа для интраназального применения | 2016 |
|
RU2617051C1 |
| ШТАММ ВИРУСА ГРИППА А/Гонконг/1/68/162/35 (H3N2)-УНИВЕРСАЛЬНЫЙ ДОНОР ВНУТРЕННИХ ГЕНОВ ДЛЯ РЕАССОРТАНТОВ И РЕАССОРТАНТНЫЕ ШТАММЫ А/СПБ/ГК/09 (H1N1) И А/НК/Astana/6:2/2010 (H5N1), ПОЛУЧЕННЫЕ НА ЕГО ОСНОВЕ | 2011 |
|
RU2511431C2 |
| Способ получения антигена или антигенов для производства противогриппозной вакцины и вакцина на его основе | 2019 |
|
RU2710239C1 |
| Пентавалентная субъединичная вакцина против респираторных инфекций и способ ее получения | 2022 |
|
RU2804948C2 |
| РЕАССОРТАНТ ReM8 - ВАКЦИННЫЙ ШТАММ ВИРУСА ГРИППА А ПОДТИПА Н1N1 | 2011 |
|
RU2457245C1 |
Группа изобретений относится к медицине, а именно к иммунологии, и направлена на получение гриппозной вакцины в жидком виде. Живая вакцина в жидком виде для профилактики гриппа включает штаммы вирусов гриппа типа H1N1 H3N2, В и стабилизатор. В качестве стабилизатора используют комплекс, состоящий из желатина, соли динатриевой этилендиамин тетрауксусной кислоты с мальтозой, при следующем содержании в дозе 0,5 мг: штамм вируса гриппа подтипа H1N1 и H3N2 со специфической активностью не менее 106,9 ЭИД50; штамм вируса гриппа типа В со специфической активностью не менее 106,4 ЭИД50; желатин - 4,5-5,5 мг; соль динатриевая этилендиамин тетрауксусной кислоты - 0,045-0,055 мг; мальтоза - 0,45-0,55 мг. Группа изобретений относится также к способу получения вышеуказанной гриппозной вакцины. Использование данной группы изобретений позволяет получить живую гриппозную вакцину в жидком виде с более высокой степенью очистки от овальбумина и примесных белков, а также способствует сохранению специфической активности вакцины при хранении. 2 н.п. ф-лы, 2 табл.
1. Живая вакцина в жидком виде для профилактики гриппа, включающая штаммы вирусов гриппа типа H1N1 H3N2, В и стабилизатор, отличающаяся тем, что в качестве стабилизатора используют комплекс, состоящий из желатина, соли динатриевой этилендиамин тетрауксусной кислоты с мальтозой, при следующем содержании в дозе 0,5 мг:
- штамм вируса гриппа подтипа H1N1 и H3N2 со специфической активностью не менее 106,9 ЭИД50;
- штамм вируса гриппа типа В со специфической активностью не менее 106,4 ЭИД50;
- желатин - 4,5-5,5 мг;
- соль динатриевая этилендиамин тетрауксусной кислоты - 0,045-0,055 мг;
- мальтоза - 0,45-0,55 мг.
2. Способ получения живой вакцины по п. 1 для профилактики гриппа, включающей штаммы вирусов гриппа типа H1N1 H3N2, В, путем культивирования вируса гриппа в развивающихся куриных эмбрионах, отделение вируссодержащей аллантоисной жидкости, осветления и стабилизации, отличающийся тем, что после отделения вируссодержащей аллантоисной жидкости в нее добавляют раствор протамина сульфата, далее осветленную вируссодержащую аллантоисную жидкость подвергают центрифугированию и предварительному фильтрованию, затем концентрируют, из концентрированной вируссодержащей аллантоисной жидкости удаляют овальбумин и примесные белки, а в качестве стабилизатора используют комплекс, состоящий из желатина, соли динатриевой этилендиамин тетрауксусной кислоты с мальтозой.
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ГРИППА | 2005 |
|
RU2290205C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 1991 |
|
RU2033182C1 |
Авторы
Даты
2016-12-10—Публикация
2015-04-06—Подача