Изобретение относится к микробиологической промышленности, молекулярной биологии и генетической инженерии и представляет собой сконструированную in vitro рекомбинантную плазмиду, обеспечивающую биосинтез лейкоцитарного интерферона человека, и штамм E. coli, содержащий эту плазмиду, - продуцент лейкоцитарного интерферона αF человека.
Целью изобретения является упрощение технологии крупномасштабного производства лейкоцитарного интерферона αF человека.
П р и м е р 1. Конструирование рекомбинантной плазмиды pIFN- αF-P2.
1. Конструирование рекомбинантной плазмиды pGDP1.
150 мкг РФ1 ДНК фага ФХ174 расщепляют с помощью 200 ед. эндонуклеазы рестрикции AluI в буфере, содержащем 50 мМ NaCl, 10 ммоль трис-HCl (рН 7,6), 10 ммоль MgCl2 и 10 ммоль меркаптоэтанола, при 37оС в течение 2 ч. Общий объем реакционной смеси 800 мкл. Смесь субфрагментов обрабатывают фенолом, осаждают этанолом и растворяют в 150 мкл ТЕ-буфера, содержащего 10 ммоль трис-HCl (рН 8,0) и 1 ммоль ЭДТА, после чего наносят на 8%-ный полиакриламидный гель (ПААГ) и подвергают электрофоретическому разделению при 60 мА в течение 8 ч. Полоску геля, содержащую фрагмент ДНК А6, вырезают и ДНК элюируют по Максаму - Гилберту.
Полученный таким образом фрагмент, содержащий промотор, рибосомо-связывающий участок (последовательность Шайн - Дальгарно SD) и 19 N-концевых кодонов гена D фага ФХ174, встраивают в плазмидный вектор pBRH4, который предварительно расщепляют эндонуклеазой рестрикции EcoRI и обрабатывают Кленовским фрагментом ДНК-полимеразы 1 E. coli в присутствии dATP и dTTP для достройки выступающих 5'-концов. 1 мкг подготовленного таким способом вектора pBRH4 и 0,1 мкг фрагмента Р1 соединяют с помощью 5 ед. Т4-ДНК-лигазы в буфере, содержащем 50 ммоль трис-HCl (рН 7,5), 10 ммоль MgCl2, 5 ммоль DTT и 0,2 ммоль ATP, при 15оС в течение 16 ч. Общий объем реакционной смеси 50 мкл. Полученной смесью рекомбинатных ДНК трансформируют клетки E. coli К 802 по известному методу. Эффективность трансформации составляет 107 колоний на 1 мкг плазмидной ДНК pBR 322. Отбирают клоны, устойчивые к тетрациклину (10 мкг Тс на 1 мл), и проводят их рестрикционный анализ.
2. Конструирование рекомбинантной плазмиды pGDP2.
Фрагмент Р1 выделяют из состава плазмиды pGDP1, расщепляя ее (200 мкг) с помощью 400 ед. эндонуклеазы. EcoR1 в буфере, содержащем 100 ммоль NaCl, 50 ммоль трис-HCl (рН 7,5), 10 ммоль MgCl2, 1 ммоль DTT, при 37оС 90 мин. Общий объем реакционной смеси 800 мкл. Смесь субфрагментов обрабатывают фенолом, осаждают этанолом и растворяют в 150 мкл ТЕ-буфера. Отделение фрагмента Р1 от исходного вектора производят с помощью электрофореза в 8%-ном ПААГ при 60 мА в течение 8 ч. Фрагмент Р1 элюируют из геля, как указано. Затем фрагмент Р1 дефосфорилируют, вводят 5'-концевую метку с помощью [j-32Р]АТР и Т4-полинуклеотидкиназы по Максаму - Гилберту. Меченый фрагмент Р1 расщепляют эндонуклеазой рестрикции BspRI на большой [226 пар оснований (п. о. )] и малый (11 п. о.) EcoRI-BspRI-фрагменты. 14 мкг полученной смеси фрагментов расщепляют с помощью 14 ед. эндонуклеазы Hinf I в буфере, содержащем 50 ммоль NaCl, 10 ммоль трис-HCl (рН 7,6), 10 ммоль MgCl2 и 10 ммоль меркаптоэтанола, при 37оС, отбирая аликвоты через 5, 10, 20, 30 и 40 мин. Общий объем реакционной смеси 40 мкл.
Так добиваются частичного гидролиза фрагмента P1 эндонуклеазой Hinf I. Смесь субфрагментов наносят на 8%-ный ПААГ и разделяют при 60 мА в течение 6 ч. Фрагмент Р2 (226 п.о.) элюируют из геля, как указано, и используют для конструирования плазмиды pGDP2. Для этого 0,05 мкг фрагмента Р2 обрабатывают 5 ед. S1-нуклеазы в буфере, содержащем 0,2 моль NaCl, 50 ммоль ацетата натрия (рН 4,5), 1 ммоль ZnSO4 и 5%-ный глицерин, при 20оС в течение 20 мин. По окончании инкубации смесь обрабатывают фенолом, хлороформом и ДНК осаждают этанолом. Затем подготовленный таким образом фрагмент Р2 встраивают в плазмиду pBRH4, предварительно расщепленную эндонуклеазой EcoRI и обработанную Кленовским фрагментом ДНК-полимеразы 1 E. coli в присутствии dATP и dTTP. Ферментативное соединение фрагмента Р2 и вектора проводят, как указано, с помощью Т4-ДНК-лигазы в 50 мкл реакционной смеси. Полученной смесью рекомбинантных плазмид трансформируют клетки E. coli HB 101 и отбирают клоны, устойчивые по крайней мере к 10-20 мкг тетрациклина на 1 мл среды. Отобранные клоны подвергают рестрикционному анализу с последующим определением первичной структуры вставок.
3. Получение рекомбинантной плазмиды pIFN- αA-P2.
5 мкг неэкcпрессирующей плазмиды pIFN- αA-310 обрабатывают 10 ед. эндонуклеазы рестрикции EcoRI в буфере, содержащем 100 ммоль NaCl, 50 ммоль трис-HCl (рН 7,6), 10 ммоль MgCl2 и 1 ммоль DTT, при 37оС в течение 90 мин. Общий объем реакционной смеси 50 мкл. Затем ДНК осаждают этанолом и растворяют в 50 мкл буфера, содержащего 33 ммоль трис-HCl (рН 7,9), 66 ммоль ацетата калия, 10 ммоль MgCl2 и 1 ммоль DTT. В реакционную смесь добавляют dTTP до конечной концентрации 0,4 ммоль и 1,5 ед. Т4-ДНК-полимеразы. Реакцию проводят при 12оС в течение 90 мин, затем ДНК осаждают этанолом и растворяют в буфере, содержащем 0,2 ммоль NaCl, 50 ммоль ацетата натрия (рН 4,5), 1 ммоль ZnSO4 и 5%-ный глицерин. К реакционной смеси (20 мкл) добавляют 20 ед. S1-нуклеазы и инкубируют при 20оС 30 мин. По окончании реакции ДНК обрабатывают фенолом, хлороформом и осаждают этанолом. 1 мкг подготовленной таким образом плазмиды pIFN- αA-310 сшивают с 0,2 мкг фрагмента Р2, обработанного аналогично вектору Т4-ДНК-полимеразой в присутствии dTTP и S1-нуклеазой. Лигирование проводят в 50 мкл буфера, содержащего 20 ммоль трис-HCl (рН 7,6), 10 ммоль MgCl2, 5 ммоль DTT, 0,2 ммоль ATP и 20 ед. Т4-ДНК-лигазы, при 10оС в течение ночи.
Продуктами лигазной сшивки трансформируют клетки E. coli К 802 и с помощью гибридизации колоний in situ отбирают клоны, устойчивые к тетрациклину и содержащие вставку - фрагмент Р2. В качестве "зонда" при гибридизации используют 32Р - меченый фрагмент Р2.
20 из 140 гибридизирующихся с промоторсодержащим "зондом" клонов анализируют на продукцию интерферона радиоиммунологическим методом. В результате получают плазмиду pIFN- αA-Р2.
4. Конструирование рекомбинантной плазмиды pIFN- αF-Р2.
20 мкг плазмиды pIFN- A-P2 расщепляют смесью эндонуклеаз рестрикции. Hind III и Sam3AI в 50 мкл буфера, содержащего 50 ммоль трис-HCl (рН 7,5), 50 ммоль NaCl, 10 ммоль MgCl2, 1 ммоль DTT и 20 ед. каждой из эндонуклеаз, при 37оС в течение 1 ч. Реакционную смесь подвергают электрофоретическому разделению, как указано, для Alu I-гидролизата РФ1 ДНК фага ФХ174. Фрагмент ДНК, содержащий 251 п.о., элюируют из геля, как указано.
20 мкг плазмиды pIFN- αF-7, содержащей неэкспрессируемый ген интерферона αF, расщепляют эндонуклеазой рестрикции BamHI в буфере, состав которого указан выше, в присутствии 20 ед. фермента, 37оС в течение 1 ч. Затем в реакционную смесь добавляют 5 ед. эндонуклеазы Sam3AI и проводят ограниченный гидролиз расщепленной BamHI плазмиды при 37оС в течение 20 мин. Общий объем реакционной смеси 50 мкл. Фрагмент длиной 851 п.о. и содержащий С-концевую область гена αF-интерферона с помощью электрофореза в 4%-ной ПААГ отделяют от других фрагментов. 20 мкг вектора pBR 322 расщепляют смесью эндонуклеаз рестрикции BamHI и Hind III, как указано, и с помощью электрофореза в 1% -ном агарозном геле выделяют большой BamHI-Hind III - фрагмент плазмиды pBR 322. Затем 0,1 мкг данного фрагмента ферментативно сшивают с 0,01 мкг Hind III-Sam3AI-фрагмента (251 п.о.) плазмиды pIFN- αA-P2 и 0,01 мкг Sam3AI-BamHI - фрагмента (851 п.о.) плазмиды pIFN- αF-7 в 100 мкл буфера, содержащего 50 ммоль трис-HCl (рН 7,6), 10 ммоль MgCl2, 1 ммоль DTT и 0,2 ммоль ATP, с помощью 10 ед. Т4-ДНК-лигазы при 14оС в течение ночи. Полученной смесью рекомбинантных плазмид трансформируют клетки E. coli. Отбирают клоны с высоким уровнем биосинтеза зрелого αF-интерферона человека с помощью р адиоиммунологического анализа и получают рекомбинантную плазмиду pIFN- αF-P2.
П р и м е р 2. Получение штамма - продуцента лейкоцитарного αF-интерферона человека.
Рекомбинантную плазмиду pIFN- αF-P2 трансформируют в штамм E. coli К 802, как указано в примере 1, и получают штамм - продуцент зрелого лейкоцитарного интерферона αF человека.
Активность интерферона определяют методом ингибирования цитопатического действия вируса везикулярного стоматита на диплоидные фибробласты человека и радиоиммунологическими методами. Содержание интерферона в 1 л культуры при OD550 = 2,0 составляет 3 х 108 ед. активности.
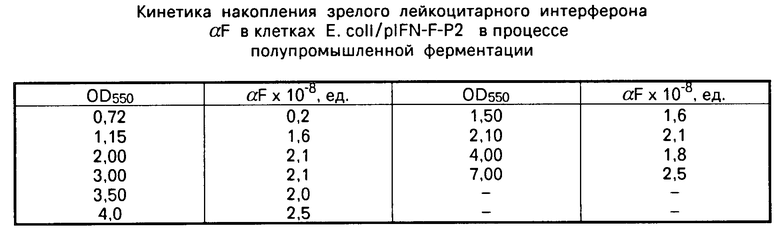
П р и м е р 3. Кинетика накопления интерферона в культуре штамма - продуцента E. coli К 802/pIFN- αF-P2 в зависимости от фазы роста.
250 мл среды, содержащей в 1 л 10 г пептона, 5 г дрожжевого экстракта, 5 г NaCl и 5 мг тетрациклина (рН 7,5), загружают в 500-литровый ферментер и инокулируют 2,5 л ночного посевного материала (OD550 = 2,5). Режим культивирования: 37оС, воздух 1:1, давление 0,5 атм. Через определенные промежутки времени отбирают аликвоты и определяют в них активность интерферона радиоиммунологическими методами. В таблице представлены данные по определению активности интерферона в клеточных экстрактах штамма - продуцента E. coli, содержащего рекомбинантную плазмиду pIFN- αF-P2, в зависимости от оптической плотности культуры при OD550.
Из данных таблицы следует, что максимальный уровень активности интерферона в бактериальной клетке достигается при OD550 культуры штамма-продуцента около 2,0. При этом средняя активность интерферона в клеточных экстрактах составляет 2 х 108 ед. активности в 1 л культуры. В связи с этим ферментацию штамма-продуцента наиболее выгодно проводить до плотности культуры не выше 2,0 Е/л (550 нм).
Таким образом, новая рекомбинантная плазмида pIFN- αA-P2, а также штамм E. coli, содержащий эту плазмиду, - продуцент лейкоцитарного интерферона αF человека позволяют значительно упростить процесс крупномасштабного получения интерферона αF человека при сохранении высокого уровня биосинтеза.
| Авторское свидетельство СССР N 1200811, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1994-12-30—Публикация
1984-07-13—Подача