Изобретение относится к новому химическому соединению/ конкретно к 3β-хлор-4β-окси-24S-этил-5β-холестан-6-ону формулы I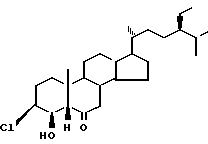 и способу его получения. Соединение (I) проявляет фиторостостимулирующую активность и может быть использовано в практике сельского хозяйства в качестве регулятора роста растений.
и способу его получения. Соединение (I) проявляет фиторостостимулирующую активность и может быть использовано в практике сельского хозяйства в качестве регулятора роста растений.
Целью изобретения является получение нового производного β-ситостерина (V), превосходящего по фитостимулирующей активности известные соединения β-экдизон (II), гиббереллин A3 (III) и гетероауксин (IV).
Соединение (I) получают в результате взаимодействия 3β-хлорхолест-24S-этилхолест-5-ена (V) с двуокисью селена при кипячении и последующей обработки полученного нового соединения 3β-хлор-24S-этилхолест-5-ен-4β-ола (VI) трифторнадуксусной кислотой в метиленхлориде. Исходные 3 β-хлор-24S-этилхолест-5-ен получают из β-ситостерина известным способом. 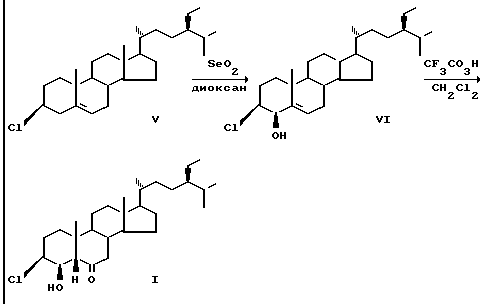
П р и м е р. К раствору 8,5 г (19,6 ммоль) 3 -хлор-24S-этилхолест-5-ена в 250 мл диоксана прибавляют 4,0 г (36 ммоль) двуокиси селена. Реакционную смесь кипятят с обратным холодильником в течение 3,5 ч, после охлаждения до комнатной температуры фильтруют через окись алюминия.
Фильтрат упаривают в вакууме и остаток подвергают колоночной хроматографии на силикагеле, алюируя смесью гексана с эфиром (25: 1). Получают 3,35 г (7,46 ммоль, 38% ) 3 β-хлор-24S-этилхолест-5-ен-4β-ола (VI). Т. пл. 99-102оС (ацетон).
Найдено, % : С 77,58; Н 11,17; Сl 7,60.
C29H49OCl
Вычислено, % : С 77,55; Н 11,00; Cl 7,89.
М. м. 449, y. e.
ИК-спектр (KBr), см-1: 3550 (OH).
Спектр ПМР (100 МГц, CDCl3, δ), м. д. : 0,66 (с, 3Н, 18 - Me), 0,88 (с, 3Н, 19 - Me), 4,02 (м, W/2 = 24 Гц, 1Н, С3-Hα), 4,17 (м, W/2 = 6 Гц, 1Н, С4-Hα), 5,73 (м, 1Н, С6-Н).
К раствору 0,78 г (1,7 ммоль) 3 β-хлор-24S-этилхолест-5-ен-4β-ола (VI) в 20 мл метиленхлорида приливают при перемешивании раствор трифторнадуксусной кислоты (приготовлен прибавлением 1,7 мл (15 ммоль) 30% -ной перекиси водорода к раствору 2,4 м (17 ммоль) трифторуксусного ангидрида в 10 мл метиленхлорида). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч, затем фильтруют через окись алюминия. Фильтрат упаривают в вакууме, остаток подвергают колоночной хроматографии на силикагеле, элюируя смесью гексана с эфиром (50: 1). Получают 0,51 г (1,1 ммоль) (65% ) 3 β-хлор-4β-окси-24S-этил-5 β-холестан-6-она (I). Т. пл. 194-196оС (гексан).
Найдено, % : C 74,90; Н 10,60; Cl 7,80.
С29Н49O2Cl
Вычислено, % : C 74,88; Н 10,62; Cl 7,62.
М. м. 465,16 y. e.
ИК-спектр (KBr), см-1: 3550 (OH), 1712 (C= O).
Спектр ПМР (360 МГц, CDCl3, δ), м. д. : 0,69 (с, 3Н, 18-Me), 1,04 (с, 3Н, 19-Me), 0,99 (д, J = 6,6 Гц, 3Н, 21-Me), 0,84 (д, J = 6,6 Гц, 6Н, 26/27-Me), 0,83 (т, J = 6,7 Гц, 3Н, 29-Me), 4,32 (м, W/2 = 5 Гц, 1Н, С3-Hα), 4,51 (дд, J1 = 11,60 Гц, J2 = 6,56 Гц, 1Н, С4-Hα).
Изучение биологической активности 3β-хлор-4β-окси-24S-этил-5 β-холестан-6-она (I) проводилось на растениях фасоли и рапса. В качестве эталона служили фитогормоны гиббереллин А3 (III) и гетероауксин (VI). Использовались следующие тесты для определения фиторостостимулирующей активности.
Рост корней фасоли. По 10 семян фасоли помещали в чашки Петри и приливали по 10 мл раствора с исследуемыми веществами. Закрытые чашки помещали в темноту при 24оС на 7 дней. По истечении этого срока измерили длину корней фасоли. Результаты испытаний приведены в табл. 1.
Рост фасоли. По 10 семян фасоли помещали в чашки Петри и приливали по 10 мл раствора, содержащего исследуемые вещества. Чашки ставили на сутки в темноту, затем замоченные семена высаживались по три в стаканчики с почвой. Дальнейшее прорастание и рост проростков проходили при 12-часовом фотопериоде при искусственном освещении в течение 10 суток. Измеряли длину гипокотилей фасоли. Результаты приведены в табл. 2.
Тест с растениями рапса. Использовали рапс сорта Ольга. Семена проращивали двое суток в темноте, затем переносили в чашки Петри с растворами исследуемых соединений. Вносили по 2 мл раствора и по 10 семян рапса в чашку диаметром 4 см. Дальнейший рост проходил на свету в течение 3 суток. Измеряли длину корней рапса. Результаты измерений приведены в табл. 3.
Как видно из представленных в табл. 1-3 данных, описываемое соединение 3β-хлор-4β-окси-24S-этил-5β-холестан-6-он обладает фиторостостимулирующим действием. В этом отношении он не уступает известным фитогормонам гиббереллину А3 (III) и гетероауксину (IV), а при некоторых концентрациях превосходит их.
3β-Хлор-4β-окси-24S-этил-5 β-холестан-6-он по фиторостостимулирующей активности превосходит структурный аналог α-экдизон по крайней мере в 10 раз. ЛД50 описываемого соединения составляют более 4500 мг/кг.
Описываемый способ позволяет получить новое производное β-ситостерина (I), проявляющее высокую фиторостостимулирующую активность. (56) Ахрем А. А. , Левина И. С. и Титов Ю. А. Экдизоны - стероидные гормоны насекомых. Минск: Наука и техника, 1973, с. 85.
Carlisle D. B. , Osborne D. J. , Ellis P. E. , Moorhouse J. E. Reciprocal effect of insect and plant growth substances. - Nature, 1963, v. 200, N 4912, p. 1230.
Мельников Н. Н. и др. Справочник по пестицидам. М. : Химия, 1985, с. 36.
Sharplees K. B. , Michaelson R. C. Higt stereo and regioselectivities in the transition metal catalyzed epoxidation of olefinic alcohols by tert-butyl hydroperoxide. - J. Am Chem. Soc. , 1973, v. 95, N 18, p. 6136-6137.
Shoppee C. W. Steroids and Walden intersion; IV, Derivatives of 6-Ketositostane and 6: 17-diketoandroctane. - J. Chem. Soc. , 1948, N 7, p. 1043-1045.
| название | год | авторы | номер документа |
|---|---|---|---|
| 3 @ -Хлор-24S-этилхолест-5 @ -ен-4 @ -ол в качестве полупродукта в синтезе 3 @ -хлор-4 @ -окси-24S-этил-5 @ -холестан-6-она | 1986 |
|
SU1356428A1 |
| 2 @ ,3 @ ,22S,23S-Тетраокси-24S-этилхолест-4-ен-он, обладающий фиторостостимулирующей активностью | 1987 |
|
SU1433005A1 |
| (22ζ)-6b-МЕТОКСИ-3a,5-ЦИКЛО-5a-ХОЛЕСТАН-24-ОН-22-ОЛ В КАЧЕСТВЕ ПОЛУПРОДУКТА В СИНТЕЗЕ (22R,23R)-3b-АЦЕТОКСИ-22,23-ИЗОПРОПИЛИДЕНДИОКСИ-24-МЕТИЛХОЛЕСТ-5-ЕНА | 1991 |
|
RU2024540C1 |
| (22R)-20- 3′ ИЗОПРОПИЛИЗОКСАЗОЛИН-5-ИЛ) 3α ЦИКЛО 5α ПРЕГНАН-6-ОН, ПРОЯВЛЯЮЩИЙ ФИТОРОСТОСТИМУЛИРУЮЩУЮ АКТИВНОСТЬ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1990 |
|
SU1786807A1 |
| Способ получения 3 @ -хлор-24R-этилхолест-5-ен-4 @ -ола | 1988 |
|
SU1536783A1 |
| СТЕРОИДЫ, СПОСОБ РЕГУЛИРОВАНИЯ МЕЙОЗА | 1996 |
|
RU2182909C2 |
| НОВЫЕ НАФТО[2,1-b]КАРБАЗОЛПРОИЗВОДНЫЕ ФУЗИДОВОЙ КИСЛОТЫ, СПОСОБ ПОЛУЧЕНИЯ И АНТИМИКРОБНЫЕ СВОЙСТВА | 2019 |
|
RU2746947C2 |
| КАРДИОЗАЩИТНОЕ СРЕДСТВО И ЕГО КОМПОЗИЦИЯ | 1995 |
|
RU2166319C2 |
| Новые 3,4-гидроксиамины пинановой структуры | 2016 |
|
RU2631871C1 |
| СПОСОБ ПОЛУЧЕНИЯ 17-(3-ГИДРОКСИПРОПИЛ)-17-ГИДРОКСИСТЕРОИДОВ | 2008 |
|
RU2466137C2 |



Изобретение касается замещенных стероидов, в частности получения 3b-хлор- 5b-окси-24S-этил-5b- холестан-6-она (ХН), который обладает фиторостостимулирующей активностью и может быть использовано в сельском хозяйстве. Цель изобретения - создание нового более активного соединения указанного класса. Синтез ХН ведут окислением 3b-хлор-24S- этилхолест-5-ена (I) двуокисью селена (II) при кипячении в среде диоксана с последующей обработкой трифторнадуксусной кислотой (III) в среде метиленхлорида при комнатной температуре. Целесообразно использовать соотношение I и II, равное 1: 1,8, а соединение III использовать в 8,8-кратном избытке по отношению к промежуточному продукту окисления. Выход ХН 65% , т. пл. 194 - 196С (гексан), брутто ф-ла C29H49O2Cl. ХН проявляет активность в отношении роста фасоли, рапса, аналогичную гиббереллину A3 и гетероауксину IV, но в 10 раз лучше известного α -экдизона. Токсичность LD50 4500 мг/кг. 2 с. п. 1 з. п. ф-лы, 3 табл.
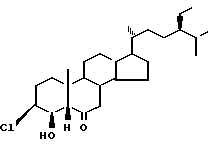
обладающий фиторостостимулирующей активностью.
Авторы
Даты
1994-01-30—Публикация
1986-01-10—Подача