Изобретение относится к молекулярной биологии и биохимии и может быть использовано для изучения регуляции биосинтеза белка в клетках эукариоти- ческих организмов.
Цель изобретения - повышение чистоты целевых продуктов.
Поставленная цель достигается с помощью диссоциации полирибосом, связанньгх с твердым иммуносорбентом для рибосом (твердофазной диссоциацией полирибосом), известными агентами. Препарат цитоплазматических рибонук- леопротеидов инкубируют с твердым . иммуносорбентом. При этом полирибосомы, рибосомы и их субчастицы, присутствующие в препараты, связывают- ся с ним. Жидкую фазу, содержащую свободные информосомы, отделяют от твердой колоночной хроматографией или центрифугированием, после чего проводят твердофазную диссоциацию полири- босом известными агентами. Полирибо- сомные информосомы, освободившиеся от полирибосом в процессе диссоциации их на рибосомныё субчастицы, переходят в жидкую фазу. Те рибосомш 1е /субчастицы, которые образовались в результате диссоциации полирибосом и рибосом и до этого не были непосред- ственно связаны с иммуносорбентом в составе рибосомы, тоже переходят в зкидкую. фазу .и загрязняют освободившиеся полирибосомные информосомы. Поэтому необходим избыток твердого им- муносорбента для их связьгаания, который устанавливается опытным путем. Жидкую фазу с освободившимися полирй- босомными информосомами отделяют от твердой колоночной хроматографией или центрифугированием.
Источники цитоплазматических ин- формосом (клетки, ткани, органы, целые организмы) инкубируют с радио активным предшественником информосом в течение 20-30 мин.
Пример 1. Отделение полирибо- сомных информосом от свободных из листьев гороха.
Получение цитоплазматических ри бонуклерпротеидов,
10 г зеленых листьев гомогенизируют, в буфере, содержащем 200 Трис рН 8,5, 150 мМ КС1, 5 нМ MgCl, 5 ( 2-меркаптоэтанола, 250 мМ сахарозы и 5 мкг/мп цикпогексИмида. Объем буфера 20 иг, Гомогенат фильтруют два слоя нейлона и жидкость центрнфу
пc g 5 Q
5
0
50
гируют при 3000 g в течение 5 мин. Надосадочную жидкость фильтруют и центрифугируют при 23000-g в течение 20 мин в роторе SV 50.1. Надосадочную жидкость обрабатывают Тритоном Х-100 (0,5%) в течение 10 мин и центрифугируют при I05000-g в течение 4 ч в роторе SW 50.1, Для мечения in vitro осадок цитоплазматических рибонуклео- протеидов суспендируют в буфере, содержащем 50 т HEPES, рН 7.8, 10 мМ КС1, 10 MgClj, 5 мМ дитиотрейтола, 5 мкг/мп циклогексимида, 0,25 r4i фе- нилметилсульфонилфлюорида, 0,025 Й1 лейпептина, 15 ед. РНКазина, Агрегаты удаляют центрифугированием при 15000 g в течение 15 мин, 1-5 AgdoSA, рибонуклеопротеидов.инкубируют со смесью, содержащей 12 ед. Т4 РНК-ли- загы и 100 мкКи З , 5( 5 -5 Р) цити- диндифосфата, приготовленной на буфере для суспендирования. Объем смеси 30 мкл. Реакцию мечения проводят при +28°С в течение 30 мин, Дпя остановки реакции смесь охлаждают до +2 С. и разбавляют в 10 раз буфером для суспендирования без РНКазина и подвергают иммуноаффинной хроматографии.
Выделение цитоплазматических рибосом дпя иммунизации кроликов,
10 г зеленых листьев гомогенизировали в 20 мл буфера, содержащего 200 т. Трис/ рН 7,3, 150 ьй« КС1, 5 мМ MgClj, 5 мМ МЭТ, Гомогенат, фильтруют через два слоя нейлона и цент- . рифугируют при 3000 g в течение 5 мин, Надосадочную жидкость центрифугируют при 23000-g в течение 20 мин в роторе SW27, После удаления лйпид- ного слоя Надосадочную жидкость сливают и обрабатывают Тритоном Х-100 до конечной концентрации 0,5%-в тече - кие 10 мин. Наслаивают на 1 М сахарозу, приготовленную на буфере для гомогенизации, и центрифугировали при 105000 g а течение 5,5 ч в рото- ре SW 50,1, Осадок суспендировали в .буфере, содержащем 50 t Трис, рН 7,4 250 мМ NaCl, 5 мМ MgCl, 1 wM МЭТ, После удаления агрегатов центрифугированием 50-75 AJJP ед, жбосом наносят на градиент концентрации сахарозы 15-30%, приготовленный на буфере для суспендирования, и центрифугируют при 100000«g в течение 195, мин в роторе SW27, Градиенты фракционирумт по 1,3 мл и после измерения Alt во фракциях отбирают пиковые фракции монорибосом, разбавляют буфером для суспендирования с
20 мМ NaCl вместо 250 мМ NaCl в два раза. Разбавленные фракции заморажи- . вают при -75°С до иммунизации. Иммунизация кроликов. 1 мг рибосом смешивают с равным объемом полного адью- ванта Фрейнда и несколько, раз пропус- кают через иглу птрица. Препарат ю вводят в объеме 0,5-1 мл внутримьппеч- но в оба бедра и под обе лопатки. Инъекции антигена повторяют еженедельно в течение I мес. без адьюван- та в те же точки. Через 1 нед. после 15 последней инъекции берут кровь краевой вены уха и определяют наличие антител по двойной иммунодиффузии по Ухтерлони. После месячного перерыва цикл повторяют с 0,5 мг рибосом. За 20 неделю перед каждым взятием крови проводят подстегивающие инъекции антигена.
Приготовление иммуносорбента. Протеин А-сефарозу CL-4B (Фарма- 25 ция Швеция) замачивают и отмывают согласно инструкции фирмы, затем промывают бу(Ьером, содержащим 20 мМ К- Na-фосфат, рН 7,6, NaCl 2,5 мл протеин А-сефарозы насыщают ЗО IgG, выделенным из иммунной сыворотки по A.Novotny-Basis Exercises in Inununochemistry. A batooratory Manual. Berlin Heidelberg New Jerk, 1979, p. 1-19 либо к зтому количеству про- ,. теин А-сефарозы добавляют 4 мл иммунной сыворотки. В обоих случаях инкубацию антител с носителем проводят j в течение 30-60 мин в колонке из по- липропипена (наконечник С 6000, 6 « дО
к1,25 см, Пипетман фирмы Жилсон) с фильтром из распущенного мираклоза на дне« Для удаления несвязавшихся белков колонку промывают вьщте приведенным буфером (фосфатным) до тех 45 пор, пока поглощение элюата прн 280 нм не снизится до постоянного уровня. Затем колонку промывают буфером, содержащим 20 мМ ТЭА, рН 7,6, 25 1 КС1, 5 мМ MgCl, 1 кМ МЭТ. JQ
Процедура иммуноаффинной хроматографии.
Из разбавленной в 10 раз реакционной смеси общим объемом .300 мкл (ме- ченый препарат цитоплазматических рн -в бонуклеопротеидов) берут аликвоту в 20 мкл и фиксируют формальдегидом до конечной концентрации 4% в течение 24 ч для анализа в градиенте плотности CsCl, а также две аликвоты 5 и 10 мкл для измерения радиоактивности Оставщуюся часть, доводят до объема J,5 мл ТЭА -: буфером, которым прорывают колонку. Буфер из колонки отсос вают и вносят 1,5 мл препарата (5 Ajfo ёд., 2-5 Ю имп./мин). Инкубация продолжается в течение 30-60 мин при . 3атем отсасывают фракции элюата по 1,5 мп до снижения радиоактивности до постоянного уровня (для измерения радиоактивности берут аликвоты из каждой фракции злюата),. добавляя после отсасывания столько же ТЭА-буфера. Таким образом отделяют свободные информосомы. Фракцни элюатов со свободными информосомами фиксируют 4%-нын формальдегидом дпя анализа в градиенте плотности CsCl. Для получения полирибосомных инфор- мосом, из колонки отсасывали предыдущий буфер и вносили столько же буфера, содержащего 90 мМ К, Na-фосфа- та, 0,5 t MgClg, 1 мМ KCl, рН 7,6. Связанные с иммуносорбентом полирибосомы инкубируют с этим же буфером в течение 30-60 мин при (твердофазная диссоциация). Элюцию фосфат- ньм.буфером, проводят путем отсасывания, как описано выше . Для анализа в градиенте плотности CsCl порции фосфатного элюата обязательно диали- зуют против буфера, содержащего 20 мМ ТЭА, рН 7,6, 26 мМ КС1, 5 мМ MgCl, ь МЭТ и 4% формальдегида, (перёд диализом во фракции фосфатного элюата добавляют формальдегид до конечной концентрации 4%).
Полученные результаты идентичны результатам, полученным на зародышах пшениф (см. пример 2).
Пример2. Фракцию IgG кроличьих антител или антисьгаоротку к рибосомам зародылей пщению т инкубируют с протеин А - Сефарозой С1-4В (Фармация, Швеция) согласно инструкции фир мы4 Дпя элюции свободных информосом колонку.с иммуносорбентом промывают буфером, содержащим 20 нИ триэтанол- амииа, рН 7,6, 25 KCl, 5 MgCl и 5 htff 2-меркаптоэтанола. В том же буфере в колонку с иммуносорбентом вносят 10 Ajjjопт, ед, препарата цитоплазматических рибонуклеопротеидов из прораставвтх в течение 12 ч и меченых 5- н-уридином зародышей пшени- ф Такое количество рибонуклеопроте- ццов достаточно дпя создания иеобхо514
димого избытка с 2,5 мл иммуносор- бента при титре антисыворотки более 500 определенному с помощью двойной иммунодифузии по Ухтерлони, Инкубацию рибонуклеопротеидов с иммуносор- бентом проводят при в течение . I ч при периодическом помешивании. Затем отсасывают порции по 1-2 мл до снижения радиоактивности до постоянного уровня, добавляя при этом в колонку столько же этого буфера, Дпя получения полирибосомных информосом колонку с иммуносорбентом затем переводят в 90 Ndl К, Na-фосфатный буфер, рН 7,6, при соотношении I мл фосфатного буфера на 1 мл влажного иммуно- сорбентв; так, чтобы диссоциировать полирибосомы в течение 0,5-1,0 ч, Элюцию полирибосомных информосом проводят фосфатным буфером также,как описано выше, до снижения радиоактивности до постоянного уровня, Дпя анализа в градиенте плотности CsCl порции элюата диализуют против три- этаноламинового буфера, В качестве твердого носителя испрльзутот протеин - А - Сефарозу С1-4В (Фармация, Швеция).
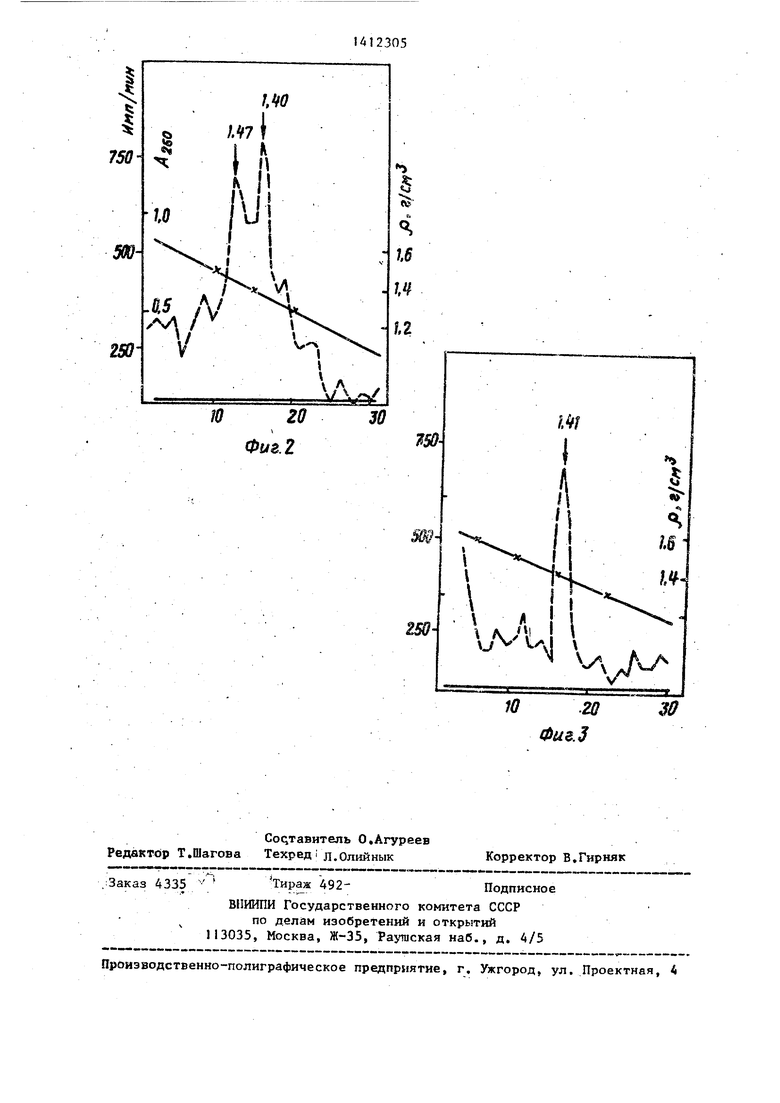
Главной характеристикой цитоплаз- матических информосом является значение их плавучей плотности в гради- )енте CsCl, равное I,40-1,47 г/см, Фиг, 1 дает представление о характере злюции свободных (а) и полирибосомных (б) ин4юрмосом (на этой и последующих фиг, прерывистая линия - радиоактивность, имп,/мин; сплошная - поглощение при 260 нм (А., ), линия, прерывающаяся крестиками - плотность (f), г/см , по оси абс56
цисс - порции элюата, мл, или фракции градиента плотности CsCl. Видно, что основная масса свободйьпс инфор- мосом (фиг, 2) элюируется в первых трех порциях, затем их количество снижается до постоянного уровня. Если в это время провести твердофазную диссоциацию полирибосом, то величина
радиоактивности снова повьппается почти до первоначального уровня что свидетельствует об освобождении из полирибосом каких-то РНК-связывающих структур. Анализ в градиенте плотности -CsCl этих структур показывает, что они являются информосомами (фиг,3). Как видно из фиг, 2 и 3, информосомы не загрязнены рибосомным материалом, обнаруживающимся по по глощению при
нм в зоне плотностей ,52- 1,36 г/см5.
Формула изобретения
Способ отделения полирибосомных информосом от свободных путем аффинной хроматографии, включающий диссоциацию полирибосом, инкубацию в буферном растворе и элюцию целевых про- дуктов, отличающи)Чся тем, что, с целью повышения чистоты целевых продуктов, перед диссоциацией, проводят инкубацию с иммуносорбентом ДПЯ рибосом до полного связывания риб9сомного материала, затем отделяют свободные информосомы из жидкой фазы, проводят твердофазную диссоциацию связанных полирибосом смесью 90 мМ K-Na-фосфатного буфера с 0,5 ьй хлорида магния и I мМ хлорида калия, рН 7,6 при ,


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения большого фрагмента ДНК-полимеразы I ЕSснеRIснIа coLI - фрагмента Кленова | 1988 |
|
SU1541256A1 |
| СПОСОБ ПОЛУЧЕНИЯ СЕЛЕКТИВНОГО ИММУНОСОРБЕНТА ДЛЯ УДАЛЕНИЯ АНТИТЕЛ-IgG К ДЕСМОГЛЕИНУ 3 ТИПА ИЗ СЫВОРОТКИ КРОВИ БОЛЬНЫХ ПУЗЫРЧАТКОЙ | 2015 |
|
RU2622005C2 |
| Способ получения ДНК-полимеразы 1 ЕSснеRIснIа coLI | 1988 |
|
SU1622393A1 |
| ХРОМАТОГРАФИЧЕСКИЙ СПОСОБ ВЫДЕЛЕНИЯ АЛЬФА-ФЕТОПРОТЕИНА | 1996 |
|
RU2094078C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭСТРОГЕНСВЯЗЫВАЮЩЕГО БЕЛКА, АССОЦИИРОВАННОГО СО ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ | 2012 |
|
RU2489440C1 |
| Способ получения рибонуклеазы Н из ЕSснеRIснIасоLI | 1987 |
|
SU1495377A1 |
| Способ конструирования плазмидной ДНК,штамм @ @ -продуцент эндонуклеазы рестрикции @ и способ получения эндонуклеазы рестрикции @ | 1981 |
|
SU1040791A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛАКТАТДЕГИДРОГЕНАЗЫ | 2001 |
|
RU2180688C1 |
| Способ получения аденовирусных антигенов | 1986 |
|
SU1364342A1 |
| СПОСОБ ВЫДЕЛЕНИЯ ФРАКЦИЙ ГЕТЕРОГЕННЫХ АНТИГЕНОВ, СХОДНЫХ МЕЖДУ АНТИГЕНАМИ МИКРООРГАНИЗМОВ РОДА BRUCELLA И ПАРЕНХИМАТОЗНЫМИ ТКАНЯМИ ЧЕЛОВЕКА | 2001 |
|
RU2215295C2 |

Изобретение относится к молеку- лярно& биологии, биохимии и предназначено для изучения регуляции биосинтеза белка в клетках зукариотичесхих организмов. Цель изобретения - повышение чистоты целевых продуктов. Для . этого проводят диссоциацию полир1|бО сом известными агентами. Препарат ци- топлазматических рибонуклеопротеидов инкубируюткС твердым иммуносорбентом. Жидкую фазу со свободными информосомами отделяют от твердой колоночной хроматографией или центрифугированием, затем проводят твердофазную диссоциацию полирибосом известными агентами. Необходим избыток твь-рдого им- муносорбента для связывания,. Источники цитоплазматических информосом (клетки, ткани, органы) инкубируют с радиоактивнь1м предшественником информосом 20-30 мин. 3 шт. с S
Л
Х
Ч
/ Фиа.1 5
Ю
Фив.З
30
| Спирин А.С., Гаврипова Л.П.Ри- босома, М.; 1971, с | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
Авторы
Даты
1990-12-15—Публикация
1986-03-11—Подача