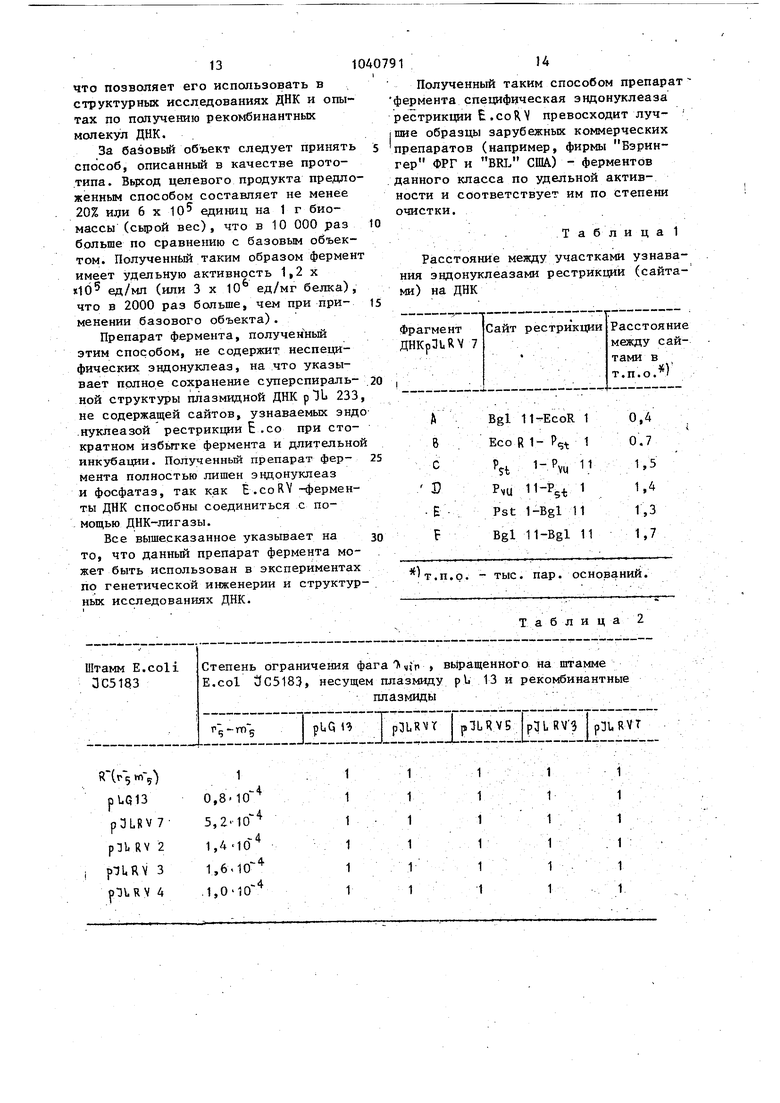
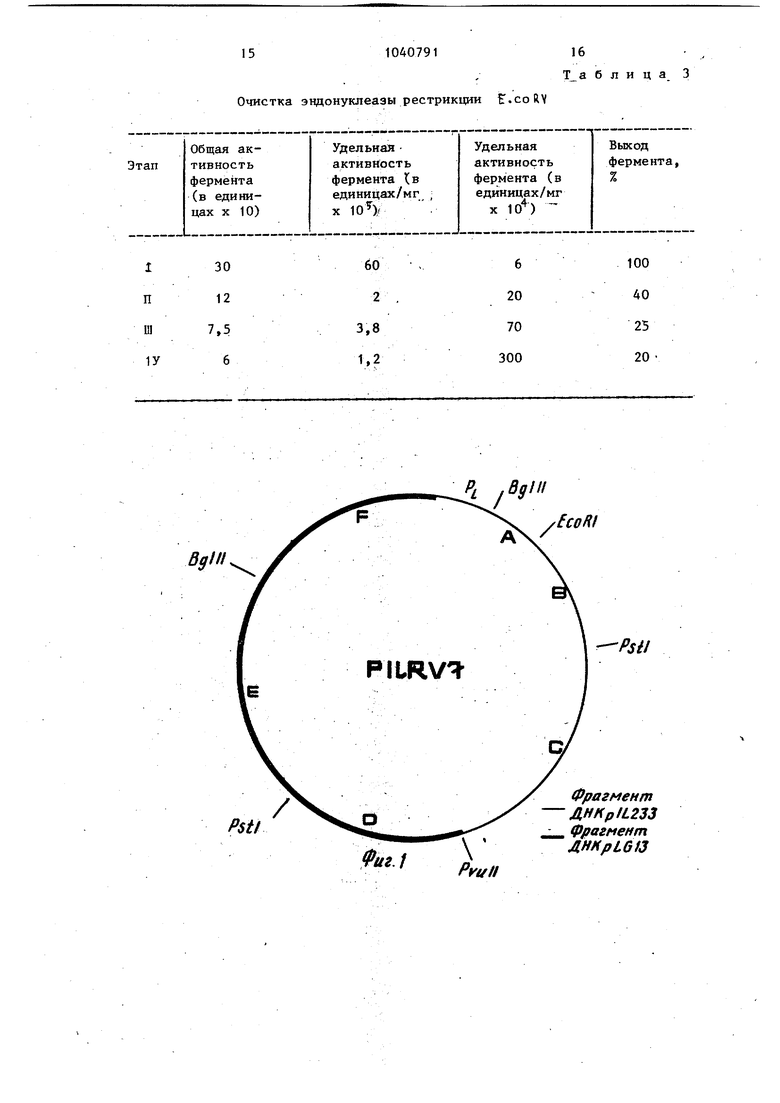
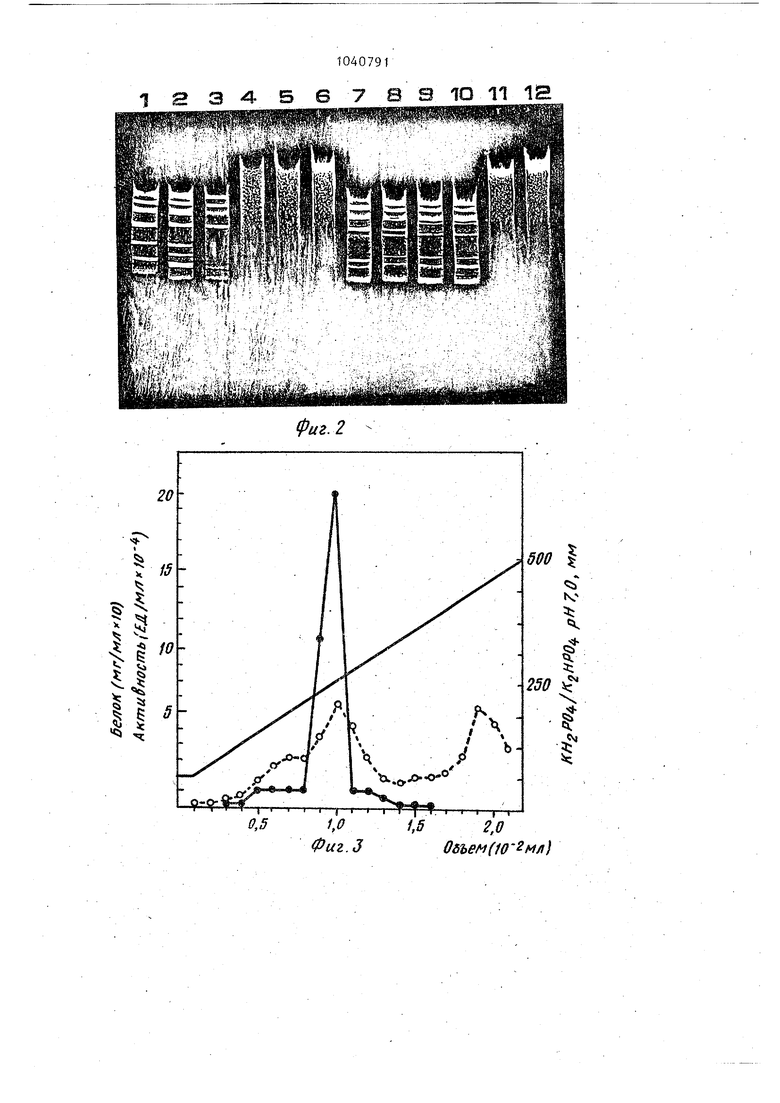
1 Изобретение относится к микробио логической промышленности и генетической инженерии. Фермент E.coR V используют в генетической инженерии в эксперимен тах по конструированию рекомбинантных ДНК. Известен способ конст й рования рекомбинантной плазмидной ДНК,который основан на клонировании фрагмен тов ДНК с полностью спаренными концами при помощи векторарЗЬ 233,обес печивающего прямую селекцию рекомбинантов. и сверхсинтез ферментов lj Известна плазмидная ДНК, кодирую щая синтез эндонуклеазы рестрикции ECoRV известен соответствующий штамм Е. coli - продуцент {, соRV и способ получения указанного фермента 2 . Способ получения фермента Е.соRV включает вьфащивание штамма - проду цента, разрушение клеток, осаждение клеточных обломков и последующую хроматографию полученного раствора фермента. Однако в известной плазмидной ДНК pLQ 13 с размером 4,7 Mg не обнаружено дополнительных генетит ческих маркеров. Уровень синтеза эндонуклеазы рестрикции Е- со R V относительно невысок и равен - 50 х X Ю единиц на грамм сырого веса биомассы клеток. Целью изобретения является получение рекомбинантной плазмидной ДНК ,RY7, кодирующей эндонуклеазу. рестрикции Е.со. RV, содержащей ген системы рестрикции и модификации Е.со 1 V, которые находятся под конт ролем промотора фага-/ Р . Цель изобретения - получение шта ма - продуцента t, со R V , увеличе ние выхода целевого продукта (ферме та Е, с 5 ft V и повьштение степени его очистки).- . Для достижения цели в способе конструирования плазмидной ДНК, вкл чающем обработку двух плазмид эндонуклеазами рестрикции, соединение фрагментов плазмид с помощью ДНК-ли газы фага Т-4, трансформацию клеток E.coli смесью полученных фрагментов плазмид, отбор среди трансФормантов, устойчивых к ампициллину клоно Iобеспечивающих рестрикцию и модифик ;цию фага с последующим вьщелением |соответст.вующей плазмидной ДНК в ка 91 честве плазмид используют плазмиды рЗЦ 233 и р L С| 13 и соединяют фрагм менты плазмид в условиях торцовой сшивки. . Для получения штамма - продуцента используют штамм Escherichia coli ВКМ В-1450 D (Всесоюзная Коллекция Микроорганизмов при Институте биохимии и физиологии микроорганизмов АН СССР) - продуцент эндонуклеазы рестрикции Е.соК . Для достижения цели в способе получения эндонуклеазы рестрикции Е.со R V , включающем выраш вание штамма - продуцента, разрушение клеток, осаждение клеточных обломков и последующую хроматографию полученного раствора в качестве штамма - продуцента используют штамм Е. coli ВКМ В-1450 D, в.ыращивание проводят до середины логарифмической фазы роста, а после осаждения клеточных обломков проводят фракционирование раствора фермента на фосфоцеллюлозе с последующей хроматографией на гидросилапатите. Пример 1. Рекомбинатная плазмидная ДНК pILR VT с размером 7 т.п.о.(схема плазмидной ДНК рЧЬКУ представлена на фиг. 1) содержит гены системы рестрикции и модификации E-coRV , которые находятся под контролем промотора фага лямбда 7i pi и состоит из Bgl H-PV-U 11-фрагмента ДНК pDLHV 7, содержащего сайты рестрикции Bgl 11,E.coR 1, Р,;. 1, расстояние между которыми 0,4; 0,7 и 1,5 т.п.о. (фиг. 1, табл. 1). 11-Bgl 11-фрагмента ДНК плазмиды pbQ 13, содерждщего сайты рестрикции PVU 11, P( Bgl 11 расстояние между которыми соответственно равно 1,4; 1,3 т.п.о. (фиг. 1, табл. 1); Bgl 11-фрагмента, состоящего из Bgl 11-Hpa1 фрагмента ДНК plU 233 с промотором pij и Bgl 11 - Ру(л 11 фрагмента ДНК плазмиды рЬС, 13 (фиг.1, табл. 1). Ыа-ген, ответственный за синтез 8-лактамазы, гены системы рестрикции и модификации Е,сой и репликом.плазмиды pBR 322. Сущность способа конструирования указанной плазмиды состоит в 1ТОМ, что ДНК плазмиды р Д 233 одновременно расщепляют эндонуклеазами рестрикции Hpal и Руц 11 смешивают с Р. 11 фрагментами р IR 13 и соед VU няют ДНК-лигазой фага Т-4 в условия торцовой сшивки. Полученной смесь трансформируют клетки B.coli и отбирают клоны на селективной агаризо ванной среде с ампициллином, среди полученных трансформантов по устойчивости к ампициллину отбирают клон обеспечивающие рестрикцию и модификацию фага. , из полученных клоно вьщеля.ют иско1 1е рекомбинатные плаз миды.. -Штамм - продуцент эндонуклеазы рестрикции E.coRV , полученный трансформаи;ией штазмиды p3UR V 7 в штамм E.coli 1JC 5183, обеспечивает синтез эндонуклеазы рестрикции Е. со R V в количестве не менее 2 х 10 единиц на грамм сьфого веса клеток. Штамм Escherichia coli ТС 5183, содержа Щ1й плазмиду plJLRV 7, депонирован в Всесоюзной Коллекции Микроорганиз мов при ИБФМ АН СССР под номером ВКМ В-1450 Д. Штамм E.coli JC5183, содержащий плазмиду рTLRV 7, характеризуется следующими признаками. Морфологические признаки. Клетки прямые, палочковидной формы, 1,2 - 1,6 X 2,0 X 6,0 мкм, подвижные, с перитрихиальными жгутиками, грамм-отрицательные, неспороносные. Культуральные признаки. Хорошо растут на простых питательных средах. При росте на мясо-пептонном агаре, питательном агаре Дифко колонии гладкие, круглые, прижаты, блестящие, серы, край ровньм, мутные. При росте в жидких средах: мя сопептонном бульоне, LB -бульоне образуют ровную интенсивную муть. Физиолого-биохимические признаки. Растут в пределах от 4 до 45 С при оптимуме рН от 6,8 до 7,5. В ка честве источника углерода используют многие углеводы, спирты, органические кислоты, в частности oi -глю- козу, оС -фруктозу, галактозу, араби нозу, лактозу, трегалозу. Не .усваивают ацетат, аданит. В качестве неточника азота используют как минеральные соли в аммонийной и нитратной форме, так и в органической фор ме в виде пептона, аминокислот. Нит раты восстанавливают до нитритов. Желатину не разживают. Уреазная акт ность не обнаруживается. Индол не образуют. Устойчивость к антибиотикам.Проявляют устойчивость к ампициллину. Предлагаемый способ получения специфической эндонуклеазы Е, со RV включает в себя выращивание биомассы клеток штамма-пррдуцента, содержащего плазмиду ft V 7, в жидкой питательной среде до середины логарифмической стадии роста, разрущение клеток ультразвуком, осаждение клеточных обломков центрифугированием, фракционирование на фосфоц€ ллюлозе, используя ступенчатое повьшение ионной силы буферного раствора с после.дун)щей очисткой активных фракций фермента на гидроксилапатите. Пример 2. При конструировании рекомбинатной плазмиды 91ЬR 7 донором служила ДНК плазмиды р LQ 13, а реципиентом - ДНК плазмиды 233. Для вьщеления плазмидной ДНК p.Gi13 штамм 3 С5183, содержащий плазМИДУ, подрап1ивают до титра 5-10 кл/мг в 1,2 л среды В (Среда LB содерлшт 10 г бактотриптона, 5 г дрожжевого экстракта и 10 г NaCl, рЕ 7,4 на 1 л в оды) . I Клетки осаждают центрифугирова- . нием при 6000 g, 4°С и ресуспендиру- . ют в 40 МП 25%-ной сахарозы в 0,05 М трис-НС1 буфере, рН 8,0. Лизис проводят при 0°С. Дпя этого, к суспензии добавляют 4 мл раствора лизоцима (5 мг/мп), через 10 мин - 16 .мл раствора ЭДТА, рН 8,0 и через 5 мин, осторожно перемешивая, смесь 5 М раствора NaCl до конечной концентрации 1М с 10%-ного раствора додецилсульфата натрия до конечной концентрации Т%-ной. Полученный таким образом лизат инкубируют при +4°С 12 ч. Лизат осветляют центрифугированием при 22500 g (+2С, 60 мин). ДНК концентрируют добавлением 50%-ного раствора полиэтнпенгликоля 6000 до конечной концентрации 10%-ной и 5 М раствора цо конечной концентрации М, смесь задерживают 6 ч при +4°С. Образовавшийся осадок собирают центрифугированием при 2000 g, 4°С (5 мин) и ресуспендируют при 4°С в 16 мл ТЭН-буфера (30 мМ трис-НС1, рН 8,0, 2,5 мМ ЗДТА, 50 мМ NaCl). Препарат экстрагируют один раз хлороформом. Фазы разделяют центрифугированием при 9000 g, 4°С5 10 мин. Верхнюю фазу, содержащую ДНК, диали зуют в течение 16 ч против ТЭН-буфе ра, при трехкратной смене буфера (+4°С) . К раствору добавляют бромид этидия до конечной концентрации 300 мкг/мл и CsCl плотности 1,3925, после чего препарат центрифугируют при 96000 g 40 ч (+15°С). Отбирают зону, содержащую плазмидную ДНК, шприцем, проколом пробирки сбоку. Полученный препарат экстрагируют из амиловым спиртом до полного удаления этидия, после чего диализуют пр +4°С против ТЭ-буфера. Затем ДНК экстрагируют фенолом, насыщенным 50 мМ трис-НС1, рН 8,0. От фенола избавляются экстракцией равными объемами эфира 5 раз. На завершающем этапе ДНК концентрируют добавлением трех объемов охлажденного 96%-ного этанола при -20°С. После 6 ч при -20°С осадок собирают центрифугированием при 6000 (-10°С, 15 мин.), высушивают в 500 мкп ТЭ-буфера. Для вьщеления плазмидной ДНК 233 клетки с плазмидой вьфащивают в 500 мл бульона L, В . Клетки собирают центрифугированием при 6000 g 15 мин +4°С. Осадок суспендируют в 4 МП 25%-ной сахарозы в 50 мМ трис-НС1 рН 8,0. Начиная с . этого этапа, все последующие операции проводят на холоду (0°С). К суспензии клеток добавляют 1,2 мп л зоцима (5 мг/мл), через 10 мин в инкубационную смесъ вносят 2,6 мл 0,25 М ЭДТА, рН 8,0. Полученньш лизат центрифугируют 1 ч при 48000 +3°С. К суперната-«ту добавляют бро,МИД этидия до конечной концентрации 300 мкг/мл. CsCl до плотности 1,3925 и центрифугируют при 96000 g 40 ч. +15°С. Отбирают зону, содержащую плазмидную ДНК шприцем, проколом пробирки сбоку. Бромид этидия удаляют экстракцией изоамиловым спиртом. Раствор ДНК диализуют 24 ч против ТЭ буфера при четырех сменах буфера. Полученные препараты ДНК плазмид pLCt 13 и , 233 используют д.пя кон струирования рекомбинантной pHRV 7 ДНКрЫ513 (3 мкг) инкубируют с эндо нуклеазой рестрикции Ру, 11 в буфер А: 20 мМ трис-НС рН 7,6, 10 мМ дитиоэритритола, а ДНК ppu 233 (1 мкг с эндонуклеазой рестрикции Hpal и руц 11 - в буфере В: 50 мМ трис-Н,С1, jpH 7,6, 50 мМ КС1, 10 мМ MgClj. Гидролиз проводят 1 ч при 37°С, после чего гидролизаторы прогревают до 65°С 10 мин. Полноту гидролиза npo-v веряют электрофорезом в 0,9%-ном агарозе в ацетатном буфере. В дальнейшем ДНК pLQ 13 (2 мкг) смешивают с ДНК pJl, 233 (0,2 мкг) и осаждают тремя объемами 96%-ного этанола 1 -20°С, 4 ч) . Осадок собирают центрифугированием при 10 000 g, 4 мин, высушивают и растворяют в 5 мкл буфера С: 50 мМ трис-nCl, рН 7,4, 50 мМ, 10 мМ Mg. Добавляют дитиоэритритол и АТФ до конечной концентрации 10 мМ и 100 мкМ соответственно и 5 мкл лигазы для торцовой ошивки. Общий объем лигируемой смеси - 12 мкл. Лигирование проводят при комнатной температуре (18-22°С), 36 ч. Через двенадцатичасовые интервалы отбирают аликвоту. (2 мкл), разводят до 50 мкл дистиллированной водой и трансформируют Са 2-клетки Е. coli. Получение компетентных клеток и трансформацию проводят по Cohen S.N., А.С.V.Chang (1972. PNAS, USA, 69: 2liO-21l4). Трансконъюганты высевают на селек-. тивную среду с ампициллином . (30 мкг/мл). Выросшие клоны тестируют на наличие плазм1щной ДНК с ожидаемым молекулярным весом (5MD) методом Т.ЕС. kchard (1978, Plasmid, 1, 548-558). Для анализа физической структуры плазмидную ДНК вьщеляют ускоренным методом (Klein P.L. etal, 1980, Plasmid, 8, 88-93). Рестрикционный анализ проводят с помощью эндонуклеаз Pg.-1, Bg 1 11, PVI, 11. Отобранные. клоны проверяют на присутствие системы рестрикциимодификации EcoRV. Для этого сравнивают эффективность посева (э.п.) фага , О на клетках, содержащих рекомбинантные плазмиды, а также штаммах iC 5183 ( и 105183 ( Р Wt ) с плазмидой pLQ 13. Наличие в клетках модификации устанавливают при снижении э.п. методом (Т. Arai, A.Aoici, J.Bact. 5, IE, 1962) . Полученные данные представлены в табл. 2. Как видно из табл. 2, щтамм 3C5183/pLQ13 на четыре порядка ограничивает размножение фага по сравнению со штаммом С5183 ( V 5 ) несущем плазмиду pL 13, Наиболее высоким уровнем огра ничения обладает штамм ОС5183/ (в 5 раз более высоким по сравнению со штаммом JC5183/pbQ 13). Фаги, выращенные на клонах с реком.бинантными плазмидами, дают одинаковьй титр на штаммах ОС5183 иЗС 5183 /pLG13. Таким образом, рекомбинантная плазмида p.3L R V 7 содержит гены системы рестрикции-модификации Есо Я Y ген беталактамазы, определяющей резистентность к ампициллину а также,как показано на фиг. 1, мощный промотор фага . Плазмид состоит из Нра1-Ру -11 фраг мента плазмидыр и 233 с размером 2300 пар оснований и Р,,у -1 1 фрагмента плазмвды plQ 13 с размером в 3700 пар оснований. Общий размер плазмиды - 7 000 пар оснований, В ДНК плазмиды рТLRV7 имеется два сайта эвдонуклеазы Р, 1, два сайта эндонуклеазы В gl 11 и по одному . сайту эндонуклеаз 11 и E.coRI Расстояние между сайтами даны в табл. 1 . Фаговьй промотор распо ложен на Bgl 11-Bgl 11 фрагменте плазмиды p1bRV7 и удален на 300 пар оснований от начала фрагмента 11 плазмиды pJQ 13. Следовательно, фаговый промотор ) максимально приближен к генам системы рестрикциимодификации E. и обеспечивает их .активность. Репликация плазмиды fiJURV 7 осуществляется за счет реп- ликона плазмидырBR 322. ПримерЗ. Для получения штамм-продуцента эндонуклеазы рестрикции Е, coR V рекомбинатную плазмид ную ДНК pHRV-7 трансформируют в штамм Е. coli С5183. Фенотип штам ма 3C5l83-ExoV Erdo 1-Ехо V Ш (Молекулярная биология, т.1, ч.II с. 77, 1980), что позволяет его использовать в качестве хозяина, обла дающего минимальным уровнем примесных ферментативных активностей. Клетки штамма ЗС5183 подращивают до титра 2-3 10 мкл/мп, после чего осаждают при 6000 g 15 мин, . Клетки суспендируют в равном , объеме О, Шхлористаго кальция и вьщерживают при ОС 1 ч, после чего повторно осаждают при 6000 g, и ресуспендируют в 1 мп О, Ш 91В хлористого кальция. В ЬО мкл ДИК, полученной после пигазной обработки. Добавляют 10 мкл компетентных клеток. Смесь вьщерживают 20 мин при 0°С, затем 2 мин при и 10 мин при комнатной температуре, добавляют 1,3 МП среды 18 , инкубируют 2ч при 37°С с аэрацией. Суспензию высевают на чашки с ампициллином (30 мкг/мл).Трансформанты отбирают по методу, описанному в примере 1. Сконструированный штамм E.coli ;ЗС5183 с плазмидой pTUk V 7 к. штамм Е. coli ЗС5183 с плазмидой , рЬ013 проверяют на продукцию реет - .. риктазы Е. coi . Для этого обе культуры подращивают в 1 л среды LВ до титра 5 X 10 кпеток 1 мп. Клетки . осаждают центрифугированием при 6000 g 15 мин, после чего по 0,9 г сырого веса биомассы каждого штамма суспендируют в 6 мп буфера 50 мМ трис-HCl, рН 7,6, 0,2 М NaCl 3 мМ -, меркаптоэтанола 100 мкг/мл лизоцима и вьдёрживают 40 мин при 0°С. Клетки разрушают ультразвуком. Полученньй экстракт центрифугируют при 48000 g 2°С ч. Супернатант используют для определения активности фермента. С этой целью делают серийные разведения экстракта: 1/100, 1/500, 1/1000, 1/25.000, 1/50000 (сМ.фиг.2). По 1 мкл на каждого разведения инкубируют 1 ч при 37°С с 1 мкг ДНК фага 9i в 30 мкл инкубационной смеси с 50 мМ трис-НС1 рН 7,6, 50 мМ NaCl, 10 мМ MgClj, 6 мМ В-меркаптоэтанолом. Электрофореграмма продуктов гидрачиза представлена на фиг. 2. Как видно, уровень активности фермента эндонуклеазы рестрикции E.coRV в бесклеточном экстракте сконструированного штамма Е. coli ВКМ B-1450I) более чем в 5 раз вьппе уровня активности этого же фермента в штамме Е. coli 3C5183/pl,Q 13 и составляет в пересчете на 1 г сьтрого веса биомассы около 3 000 000 ед активности фермента E.coKV, Пример 4. Вьщеление специфической эндонуклеазы рестрикции Б.coli. Клетки Е. coli 05183, содержащие рекомбинантную плазмиду p:jLRV7, выращивают при , с обильной аэрацией до середины логарифмической стадии роста в среде U 8 . Выход биомассы составляет около 2 ч на литр среды. Биомассу клеток штамма-продзцента собирают центрифугированием при 6000 g 30 fин. Полученную биомассу клеток хранят, при -20°С. 10 граммов (по сырому весу биомас сы клеток суспендируют в 50 мп буфер ного раствора А: 50 мМ калий-фосфатного буфера, рН 7$О 1 мМ ЭДТА, 1 мМ NaN,j , 7 мМ В-меркаптоэтаиола, содержащего 400 мМ NaCl,добавляют лизоцим до конечной концентрации 100 М1сг/мл и инкубируют (0°С) 15 мин, Полученные после обработки бактериальных- клеток лизоцимом сферопласт разрушают ультразвуком на дезинтегра торе типа М Е 30 с х 20 раз с интервалом в 90 с. При разрушении температура суспензии не должна превышать +8°С. Кпеточньй дебрис убирают центрифугированием при 75000.в течение 90 мин +4°С, В полученном экстакте определяют активность фермента в разведении 1:10, IrlOOj 1:500 и 1:100. 1:10000 (разводят буферным раствором А до конечной концентрации NaCl 200 NsM) о Разведенньш экстракт наносят на колонку с фосфоцеллюлозой (2x25 см, V/hatman Р 11) , уравновешенную буфером А, содержащем 200 мМ NaCl. Колонну с фосфоцеллюлозой после нанесения экстракта клеток промывают 2-3 объемами колонки буфер 1ым раствором А, содержащим 200 мМ NaCl и фермент элюируют тремя порциями буфера А, содержащего 400 мМ, 600 мМ и 800 мМ NaCl. Активные фракции фермента элюируются в 1/3 объема фракции 400 мМ NaCl и 2/3 объема фракции 600 мМ NaCl. Активность фермента Е.со RV определяется в разведениях элюата в 1:10, 1:100 и 1:500 раз. Активные фракции фермента t.coRV объединяют вместе и разводят холодным (+4°С буферным раствором А без NaCl в два раза, и наносят на колонку (2x5 см) с гидроксиланатитом и элюируют фермент 200 мл линейного градиента концентрации калийфосфатного буфера рН 7,0 от 50 до 500 Mf-I (см. фиг. 3). Активность фермента E.coRV определяют во фракциях в разведении 1:10, 1:100, 1:200,. 1:500. 20 г/О элюата с гидроксилапати та, обеспечивающие полньй гидролиз 1 мкг ДНК фага 9 в разведении 1:200 диализованные при двухкратной смене через 4 ч против буферного растворз 9110 Б, содержащего 10 мМ калий-фосфатного буфера рН 7,0, 1 мМ ЭДТА, 1 тМ NaN..., , 2 мМ В-меркаптоэтанола окончательно концентрируют диализом против буферного раствора & , содержащего 50% (об/об) глицерина. После концентрирования фермента при диализе против 50%-ного глицерина, объем раствора фермента Е . составил Аэ8 мп с удельной актив ностью 1, 2х 10ед/мл (3 000 000 ед/мг белка). Это составляет 6 000 000 ёд или 20% от суммарной активности в неочищенном экстракте (см. табл. 3). За единицу активности специфической эндон5клеазы E.coRV принимают минимальное количество фермента, необходимого для полного расщепления 1 мкг ДНК фага в течение 1. ч при 37°С. Полученньй фермент E.coRV разводят буферным раствором, содержащим 10 мМ трис-HCl, рН 7,5, 1 мМ ЭДТА, мМ NaNjj lO мМ ДТТ, 200 мкг/мл 1 желатина и 50% (об/об) глицерина в 100, 500 и 1000 раз и определяют активность. Дпя этого к 3 пробам объемом по 30 мкл, содержащим 1 мкг ДНК фага f С,852, 50 мМ трис-HCl, рН 7,5, 50 мМ NaCl и 10 мМ MgCl, добавляют 1 мкл разведенного в 100, 500 и 1000 раз фермента соответственно, инкубируют 1 ч при 37°С и.5 мин при 65°С и охлаждают в ледяной бане. Полученные таким образом пробы ана- лизируют электрофорезом в пластинчатом 0,8%-ном агарозном геле (90 мМ трис-боратный буфер, рН 8,3). Пригодность полученного фермента для структурных иссх дований ДНК и опытов по конструирова.нию in vitro рекомбинантных молекул ДНК определяют следующим образом: а)инкубируют ДНК плазмиды рЗЪ233, не содержащей сайта расщепления эндо- нуклеазы E.coRV , с 10-кратным избытком фермента-в течение 2 ч, при последующем анализе электрофорезом не наблюдают перехода ковалентнозависимой суперскрученной формы плазмидной ДНК в релаксированную и линейную формы, что указывает на отсутствие примесей неспецифичес1шх эндонуклеаз в препарате фермента; б)пригодность препарата фермента E..coRVдля генно-инженерных работ определяют по способности воесоединения E.coRV фрагментов ДНК бактериофага лямбда с. помощью ДНК-ли газы бактериофага Т-4 с последующим электрофоретическим анализом продуктов реакции (см. фиг. 4).. Таким образом, предлагаемые объек ты позволяют получать высокоочищенньш препарат эндонуклеазы рестрикции E.coRV с высоким выходом. Предлагаемые изобретения позволяют получить штамм E.coli продуцент эндонуклеазы рестрикции E.cpRV,...ypoвень содержания фермента в предлага мом штамме Е . coli ВШ В 1450D не менее 3 х 10 единиц на 1 г сырого веса биомассы клеток, что в пятьраз превосходит по уровню синтеза исходной штамм 3 C5183/plCi 13 . Данные для сравнения приведены на фиг. 2. ; Рекомбинантная плазмида р 1 R Y 7 содержит маркер резистентности клето к ампициллину, что дает возможность стабильного культивирования клеток с рекомбинантной плазмидой. Схема очистки активного фермента эндонуклеазы E.coRV 1. НЕОЧИЩЕННЫЙ ЭКСТРАКТ 1 П. Фракционирование на фосфоцеллкшозе Р11 (0,4 М, 0,6 М, 0,8 М NaCl) Точки элюции фермента 0,4 и 0,6 М NaCl Ш. Хроматография на ГАП (0,05 М 0,5 М . . K-фосфатного буфера рН 7, Точка элюции фермента 0,23 М К фосфатного буфераfy. Концентрирование фермента (диализ против 50% глицерин Признак является особенно существенным при подготовке посевного материала для засева больших объемо в условиях промьшэтенного производст ва фермента, так как позволяет созранить популяцию клеток с системой модификации и рестрикции E.coRV . . Кроме того, наличие в плазмиде маркера резистентности к ампициллину открывает перспективы дальнейшего конструирования различных штаммов Е.coli с увеличенным синтезом конеч ного продукта и с пониженным содер жанием интерферируюищх ферментов. 9112 Предлагаемый способ конструирования рекфмбинантной плазми;;ной ДНК обеспечивает высокое содержание плазмиды в клетках за счет многокопийности вектора и приближенность мощного фагового промотора и генам, кодирующим синтез .рестриктазы и метилазы E.coRV , что в сумме увеличивает дозу гена и повышает эффективность транскрипции. В отличие от известных способов конструирования в предлагаемом изобретении в качестве вектора использовалась плазмида P:JL 233, которая позволяет прямую селекцию клонов с рекомбинантными плазмидами при интеграции чужеродных фрагментов с полностью спаренными концами. Применение данной системы клонирования обеспечивает введение чужеродных генов под контроль мощного промотора фага 1 р без дополнительного синтеза исскуственных липких концов, которые могут нарушать транскрипцию на границе вектор-чужеродный фрагнент. Штамм- E.coli ВКМ B-1450D как продуцент специфической эндонуклеазы Е,со обладает следующими преимуществами : а)повышенный синтез конечного продукта; б)пониженное содержание неспепдфических нуклеаз (например,t-соRV) , что позволяет существенно упростить способ очистки ферментаJ в)отсутствие ауксотрофных митаций Позволяет получать биомассу клеток на синтетических средах в резистентностью к ампициллину и обеспечивает стабильное культивирование штамма-продуцента. Перечисленные свойства данного штамма позволяют его использовать в качестве продуцента как в лабораторных условиях, так и на промышпенных установках, что особенно важно в связи с отсутствием этого фермента и его. изошизомеров в коммерческих каталогах изостранных фирм. Предлагаемый способ вьделения пецифической эндонуклеазы рестрикии E.coRV позволяет сократить вре- я получения фермента в 2-3 раза и величить выход конечного продукта в 10 000 раз по сравнению с базовым бъектом. Полученный таким образом репарат эндонуклеазы EoCoR-V не одержит интерферирующих активностей,
что позволяет его использовать в структурных исследованиях ДНК и опытах по получению рекомбинантных молекул ДНК.
За базовьй объект следует принять способ, описанньй в качестве прототипа. Вьрсод целевого продукта предложенным способом составляет не менее 20% ю}и 6 X 10 единиц на 1 г биомассы (сьфой вес), что в 10 000 раз больше по сравнению с базовым объектом. Полученный таким образом фермент имеет удельную активность 1,2 к xld ед/мл (или 3 X 10 ед/мг белка), что в 2000 раз больше, чем при применении базового объекта).
Препарат фермента, полученный этим способом, не содержит неспецифических эндонуклеаз, на что указывает полное сохранение суперспиральной структуры плазмидной ДНК рТЬ 233, не содержащей сайтов, узнаваемых эндо .нуклеазой рестрикции Е.со при стократном избытке фермента и длительной инкубации. Полученный препарат фермента полностью лишен эндонуклеаз и фосфатаз, так как E.coRV -ферменты ДНК способны соединиться с по- мощью ДНК-лигазы.
Все вышесказанное указывает на то, что данный препарат фермента может быть использован в экспериментах по генетической инженерии и структурных исследованиях ДНК. Штамм E.coli ЗС5133
рЬО Tp3LRVr I р1ЬЯУ5 |p3LRV3Tp:)U
Сгз )
1
r4 0,8. 10 pl.Q13
Г 4
5,2-10 p3LRV7 -4
1,4-10 pllRV 2
-4
1,6-10 pTURV 3
,-4 .1,040
31 RV 4
Полученный таким способом препарат фермента специфическая эндонуклеаза рестрикции Е.соRV превосходит луч(Шие образцы зарубежных коммерческих препаратов (например, фирмы Бэрингер ФРГ и ВШ. США) - ферментов данного класса по удельной активности и соответствует им по степени очистки.
Т а б л и ц а 1
Расстояние между участками узнавания эндонуклеазами рестрикции (сайтами) на ДНК
т.п.о. - тыс. пар. оснований.
Та б л и ц а 2
RVT Степень ограничения фага вь1ращенного на штамме E.col ЗС5183 несущем плазмиду рЬ 13 и рекомбинантные плазмиды
15
Очистка эвдонуклеаэы рестрикции .coRV
1040791
16
Таблица 3





| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАТНАЯ ПЛАЗМИДНАЯ ДНК PECO29KI, ОПРЕДЕЛЯЮЩАЯ СИНТЕЗ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ ECO29KI И ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ ECO29KI | 1992 |
|
RU2054037C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК ECO 1831KI, ОПРЕДЕЛЯЮЩАЯ СИНТЕЗ ЭНДОНУКЛЕАЗЫ РЕСТРИКАЦИИ ECO 1831KI, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ ECO 1831KI | 1992 |
|
RU2054042C1 |
| Способ конструирования рекомбинатной плазмидной ДНК и штамм продуцент эндонуклеазы рестрикции | 1982 |
|
SU1074139A1 |
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ CFRBI | 1992 |
|
RU2038382C1 |
| Рекомбинантная плазмидная ДНК pBG М3, определяющая синтез эндонуклеазы рестрикции С @ BI | 1988 |
|
SU1573026A1 |
| Рекомбинантная плазмидная ДНК @ ,способ конструирования плазмидной ДНК и штамм-продуцент эндонуклеазы рестрикции @ | 1983 |
|
SU1130602A1 |
| Рекомбинантная плазмидная ДНК @ 435,кодирующая синтез ДНК-лигазы фага Т 4.способ ее конструирования и штамм @ . @ ВКМ в-1449-продуцент ДНК-лигазыфага Т4 | 1981 |
|
SU1122003A1 |
| РЕКОМБИНАНТНЫЙ ШТАММ БАКТЕРИЙ Escherichia coli N41 (pBpuN4/MR)-ПРОДУЦЕНТ САЙТ-СПЕЦИФИЧЕСКОЙ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ BpuN4I | 2013 |
|
RU2529362C1 |
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ ECO27K1 | 1993 |
|
RU2044053C1 |
| Рекомбинантная плазмидная ДНК рСЕК 10,кодирующая синтез фрагмента Кленова ДНК-Полимеразы 1 Е.coLI,и способ ее конструирования | 1986 |
|
SU1392094A1 |


1. Способ конструирования плаз мидией ДНК, включающий обработку двух плазмид эндонуклеазами рестрикции, соединения фрагментов плазмид с помощью ДНК-лигазы фага Т-4, трансформацию клеток Escherichia coli смесью полученных фрагментов плазмид, отбор среди .трансформантов, устой- чивых к ашшциллину клонов, обеспечивающих рестрикцию и модификацию 71 с последующим .йьщеленнем ЙАТг: iq :ii iir:: Тея-;5р ::,;л, iiS.i{or; i A соответствующей плазмидной ДНК, о т л а ю щ и и с я тем, что, с .целью получения рекомбинатной.плазмид.ной ДHK,pjLR у 7, кодирующей эндпнуклеазу рестрикции E.coRV, содержащей гены системы рестрикции и модификации E.coRV, которые находятся под контролем промотора фага Ti Р , в качестве плазмнд используют плазмиды 1 233 ирЬС 13 и соединяют фрагменты плазмид в условиях торцовой сшивки. 2.Штамм Escherichia coli BKMB-1450D (Всесоюзная коллекция микроорганизмов при Институте биохимии и физиологии микроорганизмов АН СССР) - продуцент эндонуклеазы рестрикции E.coR V. 3.Способ получения эндонуклеазы рестрикции Ё.сoR,включающий выращивание штамма - продуцента, разрушеНия клеток, осаждение клеточных обломков и последующую хроматографию полученного раствора, отличаю41 О щийся .тем, что, с целью увеличения выхода целевого продукта и по.вьшения степени очистки в качестве штамма - продуцента используют штамм . E.coli BKMB-1450D выpaшJiвaниe проводят до середины логирифмической фазы роста, а после осаждения клеточ-. ньк обломков пров.одят фракционирование раствора фермента на фосфоГцеллюлозе с последующей хроматографией на г идроксил апатите.
РзИ 3ff/l/ EcoRI Psil Фрагмент - jB,NKplL233 . фрагиент AHKpL6f3
1 е 3 567
.2
чь
.
Фиг.З
S 1О 11 1Н
,
Объем (10 мл
ФигЛ
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Солонин А.С | |||
| и др | |||
| Всесоюзньй симпозиум Макромолекулы клетки, структура, функции, взаимодействия, Тезисы докладов, Москва, 1979, с | |||
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Glatman L | |||
| ,VII International colloqium on laboratory methods for epidemidlogical surveillance, p | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Приспособление для изготовления в грунте бетонных свай с употреблением обсадных труб | 1915 |
|
SU1981A1 |
Авторы
Даты
1985-02-07—Публикация
1981-07-30—Подача