Изобретение относится к химии полимеров, в частности к способам получения олигоэфиракрилатов (ОЭА), которые могут найти применение в качестве полимеризационноспособных соединений, в том числе в анаэробных герметизирующих составах, применяемых в различных областях машиностроения для фиксации и уплотнения резьбовых соединений.
Анаэробные композиции на основе олигоэфиракрилатов должны быть работоспособны при повышенных температурах (не менее 375оС), т.е. обладать повышенной термостабильностью.
Целью изобретения является способ получения новых олигоэфиракpилатов для создания анаэробных герметиков и повышение прочности отвержденных герметиков до и после прогрева при повышенных температурах (не ниже 375оС) с широким интервалом значений кинематической вязкости (3000-40000) ˙10-6 м2/с.
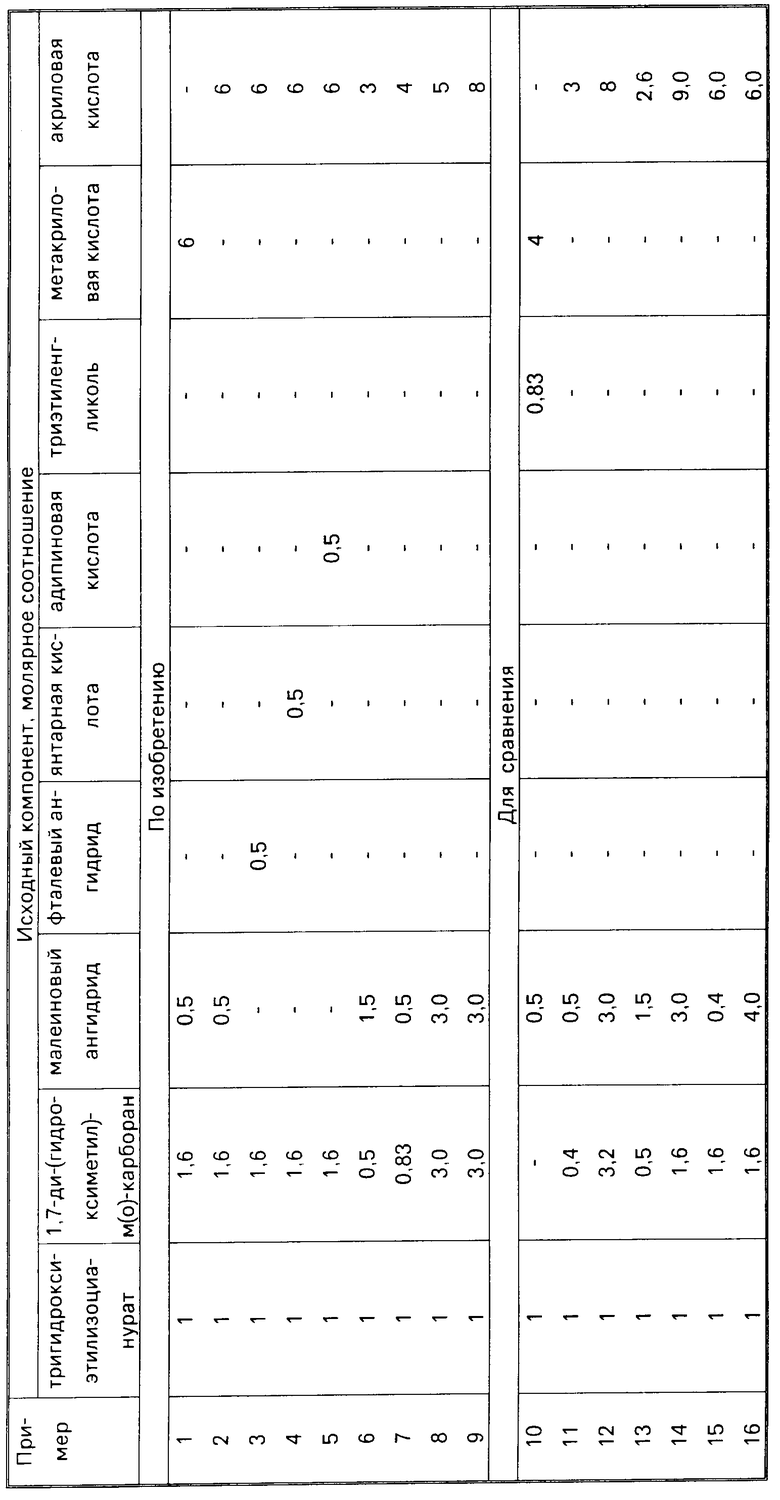
П р и м е р 1. В реактор, снабженный мешалкой, термометром, обратным холодильником и насадкой Дина Старка, загружают 26,1 г (0,1 моль) тригидроксиэти- лизоцианурата, 32,96 г (0,16 моль) 1,7-(дигидроксиметил)-м-карборана, 4,9 г (0,05 моль) малеинового ангидрида, 51,6 г (0,6 моль) метакриловой кислоты (молярное соотношение указанных компонентов соответственно 1:1,6:0,5; 6), 1,55 г (3% от количества метакриловой кислоты) гидрохинона, 4,6 г (4% от суммы реагентов) серной кислоты и 114 г (1,23 моль) толуола.
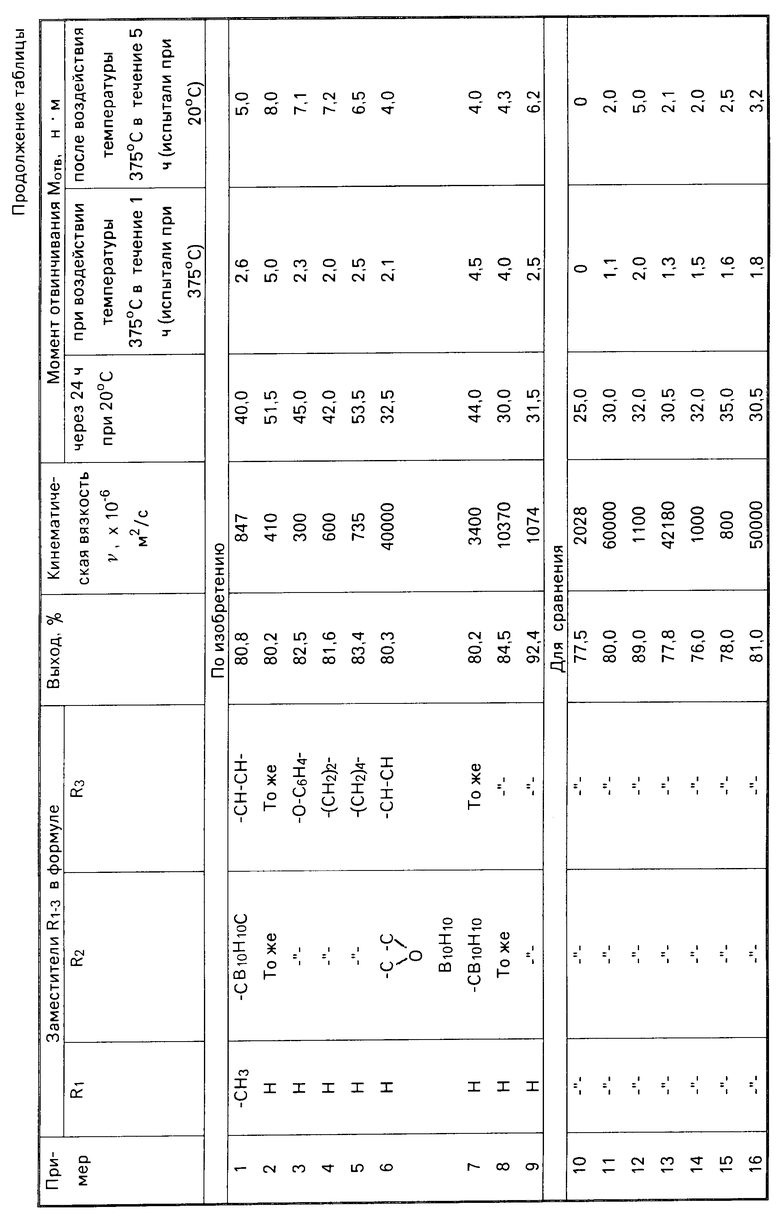
Реакционную смесь при постоянном перемешивании нагревают до кипения и отгоняют образующуюся воду в смеси с толуолом. Толуол возвращают в реакционную смесь, а воду замеряют. За 4 ч выделяется 11 мл воды (98,6% от теоретического). Реакционную смесь охлаждают, разбавляют 200 мл толуола и промывают 20%-ным водным раствором гидроксида натрия (3х70 мл) и водой (5х80 мл). После отгонки толуола в вакууме получают 78,85 г (80,8% от теоретического) светло-желтого продукта со следующими показателями: кинематическая вязкость ν= 847 ˙10-6 м2/с; nD20=1,5242; число омыления 517,2 мгКОН/г; бромное число 73,9 г Br/100 г; содержание гидроксильных групп 0,68% кислотное число 0,54 мг КОН/г; содержание гидрохинона 0,007% толуол отсутствует. Полученный ОЭА не кристаллизуется в течение 6 месяцев.
П р и м е р 2. ОЭА получают по примеру 1 из 26,1 г (0,1 моль) тригидроксиэтилизоцианурата, 32,96 г (0,16 моль) 1,7-ди-(гидроксиметил)-м-карборана, 4,9 г (0,05 моль) малеинового ангидрида и 43,2 г (0,6 моль) акриловой кислоты (молярное соотношение 1:1,6:0,5:6) в присутствии 4,29 г (4% от суммы реагентов) серной кислоты и 1,3 г (3% от акриловой кислоты) гидрохинона, в среде 120 г (1,3 моль) толуола. За 4 ч выделяется 11 мл (98,6% от теоретического) воды. Реакционную смесь охлаждают, разбавляют 200 мл толуола и промывают аналогично примеру 1. После отгонки толуола получают 72,36 г (80,2% от теоретического) красноватого продукта со следующими показателями: кинематическая вязкость ν=410˙10-6 м2/с; nD20=1,5263; число омыления 617,2 мг КОН/г; бромное число 81,4 г Br/100 г; кислотное число 0,9 мг КОН/г; содержание гидроксильных групп 0,63% содержание гидрохинона 0,004% толуол отсутствует. Полученный ОЭА не кристаллизуется в течение 6 месяцев.
П р и м е р 3. ОЭА получают по примеру 1 из 26,1 г (0,1 моль) тригидроксиэтилизоцианурата, 32,96 г (0,16 моль) 1,7-ди-(гидроксиметил)-м-карборана, 7,4 г (0,05 моль) фталевого ангидрида и 43,2 г (0,6 моль) акриловой кислоты (молярное соотношение 1:1,6:0,5:6) в присутствии 6,58 г (6% от суммы реагентов) n-толуолсульфокислоты, 1,3 г (3% от количества акриловой кислоты) нафтохинона, 0,003 г фенотиазина в среде 120 г (1,3 моль) толуола. За 5 ч выделяется 11,1 г (99% от теоретического) воды. Реакционную массу охлаждают, разбавляют 200 мл бензола и промывают, как в примере 1. После отгонки толуола получают 76,47 г (82,5% от теоретического) светло-желтого продукта со следующими показателями: кинематическая вязкость ν=300˙ 10-6 м2/с; nD20=1,529; число омыления 553,9 мг КОН/г; содержание гидроксильных групп 0,31% содержание нафтохинона 0,01% толуол отсутствует. Содержание фенотиазина 0,0038% бромное число 69,4% г Br/100 г; кислотное число 0,59 мг КОН/г. Полученный ОЭА не кристаллизуется в течение 6 месяцев.
П р и м е р 4. ОЭА получают по примеру 1 из 26,1 г (0,1 моль) тригидроксиэтилизоцианурата, 32,96 г (0,16 моль) 1,7-ди-(гидроксиметил)-м-карборана, 5,9 г (0,05 моль) янтарной кислоты и 43,2 г (0,6 моль) акриловой кислоты (молярное соотношение 1:1,6:0,5:6) в присутствии 4,32 г (4% от суммы реагентов) серной кислоты и 1,3 г (3% от количества акриловой кислоты) гидрохинона, 0,004 г фенотиазина в среде 120 г (1,3 моль) толуола. За 3,5 ч выделяется 11,1 г (99% от теоретического) воды. Реакционную массу охлаждают, разбавляют 200 мл толуола и промывают как в примере 1.
После отгонки толуола получают 74,46 г (81,6% от теоретического) светло-желтого продукта со следующими показателями: кинематическая вязкость ν= 600 ˙10-6 м2/с; nD20 1,5263; число омыления 596,4 мг КОН/г; бромное число 80,3 г Br/100 г; кислотное число 1,42 мг КОН/г; содержание гидроксильных групп 0,23% содержание гидрохинона 0,003% толуол отсутствует; содержание фенотиазина 0,0042% Полученный ОЭА не кристаллизуется в течение 6 месяцев.
П р и м е р 5. ОЭА получают по примеру 1 из 26,1 г (0,1 моль) тригидроксиэтилизоцианурата; 32,96 г (0,16 моль) 1,7-ди-(гидроксиметил)-м-карборана, 7,3 г (0,05 моль) адипиновой кислоты и 43,2 г (0,6 моль) акриловой кислоты (молярное соотношение 1:1,6:0,5:6) в присутствии 4,38 г (4% от суммы реагентов) серной кислоты и 1,3 г (3% от количества акриловой кислоты) бензохинона в среде 120 г (1,3 моль) толуола. За 2,5 ч выделяется 11,2 г (100% от теоретического) воды.
Реакционную массу охлаждают, разбавляют 200 мл толуола и промывают, как в примере 1. После отгонки толуола получают 77,27 г (83,4% от теоретического) красноватого продукта со следующими показателями: кинематическая вязкость ν= 735 ˙10-6 м2/с; nD20 1,5271; число омыления 615,1 мг КОН/г; бромное число 77,5 г Br/100 г; кислотное число 2,1 мг КОН/г; содержание гидроксильных групп 0,21% содержание бензохинона 0,008% Полученный ОЭА не кристаллизуется в течение 6 месяцев.
П р и м е р 6. ОЭА получают по примеру 1 из 39,15 г (0,15 моль) тригидроксиэтилизоцианурата, 15,45 г (0,075 моль) 1,2-ди-(гидроксиметил)-о-карборана, 22,05 г (0,225 моль) малеинового ангидрида и 32,4 г (0,45 моль) акриловой кислоты (молярное соотношение 1:0,5:1,5:3) в присутствии 4,39 г (4% от суммы реагентов) серной кислоты и 0,07 г (3% от количества акриловой кислоты) гидрохинона в среде 120 г (1,3 моль) толуола. За 4 ч выделяется 10,3 г (95,4% от теоретического) воды. Реакционную массу охлаждают; разбавляют 200 мл толуола и промывают, как в примере 1. После отгонки толуола получают 61,57 г (80,3% от теоретического) вязкого светло-желтого продукта со следующими показателями: кинематическая вязкость ν= 40000 ˙10-6 м2/с; nD20 1,528; число омыления 687,3 мг КОН/г; бромное число 66,6 г Br/100 г; кислотное число 4,8 мг КОН/г; содержание гидроксильных групп 0,15% содержание гидрохинона 0,02% толуол отсутствует. Полученный ОЭА не кристаллизуется в течение 6 месяцев.
П р и м е р 7. ОЭА получают по примеру 1 из 26,1 г (0,1 моль) тригидроксиэтилизоцианурата, 17,1 г (0,083 моль) 1,7-ди-(гидроксиметил)-м-карборана, 4,9 г (0,05 моль) малеинового ангидрида и 28,8 г (0,4 моль) акриловой кислоты (молярное соотношение 1:0,83:0,5:4) в присутствии 3,08 г (4% от суммы реагентов) серной кислоты и 0,86 г (3% от количества акриловой кислоты) гидрохинона в среде 120 г (1,3 моль) толуола. За 3,5 ч выделяется 8,3 г (92,2% от теоретического) воды.
Реакционную массу охлаждают, разбавляют 200 мл толуола и промывают, как в примере 1. После отгонки толуола получают 52,82 г (80,2% от теоретического) светло-желтого продукта со следующими показателями: кинематическая вязкость ν=3400˙ 10-6 м2/с; nD20 1,5272; число омыления 580,7 мг КОН/г; бромное число 81,8 Br/100 г; кислотное число 3,3 мг КОН/г; содержание гидрохинона 0,02% содержание гидроксильных групп 0,53% толуол отсутствует. Полученный ОЭА не кристаллизуется в течение 6 месяцев.
П р и м е р 8. ОЭА получают по примеру 1 из 13,05 г (0,05 моль) тригидроксиэтилизоцианурата, 30,9 г (0,15 моль) 1,7-ди-(гидроксиметил)-м-карборана, 14,6 г (0,15 моль) малеинового ангидрида и 18 г (0,25 моль) акриловой кислоты (молярное соотношение 1:3:3:5) в присутствии 4,59 г (6% от суммы реагентов) п-толуолсульфокислоты и 0,54 г (3% от АК) гидрохинона в среде 120 г (1,3 моль) толуола. За 4,5 ч выделяется 6,8 г (84% от теоретического) воды. Реакционную массу охлаждают, разбавляют 200 мл толуола и промывают, как в примере 1. После отгонки толуола получают 53,88 г (84,5% от теоретического) вязкого светло-желтого продукта со следующими показателями: кинематическая вязкость ν= 10370˙ 10-6 м2/с; nD20 1,5446; число омыления 683,2 мг КОН/г; бромное число 44,9 г Br/100 г; кислотное число 1,8 мг КОН/г; содержание гидроксильных групп 1,0% содержание гидрохинона 0,008% толуол отсутствует. Полученный ОЭА не кристаллизуется в течение 6 месяцев.
П р и м е р 9. ОЭА получают аналогично примеру 8, но акриловой кислоты берут 28,6 г (0,4 моль) при молярном соотношении 1:3:3:8 в присутствии 3,5 г (4% от суммы реагентов) серной кислоты и 0,86 г (3% от количества акриловой кислоты) гидрохинона в среде 120 г (1,3 моль) толуола. За 4 ч выделяется 7,6 г (92,6% от теоретического) воды. Реакционную смесь охлаждают, разбавляют 200 мл толуола, получают 56,67 г (92,4% от теоретического) светло-желтого продукта со следующими свойствами: кинематическая вязкость ν1074˙10-6 м2/с; nD20 1,5356; число омыления 673,6 мг КОН/г; бромное число 69,5 г Br/100 г; кислотное число 0,68 мг КОН/г; содержание гидроксильных групп 0,2% содержание гидрохинона 0,02% толуол отсутствует. ОЭА не кристаллизуется в течение 6 месяцев.
Приготовление и испытание анаэробных композиций. 100 г каждого из полученных по примерам 1-9 ОЭА смешивают в стеклянном стакане при комнатной температуре с 1,0 г гидропероксида кумила, 0,6 г диметил-п-толуидина, 0,7 г о-бензолсульфимида, 0,02 г 2,2,6,6-тетраметил-4-оксопиперидил-1-оксила и 0,02 г малахитового зеленого.
Полученные жидкие анаэробные композиции наносят на стальные резьбовые пары (болт-гайка М10 x1,5) и оставляют на 24 ч для отверждения при комнатной температуре.
В течение указанного времени происходит полимеризация анаэробного состава с образованием сшитого твердого полимера. Затем с помощью динамометрического ключа раскручивают резьбовые пары и определяют момент отвинчивания (Мотв), который принимают за исходную прочность.
Для определения прочности при повышенных температурах резьбовые пары, отвержденные при комнатной температуре в течение 24 ч нагревают при 375оС в термостате в течение определенного времени (1 или 5 ч). Затем часть образцов раскручивают через 20 с после извлечения их из термостата, а другие охлаждают до комнатной температуры и затем раскручивают.
В таблице приведены сравнительные результаты по технологии получения олигоэфиракрилатов и термостабильности отвержденных анаэробных герметиков на их основе по новому способу и по способу-прототипу.
Из таблицы видно, что способ позволяет получить ОЭА с широким диапазоном вязкости (от 300 ˙10-6 до 40000˙ 10-6 м2/с) и высоким выходом (80,2-92,4%), а анаэробные герметики на основе полученных ОЭА имеют повышенную исходную прочность (Мотв через 24 ч при 20оС составляет 30-53,5 н˙м по сравнению с 25 н˙м по прототипу) и повышенную прочность при прогреве при 375оС.
Так, после прогрева образцов АГ при 375оС в течение 1 ч момент отвинчивания составляет 2,1-5,0 н˙м (испытание при 375оС), а при выдержке резьбовых пар при этой же температуре в течение 5 ч Мотвнаходится на уровне 4,0-8,0 н˙м (испытано после охлаждения образцов при 20оС), в то время, как по прототипу эти значения равны нулю.
Снижение в реакционной смеси количества 1,7-ди-(гидроксиметил)-м-карборана до менее 0,5 моль на 1 моль тригидроксиэтилизоцианурата приводит к снижению термостабильности полимеров, (пример 11 для сравнения) и увеличению вязкости ОЭА, что затрудняет использование их в анаэробных композициях. Увеличение содержания 1,7-ди-(гидроксиметил)-м-карборана до более 3,0 моль нецелесообразно (см. пример 12 для сравнения), так как дальнейший рост выхода и термостабильности не наблюдается.
Введение акриловой кислоты в количестве менее 3,0 моль на 1 моль тригидроксиэтилизоцианурата приводит к снижению выхода ОЭА (см. пример 13 для сравнения) и вызывает уменьшение термостабильности отвержденных анаэробных герметиков, а увеличение количества акриловой кислоты до более 8,0 моль/моль нецелесообразно (см. пример 14 для сравнения), поскольку рост выхода, термостабильности не наблюдается.
Снижение в реакционной смеси количества малеинового ангидрида до менее 0,5 моль на 1 моль тригидроксиэтилизоцианурата приводит к снижению выхода и термостабильности ОЭА (см. пример 15 для сравнения), а увеличение содержания дикарбоновой кислоты до более 3,0 моль приводит к получению ОЭА с высокой вязкостью без увеличения термостабильности полимеров (см. пример 16 для сравнения).
Таким образом, из приведенных примеров и свойств получаемых ОЭА и анаэробных композиций следует, что изобретение позволяет получать жидкие некристаллизующиеся олигоэфиракрилаты в широком диапазоне значений кинематической вязкости с высоким выходом (80,2-92,4% от теоретического).
Использование олигоэфиракрилатов в качестве основы анаэробных композиций позволяет повысить термостабильность отвержденного полимерного слоя и сохранить его работоспособность при температуре 375оС.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ДЛЯ АНАЭРОБНЫХ ГЕРМЕТИКОВ | 1988 |
|
RU1582593C |
| АНАЭРОБНАЯ КОМПОЗИЦИЯ | 1986 |
|
RU1522716C |
| СПОСОБ ПОЛУЧЕНИЯ ОЛИГОЭФИРАКРИЛАТОВ | 1972 |
|
SU328122A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИЭФИРАКРИЛАТОВ | 1972 |
|
SU339171A1 |
| Способ получения азотсодержащих олигоэфиракрилатов | 1972 |
|
SU476290A1 |
| Вулканизуемая резиновая смесь | 1977 |
|
SU709638A1 |
| СПОСОБ ПОЛУЧЕНИЯ ОЛИГОЭФИРАКРИЛАТОВ | 1971 |
|
SU309001A1 |
| ДИМЕТАКРИЛОВЫЕ ЭФИРЫ ДИМЕРИЗОВАННОЙ ЖИРНОЙ КИСЛОТЫ | 2011 |
|
RU2453531C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОЛИГОЭФИРАКРИЛАТОВ | 1970 |
|
SU275410A1 |
| Способ получения хлорсодержащих олигоэфиракрилатов с симм-триазиновым циклом | 1974 |
|
SU546612A1 |
Изобретение относится к гетероциклическим соединениям, в частности к получению промежуточных продуктов (ПП) для синтеза анаэробных герметиков для фиксации и уплотнения резьбовых соединений на основе олигоэфиракрилатов (ОЭА). Цель повышение термостабильности анаэробных герметиков. Получение ПП ведут взаимодействием тригидроксиэтилизоцианурата, гликоля-ди-(гидроксиметил)-м(о)-карборана, дикарбоновой кислоты (или ее ангидрида) и метакриловой кислоты при молярном соотношении 1:0,5-3,0:0,5-3,0:3,0-8,0. Процесс ведут в среде растворителя при температуре кипения реакционной смеси в присутствии катализатора этерификации и ингибитора полимеризации. Использование ОЭА позволяет повысить термостабильность отвержденного полимерного слоя и сохранить его работоспособность при 375°С. 1 табл.
СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ДЛЯ СИНТЕЗА АНАЭРОБНЫХ ГЕРМЕТИКОВ для фиксации и уплотнения резьбовых соединений на основе олигоэфиракрилатов путем взаимодействия тригидроксиэтилизоцианурата, дикарбоновой кислоты или ее ангидрида, гликоля и метакриловой кислоты в среде растворителя при температуре кипения реакционной смеси в присутствии катализатора этерификации и ингибитора полимеризации, отличающийся тем, что с целью повышения термостабильности анаэробных герметиков, в качестве гликоля используют ди-(гидроксиметил)-м (о)-карборан и процесс проводят при молярном соотношении тригидроксиэтилизоцианурат: ди-(гидроксиметил)-м (о)-карборан: дикарбоновая кислота (или ее ангидрид): (мет)акриловая кислота 1 0,5 3,0 0,5 3,0 3,0 8,0.
| Авторское свидетельство СССР N 1165031, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-08-20—Публикация
1986-12-19—Подача