(21)4015072/23-04
(22)17.01.86
(31)195/85
(32)17.01.85
(33)ни
(46)30.03.89. Бюп.
№ 12
(71)-Хиноин Дьедьсер Еш Ведьесети Термекек Дьяра РТ (HU) (72) Геза Галамбош, Йожеф Иванич, Дьердь Дорман, Карой Канаи, Иштван Темешкези, Габор Ковач, Иштван Штад- лер, Петер Кермеци, Пал Хадхази, Шандор Вираг и Миклош Кишш (HU)
(53)547.514.71.07 (088.8)
(56)Flohe et al. Arnzeimittelforsc- hung., ai. 1240,1983.
Moncada S. and Vane. I.R.-I. Med. Chem, 23, 591, 1980.
(54)СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИНТЕРФУРАНИЛЕНПРОСТАЩКПИНОВ
(57)Изобретение относится к гетероциклическим соединениям, в частноста к получению производных интерфурани- ленпростациклинов фор-лы I
НО
о-у
Ал,
соон
B-R.
он
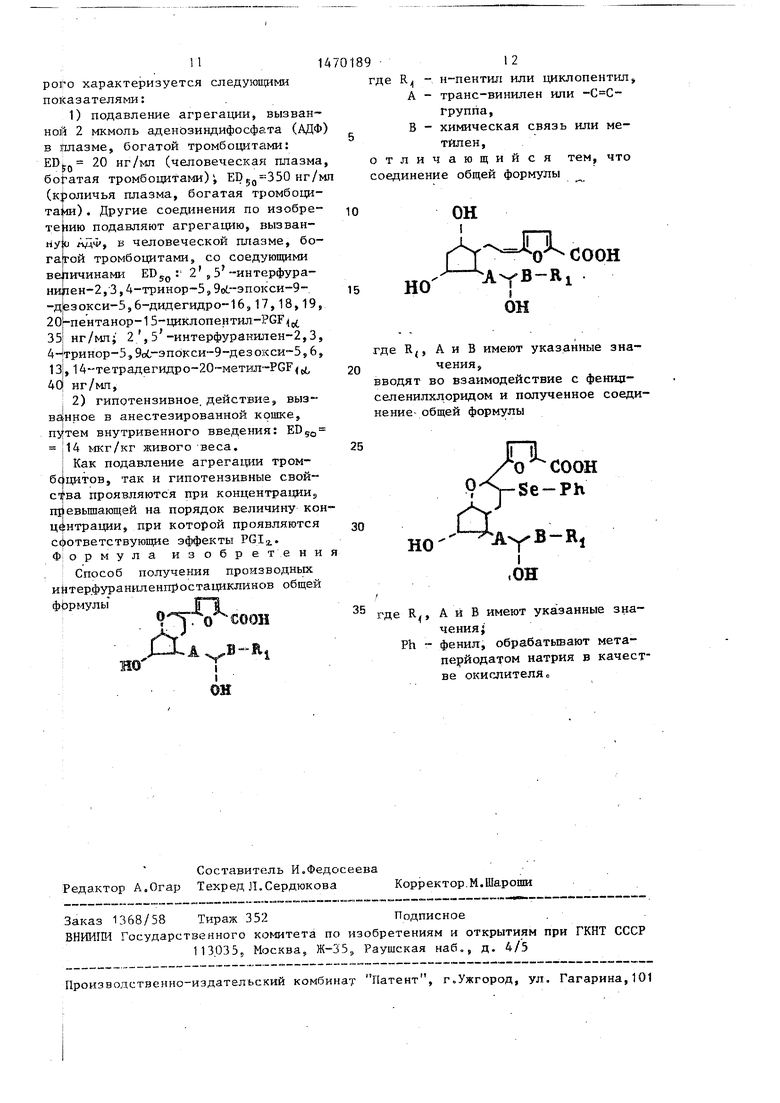
где R - н-пентил или циклопентил; А - транс-винилен или -С С-группа;
В - химическая связь или метилен, обладающих селективным фармакологическим действием с повьшенной стабильностью. Цель. - получение новых соединений указанного класса, обладающих большей активностью. Получение целевых соединений ведут из 2 , 5 -интерфуранилен- -2,3,4-тринор-РСР2-фенилседенш1хло- рида. Прлученное соответствующее 6-фенилселе шл -производное соедине НИН фор-лы I обрабатывают метаперйо- датом натрия в качестве окислителя.
Q
to
4 




| название | год | авторы | номер документа |
|---|---|---|---|
| Производные интерфураниленпростациклина, обладающие гипотензивными свойствами и способностью подавлять агрегацию тромбоцитов | 1986 |
|
SU1467056A1 |
| Производные 2,3,4-тринор- 1,5-интер-м-фениленпростациклина, обладающие цитозащитными свойствами | 1983 |
|
SU1382834A1 |
| Способ получения производных интер- @ -фениленпростациклинов | 1982 |
|
SU1391501A3 |
| Способ получения производных 7-оксо-простациклина или их солей | 1985 |
|
SU1376939A3 |
| Способ получения производных 2,3,4-тринор- @ -интер-фениленпростагландина | 1982 |
|
SU1138020A3 |
| Оптически активные производные 7-оксопростациклина,обладающие антиагрегатным и гипотензивным действием | 1985 |
|
SU1421741A1 |
| Способ получения производных 4-оксо @ | 1982 |
|
SU1128834A3 |
| Способ получения производных 7-оксопростациклина | 1986 |
|
SU1424735A3 |
| Способ получения солей эфедрина с аналогами 7-оксо-PGJ @ | 1986 |
|
SU1454250A3 |
| Соли аналогов 7-оксо-PGJ @ с эфедрином,проявляющие тормозящее свертываемость крови действие и снижающие кровяное давление | 1986 |
|
SU1447823A1 |

1
Изобретение относится к способам получения новых производн ых интер- фураниленпростациклинов общей формулы I
А
соон
А .В-Rj
ОН
где R, - н-пентил или циклопентил, А - транс-винилен или -С Сгруппа,
В - химическая связь или .метилен ,
обладающих селективным фармакологическим действием наряду с повышенной стабильностью.
Цель изобретения - получение новых производных аналогов простацик- лина, обладающих более селективными фармакологическими свойствами и боль00 СО
С/1
шей стабильностью в сравнении с природным простаи 1кликом.
Пример 1. Получение 2,5 -интерфуранил ен-2,3,, 4- тринор-5, -эпокси-9-дезокси-6 фенилселенил-- -PGFiei метилового сложного эфира. К суспензии 700 нг бикарбоната натрия в 100 мл дихлорометана, содержащего 2,7 г (6,88 ммоль) -ин-1 ерфуранш1ен-2,3,4--тринор-РСР метилового сложного эфира, добавляю по каплям раствор 1,63 г (8,26 .ммол фенилселенилхлорида в 30 мл дихлор- метана при -78°С в течение 10 мин. Реакция протекает в течевие 90 мин. j После этого к реакционной смеси до- 1 бавляют 500 мл эфира и полученньй j желтый раствор последовательно промьшают 50 мл насьщенного раствора I бикарбоната натрия, 100 мл воды, 100 МП насыщенного раствора хлорист I го натрия и высушивают над безводны |.сульфатом магния. Неочищенный проду I подвергают хроматографии на коротко колонке (100 г кизельгеля G с постепенным элюированием от смеси гексан ацетон 2:1 до смеси гексан - ацетон .11:1), чтобы получить 1450 мг целевог продукта в виде желтовато-белых кристаллов, т. пл, 86-88°С., R 0,45 (этилацетат) УФ-спектр (): Moiice 260 нм, log 4,210. I И р |1 м е р 2. Получение 2,5- I -интерфуран1шен-2,3,4-тринор--5, 9еС- |-эпокси-9-дезокси- 5, 6-дидегидро- метилового сложного эфира
1 мл насыщенного раствора бикарбоната натрия добавляют к. раствору, содержащему 1400 мг (2,56 ммоль) |2 ,5 -интерфуранилен-2 3,4-тринор- 5,9о(,-эпокси-9-дезокси-6-фени. денил-РСР метилового сложного эфи- , ipa в 50 МП метанола., и порционно добавляют. 820 мг (3,84 ммоль) метаперйодата натрия при . Смесь перемешивают при в течение 1 ч затем при комнатной температуре в течение 4 ч. Смесь фильтруют при отсасывании,и осадок двадоды промывают порциями по 10 мл этилацетата, К фильтрату добавляют 400 мл этил- ацетата, и последовательно экстрагируют 50 мл водьц 50 мл насьщенного раствора хлористого .Натрия и высушивают над безводным сульфатом магния в присутствии триэтилам11на. После удале- йия растворителя полученньй матерк
10
ал очищают с помощью хроматографии на короткой колонке (200 г кизельгеля G с постепенным элюированием от смеси гексан - ацетон 2:1 до гексан - ацетон 1:1), чтобы получить 425 мг целевого продукта в виде желтовато-белых кристаллов, Т.Ш1. 114- 117 С, Rj 0,62 (гексан-ацетон 1:1) УФ-спектр ():,, 326 нм, loge 3,93-; , 301 нм, log
4,14.
i Р и м е р 3. Получение 2,5- -интерфуранилен-2, 3,4-тринор-5, 9е6- (5 -эпокси-9-дезокси 5,6-дидегидро- .
5 мл (5 ммоль) водного раствора 1 моль/л гидроокиси натрия добавляют к раствору, содержащему 400 мг 2Q (1,02 ммоль) 2,5 -интерфуранш1ен- -2,3,4-ТРИНОР-5,9o(L-эпoкcи-9-дeзoкcи- -5.,6-дидeгидpo-PGF, метилового сложного эфира в 1Q МП метанола, и смесь перемешивают при комнатной темг/ера- 25 туре в течение 3ч. Метанол удаляют без нагревания под пониженным давлением, и остаток экстрагируют растворителями, охлажденными до 5°С. Добавляют сначала 25 мл эфира и 30 мл 5Q воды и отделяют эфирную фазу. Водную фазу повторно промывают 20 мл эфира,- затем подкисляют до рН 3-4, используя примерно 8 мл водного раствора кислого сульфата натрия., Водньй слой дваж,цы экстрагируют порциями по 25 мл эфира, органические фазы смешивают и дважды проьгьшают порциями по 10 мл насыщенного раствора хлористого натрия и высушивают над без- водным сульфатом магния, чтобы получить после выпаривания 292 мг чистого целевого продукта в виде желтова- то-бельк кристгзллов, т.пл. 108- 110 С, RJ 05,30 (бензол - диоксан - уксусная кислота 20: ЮП), УФ-спектр (,.ОН): 295 нм, log 235 нм, logf 3,93. Пример 4. Получение 11„15- -бис(тетрагидропиранил)-2 ,5 кктер- фуранилен-2,3,4-тринор-5-оксо-РОР сложного метилового эфира
Раствор 2 моль/л н-бутиллития (2,2 мл, 4,4 ммоль) в гексане добавляют по каплям к раствору, содержащему 300 мг (2,67 ммоль) 2-фу- ранкарбоновой кислоты в 25 мл тетра- гидрофурана, при --78 с, и смесь перемешивают при этой же температуре в течение 40 мин. После этого пскаплям добавляют раствор, содержащий 303 мг (0,68 ммоль) 3-OKCO-7J3- -(3 -те тр агидр опиранилок си-1 -ок тен -1 -ил)-8о -тетрагидропиранш10кси-2- -оксабицикло 4,3,0 нонана в 14 мл тетрагидрофурана. Смесь перемешивают при этой же температуре в течение 30 мин, после чего температуру постепенно повышают до. О С и реакцию останавливают путем добавления 20 мл воды. После добавления 40 мл эфира органическую фазу промывают 20 мл 0,1 н. раствора гидроокиси натрия, а затем 20 мл воды. Смешанную водную фазу подкисляют до рН 3-4 путем добавления 20 мл ра.створа бисульфата натрия, дважды промывают порциями по 40 МП эфира и смешивают органические фазы. После промывки 10 мл цоцы и 10 мл насьщенного раствора хлористого натрия к органическому раствору при 0°С добавляют 10мл эфирного раствора диазометана, смес перемешивают в течение 5 мин, а затем высушивают над безводным сульфа том магния. После очистки с помощью хроматографии на короткой колонке (25 г кизельгеля G и смесь гексан - этилацетат 2:1 в качестве элюанта) получают 69 мг целевого продукта в виде бесцветного масла, R 0,40 (смесь гексан - этилацетат 1:1), - УФ-спектр (С,Н50Н),кс 256 нм, loge 4,200.
Пример 5. Получение 2,5- -интерфуранил ен-2,3,4-тринор-5, 9ot- -эпокси-9-дезокси-5,6-дидегидро- -PGF (i, сложного метилового эфира.
Раствор , содержащий 94 мг (0,20 ммоль) Л, 15-диацетил- 2 ,5 - -интерфуранилен-2,3,4-тринор-5, 9о6- -эпокси-9-дезокси-5,6-дидегидро- -PGF сложного метилового эфира и 1 мл (1 ммоль) 1 моль/л метаноль- ного раствора метилата натрия в 3 мл метанола, перемешивают при комнатной температуре в течение 3ч. После добавления 50 мл эфира смесь промьшают 8 мл холодной воды, дважд порциями по.8 мл насыщенного раствора хлористого натрия и высушивают над безводным сульфатом магния. После очистки ,с помощью хроматографии на короткой колонке (10 г кизельге- ля G и смесь гексан - ацетон 2:1 в качестве элюанта) вьиеляют 63 г целевого продукта, которьй полностью
5
0
0
0
идентичен веществу, описанному в примере 2.
Пример 6. Получение 2 , -интерфуранилен-2,3,4-тринор-5, SDL- -эпокси-9-дезокси-6-фенилселенил- -16,17,18,19,20-пентанор-15-циклопен- тил-PGF сложного метилового эфира. 2,798 г бикарбоната натрия сусQ пендируют в растворе, содержащем 2,60 г (6,66 м1-;сль) 2, -интepфy- paншIeн-2,3,4-тpинop-PGFg сложного метилового эфира в 100 мл дихлорме- тана, после чего в этот раствор по каплям в течение 30 мин при -78 С добавляют 1,912 г (9,99 ммоль) фенил селе нилхлорид а, растворенного в 30 мл дихлорметана. Смесь перемешивают в течение 30 мин, затем добавляют 5 мл триэтиламина и раствору дают нагреться до комнатной темпера- . туры. После добавления 500 мл эфира раствор последовательно промьшают 70 мл воды и 70 мл насыщенного раст5 вора хлористого натрия. После очистки с помощью хроматографии на короткой колонке (250 г кизельгеля G и постепенное элюирование от смеси гексан - ацетон 2:1 до смеси гексан - ацетон 1:1) получают 1,150 г целевого продукта в виде белых кристаллов, т.пл. 153-154 С, R 0,33 (этилацетат); УФ-спектр (CjHsOH): Л,, 260 Пример
-интерфуранилен-2,3,4-тринор-5,9 - -эпокси-9-дезокси-5,6-дидeгидpo- -16J17,18,19, 20-пентанор-15-цикло- пeнтил-PGF p сложного метилового эфира.
3 мл насыщенного раствора бикарбоната натрия и 647 мг (3,02 ммоль) мётаперйодата натрия добавляют к раствору, содержащему 1,1 г (2,02 ммоль) 2,5 -интерфуранилен-2,3,41-тринор-5, 9в -эпокси-9-дезокси- -6-фенилселенил-16,17,18,19,20-пен- тaнop-15-циклoпeнтил-PGF сложного метилового эфира (полученного аналогично описанному в примере 6) в
0 50 мл метанола, охлажденного до О с. После перемешивания при О С в течение 30 мин и при 25°С в течение 3 ч, реакционную смесь отфильтровьшают отсасыванием, осадок дважды промы-
вают порциями по 5 мл метанола, и- фильтрат выпаривают почти полностью под пониженным давлением. Остаток разбавляют 200 мл этилацетата, экстнм, log 6 4,205.
Пример 8. Получен:ие 2,5- -интерфуранш1ен-2,3,4-тринор--5, 9oi- эпокси-9-дезокси-5,6-ди;дегидро-16, 7,18.19.20-пентанор--13-щклопентил- PGF.
Раствор, содержащий 250 мл .0,64 ммоль) 2 ,5 -интерфуранилен-- -2,3,4-тринор-5, 9о6-эпокси-9 дезокси- -5,6-дидегидро-16, 17,. 18, 19,20-пен- танор-15-циклопентил-РСР;(о сложного ьютилового эфира и 5 мл (5 ммоль)
Iмоль/л водного раствора гидрата сжиси натрия в 15 мл метанола, вы- лерживают при комнатной температуре
IIтечение 3 ч, а затем выпаривают приблизительно до цоловины его объ- :ма, затем смесь очищают о:хлажяенны- NH растворителями следуювщм образом Ele разбавляют 25 мл воды ji 25 мл эфира и водную фазу подкисляют до рН -4 путем добавления 1 мсшь/г раст- нора бисульфата натрия. Осажденньш рельй материал растворяют в 50 мл З Тилацетата и раздепяшт две фазы . Иодную.фазу снова промывают 20 мл зтилацетата, этилацетатные фазы сме- пшвают, дважды промывают порциями по 10 мл насыщенного раствора хлористого атрия и высушивают над безводным Сульфатом магния. После выпаривания г(олучают 199 мг целевого продукта в Ниде белых кристаллов, т.ап, 157- R 0,28 (смесь бензол - ди- Оксан - уксусная кислота 20:10;1),
Пример 9, Получение кальциевой соли 2,5 -интepфypaнилeн-2,3,4 - Tpинop-5,9o.-эпoкcи-9 дeзoкcи-5,6- - дидeгидpo- 16, 17,18,19,20-пентанор- - 15-циклопентил-РСР ,..
Раствор, содержащий 176 мл (0,45 ммоль) 2,5 -интерфуранилен- - 2,3,4-тринор-5 5 9о(,-эпокси 9-дезокси-- -5, 6-дидегидро-16,17,19,18,, 20-цен- танор-15-циклопентил-РСЕ сложного метилового эфира и 5 мл 1 н. раство10
1470189 8
ра гидроокиси натрия в 10 мл метанола, перемешивают при комнатной температуре в течение 90 мин, затем метанол удаляют под пониженным давлением. После добавления 10 мл воды к остатку и промывки с помощью 25 мл эфира водную фазу подкисляют до рН 4 путем добавления примерно 5 мл 1 моль/л раствора бисульфата натрия и экстрагируют холодную смесь 3 раза порциями по 3 мл этилацетата. Сме- шанньй этилацетатньй раствор промывают с помощью 10 мл насьнценного ра15 створа хлористого натрия. После выпаривания остаток растворяют в 10 мл тетрагидрофурана и после добавления 3 МП воды добавляют 30 мг (0,53 ммоль) окиси кальция. Полученный мутный ра20 створ перемешивают в течение ночи, затем фильтруют, фильтрат выпаривают досуха и после добавления бензола его снова вьшаривают досуха. Остаток после вьтаривания перемешивают с
25 20 мл этанола, в течение 20 мин и . фильтруют. После вьшаривания фильтрата получают целевой продукт как чистое вещество в виде белых крис- талрв, т.пл. 150-155 С (с разложен.),
30 R О,28(смесь бензол - диоксан - уксусная кислота 20:10:1).
Содержание кальция в веществе можно определить путем кондуктомет- рического титрования с помощью кис2 лоты. В этом случае содержание каль- Щ1Я в образце 15 мг составляет 0,785 мг.
Пример 10. Получение 2,5 т -интерфуранил ен-2,3,4-тринор 5,9oi.- ,-эпокси-9-дезокси-6-фенилселенил- -13,14-дидегидро-20 метш1 РСР(еб ,сложного метилового эфира.
После добавления 194 мг , (2,31 ммоль) бикарбоната натрия к раствору, содержащему 780 мг (1,93 ммоль) 2,5 -интepфypaншIeн -2 , 3 5 4-тринор-13,14-дидегидро-20- -метил-РСР,2вб сложного метилового эфира в 15 мл дихлорметана, раствор охлаждают до , при перемешивании в течение 10 мин добавляют 443 мг (2,31 ммоль) фенилселенил- хлорида, растворенного в 5 мл ди- хлорметана, и смесь перемешивают при -78°С еще в течение 1ч. После разбавления 50 мл этилацетата смесь последовательно промывают 10 Мл на- сьпценного раствора бикарбоната натрия, 20 мл воды, 20 мл насыщенного
40
45
50
-интерфуранилен-2,3,4-тринор-5,9с(,- -эпокси 9-дезокси-5,6,13,14-тетра- г идро-20-метил-РСР, сложного метилового эфира.
143 мг (0,67 ммоль) метаперйода натрия добавляют к раствору, содержащему 250 мг (0,45 ммоль) 1,5-интерфуранил ен-2,3,4-тринор-5, 9oi.- -эпокси-9-дезокси-6-фенилселенил- -13,14-дидегидро-20-метил-РСР,
I Ot
сложного метилового эфира (полученного аналогично описанному примеру .10) и 0,5 мл насыщенного раствора бикарбоната натрия в 3 мп метанола, при 0°С. Смесь перемепи- вают при 0°С в течение 30 мин, а затем при комнатной температуре в течение ночи. После фильтрования осадок промывают 5 мл этилацетата. Фильтрат разбавляют 10 мл воды и дважды экстрагируют порциями по . 20. МП этилацетата. Смешанный органический раствор дважды промьшают порциями по 5 мл насьщенного раствора хлористого натрия, затем высушивают над безводным сульфатом магния в присутствии триэтиламина.После очистки с помощью хроматографии на короткой колонке (30 г кизельгеля G и смесь дихлорметан - ацетон 4:1, содержащая 1% триэтиламина, в качестве элюанта) получают 24 мг целевого продукта в виде бесцветног масла, которое кристаллизуется при стоянии,.R, 0,41(дихлорметан - ацетон 4:1), т.пл. 99-100 с.
Пример 12. Получение -интерфуранилен-2,3,4-тринор-5,9(i- -эпокси-9-дезокси-5,6,13,14-тетра- дегидро-20-метил-РСГ, р.
Раствор, содержащий 24 мг (0,06 ммол) 2,5 -интерфуранш1ен- -2,3,4-тринор-5,91х;-эпокси-9-дез окси- -5,6,13,14-тетрадегидро-20-метил- -PGF сложного метилового эфира (полученного аналогично описанному в
2,51470189
10
10
15
20
примере 11) и 0,3 мл (0,3 ммоль) 1 н. водного раствора гидрата окиси натрия в 3 мл метанола, перемешивают при комнатной температуре в течение ночи; Затем метанол выпаривают под пониженным давлением и остаток разбавляют 2 мл воды. Последующие операции осуществляют при ледяном охлаждении, используя растворители с температурой 5-10 с.Смесь подкисляют до рН 3-4 путем добавления 1 моль/л раствора бисульфата натрия, а затем осажденное вещество дважды экстрагируют порциями по 10 мл этилацетата. После смешивания этил- ацетатных фаз и двойной промьшки порциями по 3 мл насьщенного раствора хлористого натрия органический раствор высушивают над безводным сульфатом магния. После вьшаривания растворителя получают 19 мп целевого продукта в виде бесцветного масла, R о,46(бензол - диоксан - уксус- 25 ная кислота 20:10:1).
Стабильность соединений общей формулы I, полученных с использованием описанного способа, сравнивали со стабильностью натриевой соли PGI. Это соединение является до- всшьно нестабильным с временем полураспада 3-4 месяца при рН 7,4. Свободную кислоту (PGI) не могут получить из-за ее еще большей нестабильности. Стабильность соединений общей формулы I является существенно более высокой. Одно из них, в частности 2,5 -интepфypaнилeн- -2,3,4-тpинop-5,9D эпoкcи-9-дeзoкcи- o 5,6-дидeгидpo-PGF,, можно накопить в виде свободной кислоты при рН 7,4 без значительного разложения в течение 12 ч. Это соединение можно хранить при -20 С при разложении менее 10% вещества в течение по меньшей мере месяца. Время полураспада 2,5 -интерфуранилен-2,3,4-тринор- 5,9о -эпокси-9-дезокси-5,6-дидегид- ро-16,17,18,19,20-пентанор-15-цикло30
5
5
0
5
пентил-PGF составляет примерно 3 ч при рН 3.
Соединения по изобретению относятся к группе низкотоксичных.
Одним из фармакологически наиболее активных соединений по изобретению является 2,5 -интерфуранилен- -2,3,4-тринор-5,9(х1-эпокси-9-дезокси- -5,6-дидeгидpo-PGF |, действие кото
роГо характеризуется следуюисими по14азателями:
1) подавление агрегации, вызванной 2 мкмоль аденозиндифосфата (АДФ) в ifmasMe, богатой тромбоцитами: EDtQ 20 иг/мл (человеческая плазма, богатая тромбоцитами), ED 350 иг/мл (кроличья плазма, богатая тромбоци- ) . Другие соединения по изобретению подавляют агрегацию, вызван- му:о АДф, в человеческой плазме, бо- гагой тромбоцитами, со соедующими величинами ЕБ, : 2 , З -интерфура- нипен-2,3,4-тринор 5, 9о{.-эпокси-9- -дезокси-55б-дидегидро 16,17,18,19, 20г-пентанор-15-циклопентил;-РСР |. 35| нг/мп; 2,5 -интерфуранилен-2,3, 4-|тринор-5,9оС-эпокси-9 дезокси 5,6, 13|, 14 тетрадегидро 20 метил-РСР ( 4Q нг/мл,
i 2) гипотензивное, действие,, выз- в4нное в анестезированной кошке, пз|тем внутривенного введения: 114 мкг/кг живого веса.
I Как подавление агрегагщи тром- бс|цитов5 так и гипотензивные свойства проявляются при концентраи 1Иэ П1|евьшающей на порядок величину кон- ц нтрации, при которой проявляются соответствующие эффекты PGIj. ф ормула изобретения
: Способ получения производных ийтер.фураниленщ)остациклинов общей
фЬрмулы
А
но
147018912
где R - н-пентил или циклопентил, А - транс-винилен или -С Сrpyniia,
В - химическая связь или метилен,
отличающийся тем, что соединение общей формулы
О
-v
I I
он
С00И
U- R
соон
15
где R, А и В имеют указанные зна- 2Q чения,
вводят во взаимодействие с фенил- селенилхдоридом и полученное соединение- общей формулы
25
30
НО
ги
соон
9 S-Se-Ph
ц
,он
35
где R, А и В имеют указанные значения jj
Ph - фенил, обрзбатьтают мета- перйодатом натрия в качестве окислителяо
соон
НО
ги
соон
9 S-Se-Ph
ц
,он
где R, А и В имеют указанные значения jj
Ph - фенил, обрзбатьтают мета- перйодатом натрия в качестве окислителяо
Авторы
Даты
1989-03-30—Публикация
1986-01-17—Подача