Изобретение относится к биотехнологии и медицине и представляет собой диплоидный штамм дрожжей сахаромицетов, содержащий рекомбинантную плазмиду, кодирующую синтез поверхностного антигена вируса гепатита В (HBsAg) - продуцент HBsAg. Генноинженерный HBsAg белок оболочки вируса гепатита В может быть использован в клинической практике для диагностики вакцинопрофилактики.
Цель изобретения - повышение продуктивности штамма и увеличение выхода белка HBsAg за счет стабилизации системы "клетка-плазмида".
Отбор штамма продуцента белка HBsAg с высокой урожайностью HBsAg, получение трансформантов со стабильной гибридной плазмидой, вероятность утраты которой в процессе наращивания биомассы менее чем 10-3 на клетку/генерацию, и возможность культивирования дрожжей на средах не требует добавок аминокислот.
Изобретение иллюстрируется следующим примером.
П р и м е р 1. Создание прототрофных гибридов дрожжей сахаромицетов основано на гетерозиготном сочетании в генотипе диплоида ауксотрофных мутаций гаплоидных родителей.
В стерильную пробирку с 1 мл полноценной среды УЕРД микробиологической петлей вносят клетки штаммов ДВУ746 и 1Р22А. Пробирку встряхивают и ставят в термостат на 18 ч (28-30оС). Далее на чашки Петри с агаризованной минимальной средой (0,67% УВ, 2% глюкозы, 2% атара, 30 мкг/мл 1-лейцина) высевают петлей истощенным штрихом смесь клеток из пробирки. Чашки инкубируют в термостате при 28-30оС в течение 2-3 суток. Выросшие колонии являются диплоидными культурами, их отсевают на скошенный агар (состав среды тот же, что и на чашках Петри), маркируют и хранят в холодильнике при +4оС. Другим доказательством диплоидности является способность таких клеток к споруляции в условиях голодания.
Полученный таким образом диплоидный штамм используют в качестве реципиента для трансформации гибридной плазмидой pNMV G39-54, кодирующей синтез поверхностного антигена вируса гепатита В (HBsAg), в составе которой имеется дрожжевой ген LEU2 в качестве селективного маркера (прототип). Трансформацию проводят по методу H. Itoet al, используя в качестве селективной среды Yeast Nitrogen Base (Difco) без добавок аминокислот. Среди полученных трансформантов проводят скрининг на продуктивность по HBsAg, стабильность плазмиды и отбирают высокоактивный штамм ДАН 2/pNMVG39-54.
Клетки дрожжей штамма ДАН2/pNMVG39-54 выращивают в 1 мл среды УЕРД (до плотности 3х108 кл/мл), а клетки штамма ДАН7-12d/pNMVG39-54 в 1 мл 0,67% Yeast Nitrogen Base c добавкой триптофана, гистидина и урацила 20 мкг/мл (до плотности 5х10 кл/мл) при 28-30оС. Клетки центрифугируют (5000g, 5 мин при + 4оС), отмывают стерильной Н2О и переносят в 50 мл среды min Pi (стр. 4-5). Культуры выращивают в условиях аэрации при 30оС 14 ч. Клетки центрифугируют (5000g; 5 мин, +4оС), отмывают 5 мл буфера А (0,02 М а-фосфат, рН 7,2, 0,2% Трилон х100). К клеточному осадку добавляют равный объем стеклянных шариков (диаметром 0,5 мм). Смесь интенсивно перемешивают в течение 3 мин при комнатной температуре на встряхивателе Vortex (Genue USA). К смеси добавляют 200 мл буфера А и продолжают разрушение клеток еще 2 мин. Смесь центрифугируют (10000g, 30 мин, + 4оС) и отбирают надосадочную жидкость, в которой определяют содержание HBsAg с помощью стандартных диагностических тестов РПГА (НИИЭиМ, г. Горький) или иммуноферментным методом AUSZYME (Abbot. USA) по прилагаемым к тест-наборам инструкциям. В каждой пробе определяют количество белка по Лоури.
Характеристика штамма ДАН2 (pNMVG 39-54).
1. Генотип реципиента штамма ДАН2- 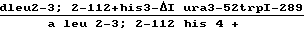 создан стандартным методом получения диплоидных линий у гетероталличных, спорогенных дрожжей-сахаромицетов. Клетки штаммов ДВУ746 (L leu 2-3, 2-112 his 3-1 ura 3-52 trp 1-289) и IR29A (d his 4 leu 2-3, 2-112) скрещивали методом совместного выращивания в полноценной среде УЕРД. Диплоидные гибриды отбирали либо на минимальной селективной среде (0,67% Yeast Nitrogen Base, 2% глюкозы, 30 мкг/мл лейцина), благодаря гетерозиготности ауксотрофных маркеров родительских штаммов, либо микроманипулятором выделяли под микроскопом зиготы по их характерной для S. cerevisiae гантелеобразной форме.
создан стандартным методом получения диплоидных линий у гетероталличных, спорогенных дрожжей-сахаромицетов. Клетки штаммов ДВУ746 (L leu 2-3, 2-112 his 3-1 ura 3-52 trp 1-289) и IR29A (d his 4 leu 2-3, 2-112) скрещивали методом совместного выращивания в полноценной среде УЕРД. Диплоидные гибриды отбирали либо на минимальной селективной среде (0,67% Yeast Nitrogen Base, 2% глюкозы, 30 мкг/мл лейцина), благодаря гетерозиготности ауксотрофных маркеров родительских штаммов, либо микроманипулятором выделяли под микроскопом зиготы по их характерной для S. cerevisiae гантелеобразной форме.
Клетки штамма ДАН2 обладают характеристикой полностью соответствующей морфологическим и физиологическим признакам дрожжей S. cerevisiae овальной формы 10-14 мкм. , интенсивно почкуются в экспоненциальной стадии роста, который оптимален при 29-30oC и рН среды 5,7-5,9. Максимальный титр культуры в полноценной среде (YEPD) достигает 3х108 клеток/мл. При размножении на минимальной среде с добавкой лейцина титр в стационарной фазе не превышает 8х107 клеток/мл. На агаризованной среде клетки образуют бело-бежевые колонии, характерные для дрожжей-сахаромицетов. Усваивают глюкозу, галактозу, сахарозу, мальтозу и несбраживаемые субстраты этиловый спирт, глицерин, ацетаты, лактозу.
Свойства штамма-продуцента.
ДАН2 по происхождению родствен штамму ДАН7-12d, трансформанты которого, полученные с помощью плазмиды pNMVG39-54, являются прототипом.
Штамм ДАН2, в результате трансформации плазмидой pNMVG39-54 с селективным маркером LEU2, становится прототрофом, т. е. не требует дорогостоящих добавок аминокислот в минимальную ростовую среду.
Рекомбинантный диплоидный штамм ДАН2/pNMVG39-54, сохраняя эффект гетерозиса, свойственный реципиенту, накапливает высокий титр клеток как в полноценной, так и в минимальной среде. В полноценной среде (УЕРД) титр клеток составляет 3х108 кл/мл, а в минимальной среде (0,67% YNB, 2% глюкозы) титр клеток - 8х107 клеток/мл).
Полученная система "клетка-вектор" стабильна как в плане сохранения заданной структуры плазмиды (проверка до 24 пассажа), так и в отношении поддержания плазмиды при митотическом и мейотическом делении дрожжевых клеток. Вероятность утраты плазмиды определяют двумя способами: анализом родословных с помощью микроманипуляционной техники и определением содержания клеток, утративших плазмидный маркер в растущей культуре. Анализ более 5000 клонов трансформантов ДАН2/pNMVG39-54 не обнаружил ни одного случая утраты плазмиды после 22 генераций. При частоте утраты плазмиды менее чем 10-3 в L/a диплоидах отпадает необходимость применения селективного пресса поддержания клеток, содержащих плазмиду.
Продуктивность штамма ДАН2/pNMVG39-54 по HBsAg составляет 1 мг н а 1 литр культуры при концентрации 8х107 кл/мл.
Минимальная синтетическая среда min Pi на 1 л КН2РО4 - 0,015 г KCl - 1 г MgSO4 - 0,5 г NaCl - 0,1 г CaCl2 - 0,1 г глюкоза - 20 г l-аспарагин - 2 г l-гистидин - 0,020 г l-триптофан - 0,020 г урацил - 0,020 г KJ - 100 мкг HBO3 - 10 мкг MnSO - 10 мкг (NH4)2MoO4 - 10 мкг FeSO4 - 50 мкг тиамин - 200 мкг рибофлавин - 200 мкг пиридоксин - 200 мкг никотин. к-та 200 мкг р-аминобензойная кислота - 200 мкг Са-пентогенат 200 мкг инозитол - 10000 мкг биотин - 2 мкг
Таким образом, изобретение позволяет получить штамм S. cerevisiae продуцент HBsAg. Урожайность HBsAg в штамме продуценте ДАН2/pNMVG39-54 составляет 1 мг на литр культуры клеток. Длительное культивирование диплоидного штамма ДАН2/pNMVG39-54 показало, что даже в неселективных условиях роста не появляются бесплазмидные клетки, т. е. система обладает практически (100% стабильностью (частота утраты плазмиды менее 2 ˙10-3). Штамм ДАН2/pNMVG39-54 является прототрофом по своим питательным потребностям, т. е. при росте на минимальной среде (0,67% Yeast Nitrogen Base) не требует внесения в среду аминокислот, что является дополнительным положительным эффектом. Дополнительным эффектом является удешевление среды культивирования из-за отсутствия необходимости внесения аминокислот (гистидицина и триптофана) и урацила.
(56) Авторское свидетельство СССР N 1380207, кл. С 12 N 15/00, 1986.
Изобретение относится к биотехнологии и медицине (вирусологии) и может быть использовано в клинической практике в целях диагностики и вакцинопрофилактики. Цель изобретения - повышение продуктивности штамма за счет повышения стабильности системы "клетка-плазмида". Цель достигается созданием диплоидных гибридов дрожжей скрещиванием α - и а-гаплоидов, которые трансформируют плазмидой pNMVG 39 - 54. Штамм-продуцент ДАН2/pNMVG 39 - 54 обладает уровнем продуктивности HBsAg 1 мг на литр культуры клеток. Способ получения штамма ДАН2/pNMVG 39 - 54 отличается тем, что скрещивают гаплоиды, далекие по происхождению (ДВУ746-США и серия гаплоидов IR собственной конструкции), диплоидные гибриды с признаками гетерозиса и трансформируют их плазмидой pNMVG 39 - 54.
Авторы
Даты
1994-03-15—Публикация
1987-12-07—Подача