Изобретение относится к области биотехнологии и. может быть использовано в производстве амида микробиологическим способом.
Цель изобретения - ускорение способа.
Пример 1. Промытые бактериальные клетки штамма N-77 (Corynebacte- rium) получают аэробным культивированием штамма в среде (рН ), состоящей из глюкозы 1, пептона 0,5 дрожжевого экстракта 0,3, экстракта сусла 0,3% и сульфата железа (ill) «7 0,05%, и промывкой полум енных клеток фосфатным буфером 0,05 М, Клетки диспергируют в фосфатном буфере ,05 М) рН 7,7 в темном месте с получением дисперсии клеток, имеющих
концентрацию 3,5 г высушенных клеток/ /л. Полученную суспензию клеток делят на две части. Одну из них оставляют при в течение ч при облучении световой энергией 1,5 х 10 мкЕ/г кл. в с, используя два комплекта люминесцентных ламп дневного света длиной волны 400-800 нм мощностью по Вт, и этот образец обозначен в дальнейшем как выдержка на свету. Другую часть оставляют при С°С в темном месте в течение 4 ч, и этот образец в дальнейшем именуют как выдержка в темноте.
При использовании каждой из клеточной суспензии из акрилонитрила получают акриламид и изучают скорость
СЛ
СА9
см
реакции с точки зрения количества получаемого таким путем акриламида.
В случае бактерий, выдерживаемых на свету, смесь 0,088 ч. клеток (здес и ниже количество представляется массой сухих клеток), 1 ч. акрилонитри- ла и 98,912 ч. 0,05 М фосфатного буфера (рН 7,7) подвергают реагированию при 10°С в реакторе на 50 мл в тече- ние 20 мин при перемешивании при описанных условиях, в дальнейшем эта реакция именуется .реакция в условиях облучения. В случае бактерий, выдерживаемых в темноте, эту реакцию пов- торяют, но не обеспечивают освещения и в дальнейшем эта реакция именуется реакцией в условиях темноты. После завершения реакции акриламид, содержащийся в каждом реакционном раство- ре, реакция в котором прекратилась, подвергают количественному анализу с помощью газовой хроматографии. В результате количество акриламила (АА) на единицу количества бактериальных клеток составило 1,1 мкмоль АА/мг кл. мин в реакции в условиях облучения и бактерий, выдерживаемых на свету, и 0,3 мкмоль АА/мг кл. мин в реакции в условиях темноты и бактерий, выдерживаемых в темноте. Отношение между этими показателями (т.е. реакция в условиях облучения и бактерий, выдерживаемых на свету / реакция в условиях темноты и бактерий, выдерживаемых в темноте) 121.
В примерах значение 41 ,А мкмоль/мг кл. мин, полученное для реакции в условиях облучения и бактерий, выдерживаемых на свету, согласно примеру 1 указано относительным показателем 100 и. Таким образом, полученное в примере 1 значение для реакции в условиях темноты и бактерий, выдерживаемых в темноте,О,83 U.
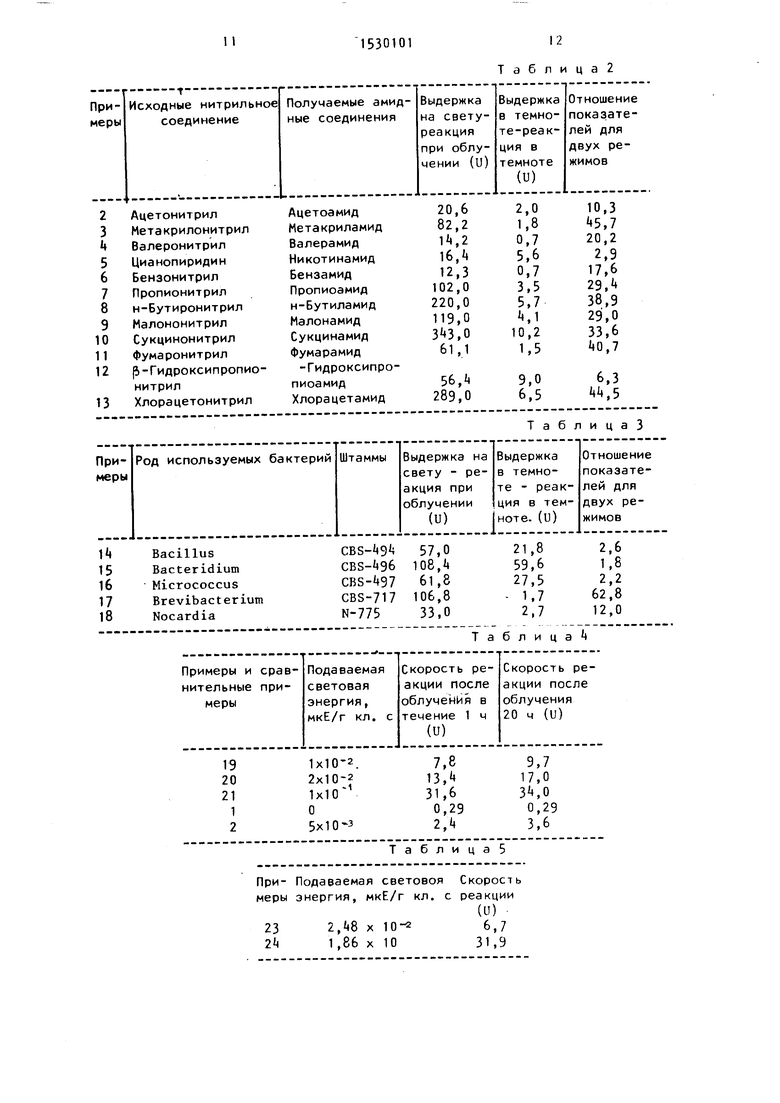
Примеры 2-13. Реакционный раствор, имеющий состав, представленный в табл.1, получают с использованием бактериальных клеток, выдерживаемых на свету и отдельно - выдерживаемых в темноте, полученных в примере 1 Реакционный раствор подвергают реагированию по методике примера 1. Соответствующие амидные соединения, содержащиеся в растворе после завершения реакции, подвергают количествен- ному анализу с помощью газовой хроматографии с получением результатов, приведенных в табл.2.
Q 0 5 „
5
0
5
0
Примеры Й-18. Промытые бактериальные клетки получают приготовлением по методике примера 1 штаммов следующих родов: Bacillus (CBS- 9) в примере 1, Bacteridium (CBS- (96) в примере 15, Micrococcus (CBS- Э7} в примере 1б, Brevibact erium (CBS-717) в примере 17 и Nocardla (N-775) в примере l8. Промытые клетки обрабатывают по методике примера 1 с получением клеток, выдерживаемых на свету и соответственно в темноте. При использовании клеток в следующем составе акриламид получают из акрило- нитрила и скорость реакции изучают с 1ОЧКИ зрения количества получаемого таким путем акриламида.
В случае штаммов, выдерживаемых на свету, смесь 0,088 ч. клеток, 1 ч. акрилонитрила и 98,912 ч. 0,05 М фосфатного буфера )рН 7,7) подвергают реагированию в течение 20 мин при 10°С в условиях перемешивания (реак- ция в условиях облучения). В случае штаммов, выдерживаемых в темноте, реакцию повторяют с тем отличием, что не производится освещения (реакция в темноте). Акриламид, содержащийся в каждом растворе после завершения реакции, подвергают количественному анализу с помои1ью газовой громатогра- фии с получением результатов, приведенных в табл.3 (сравнительные данные по влиянию освещения на получение амидов).
Примеры 19-21 и сравнительные примеры 1 и 2. Промытые бактериальные клетки штамма N-77 получают аэробным культивированием штамма в среде (рН 7,2), содержащей глюкозу 1/0, пептон 0,5, дрожжевой экстракт 0,3, солодовый экстракт 0,3% и сульфат железа (Ш) 7 0,05%, и промыванием полученных клеток 0,05 М фосфатным буфером. Клетки диспергируют в 0,05 М фосфатном буфере (рН 7,7) в темном месте с получением бактериального раствора концентрацией 22,72 мг/мл.
По 1 мл каждой клеточной суспензии загружают в стальные реакторы на 50 мл и добавляют 2 мл 0,05 М фосфатного буфера (рН 7,7). Результирующую клеточную суспензию облучают источником света, использованным в примере 1 при О С в течение 1 или 20 ч, причем количество поступающей световой энергии регулируют показанным в
табл. образом с помои(ью фильтрата, имеющего разные оптические участки и помещенного в верхней части реактора.
К каждой клеточной суспензии, об.- лученной светом, добавляют 25 мл 5 раствора акрилонитрила (в 0,05 М растворе фосфатного буфера, рН 7,7). Смесь подвергают реагированию в течение 20 мин при тех же условиях свето- вого облучения. Для сравнения реакции проводят тем же путем, но с использованием клеточной суспензии без светового облучения или при облучении световой энергией, меньшей 1x10 2 мкЕ/г кл. с.
Количество акриламида, содержащееся в этих реакционных растворах, подвергают количественному анализу с помощью газовой хроматографии для определения скорости реакции. Результаты приведены в табл.4. (Влияния облучения на скорость реакции гидратации) .
П р и м е р 22. Промытые бактериальные клетки штамма N-77 получают аэробным культивированием штамма в среде (рН 7,2), содержащей глюкозу lij пептон 0,5%, дрожжевой экстракт 0,3%, солодовый экстракт 0,3% и сульфат железа (ш) 7 0,05%, и промывкой полученных клеток 0,05 М фосфатным буфером. Затем ч. полученных клеток (содержание воды. 75%), .5 ч. акриламида, 0,5 ч. К,К-метиленбисак- риламида и 40 ч. 0,05 М фосфатного буфера (рН 7,7) смешивают с образованием однородной суспензии. К ней добавляют 5 ч. 5%-ного водного раство- ра диметиламинопропионитрила и 1C ч. 2,5%-ного водного раствора персульфата калия. Смесь подвергают полимеризации при 1С°С S течение 30 мин. Результирующий кусковой гель, содержа- щий бактериальные клетки, дробят на мелкие частицы и частицы полностью промывают 0,05 М фосфатным буфером (рН 7,7) с получением 100 ч. иммобилизованных бактериальных клеток. Им- мобилизованные клетки обрабатывают 0,05 М фосфатным буфером (рН 7,7) с получением раствора концентрацией 3,5 г сухих клеток на литр. Раствор иммобилизованных клеток делят на две порции. Одну оставляют при О С в течение 4 ч при тех же условиях светового облучения, что и в примере 1 , (выдержка на свету), а другую порцию
016
оставляют при 0 С в темном месте в течение 4 ч (выдержка в темноте).
При использовании иммобилизованных клеток в следующих составах из акрилонитрила получают соответственно ак- риламид. Скорость реакции изучают с точки.зрения количества получаемого таким путем акриламида. В случае бактерий, выдерживавшихся на свету, смесь 0,5 ч. геля иммобилизованных клеток, 2,5 ч. акрилонитрила и 97 ч. 0,05 М фосфатного буфера (рН 7,7) облучают светом в указанных условиях и подвергают реагированию при U°C в условиях перемешивания в течение 20 мин (реакция при освещении). В случае выдержки бактерий в темноте эту реакцию проводят с тем исключением, что не ведут облучения светом (реакция в темноте).
В каждом из растворов после завершения реакции акриламид подвергают количественному анализу с помощью газовой хроматографии. В результате скорость реакции при освещении и выдержке на свету 20,0 U, а в случае реакции в темноте и выдержке в темноте 0,4 и, так что отношение этих показателей 50,0.
Примеры 23 и Z . Иммобилизованные клетки штамма N-77 при выдержке на свету получают на методике примера 22. k ч. результирующих иммобилизованных клеток, 2,5 ч. акрилонитрила и 9,5 ч. 0,05 М фосфатного буфера (рН 7,7) смешивают и помещают в кубический сосуд из нержавеющей стали объемом 2,5 л, верхняя часть которого открыта. Смесь облучают в сосуде через открытую верхнюю поверхность (И см2) с помощью того же источника света с длиной волны 400- 800 нм, что и в примере 1, при световой энергии 2, i8x10 2 мкЕ/г кл. с или лампы холодного свечения мощностью 100 Вт при световой энергии 1,86x10 мкЕ/г кл. с и подвергают реагированию.при 0°С и перемешивании в течение 20 мин соответственно. Содержащийся в каждом из растворов по завершении реакции акриламид подвергают количественному анализу с помощью газовой хроматографии. Результаты приведены в табл.5.(влияние интенсивности светового облучения на скорость реакции гидратации).
Пример 25 и сравнительный пример 3. Иммобилизованные клетки
штамма получают по методике 22 Q, ч. полученных иммобилизованных клеток, .6 ч. 0,0025 М водного раствора сульфата натрия и 1,8 ч. ак- рилонитрила смешивают и помещают в разъемную стеклянную колбу на 1 л, имеющую часть, выполненную светонепроницаемой. Смесь в колбе облучают лампой типа Cool ligbt с длиной волны 400-800 нм и мощностью 150 Вт с расстояния 20 см от реакционного раствора (световая энергия около 7x10 мкЕ/ /г кл. с) при одновременном регулировании рН равным 8,5 добавлением 0,05б раствора гидроокиси натрия и подвергают реагированию при регулировании концентрации акрилонитрила в реакционной системе на уровне 2% постепенным добавлением 17,2 ч. акрило- нитрила. Таким путем получают 10 ч. раствора по завершении реакции, который содержит 20 акриламида. Количество непрореагирова вшего акрилонитрила 100 млн и менее спустя 25 ч после начала реакции.
При проведении сопоставительного примера реакцию повторяют при тех же условиях, но не используют облучения светом. Реакционный раствор содержит не более 1% акриламида спустя 25 ч после начала реакции.
Ссылочный пример 1. Штамм N-77 культивируют по методике примера 1 . Полученные -клетки N-77 разрушают при низкой температуре с помощью пресса Френча с получением клеточной суспензии. Суспензию подвергают обработке с целью удаления аминокислот и диализу для получения неочищенного ферментного раствора в виде фракции, насыщенной 50% сульфата аммония, которая содержит белок в концентрации 3,9 белка/мл. Раствор делят на 2 порции. Одну порцию выдерживают при 10 С в течение А ч в тех же условиях облучения светом, что и в примере 1 (выдержка на свету). Другую порцию выдерживают при 10°С в течение ч в темно месте (выдержка в темноте). При ис- пользовании неочищенного ферментного раствора в следующих составах из акрилонитрила получают соответственно акриламид. Скорость реакции изучают с точки зрения количества получаемого таким .путем акриламида.
В случае бактерий после выдержки на свету смесь 2,5 ч. неочищенного ферментного раствора,2,5 ч. акрило
5
Q п 5
0
Q
5
5
нитрила и У5,0 ч. 0,05 М фосфатного буфера облучают светом в описанных условиях и подвергают реагированию при и перемешивании в течение 20 мин. В случае выдержки бактерий в темноте реакцию повторяют в тех же условиях, но с тем исключением, что освещение не используют. Содержащийся в каждом из растворов после завершения реакции акриламид подвергают количественному анализу с помощью газовой хроматографии. В результате количество акриламида (АА), полученного таким путем, составляет ЮЗ мкмоль АА/мг белка мин, в случае выдержки на свету и реакции с облучением и 102 мкмоль АА/мг белка мин в случае выдержки в темноте и реакции без облучения. Отношение этих показателей 1.01. Таким образом, эффект светового облучения не наблюдается.
Ссылочный пример 2. Этот эксперимент показывает, что бактерии, не проявляющие нитрилазной активности, но обладающие другой ферментной активностью, не испытывают изменения ферментной активности под действием светового облучения.
Промытые клетки Brevibacterium ammoniagenes (IMI ) получают аэробным культивированием штамма в среде (рН 7,2), содержащей глюкозы, О,5%-фумарата натрия, 0,2 мочевины, 0,2% двузамещеннокислого фосфата калия, 0,05% сульфата магния . и % раствора после замачивания кукурузы. Клетки диспергируют в 0,05 М .фосфатном буфере (рН 7,7) в темноте для получения суспензии клеток, имеющей концентрацию 30,0 ОДбзо мкм. Бактериальный раствор делят на две порции. Одну оставляют при 30°С в течение 1 ч на расстоянии 20 см от лампы Cool Beam мощностью 150 Вт при свето- I вой энергии 7x102 мкЕ/г кл. с (вы- держка на свету). Другую порцию оставляют при 30 С в течение 1 ч в темноте (выдержка в темноте). При использовании этих бактериальных растворов в следующих составах из фумаровой кислоты получают яблочную кислоту. Скорость реакции изучают в сопоставлении с количеством получаемой таким путем яблочной кислоты.
В случае бактериального раствора после выдержки на свету смесь 50 ч. полученного бактериального раствора,
8 ч. фумлрала натрия и 42 м. 0,05 И фосфатного буфера (рИ 7,7) реагируют при 30 С и перемешивании в течение 1 м в описанных условиях облучения, В случае бактериального раствора после выдержки в темноте реакцию проводят в тех же условиях, но при отсутствии освещения. Фумаровую кислоту осаждают добавлением 2N НС1 и удаляют из раствора после завершении реакции, после чего содержание яблочной кислоты в каждом из растворов после завершения реакции определяют цветопрояви- тель ным методом с использованием 2,7 нафталиндиола. В результате количеств яблочной кислоты Bj iO мкмоль/ОД ч в случае реакции и выдержки на свету, и 3,3б мкмоль/ОД в случае реакции и выдержки в темноте. Отношение показа- телей 0,95. Таким образом, эффект светового облучения не наблюдается.
Примеры 26-28. Осуществляют способ согласно примерам 2-13 за тем исключением, что применяют другой тип нитрилов и количество используемых нитрилов составляет 2,5 м.
Полученные результаты показаны в табл.6 (получение амидов из нитрилов)
Использование способа позволяет интенсифицировать процесс гидратации при использовании его в промышленном масштабе.
5
5
состоящем по меньшей мере частично из материала, не пропускакицего свел.
2.Способ по п.1, отличающий с я тем, что воздействуют световой энергией в количестве не менее мкЕ/г кл. с.
3.Способ по п.1, отличающий с я тем, что используют суспензию штамма N-77 рода Corynehacteriiini. штамма N-776 рода Nocardia, штамма CBS- +g рода Bacillus, штамма CBS- iSt рода Bacteridium, штамма рода Micrococcus или штамма CBS-717 рода Brevibacterium.
4. Способ ПОП.1, отличающийся тем, что в качестве нит- рильного соединения используют ацето- нитрил, пропионитрил, н-бутиронитрил, п-бутиронитрил, н-валеронитрил, ак- рилонитрил, метакрилонитрил, бензо- нитрил, цианопиридин, малононитрил, сукционитрил, фуранонитрил, хлораце- тонитрил, PI-гидроксипропионитрил, аминоацетонитрил или В-аминопрописг- нитрил.
Таблица 1





| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения амидного соединения | 1986 |
|
SU1757473A3 |
| Способ получения амидов | 1988 |
|
SU1838416A3 |
| Способ получения частично гидролизованного полиакриламида | 1984 |
|
SU1271373A3 |
| Способ получения азотсодержащего полисахарида, промотирующего чувствительность к лекарствам у бактерий, устойчивых к антибиотикам | 1978 |
|
SU793408A3 |
| СПОСОБ НЕПРЕРЫВНОГО ПОЛУЧЕНИЯ АМИДНОГО СОЕДИНЕНИЯ, ПРЕДСТАВЛЯЮЩЕГО СОБОЙ АКРИЛАМИД ИЛИ НИКОТИНАМИД | 2002 |
|
RU2279480C2 |
| Способ получения аденозин-5 -трифосфата | 1980 |
|
SU1144619A3 |
| Способ очистки рекомбинантного фактора некроза опухоли | 1985 |
|
SU1630602A3 |
| Способ получения водных растворов акриламида или метакриламида | 1979 |
|
SU1299501A3 |
| Способ культивирования бактерий | 1989 |
|
SU1838408A3 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДА | 1998 |
|
RU2232193C2 |
Изобретение относится к биотехнологии и может быть использовано в производстве амида микробиологическим способом. Цель изобретения - ускорение способа. Амид получают путем гидратации нитрильного соединения с помощью суспензии грамположительных микроорганизмов при 0-20°С и PH среды 6-9, при этом суспензию предварительно облучают светом либо процесс гидратации ведут при освещении, либо осуществляют предварительную обработку светом суспензии и производят таковую по ходу реакции. Для этого используют световую энергию в количестве не менее 1.10-2 мкЕ/г клеток в 1 с. с длиной волны 200-800 нм. Реакцию гидратации проводят в сосуде, состоящем по меньшей мере частично из материала, не пропускающего свет. 3 з.п.ф-лы, 6 табл.
Формула изобретения
35
имечание.
Количество бактериальных клеток 0,088 мае.ч. рН 7,7.
2Ацетонитрил
3Метакрилонитрил Валеронитрил
5Цианопиридин
6Бензонитрил
7Пропионитрил
8н-Бутиронитрил
9Малононитрил
10Сукцинонитрил
11Фумаронитрил
12(5-Гидроксипропио
Ацетоамид20,62,010,3
Метакриламид82,21,,7
ВалерамидИ, 20,720,2
Никотинамид 6,5,62,9
Бензамид12,30,717,6
Пропиоамид102,03,529,
н-Бутиламид220,05,738,9
Малонамид119,0,29 , О
Сукцинамид3 43,010,233,6
Фумарамидб1,11,5 40,7 -ГидроксипроПодаваемая световоя Скорость энергия, мкЕ/г кл. с реакции
(и)
2, «8 X 10-2 6,7 1,86 X 10 31,9
Та6гица2
ТаблицаЗ
Таблица
Таблица5
Изобутиронитрил Изобутирамид
Аминоацетонит- Аминоацет- риламид
-Аминопропио- уй-Аминопро- нитрилпионамид
Таблицаб
О
25,7 18,3
| ДВИГАТЕЛЬ ВНУТРЕННЕГО ГОРЕНИЯ | 1929 |
|
SU17918A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Способ сужения чугунных изделий | 1922 |
|
SU38A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1989-12-15—Публикация
1984-07-11—Подача