Изобретение относится к области производных 2,4-хиназолиндиона, конкретно к новому диглицидильному производному 2,4-хиназолиндиона формулы I
проявляющему противоопухолевую активность.
Соединение формулы I может быть использовано в медицине.
Целью изобретения является изыскание новых эпоксипроизводных, проявляющих повышенную активность и низкую токсичность.
1,3-Диглицидил-2,4-хиназолиндион получается простым и технологическим способом, исходя из доступного сырья антраниловой кислоты и мочевины с высоким выходом (от 58 до 82%). Образующийся на первой стадии 2,4-хиназолиндион (II) далее подвергают взаимодействию с эпихлоргидрином, а затем продукты конденсации дегидрохлорированию щелочами
Соединение I легко может быть доведено до высокой степени чистоты перекристаллизацией из ряда растворителей (например, спиртов, диметилформамида, ацетонитрила).
Строение 1,3-диглицидил-2,4-хиназолиндиона доказано данными элементного анализа ИК- и ПМР-спектроскопии. В спектрах ПМР наблюдаются сигналы протонов глицидильных групп, м.д. (в хлороформе -D)  2,7 м;
2,7 м;  3,7 4,9 м; δ
3,7 4,9 м; δ
В ИК-спектрах наиболее характерны полосы поглощения C=O-групп (ν 1704 c.,1665 c.cм-1);; CH
Изучение противоопухолевой активности 1,3-диглицидил-2,4-хиназолиндиона производят в экспериментах на животных (мышах и крысах) с трансплантируемыми опухолями и лейкемией P-388. Данные по активности соединения I приведены в табл. 1.
Как видно из данных табл. 1, при ежедневном введении в переносимых дозах 1,3-диглицидил-2,4-хиназолиндион проявляет высокую противоопухолевую активность в отношении саркомы Иенсена (Iт 95%), саркомы М-1 (Iт 94%), саркомы Уокера (Iт 98%). Умеренно антибластическое действие выявлено на развитие лейкемии P-388 (Iт до 63%).
По сравнению с известным (1,3-диглицидилбензимидазолоном-2 II) предложенное соединение I проявляет более высокий уровень противоопухолевой активности, что видно из сравнительных данных табл. 2. Так, при одинаковых дозах вводимого препарата Iт на штамме саркомы Иенсена составляет 95% для предложенного соединения против 90% для аналога II, на штамме саркомы М-1 94 против 75% саркомы Уокера 98 против 79% Продление жизни при лейкемии P-388 также более высокое 63 против 39%
1,3-диглицидил-2,4-хиназолиндион I имеет, кроме того, несколько меньший уровень токсичности (см. табл. 3), что видно из сравнения значения ЛД100 (280 против 250 мг/г для аналога II) и максимально переносимых доз (МПД на мышах 80 против 65, на крысах 60 против 50 мг/кг).
По сравнению с тиотэфом III 1,3-диглицидил-2,4-хиназолиндион I обладает значительно меньшей токсичностью (для мышей ЛД100 280 против 30 мг/кг для тиотэфа), более высоким уровнем п/о активности на штамме саркомы М-1 (Iт 94 против 62% для тиотэфа), лейкемии P-388 (увеличение продолжительности жизни 63% тиотэф не проявляет антилейкемической активности), близкой активностью на штамме саркомы Иенсена (Iт 95 против 99%), карциносаркомы Уокера (Iт 98 против 99% для тиотэфа).
Пример 1.
А) 2,4-Хиназолиндион. В колбу емкостью 0,5 л загружают 68,5 г (0,5 моль) антраниловой кислоты 45 г (0,75 моль) мочевины и 75 мл диметилформамида перемешивают и кипятят полученный раствор в течение 3 ч. В ходе нагревания образуется осадок продукта реакции, который после охлаждения отфильтровывают, промывают эфиром, сушат. Выход 47-50 г (58 62%); т.пл. 353 354oC (из воды). Депрессии т.пл. с образцом вещества, полученным согласно не дает.
Аналогичный процесс в уксусной кислоте позволяет достичь таких же выходов чистого 2,4-хиназолиндиона.
Б) 1,3-Диглицидил-2,4-хиназолиндион. В литровую колбу, снабженную мешалкой, обратным холодильником и тубусом для загрузки веществ помещают 45 г (0,278 моль) 2,4-хиназолиндиона, 436 мл (5,56 моль) эпихлоргидрина и 0,46 г (2,78 ммоль) тетраэтиламмонийхлорида, нагревают при перемешивании смесь до 90oC и при этой температуре продолжают перемешивание в течение 10 ч. Примерно через 3,5 ч весь 2,4-хиназолиндион переходит в раствор, который по истечении всего периода нагревания охлаждают до комнатной температуры и в этих условиях дозируют при перемешивании в течение 1,5 ч 23,2 г (0,58 моль) едкого натра. После завершения дозирования щелочи продолжают перемешивание в течение 3 ч. Образовавшийся осадок соли отфильтровывают, отжимают на фильтре, промывают небольшим количеством бензола (50 мл). Фильтрат упаривают в вакууме при 50oC, после чего происходит кристаллизация продукта реакции 1,3-диглицидил-2,4-хиназолиндиона. Выход технического продукта около 75 76 г (98 100%). Продукт на фильтре обрабатывают небольшим количеством эфира (4 х 20 мл), растирают осадок с растворителем, отсасывают и сушат. Получают соединение I в виде белого кристаллического порошка. Выход 44 46 г (58 - 60%); т.пл. 130 133oC (из изопропанола).
Найдено, C 61,0; H 5,0; N 10,3.
C14H14N2O4.
Вычислено, C 61,3; H 5,1; N 10,2.
Rf 0,83 (на силуфоле (ЧССР), элюент хлороформ метанол 5:1).
1,3-Диглицидил-2,4-хиназолиндион I растворим в спиртах, ацетоне, диметилсульфоксиде, диметилформамиде, не растворим -в воде, эфире, гексане.
Пример 2. Противоопухолевую активность соединений изучают в опытах на нелинейных крысах обоего пола (масса тела 110 120 г) с трансплантируемыми опухолями: саркомой Иенсена, саркомой М-1 и саркомой Уокера; мышах линии BDF1 с лейкемией P-388. Всего используют 140 крыс и 110 мышей. Соединение вводят внутрибрюшинно, многократно (5 7 ежедневных введений), начиная через 24 120 ч после трансплантации опухоли, в виде суспензии в 10%-ном растворе поливинилпирролидона. Контрольные животные получают чистый растворитель. В каждой группе по 6 8 животных. Через сутки после последнего введения животных забивают, взвешивают, опухоли иссекают, определяют их массу и вычисляют процент торможения опухолевого роста (индекс торможения, Iт,) по формуле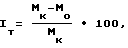
где Mк и Mо средняя масса опухоли в контрольной и опытной группах соответственно.
Продолжительность жизни животных (СПЖ) определяют по формуле
где Mо и Mк средняя продолжительность жизни животных в опытной и контрольной группе соответственно.
Оценку токсического действия 1,3-диглицидил-2,4-хиназолиндиона производят после однократного внутрибрюшинного введения (однократная летальная доза ЛД100), а также путем оценки влияния многократных введений на изменение массы тела подопытных животных по сравнению с изменением массы тела животных в контрольной группе (коэффициент роста Кр,) по формуле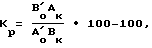
где Ао и Во средняя масса тела животного в начале опыта в опытной и контрольной группах соответственно;
Ак и Вк средняя масса тела животного (без учета массы опухоли) в конце опыта в опытной и контрольной группах соответственно;
Кр с положительным значением свидетельствует о большей, а с отрицательным о меньшей прибавке массы тела животного в подопытной группе по сравнению с контролем.
Преимущества предложенного соединения по сравнению с аналогом II заключаются в увеличении противоопухолевой активности (табл. 2) и уменьшении токсичности средства (табл. 3).
Таким образом, в ряду производных 2,4-хиназолиндиона обнаружены малотоксичные соединения, обладающие высокой противоопухолевой активностью.


Изобретение относится к гетероциклическим соединениям, в частности к 1,3-диглицидил-2,4-хиназолиндиону, проявляющему противоопухолевую активность. Цель - выявление более активных соединений. Получение ведут из антраниловой кислоты и мочевины. Полученный на первой стадии 2,4-хиназолиндион подвергают взаимодействию с эпихлоргидрином, а продукты конденсации - дегидрохлорированию щелочами. Выход 58 - 82%; LD50 280 мг/кг. 3 табл.
1,3-Диглицидил-2,4-хиназолиндион формулы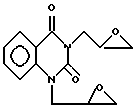
проявляющий противоопухолевую активность.
| Проценко Л.Д., Вулкина З.П | |||
| Химия и фармакология синтетических противоопухолевых препаратов | |||
| Киев, Наукова думка, 1985, с.117-124 | |||
| Патент ФРГ N 3003404, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1997-07-20—Публикация
1988-07-01—Подача