Изобретение относится к химии триазолов, конкретно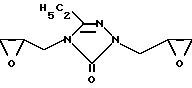
к новому диглицидильному производному 3-этил-1,2,4-триазол-5-она формулы I проявляющему противоопухолевую (ПО) активность.
Цель изобретения получение новых производных 1,2,4-триазола, обладающих большей противоопухолевой активностью и меньшей токсичностью, чем известный структурный аналог 1, 2, 4-триглицидилуразол (соединение II) и аналог по действию тиотэф.
Следующие примеры иллюстрируют способ получения нового соединения.
Пример 1. 3-Этил-1,2,4-триазол-5-он (исходный продукт). В колбу емкостью 0,5 л загружают 144 г (2,4 моль) мочевины и 145 мл (2,9 моль) 97%-ного гидразингидрата, кипятят смесь, барботируя аргоном или азотом в течение 1,5-2 ч. Из полученного раствора при 60-70oC удаляют в вакууме избыток гидразингидрата. К остатку добавляют 200 мл воды и при перемешивании и комнатной температуре дозируют 257 мл (2 моль) пропионового ангидрида в течение 1 ч. Продолжают перемешивание при комнатной температуре в течение 1 ч и 1 ч при 80oC. Затем загружают в охлажденную реакционную смесь раствор 160 г (4 моль) едкого натра в 200 мл воды и нагревают при 90-100oC в течение 4 ч. К полученному раствору добавляют древесный уголь и в горячем виде фильтруют. К охлажденному фильтрату порциями при перемешивании прибавляют концентрированную соляную кислоту до pH 7. Образующийся осадок 3-этил-1,2,4-триазол-5-она отфильтровывают, промывают спиртом и сушат. Выход 117 г (43%). Т. пл. 208-209oC (из воды). Лит. данные 208-209oC.
Пример 2. 1,4-Диглицидин-3-этил-1,2,4-триазол-5-он(I). В колбу емкостью 0,5 л загружают 12,8 г (0,113 моль) тщательно очищенного (двухкратной перекристаллизацией из воды) 3-этил-1,2,4-триазол-5-она, 180 мл (2,26 моль) эпихлоргидрина, 0,7 г (1,1 моль) 30%-ного раствора тетраэтиламмоний ацетата, нагревают до 80oC и после растворения триазолона перемешивают в этих условиях в течение 1 ч. Реакционный раствор охлаждают до 40oC и дозируют при перемешивании в течение 1 ч 9,9 г (приблизительно 0,25 моль)едкого натра. Продолжают перемешивание при 40oC в течение 5 ч. Осадок соли отфильтровывают. Фильтр пропускают через тонкий (приблизительно 1,5-2 см) слой силикагеля и упаривают. Получают 20,6 (81%) почти бесцветного смолообразного продукта, который представляет собой практически чистый 1,4-диклицидил-3-этил-1,2,4-триазол-5-он (I). Очистку осуществляют хроматографически на колонне высотой 1 м и диаметром 35 мм с силикагелем (размер частиц 100/160 мк), элюент хлороформ метанол 10 1 или экстракцией соединения I из смолообразного продукта гексаном. Выход кристаллического соединения I 7,0-8,2 г (28-40%), т. пл. 41-45oC Rf0,59 [на силикагеле "Силуфол" (ЧССР) элюентхлороформ метанол 10:1).
Найдено, C 53,7; H 6,8; N 19,0.
C10H15N3O3.
Вычислено, C 53,7; H 6,7; N 18,7.
Спектр ПМР (CDCl3 внутренний стандарт ТМС), δ м. д. 1,23 т (3Н), 2,66 м (6Н), 3,23 м (2Н), 3,53 д, 3,76 д, 3,93 д, 4,26 д (4Н).
ИК-спектр (в капле), cm-1 3060, 1700, 1590, 915, 975.
Противоопухолевую активность соединения I изучали в опытах на нелинейных крысах (самцах и самках, масса тела 110-120 г) с перевиваемыми под кожу опухолями: саркомой Иенсена, саркомой М-1 и карциносаркомой Уокера и мышах линии BDF1 (обоего поля, массой тела 20-22 г) с меланомой B-16 и лейкемией P-388. Соединение вводили животным в изотоническом растворе хлорида натрия многократно (один раз в сутки ежедневно в течение 5-7 дней) внутрибрюшинно, начиная на пятый день после перевивки солидных опухолей и через 24 ч после инокуляции лейкемии Р-388 и карциносаркомы Уокера. Через день после последнего введения вещества животных с солидными опухолями забивали, опухоли иссекали, взвешивали и путем сравнительной оценки изменения массы опухолей (в опытной и контрольной группах) вычисляли индекс торможения роста опухоли (Iт)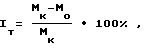
где Мк и Мo средние массы опухолей в контрольном и опытной группы соответственно.
Продолжительность жизни животных определяли по форме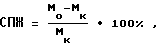
где Mo и Mк -средняя продолжительность жизни животных в опытной и контрольной группах соответственно.
Оценку токсического действия 1,4-диглицидил-3-этил-1,2,4-триазол-5-она проводили на интактных нелинейных мышах обоего пола с массой тела 18-20 г и крысах с массой тела 100-110 г. При этом определяли абсолютную смертельную дозу (ЛД100), среднюю смертельную дозу (ЛД50) и максимально переносимую дозу (МПД). Изучение производилось при однократном и пятикратном (в случае определения МПД) внутрибрюшинном введение вещества (см. табл. 2).
Токсичность веществ также оценивалась путем изучения влияния многократных введений на изменение массы тела подопытных животных по сравнению с изменением массы тела животных в контрольной группе (коэффициент роста, Кр.) по формуле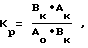
где Ao и Bo средняя масса тела животного в начале опыта в опытной и контрольных группах соответственно;
Aк и Bк -средняя масса тела животного (без учета массы опухоли) в конце опыта в опытной и контрольной группах соответственно; Кр с положительным значением свидетельствует о большей, а с отрицательным о меньшей прибавках массы тела животного в подопытной группе по сравнению с контролем.
Данные по ПО активности соединения I, а также сравнительные данные по 10 активности структурного аналога по действию 1,2,4-триглицидилуразола (соединение II) и действующего противоопухолевого препарата тиотэфа приведены в табл. 1.
Как видно из этих данных, при ежедневном введении мышам и крысам в переносных дозах соединения I отчетливо подавляют рост саркомы Иенсена (Iт93% ). Уменьшение вводимой дозы на 30% от максимально переносимой приводит к незначительному ослаблению ПО активности (Iт86%). Высокочувствительными к действию соединения I оказались и другие перевиваемые опухоли крыс, особенно карциносаркома Уокера. При внутрибрюшинном введении соединения I в переносимых дозах крысам с карциносаркомой Уокера наблюдалось практически полное торможение роста опухоли (до 99,7%). Причем у 85% животных наблюдалась практически полная регрессия опухолевой ткани. При ежедневных внутрибрюшинных инъекциях соединения I крысам с саркомой М -1 (в переносимых дозах) вызывало торможение ее роста на 97% Высокая антибластическая активность соединения I отчетливо прослеживается при использовании его для мышей линии BDF1 с меланомой В-16. Замедление роста этой опухоли 94% Соединение I также способно удлинять продолжительность жизни мышей с лейкемией Р-388 (более чем в два раза).
По сравнению с соединением II соединение I на всех использованных моделях экспериментальных штаммов опухолей проявляет более высокий уровень ПО активности, что видно из сравнительных данных табл. 1. Так, на штамме саркомы Иенсена Iт для соединения I составляет 93 против 63% для уразола, на штамме саркомы М-1 97 против 20% на штамме карциносаркомы Уокера 99,7 против 59% меланомы В-16 94 против 48% лейкемии Р-388 увеличение продолжительности жизни животных 101% для соединения I против 60% для триглицидилуразола.
Соединение I проявляет значительно менее высокий уровень токсичности по сравнению с 1,2,4-триглицидилуразолом ( в 3-4 раза), что видно из сравнения значений ЛД100, ЛД50 и МПД для соединения I и известного структурного аналога (на мышах ЛД100 для соединения I 300 мг/кг против 80 мг/кг для аналога, ЛД50 120 против 35 мг/кг, МПД75 против 25 мг/кг, на крысах ЛД100 для соединения I 240 против 60 мг/кг для аналога, ЛД50 100 против 25 мг/кг, МПД 65 против 13 мг/кг) (см. табл. 2).
По сравнению с тиотэфом соединение I проявляет значительно меньшую ( в 10 раз) токсичность (на мышах ЛД100 для соединения I 300 мг/кг против 30 мг/кг для тиотэфа, ЛД50 120 против 18,2 мг/кг, на крысах ЛД100 240 против 20 мг/кг, ЛД50 100 против 8,4 мг/кг) (см. табл. 2), а также более высокий уровень ПО активности на штамме саркомы М-1 (Iт 97 против 62%), меланомы В-16 (Iт 94 против 45%), близкий уровень ПО активности на штаммах саркомы Иенсена (Iт 93 против 99,8%), карциносаркомы Уокера (Iт 99,7 против 99,9%). В большинстве случаев применения соединения I отмечаются небольшие отрицательные коэффициенты роста (Кр) животных, свидетельствующие о хорошей переносимости вещества.

Изобретение касается производных триазола, в частности 1,4-диглицидин-3-этил-1-2,4-триазол-5-она, обладающего противоопухолевой активностью, что может быть использовано в медицине. Цель - создания новых более активных и менее токсичных веществ указанного класса. Синтез ведут из 3-этил-1,2,4-триазол-5-она и эпилхлоргидрина в присутствии водной щелочи в течение 5 ч. Выход 40% Т. пл. 41-45oC. Брутто-ф-ла C10H15N3O3. Новое вещество в 4-5 раз менее токсично, чем 1,2,4-триглицидилуразол и препарат Тиотаф. Новое соединение подавляет рост саркомы. Иенсена на 93%, саркомы М-1 на 97%, карциносаркомы Уокера на 99,7%, меланомы В-16 на 94% против 65, 20 59 и 48% соответственно. 2 табл.
1,4-Диглицидил-3-этил-1,2,4-триазол-5-он формулы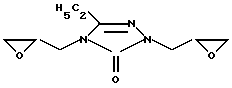
проявляющий противоопухолевую активность.
| Glhlen H | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Lieb | |||
| Ann | |||
| Chem | |||
| Автоматическое или полуавтоматическое телефонное устройство | 1925 |
|
SU1949A1 |
| Способ укрепления под покрышкой пневматической шины предохранительного слоя или манжеты | 1917 |
|
SU185A1 |
| Проценко Л | |||
| Д | |||
| Булкина З | |||
| П | |||
| Химия и фармакология синтетических противоопухолевых препаратов | |||
| - Киев: Наукова думка, 1985, с | |||
| Аппарат для испытания прессованных хлебопекарных дрожжей | 1921 |
|
SU117A1 |
| Чернов В | |||
| А | |||
| Методы экспериментальной химиотерапии | |||
| - М.: Медицина, 1971, с | |||
| Клапан | 1919 |
|
SU357A1 |
| Патент ФРГ N 3102373, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Устройство для видения на расстоянии | 1915 |
|
SU1982A1 |
Авторы
Даты
1997-07-20—Публикация
1989-10-30—Подача