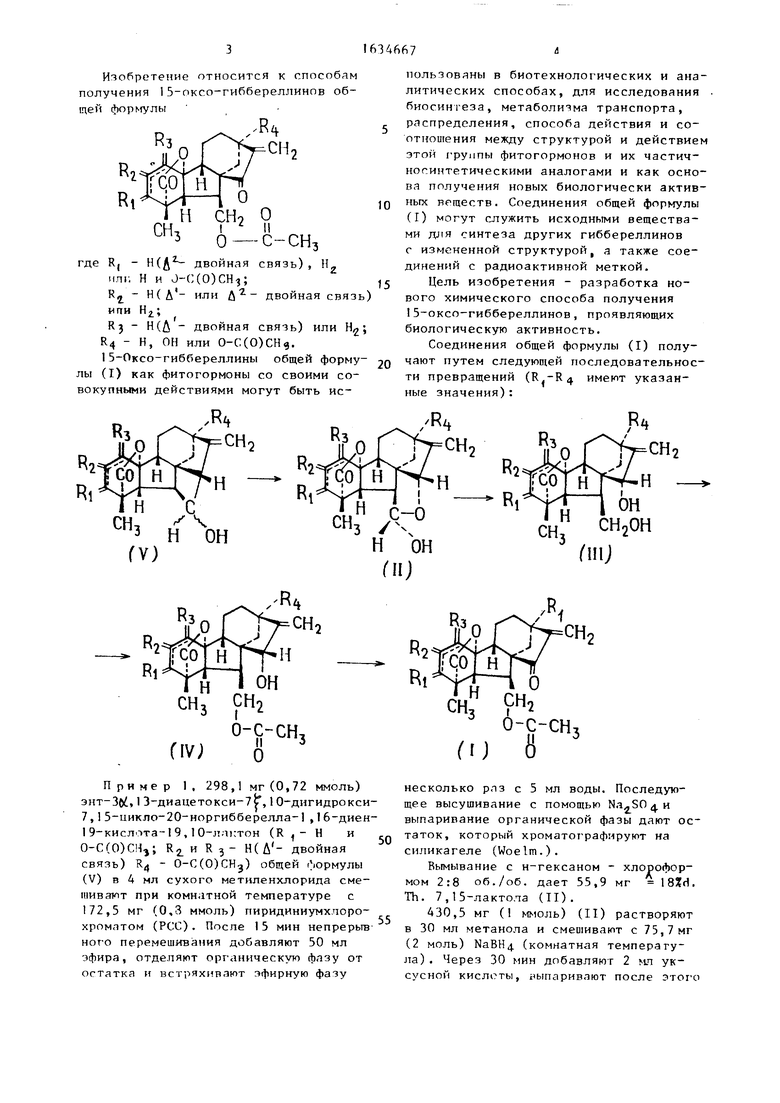
Изобретение относится к способам получения 1 5-оксо-гиббереллинов общей формулы
Ъ - ,
-. -1
г со
о
СН2 О
,, I II
1з о - с-сн3
где R, - двойная связь) , HZ ип1, Н и J-C(0)
R Н(Д - или Д двойная связь ипи
R3 (Д двойная связь) или R4 - Н, ОН или 0-С(0)СН. 15-Оксо-гибберелпины общей формулы (I) как фитогормоны со своими совокупными действиями могут быть ис
0
пользованы в биотехнологических и аналитических способах, для исследования биоситеза, метаболизма транспорта, распределения, способа действия и соотношения между структурой и действием этой группы фитогормонов и их частич- ногинтетическими аналогами и как основа получения новых биологически активных веществ. Соединения общей формулы (I) могут служить исходными веществами для синтеза других гиббереллинов с измененной структурой, а также соединений с радиоактивной меткой.
Цель изобретения - разработка нового химического способа получения 1 5-оксо-гиббереллинов, проявляющих биологическую активность.
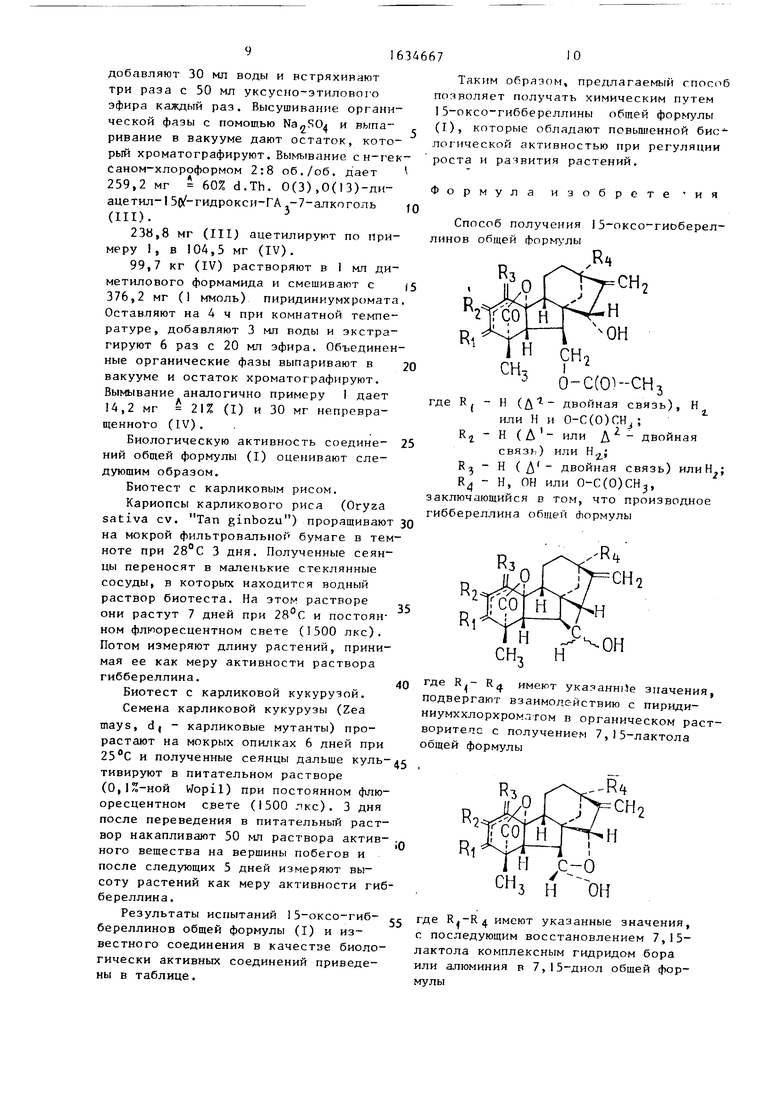
Соединения общей формулы (I) получают путем следующей последовательности превращений (R -R имеют указанные значения):



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения гиббереллин-7-кислоты | 1979 |
|
SU1109398A1 |
| Способ эпимеризации гиббереллин-7-альдегидов | 1979 |
|
SU1109399A1 |
| Способ получения замещенных азиридинов | 1973 |
|
SU464582A1 |
| Способ получения 2,3-дидезокси3-фторпиримидиннуклеозидов или их ацилпроизводных | 1973 |
|
SU666184A1 |
| Способ получения азиридинов | 1973 |
|
SU530025A1 |
| Способ получния производных изатина или их 3-тиосемикарбазонов | 1974 |
|
SU520356A1 |
| Способ получения амидов кислот пятивалентного фосфора | 1974 |
|
SU510478A1 |
| Способ получения производных простановой кислоты | 1973 |
|
SU648088A3 |
| Способ получения пептидов, содержащих сульфат тирозина | 1977 |
|
SU920053A1 |
| СПОСОБ ПОЛУЧЕНИЯ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2026296C1 |
Изобретение касается гетероциклических вешеств, в частности со-гиббереллинов - фитогормонов, используемых в биотехнологии и аналитике для исследования биосинтеза, метаболизма, транспорта, распределения, способа действия и соотношения между структурой и действием, а также для синтеза других гибберелпичов с измененной структурой и соединений с радиоактивной меткой. Цель - создание нового способа получения активных веществ указанного класса. Синтез ведут из соединения cb-лы (1), которое последовательно обрабатывают пиридиниумхлорхромлгом в органическом растворителе, комплексным гидридом бора или алюминия, ацетилирующим агентом и МпО ити пирндиниумдихрома- том с попученисм соединения ()-лы (II), ю (Л Кз & со Јъ О О5 где R - ЖД двойная связь), Н2 или СН3-С(0;-0-; ЩД нли двойная связь) или Нг; RJ - ЬКД1- двойная связь) или ; ц. - Н , ОН ли 
3 f«2
о-с-сн,
fiv;
и о
Пример 1 , 298,1 мг (0,72 ммоль) энт-ЗУ 1З-диацетокси-7, 10-дигидрокси- 7,15-цикло-20 норгибберелла-I,16-диен- 1 9-кисл та-1 9,1 0-лдктон (R - Н и 0-С(0)СН3; Rz и R3- Н(Д - двойная связь) R - O-C(O)CHj) общей Формулы (V) в k мл сухого метиленхлорида смешивают при комн.1тной температуре с 172,5 мг (0,3 ммоль) пиридиниумхпоро- хроматом (РСС). После 15 мин непрерыв ного перемешивания добавляют 50 мл эфира, отдепяют органическую фазу от остатка и встряхивают эфирную фазу
, fy
ft
(т)
0
5
несколько рлз с 5 мл воды. Последующее высушивание с помощью 4. и выпаривание органической фазы дают остаток, который хроматографируют на силикагеле (Woe 1m.).
Вымывание с н-гексаном - хлороформом 2:8 об./об. дает 55,9 мг 18%d. Th. 7,15-лакточа (II).
430,5 мг (1 ммоль) (II) растворяют в 30 мл метанола и смешивают с 75,7мг (2 моль) NaBH4 (комнатная температу- ла). Через 30 мин добавляют 2 мл уксусной кислоты, выпаривают после этого
51634667
в вакууме, добавляют 30 мл воды и три
(М
- раза встряхивают с 50 мл этилового эфира уксусной кислоты каждый раз. Высушивание органической фазы при по- мощи Na-SO. и выпаривание в вакууме дают остаток, который хроматографи- руют. Вымывание с н-гексаном - хлороформом 2:8 обЛэб. дает 250,6 мг 58% З.ТЬ. 0(3), 0(13)-диацетил-15 - гидрокси-ГА v-7-алкоголь (III), аморфный.
Катионный и анионный МС, т/е:473 (М или М) .
Дальнейшее вымывание с н-гексаном - хлороформом 6:4 об./об, дает .30,3 мл непревращенного производногс 15-гидрокси-7 ацетоксигиббереллина (IV).
Пример 2, 300 мг (0,7 ммоль) О энт-Зо, 13-диацетокси-7| , 1 0-дигидрок- си-7,15-цикло-20-норгиббереллл-16 эн 19-кислота 19,10-лактона (R - Н - и 0-С(0)СН,,, R,, и R, - Н.
R43, +93,5 (с 0 96 в этаноле). к „ к,
1R(CHClj):ViKC. см-1: 3450 вч.(ОН); 0-С(0)СН3) общей формулы (Y) в 4 мл 1770 tf-лактон-СО); 1735 (ацетил-СО); (5 сухого метиленхлоРида смешивают при
и 1250(ацетил-С-0)
Катионный и анионный МС, т/е:432 (М + или М).
Н-ЯМР (CDC1,), ррт 1,31 (S.18-HJ; 2,03 и 2,10 (з, два ацетата); 2,72 (d, J М Гц, 5-Н); 3,74-3,92 (т, 7-Н); 4,25 (га, 15-Н); 5,23 и 5,45 (т, 17-Нг); 5,29 (d, J 3,5 Гц, 3-Н); 5,82 (dd, J 9 Гц, J 3,5 Гц, 2-Н) и 6,33 (d, J 9 Гц, 1-Н).
238,8 (0,55 ммоль) (III) смешивают при комнатной температуре с 2,5 мл ацетатгидрида и 2,5 мл пиридина. После 2 ч отстаивания выпаривают в вакууме и хроматографируют остаток. Вымывание с н-гексан-хлороформом 6:4 об./об, дает 104,5 мл 40% d.Th. 0(3), 0(7), 0(13)-триацетил-15-х(-гид- рокси-ГАэ-7 алкоголь (IV) т.пл.147- 148°С (эфир).
( N8,7° (с 0,40 в этаноле) .
Катионный и анионный МС, т/е:474 (М + или М-),99,7 мг (0,21 ммоль) (IV) растворяют в I2 мл ацетона и смешивают с 1,1 г ATTENBURROW - МпО. Оставляют 200 ч при встряхивании и комнатной температуре под аргоном, фильтруют, вымывают МпО десять раз с помощью 50 мл ацетона каждый раз и выпаривают объединенные органические фазы в вакууме. Хроматография остатка на сн- ликагеле (Woe1га) дает при вымывании с н-гексаном - хлороформом 7:3 об./об. 13,9 мг 20% d.Th. 0(3),0(7),0(13)- триацетил-15-оксо-ГА3-7-алкоголь (1) аморфный.
95,7° (с 0,31 в этаноле).
HKCHCl tfjMuu, 1775 (#- лактон-СО); 1740 (ацетат-СО); 1705 (энон-СО), 1660 (энон-С с) и (ацетил-СО).
20
25
комнатной температуре с 172,5 мг (0,8 ммоль) пиридиниумхлорохромата. После 15 мин непрерывного перемешивания добавляют 50 мл эфира, отделяют органическую фазу от остатка и встряхивают эфирную фазу несколько раз с 5 мл воды. Последующее высуши- вание с помощью . и выпаривание органической фазы дают остаток, который хроматографируют на силикагеле (Woelm). Вымывание с н-гексаном-хлоро формом 2:8 об./об, дает 57 мг 19% d.Th. 7,15-лактола (II).
432,5 мг (1 ммоль) (II) растворяют
30 в 30 мл метанола и смешивают с 75,7 мг (2 ммоль) NaBH. при комнатной те мпера туре. После 30 мин добавляют 2 мл ледяной уксусной кислоты, выпаривают в вакууме, добавляют 30 мл и встряхива35 ют 3 раза с 50 мл уксусно-этилового эфира каждый раз. Высушивание органической фазы при помощи .и выпар вание в вакууме дают остаток, который хроматографируют. Вымывание с н-гек40 саном - хлороформом 2:8 об./об. дает 260 мг 60% d.Th 0(3),0(13)-диацетил 15оЈ-гидрокси-ГА -7-алкогол (III) , аморфный.
45 К(СНС1а) , см 1: 3400 br. (ОН); 1770 (ХЧпактои-СО); 1735 (ацетил-СО) ; 1250 (ацетил-С-0).
50
55
Катнонный и анионный МС, т/е:434 (М4 или М).
240 мг (III) смешивают с 2,5 мл ацетангидрида и 2,5 мл пиридина. Через 2 ц отстаивания выпаривают при в вакууме и хроматографируют остаток. Вымывание с н-гексаном - хлороформом 6:4 об./об. дает 105 мг 40% d.Th. 0(3),0(7),0(13)-триацетил-15Л-гидрок си-ГА,-7-алкоголь (IV), аморфный, ,6 ° (с 0,33 в этаноле).
Катионный и анионный МС, т/е:473 (М или М) .
Дальнейшее вымывание с н-гексаном - хлороформом 6:4 об./об, дает .30,3 мл непревращенного производногс 15-гидрокси-7 ацетоксигиббереллина (IV).
Пример 2, 300 мг (0,7 ммоль) энт-Зо, 13-диацетокси-7| , 1 0-дигидрок- си-7,15-цикло-20-норгиббереллл-16 эн- 19-кислота 19,10-лактона (R - Н - и 0-С(0)СН,,, R,, и R, - Н.
R4 к „ к,
0-С(0)СН3) общей формулы (Y) в 4 мл сухого метиленхлоРида смешивают при
комнатной температуре с 172,5 мг (0,8 ммоль) пиридиниумхлорохромата. После 15 мин непрерывного перемешивания добавляют 50 мл эфира, отделяют органическую фазу от остатка и встряхивают эфирную фазу несколько раз с 5 мл воды. Последующее высуши- вание с помощью . и выпаривание органической фазы дают остаток, который хроматографируют на силикагеле (Woelm). Вымывание с н-гексаном-хлоро- формом 2:8 об./об, дает 57 мг 19% d.Th. 7,15-лактола (II).
432,5 мг (1 ммоль) (II) растворяют
в 30 мл метанола и смешивают с 75,7 мг (2 ммоль) NaBH. при комнатной те мпера- туре. После 30 мин добавляют 2 мл ледяной уксусной кислоты, выпаривают в вакууме, добавляют 30 мл и встряхивают 3 раза с 50 мл уксусно-этилового эфира каждый раз. Высушивание органи ческой фазы при помощи .и выпари- вание в вакууме дают остаток, который хроматографируют. Вымывание с н-гексаном - хлороформом 2:8 об./об. дает 260 мг 60% d.Th 0(3),0(13)-диацетил- 15оЈ-гидрокси-ГА -7-алкогол (III) , аморфный.
К(СНС1а) , см 1: 3400 br. (ОН); 1770 (ХЧпактои-СО); 1735 (ацетил-СО) ; 1250 (ацетил-С-0).
Катнонный и анионный МС, т/е:434 (М4 или М).
240 мг (III) смешивают с 2,5 мл ацетангидрида и 2,5 мл пиридина. Через 2 ц отстаивания выпаривают при в вакууме и хроматографируют остаток. Вымывание с н-гексаном - хлороформом 6:4 об./об. дает 105 мг 40% d.Th. 0(3),0(7),0(13)-триацетил-15Л-гидрок си-ГА,-7-алкоголь (IV), аморфный, ,6 ° (с 0,33 в этаноле).
Катионкый и анионный МС , га/е: 476 (М или М) .
100 мг (IV) растворяют в 12 мл ацетона и смешивают с 1,1 г ATTENBURROW- МпО„.Встряхивают 200 ч при 20° С под аргоном, фильтруют, вымывают МпО с помощью 50 мл ацетона 10 раз и выпаривают объединенные органические
воды и встряхивают три раза с 50 мл уксусно-этилового эфира каждый раз.
Высушивание органической фазы с I и выпаривание в вакууме дает остаток, который хроматографируют. Вымывание с хлороформом-уксусно-этиловым эфиром 9:1 об/об.дает 206,3мг - 62% d.Th. 1 5(У гидрокси-ГА -7-алфаэы в вакууме. Хроматография остатка JQ коголь (), аморфный, на силикагеле (Woelm) дает при вымывании с н-гексаном - хлороформом 7: л
Мз -12,3° (схО,53 в этано:3 об./об. 14 мг S 20% d.Th. 0(3), ОГ7),0(13)-триацетил-15-оксо-ГА -7- алкоголь (Т), аморфный.15
XI + 40,2 (с - 0,42 в этаноле) .
Катионный и анионный МС, т/е:474 ( или М) .
4Н-ЯМР (CDC13), ppm: 1,14 (s, 20 18-Н3); 2,02, 2,10 и 2,11 (s, три ацетата); 2,69 (d,J 10 Гц, 5-Н) ; 4,59 (d. J 6 Гц, ); 5,26 (га, 3-Н); 5,50 и 6,28 (т. 17-Н2).
IR (СНС13)г5макс ,см-(: 1775 ( тон-СО); 1740 (ацетат-СО); 1705° (энон-СО); 1660 (энон ) и 1255 (ацетил-С-0).
Дальнейшее вымывание с н-гексаном - хлороформом 6:4 об./об. дает 30 31 мг непревращенного (IV).
ле).
1R (CHCljM. ,см- : 3470 Вг (ОН), 1770 (J -лактон-СО).
Катионный и анионный МС, т/е: 332 (М4- или М).
184,5 мг (0,55 ммоль) (III) смешивают с 2,5 мл ацетангидрида и с 2,5 мл пиридина. После отстаивания 2 ч при 20°С выпаривают в вакууме и хроматографиругат остаток. Вымывание с н-гексаном-хлороформом 2:8 об./об. дает 110,2 мг 53% d.Th. 0(7)-аце- тил-1 5 рЈ -гидрокси-ГАд--7-алкоголъ (IV) 213-215°С (из ацетона).
(XJif- 12 9° с в этаноле).
Катионный и анионный МС, га/е: 374 (М + или М).
78,5 мг (0,21 ммоль) (IV) растворяют в 12 мл ацетона и смешивают с 1,I г ATTENBURROW-MnO. Встряхивают 200 ч при 20°С под аргоном,
р 3. 227,1 мг (0,72 моль) энт-7 t ,10,1З-тригидрокси-7,15-цикфильтруют, вымывают 50 мл ацетона
Мп02 10 раз с
Приме
и выпаривают объединенло 20 норгибберелла-2,1б-диэн-19-кис-35 ные огранические фазы в накууме. Хрома- лота-19, 10-лактон (RjjHR H(A - двойная связь), RJ - Кг, R,j. - ОН) общей формулы (V) в 4 мл сухого мети- ленхлорида смешивают при комнатной
тография остатка на силикагеле (Woelm)
дает при вымывание с н-гексаном-хлороформом 4:6 об./об. 22,2 мг 28%
температуре с 172,5 мг (0,8 моль) пиридиниумхлорохромата. Через 15 мин непрерывного перемешивания добавляют 50 мл эфира, отделяют органическую фазу JT остатка и встряхивают эфирную фазу несколько раз с 5 мл воды. Последующее высушивание и выпаривание органической фазы дают остаток, который хроматографируют на силикагеле (Woelm). Вымывание с н-гексаном-хлороформом 1:9 об./об. дает 42,8 мг 18%, d.Th. 7,15-лакd.Th. О(7)-ацетил-15 оксо-ГА -7-алко- 40 голь (I), аморфный.
М -43,7° (с 0,47 в этаноле).
1R (СНС1):9Мке,см- : 1775 ( J1-лактон-СО) ; 1745 (ацетат-СО); 1705 (энон-СО).
45 H-NMR (аиетон-Dg), ppm: 1,22 (s, 18-Fj); 2,09 (s, ацетат); 4,30 до 4,56 (m, 7-Hfc); 4,86 и 5,12 (m,17-Hj, 5,58-5,86 (m, 2-H иЗ-Н).
Дальнейшее вымывание, с н-гексаном- 50 хлороформом 6:4 об/об дает 28,1 мг непревращенного (IV).
тол
(II).
75,7мг55
330,4 мг (1 моль) (II) растворяют в 30 мп метанола и смешивают с (2 ммоль) NaBH при комнатной температуре. Через 30 мин добавпяют 2 мл ледяной уксусной кислоты, потом выпаривают в вакууме, добавляют 30 мл
воды и встряхивают три раза с 50 мл уксусно-этилового эфира каждый раз.
Высушивание органической фазы с I и выпаривание в вакууме дает остаток, который хроматографируют. Вымывание с хлороформом-уксусно-этикоголь (), аморфный,
Мз -12,3° (схО,53 в этаноле).
1R (CHCljM. ,см- : 3470 Вг (ОН), 1770 (J -лактон-СО).
Катионный и анионный МС, т/е: 332 (М4- или М).
184,5 мг (0,55 ммоль) (III) смешивают с 2,5 мл ацетангидрида и с 2,5 мл пиридина. После отстаивания 2 ч при 20°С выпаривают в вакууме и хроматографиругат остаток. Вымывание с н-гексаном-хлороформом 2:8 об./об. дает 110,2 мг 53% d.Th. 0(7)-аце- тил-1 5 рЈ -гидрокси-ГАд--7-алкоголъ (IV) 213-215°С (из ацетона).
(XJif- 12 9° с в этаноле)
Катионный и анионный МС, га/е: 374 (М + или М).
78,5 мг (0,21 ммоль) (IV) растворяют в 12 мл ацетона и смешивают с 1,I г ATTENBURROW-MnO. Встряхивают 200 ч при 20°С под аргоном,
фильтруют, вымывают 50 мл ацетона
Мп02 10 раз с
и выпаривают объедине
ные огранические фазы в накууме. Хрома-
тография остатка на силикагеле (Woelm)
дает при вымывание с н-гексаном-хлороформом 4:6 об./об. 22,2 мг 28%
ные огранические фазы в накууме. Хрома-
d.Th. О(7)-ацетил-15 оксо-ГА -7-алко- голь (I), аморфный.
М -43,7° (с 0,47 в этаноле).
1R (СНС1):9Мке,см- : 1775 ( J1-лактон-СО) ; 1745 (ацетат-СО); 1705 (энон-СО).
H-NMR (аиетон-Dg), ppm: 1,22 (s, 18-Fj); 2,09 (s, ацетат); 4,30 до 4,56 (m, 7-Hfc); 4,86 и 5,12 (m,17-Hj, 5,58-5,86 (m, 2-H иЗ-Н).
Дальнейшее вымывание, с н-гексаном- хлороформом 6:4 об/об дает 28,1 мг непревращенного (IV).
Приме р 4. 7,15-лактол (II) получают по примеру 1.
430,5 мг (I ммоль) (II) растворяи смешивают с
ют в 60 мл метанола 507,8 мг (2 ммоль) LiAlH (Ot.C, при комнатной температуре. Через 1 ч добавляют 2 мл ледяной уксусной кислоты, потом выпаривают в вакууме,
9163
добавляют 30 мл воды и встряхивают три раза с 50 мл уксусно-этилового эфира каждый раз. Высушивание органической фазы с помощью и выпаривание в вакууме дают остаток, который хроматографируют. Вымывание сн-гек
саном-хлороформом 2:8 об./об. дает 259,2 мг 60% d.Th. 0(3),0(13)-ди- ацетил-1 Sty -rHflpoKCH-FA ,-7-алкоголь JQ (III).
238,8 мг (III) ацетилируют по примеру 1, в 104,5 мг (IV).
99,7 кг (IV) растворяют в 1 мл ди- метилового формамида и смешивают с /5 376,2 мг (1 ммоль) пиридиниумхромата. Оставляют на 4 ч при комнатной температуре, добавляют 3 мл воды и экстрагируют 6 раз с 20 мл эфира. Объединенные органические фазы выпаривают в 20 вакууме и остаток хроматографируют. Вымывание аналогично примеру 1 дает 14,2 мг 21% (I) и 30 мг непревращенного (IV) .
Биологическую активность соедине- 25 ний общей формулы (I) оценивают следующим образом.
Биотест с карликовым рисом.
Кариопсы карликового риса (Oryza sativa cv. Tan ginbozu) проращивают зо на мокрой фильтровальной бумаге в темноте при 28°С 3 дня. Полученные сеянцы переносят в маленькие стеклянные сосуды, в которых находится водный раствор биотеста. На этом растворе
35
они растут 7 дней при 28 С и постоян
ном флюоресцентном свете (1500 лкс). Потом измеряют длину растений, принимая ее как меру активности раствора гиббереллина.
Биотест с карликовой кукурузой.
Семена карликовой кукурузы (Zea mays, df - карликовые мутанты) прорастают на мокрых опилках 6 дней при 25°С и полученные сеянцы дальше культивируют в питательном растворе (0,1%-ной Wopil) при постоянном флюоресцентном свете (1500 лкс). 3 дня после переведения в питательный раствор накапливают 50 мл раствора актив- ного вещества на вершины побегов и после следующих 5 дней измеряют высоту растений как меру активности гиббереллина.
Результаты испытаний 15-оксо-гиб- береллинов общей формулы (I) и известного соединения в качестве биологически активных соединений приведены в таблице.
10
Таким образом, предлагаемый способ позволяет получать химическим путем 15-оксо-гиббереллины общей формулы (Т), которые обладают повышенной логнческой активностью при регуляции роста и развития растений.
Формула изобрете и я
Способ получения 15-оксо-гиоберел- линов общей формулы
R«
R;
0-С(
где R, - Н (Д1- двойная связь), Н или Н и 0-С(0)СН.;
I5
Н (Л или Д - двойная
связь) или
Н ( Д(- двойная связь) илиН
Н, ОН или 0-С(0)СН3, заключающийся в том, что производное гиббереллина общей Формулы
(
R-
R3 - R/i
зо 35
ОН
4 имеют указанное значения, подвергают взаимодействию с пириди- ниумххлорхромлгом в органическом растворителе с получением 7,15-лактола общей формулы
R
ОН
где R.-R имеют указанные значения, с последующим восстановлением 7,15- лактола комплексным гидридом бора или алюминия в 7,15-диол общей формулы
R
CH2OH
где R,-R имеют указанные значения, с последующим его ацетилированием в 15-гидрокси-7-ацетокси гибберел- линовое проитводное общей формулы
Активность 15-оксо-гиббереллинов обшей формулы (I) в биотестах с карликовым рисом и с карликовой кукурузой (концентрация активного вещества: моль/л)
Контроль растворения
0(3), 0(7), 0(13)-триацетил-ГА3-7-ал к о голь
(I) по примеру 1
0(13), 0(7), 0(13)-триацетил-ГА,-7-алкоголь
(I) по примеру 2Ј.
0(7),0(13)-диацетил-ГАЈ-7-алкоголь
(I) по примеру 3
Известное активное вещество
R
CH,
CH7 0-C(0)-CH3
где Rj-Rjj имеют указанные значения, с последующим его окислением двуокисью марганца или пиридиниумди- хронатом.
100
104 1 10
102 107 106
1 10
| Jamaguchi I, Jokofa Т., Murofus- hi N | |||
| , Ogawa J., Takahashi N | |||
| - Agric | |||
| Biol | |||
| Chem, П570), 34, 1439 | |||
| Bukovac M,I., Juda E., Murofus- hi N., Takahashi N | |||
| - Plant, Phys., |
Авторы
Даты
1991-03-15—Публикация
1981-04-21—Подача