Изобретение относится к иммунологии и может найти применение в клинической практике для оценки состояния гуморального иммунитета и в биотехнологии,
Целью изобретения является повышение точности способа за счет определения количества и аффинитета антител, продуцируемых отдельной антителообразующей клеткой суспензии.
Поставленная цель достигается тем, что в известном способе, включающем иммобилизацию антигена на нитроцеллюлозной мембране, культивирование на ней анализируемой клеточной суспензии, с последующим удалением клеток и выявлением пятен иммунных комплексов иммунопероксидаз- ным методом, согласно изобретению в качестве субстрата в иммунопероксидазном
методе используют п-фенилендиамин в буфере с рН 6,2 - 6,3, нитроцеллюлозную мембрану денситометрируют, анализируют форму пика оптической плотности каждого пятна на ней, используя характеристики пика оптической плотности, численно решают уравнение диффузии антител по иммобилизованному антигену, и определяют аффинитет и количество антител, продуцируемых каждой антителообразующей клеткой за время эксперимента. Сумма продуктивно- стей всехантителобразующих клеток в совокупности с их количеством, полностью характеризует активность антителообра- зующих клеток в анализируемой клеточной суспензии.
Использование в качестве субстрата л- фенилендиамина в буфере с рН 6,2 - 6,3
о ю
VI сл
0
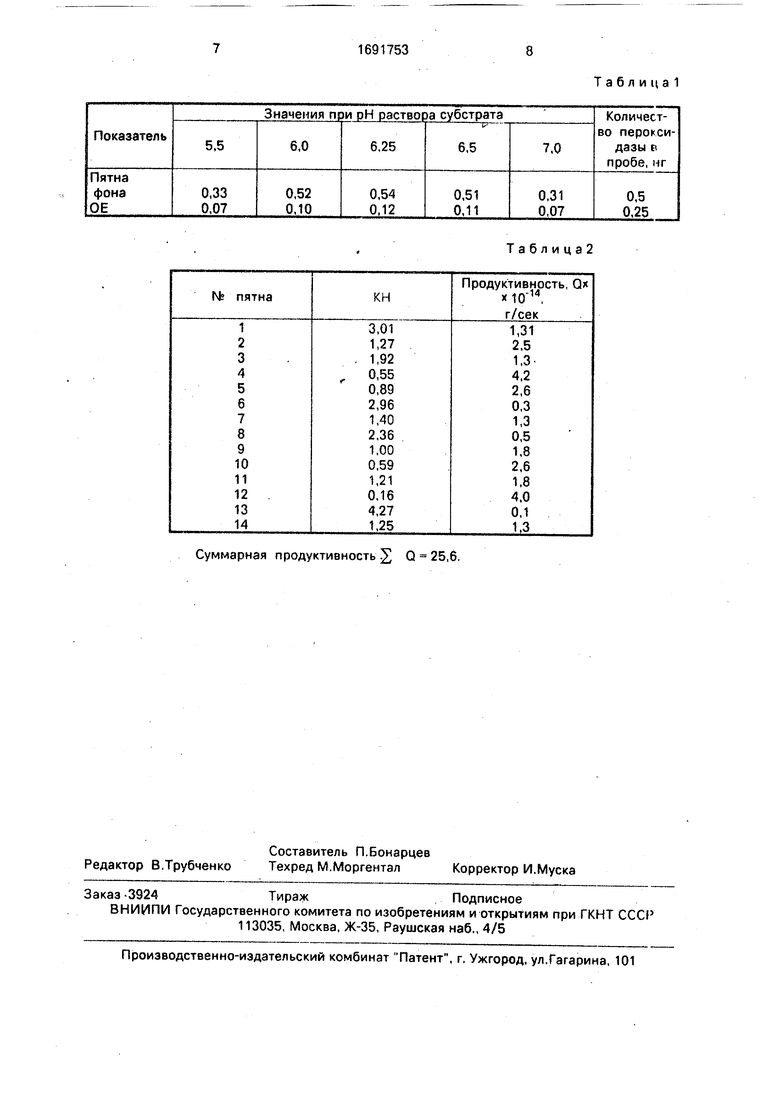
позволяет добиться максимальной чувствительности при выполнении иммуноперокси- дазного метода. Выбор субстрата и условий был осуществлен в предварительных экспериментах с иммобилизованной на нитро- целлюлозной мембране пероксидазой хрена, Максимальная интенсивность окраски была получена при использовании п-фе- нилдиамина в буфере с рН 6,2 - 6,3 (табл.1). Высокая чувствительность иммуно- пероксидазного метода позволяет сократить время, всего способа, тем самым снизить ошибку неоднородности продукции антител, а интенсивная окраска пятен дает возможность провести детальное сканирование каждого пятна. Анализируя форму пика оптической плотности пятна, удается рассчитать с помощью предложенных формул, аффинитет и количество антител продуцируемых каждой клеткой за единицу времени. Тем самым охарактеризовать активность антителообразующих кле- гок в исследуемой клеточной суспензии двумя параметрами: количеством антитело- образующих клеток в расчете на общее количество клеток и суммарной их продуктивностью, вычисленной с учетом аффинитета антител продуцируемых каждой отдельной антителообразующей клеткой. Таким образом, становится возможным в одном эксперименте полностью и точно охарактеризовать активность антителообразующих клеток.
Сущность способа заключается в следующем.
Нитроцеллюлозную мембрану с сорбированным на ней антигеном, помещают на дно сосуда для культивирования клеток, куда затем вносят анализируемую клеточную суспензию в среде культивирования. После инкубации в атмосфере 5% углекислого газа при 37°С в течение 3 ч, мембрану промывают и переносят в раствор антиимму- ноглобулинового коныогата на 16-20 ч. Затем тщательно отмывают и инкубируют с раствором п-фенилендиамина в буфере с рН 6,2 - 6,3 в течение 5-10 мин. Реакцию останавливают, перенося мембрану в дистиллированную воду. Высушенную мембрану денситометрируют, определяя для каждого проявившегося пятна максимальную оптическую плотность (пятно учитывают если его максимальная оптическая плотность не меньше 0,05) и диаметр на полувысоте пика оптической плотности. Эти данные используют для численного решения системы уравнений, полученных из теоретических представлений о диффузии антител из точечного источника по антигену иммобилизованному на пористом носителе
00
1 -е
У A4t
/
1 + кнр) оЗ
0)
У Д4
Ј±ЕнаЙ.,о)ф1
где у - параметр интегрирования;
1о(у) - функция Бесселя;
0 S - концентрация связанных антител в центре пятна;
А- коэффициент диффузии; К - константа связывания в реакции антиген-антитело;
Н - концентрация иммобилизованного антигена;
Q - продуктивность клетки; t - время опыта; DI - шаг сканирования;
0 D2 - диаметр пятна на полувысоте оптической плотности,
Решая систему уравнений, определяют КН0 - величину, характеризующую аффинитет, и Q - продуктивность, антителооб- 5 разующей клетки (количество, г) иммуноглобулинов, секретированное клеткой в единицу времени (с). Для этого оценивают недостающие параметры: коэффициент диффузии - в случае иммуног- 0 лобулинаС Л 0, (с/ст); время опыта х 10800с(3ч); Da-определяется в эксперименте; SD- величина, пропорциональная максимальной оптической плотности пятна, определяемой в экспери- 5 менте. Подставляя эти данные в уравнении, их решают численно. Программа реализуется на ЭВМ типа ДВК - 3 или IBM PC. В результате для каждой антителообразующей клетки, оставившей на мембране 0 след в виде окрашенного пятна, получают величину, характеризующую ее продуктивность, с учетом аффинности секретируемых антител. Сумма продуктивностей каждой антителообразующей клетки и их общее 5 количество в анализируемой клеточной суспензии полностью характеризуют активность антителообразующих клеток,
П р и м е р 1. Предварительно готовят диски нитроцеллюлозных мембран по размеру дна сосуда для культивирования клеток. Эти диски помещают на 2 -3 ч в раствор антигена - очищенного вируса гриппа A/PR/8/34 (0,5 мг/мл вирусного белка в 0,1 М фосфатном буферном растворе рН 7,4). После чего диски тщательно отмывают в фосфатном буферном растворе 3 раза и 2 раза в среде культивирования (199 среда, содержащая 10% эмбриональной сыворотки крупного рогатого скота). Влажные диски размещают на дно б-луночного планшета для культивирования клеток. Отдельно готовят суспензию клеток из селезенки инфицированных вирусом гриппа A/PR/8/34 мышей на 10 сутки инфекции. Суспензия содержит 105 клеток в 3 мл среды культивирования. В лунки планшета переносят по 3 мл суспензии. После чего планшет помещают С02-инкубатор (5% CCte; 37°С) на 3 ч. По окончании инкубации нитроцеллюлозные диски извлекают, маркируют и отмывают от осевших на них клеток в холодном физиологическом растворе, содержащем 10 мМ ЭД- ТА. Далее диски отмывают 4 раза в буфере с молоком (2 ч обезжиренного молока + 1 ч забуференного фосфатами физраствора) и помещают на ночь при 4°С в раствор антииммуноглобулинового конъ- югата (антитела против IgG мыши, меченные пероксидазой хрена в буфере с молоком) в рабочем разведении. Непрореагировавший коньюгат отмывают 4 раза буфером с молоком и 2 раза физраствором. Нитроцеллюлозные диски подсушивают и помещают в раствор субстрата (1 мг/мл п- фенилендиамина в 0,1 М фосфатцитратном буфере р Н 6,25) на 7 мин. Реакцию останавливают, перенося диски в дистиллированную воду на 30 мин, после чего их высушивают и денситометрируют на лазер- ном денситометре Ультросан (LKB. Швеция) с шагом 80 мкм, принимая за пятно превышение оптической плотности над фоном на 0,05 ОЕ. Определяют максимум оптической плотности для каждого пятна, диаметр пят- на на полувысоте пика оптической плотности и общее количество пятен на единицу площади фильтра. Сканирование и обсчет проводят с помощью разработанного пакета программ. Полученные для каждого пят- на характеристики подставляют в систему уравненмй(1), которую решают численно, на ЭВМ IBM PC, определяя аффинитет антител и их количество, секретируемых каждой клеткой за единицу времени. Из расчетных данных, полученных в результате сканирования участка нитроцеллюлозной мембраны (4 см2), формируют таблицу (см.табл.2). В этой таблице каждой антителообразующей клетке, оставившей след на мембране, соответствует свой номер, значение пКН - характеризует аффинитет синтезируемых клеткой антител, Q - продуктивность каждой клетки (количество секретирован- ных иммуноглобулинов в единицу времени). Q - суммарная продуктивность проанализированных антителообра- зующих клеток. Сумма продуктивностей антителообразующих клеток и их общее количество полностью характеризуют активность антителообразующих клеток в анализируемой клеточной суспензии (см.табл.1 и 2).
Предлагаемый спосоо, по сравнению с известным, имеет ряд преимуществ. Способ позволяет анализировать аффинитет антител секретируемых отдельной антителообразующей клеткой, и на основе этого определять истинное количество антител секретируемых каждой клеткой. Характеризовать активность антителообразующих клеток подзум параметрам: количеству клеток и их продуктивности.
Способ разработан в лаборатории молекулярной биологии вирусов отдела молекулярной биологии НИИЭМ АМН СССР.
Формула изобретения
Способ определения активности антителообразующих клегок путем иммобилизации антигена на нитроцеллюлозной мембране, культивирования на ней анализируемой суспензии клеток с последующим удалением клеток и определением активности антителообразующих клетик по анализу пятен иммунных комплексов иммуноперок- сидазным методом окраски, о т л и ч а ю - щ и и с я тем, что, с целью повышения точности способа за счет определения количества и аффинитета антител, продуцируемых отдельной антителообразующей клеткой суспензии, в иммунопероксидаз- ном методе окраски иммунных комплексов в качестве субстрата используют, п-фени- лендиамин в буферном растворе с рН 6,2 - 6,3, а пятно окраски антител от отдельной клетки денс тометрируют и определяют максимальную оптическую плотность пятна и его диаметр на полувысоте пика оптической плотности с последующим вычислением по программе на ЭВМ количества и аффинитета антител отдельной клетки.
Таблица


Изобретение относится к иммунологии и может найти применение в клинической практике для оценки состояния гуморального иммунитета и в биотехнологии. Целью изобретения является повышение точности способа за счет определения количества и аффинитета антител, синтезируемых отдельной клеткой. Цель достигается тем, что анализируемую клеточную суспензию культивируют на нитроцеллюлозной мембране с иммобилизованным на ней антигеном, участки со связанными антителами выявляют, инкубируя мембрану с антиимму- ноглобулиновым конъюгатом и окрашивая n-фенилендиамином в буфере с рН 6,2 - 6,3 Мембрану денситометрируют, определяя для каждого пятна на ней максимальную оптическую плотность и диаметр на полувысоте пика оптической плотности, по этим данным определяют аффинитет антител и продуктивность каждой антителообралую- щей клетки, что в совокупности с количеством проявившихся пятен полностью характеризует активность популяции анти- телообразующих клеток 2 табл сл с
Суммарная продуктивность 2) Q 25,6.
Таблица2
| l.lmmunol | |||
| Methods, 1985, v.79 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
1991-11-15—Публикация
1989-04-12—Подача