Изобретение относится к медицине и может быть использовано в медицинской ксенобиохимии, в токсикологии, профпато- логии и патологической физиологии.
Целью изобретения является повышение точности, чувствительности и упрощение способа.
Цель реализуется путем .инкубации при 37°С 5-30 мкм МА в инкубационной смеси, состоящей из 1,0 мл 0,05-0,200 М трис-НС1 буфера (рН 7-8,0), 0,5 мкм НАДФН, 5 мг/мл микросомального белка при времени инкубации, равном не менее 5 мин, и оценкой скорости метаболизма акрилата по уровню образования формальдегида (Ф).
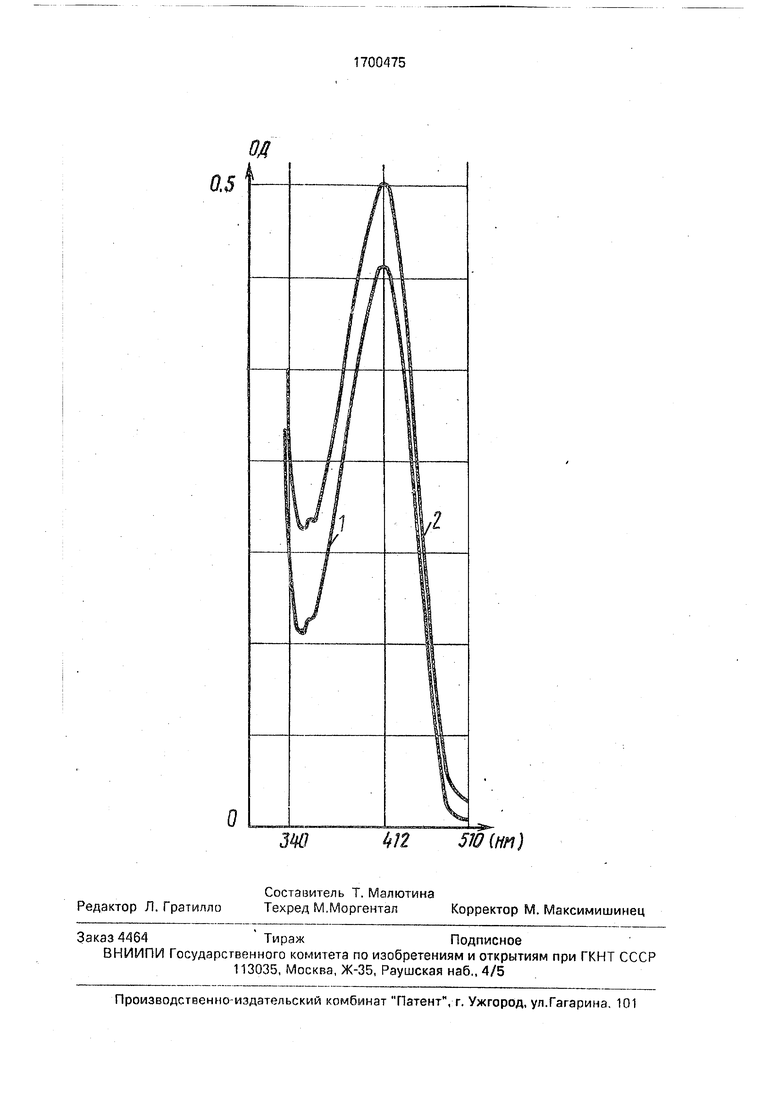
На чертеже дан график (кривые 1 и 2), поясняющий предлагаемый способ.
Способ осуществляется следующим образом.
По способу используют микросомы (МК), полученные из печени крыс.
У забитых животных методом срединной лапаротомии вскрывают брюшную стенку и перфузируют при 4°С печень раствором 50 мМ трис-HCI (рН 7,4), содержащим 1,15% КС и 0,5 мМ ЭДТА. Печень измельчают ножницами, смешивают с раствором перфузата в соотношении 1 г ткани : 3 мл перфузата. Гомогенат печени центрифугируют при 17000 g на протяжение 10 мин, после чего берут надосадочную жидкость, разводят 50%-ным раствором ПЭГ до конечной 5%-ной концентрации ПЭГ и центрифугируют 10 мин при 18 000 об/мин.
1
Я
Определение микросомального белка проводят методом Лоури. Общее содержание цитохрома Р-450 определяют по СО-пику в дифференциальном спектре восстановленного гемопротеида методом Omura Т., Sato R. Определение генерации Ф проводят при инкубации 5,30 и 180 мМ МА с 5-12 мг/мл белка микросом печени крыс в инкубационной смеси объемом 1,0 мл, состоящей из 0,05-0,200 М трис-HCI буфера (рН 7,0-8,0), 0,5 мМ НАДФН, Инкубацию проводят при 20, 37, 45°С на протяжении 5, 15, 45 мин. Реакцию останавливают добавлением 20% ТХУ в количестве 0,25 мл на 1 мл инкубационной среды. Содержание Ф определяют в пробах до и после инкубации акрилатов с помощью цветной реакции с реактивом НАШЕ по известному методу, суть которого заключается в осаждении белка центрифугированием при 7 000 об/мин на протяжении 10 мин. К 0,5 мл полученного супернатанта добавляют 2,0мл раствора НАШЕ, после чего проводят инкубацию в водяной бане при 37°С на протяжение 45 мин. Измерение оптической плотности окраски по ОД проводят на СФ-26 при длине волны 412 нм. Подсчет Ф проводят, исходя из коэффициента молярной экстинкции, равного 1,5 . При этом из показаний ОД опытов вычитается ОД фона, равная экстинкции образца перед проведением их инкубации. Скорость метаболизма зкрилата рассчитывается по формуле
АЕ 1,25 1000
1,5-Б-Т
где Т - время инкубации, мин;
Б - белок, мг/мл в пробе; 1,5 - коэффициент молярной экстинкции Ф, равный 1,5 (умножением на 1000, переводим скорость образования Ф из микромоль в наномоль);
1,25 - разведение 1 мл инкубационной среды добавкой 0,25 мл 20%-ного раствора ТХУ;
А Е Et - Ео,
где Et - оптическая плотность, полученная при инкубации за время 5, 15, 45 мин;
Ео - оптическая плотность смеси при времени инкубации 0 мин.
Пример расчета скорости метаболизма метилакрилата в микросомальном препарате показан в табл.1.
В процессе микросомального метаболизма из МА метилметакрилата (ММА) образуется Ф (чертеж). Уровень его нарастает со временем инкубации, что видно из табл.2.
Скорость метаболизма МА зависит от концентрации НАДФН в инкубационной
смеси.
Данные представлены в табл.3. Результаты показывают, что 0,5 мМ НАДФН является насыщающей концентрацией.
0 Зависимость скорости окисления МА от молярности трис-HCI буфера в инкубационной среде показана в табл.4.
Изучение зависимости оценки метаболизма МА от рН инкубационной среды пока5 зывает, что интенсивность его генерации через 5,15 и 45 мин в сериях опытов, имеющих рН 7-8,0, не отличается. При рН 8,5 уровень Ф через 5 мин был в 1,9-2,7 раз ниже, чем в сериях опытов с рН 7,5-8,0
0 (табл.5). Эти результаты показывают, что интенсивность образования Ф одна и та же при значениях рН 7-8,0,
Скорость метаболизма МА зависит от рН инкубационной среды (табл.5).
5 Изучение зависимости скорости метаболизма от температуры инкубационной среды показывает, что при температуре, равной 37°С, уровень Ф немного выше при 20 и 45°С, через 5 и 45 мин инкубации раз0 ница была 2-кратной с достоверностями (,001; ,05) при инкубации на протяжении 15 мин яри 37 и 45°С по сравнению с аналогичной серией опытов при 20°С (табл.6).(
5 Эти результаты показывают, что метаболизм МА при температуре 37 и 45°С не отличается. Со снижением температуры до 20°С имеется резкое уменьшение скорости при 15 мин инкубации. Изучение зависимо0 сти скорости образования Ф от содержания белка, концентрации акрилата и времени инкубации представлено в табл.7. При наличии в инкубационной среде микросомального белка, равного 5 мг/мл, и 5 мМ
5 концентрации МА содержание Ф через 15 мин инкубации выше, чем через 5 мин (,05), а через 45 мин выше, чем через 15 мин (,001). При этом же содержании белка, но концентрации акрилата, равной 30
0 мМ, отмечается та же закономерность: содержание Ф через 45 мин выше, чем через 15 и 5 мин инкубации (,01).
Предложенный способ обладает в 6,6 раз более высокой чувствительностью и в 6
5 раз более высокой точностью по сравнению с прототипом и в 5 раз уменьшает затраты времени на проведение анализов. Достижение положительного эффекта предложенного способа по сравнению с прототипом представлено в табл.8.
По предлагаемому способу использовалась смесь объемом 1,0 мл, 0,1 М трис-НС1 буфера, рН 7,4, содержащая белка 5 или 12 мг; белка микросом печени 5 или 30 мкм, метилметакрилата, суспендированного в 0,83%-ном тритоне. Инкубация проводилась при 37°С на протяжение 45 мин при постоянном встряхивании. По известному способу использовалась смесь объемом 3,0 мл, состоящая из 0,26 мМ бикарбонатного буфера, рН 7,4; 33 мг белка микросом печени, 90 мкм метилакрилата, суспендированного в 0,83%-ном тритоне. Инкубация проводилась при 37°С на протяжении 20 мин при постоянном встряхивании. По предлагаемому способу измерялся формальдегид, а по известному - акриловая кислота.
Формула изобретения Способ определения скорости метабо- лизма акрилатов в микросомальном препарате путем инкубации акрилатов в присутствии реагента, отличающийся тем, что, с целью повышения точности, чувствительности и упрощения способа, инку- бационная смесь дополнительно содержит НАДФН в насыщающей концентрации, инкубацию проводят не менее 5 мин при 37°С,
затем реакцию останавливают ТХУ, отделяют супернатант, добавляют к нему 2 мл раствора реагента, содержащего 0,004 мл ацетилацетона, 0,006 мл ледяной уксусной кислоты и 0,3 г уксусно-кислого аммония, измеряют продукт реакции при 1 нм, а количество образовавшегося формальдегида (наномоль/миллиграмм белка за время инкубации, минута) рассчитывают по формуле
Сф
АЕ 1.25 1000 1,5 Б -Т
где Т - время инкубации, мин;
Б - белок, мг/мл в пробе;
1,5 - коэффициент молярной экстинк- ции формальдегида, равный 1,5
1,25 - разведение 1 мл инкубационной среды за счет добавки 0,25 мл 20%-ного раствора ТХУ;
AE Et-E0,
где Et - оптическая плотность, измереь лая после инкубации в течение 5, 15, 45 мин;
Ео - оптическая плотность при времени инкубации 0 мин.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения иммуносупрессивного действия ксенобиотиков | 1987 |
|
SU1587446A1 |
| Способ определения активности эпоксидгидролазы | 1988 |
|
SU1567971A1 |
| Способ получения цитохрома Р-450 | 1989 |
|
SU1693043A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ МАЛОНОВОГО ДИАЛЬДЕГИДА С ПОМОЩЬЮ ТИОБАРБИТУРОВОЙ КИСЛОТЫ | 1995 |
|
RU2112241C1 |
| Способ определения антиокислительной активности веществ | 1984 |
|
SU1239595A1 |
| КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СВОЙСТВОМ РЕПАРИРОВАТЬ МЕМБРАНЫ ГЕПАТОЦИТОВ | 1993 |
|
RU2043110C1 |
| Способ иммобилизации микросом печени | 1983 |
|
SU1161553A1 |
| Средство для реконструкции мембран IN VIтRо | 1990 |
|
SU1747072A1 |
| СПОСОБ ВЫЯВЛЕНИЯ АНТИТОКСИЧЕСКИХ СВОЙСТВ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ | 2006 |
|
RU2316597C1 |
| Способ определения токсичности промышленных сточных вод | 1989 |
|
SU1751670A1 |
Изобретение относится к медицине и может быть использовано в медицинской ксенобиохимии, токсикологии, профпатоло- гии и патологической физиологии. Цель изо- бретения - повышение точности, чувствительности и упрощение способа. Цель достигается путем инкубации 5-30 мкм метакрилатов в инкубационной среде, состоящей из 1,0 мл 0,05-0,200 М трис НС буфера (рН 7-8,0), 0,5 мкм НАДФН, 5 мг/нл микросомального белка. Инкубацию приводят не менее 5 мин при 37°С, затем реакцию останавливают ТХУ, отделяют супернатант, добавляют к нему 2 мл раствора реагента, содержащего 0,004 мл ацетилацетона, 0,006 мл ледяной уксусной кислоты и 0,3 г уксус- но-кислого аммония, продукт реакции измеряют при 412 нм с последующим расчетом количества образовавшегося формальдегида. Способ обладает в 6 раз большей чувствительностью по сравнению с прототипом и значительно сокращает время проведения массовых анализов. 1 ил., 8 табл. (Л
Примечание, Инкубационная смесь состоит из 0,1 М трис-HCI буфера (рН 7,5), 1мМ НАДФН, 30 мМ МА и 12 мг/мл микросомального белка печени контрольных крыс.
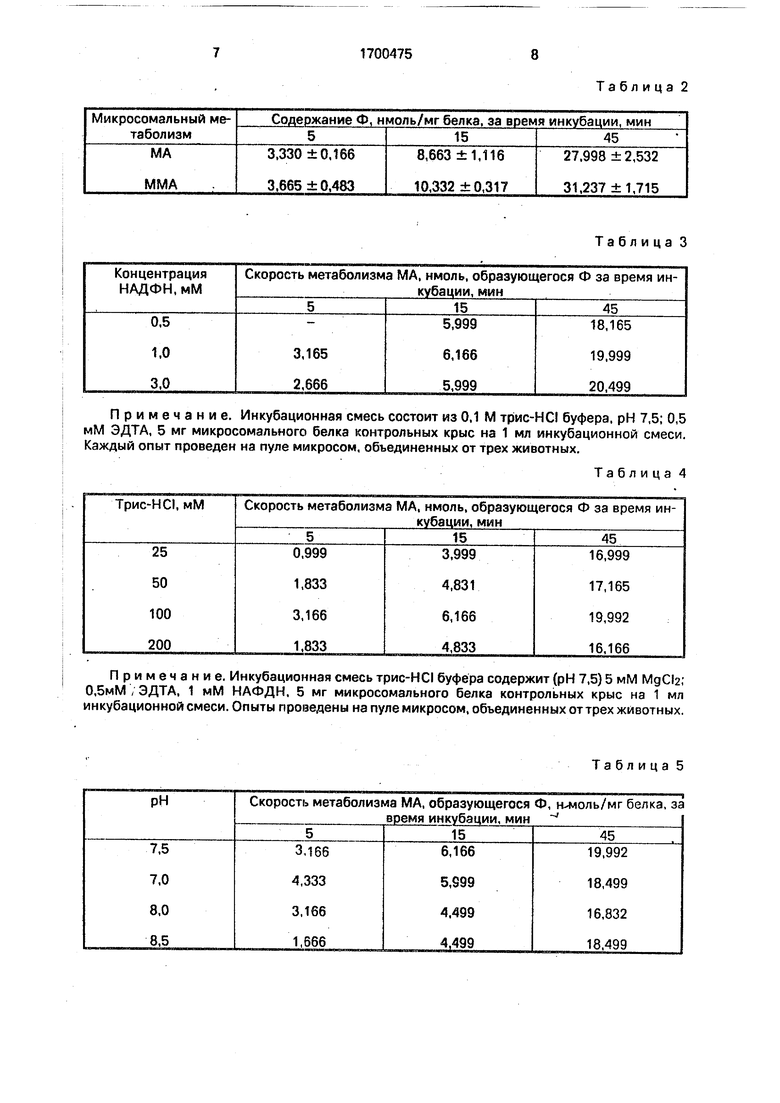
Таблица 1
Примечание. Инкубационная смесь состоит из 0,1 М трис-HCI буфера, рН 7,5; 0,5 мМ ЭДТА, 5 мг микросоиального белка контрольных крыс на 1 мл инкубационной смеси. Каждый опыт проведен на пуле микросом, объединенных от трех животных.
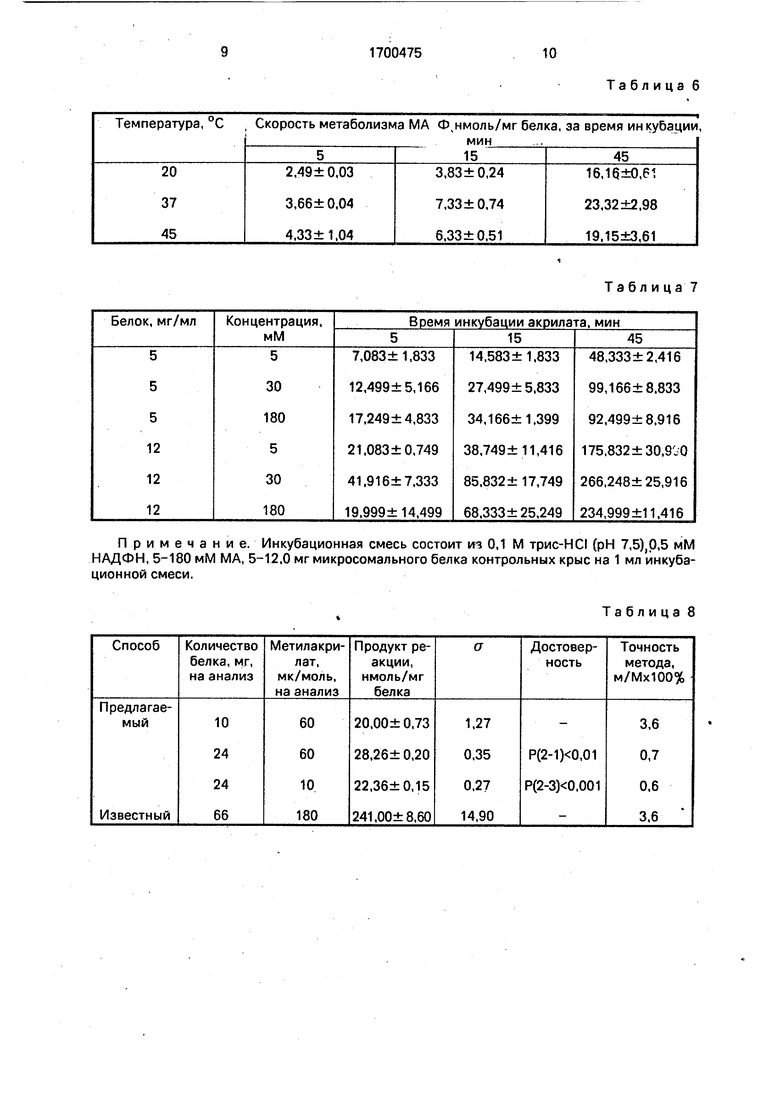
Таблица 4
Примечание. Инкубационная смесь трис-HCI буфера содержит (рН 7,5) 5 мМ MgCte; 0,5мМ / ЭДТА, 1 мМ НАФДН. 5 мг микросомального белка контрольных крыс на 1 мл инкубационной смеси. Опыты проведены на пуле микросом, объединенных от трех животных.
Таблица 2
Таблица 3
Таблица 5
Примечание. Инкубационная смесь состоит из 0,1 М трис-HCI (рН 7,5),0,5 мМ НАДФН, 5-180 мМ МА, 5-12,0 мг микросомального белка контрольных крыс на 1 мл инкубационной смеси.
Таблица 6
Таблица 7
Таблица 8
О
510 (т
| Toxicol | |||
| Appl | |||
| Pharmacol., 1981, № 57, рр.208-219. |
Авторы
Даты
1991-12-23—Публикация
1988-08-26—Подача