Изобретение относится Kj yipco6y получения ,дагидpoтиoпиpaнoв.
Широкое использовЖнйе дигидротяо- пиранов в тонком органическом синтезе ; для получения карбоциклических, ацик- ; лических, гетероциклических углеводо ; родов, в частности ювенильного гормо- на, аналогов зигоспорина, эритроноли дов,послужило поводом поиска новых , лутей их синтеза. Практическое принеЧ нение дигидротиопиранов в большой ме
ipe зависит от доступности исходных
гетероциклов.;
Наиболее близким к изобретению по тех1шческой сущности является способ получения дигидротиопиранов реакцией диалкилсульфоксидов с бутадиеном под действием фосфиновых комгшексов Pd или N1 PJ.
; Схема реакции -- м I
RCHaSCHjR - RCH-S3+RCH-CH2tHzO
n
M-Ln
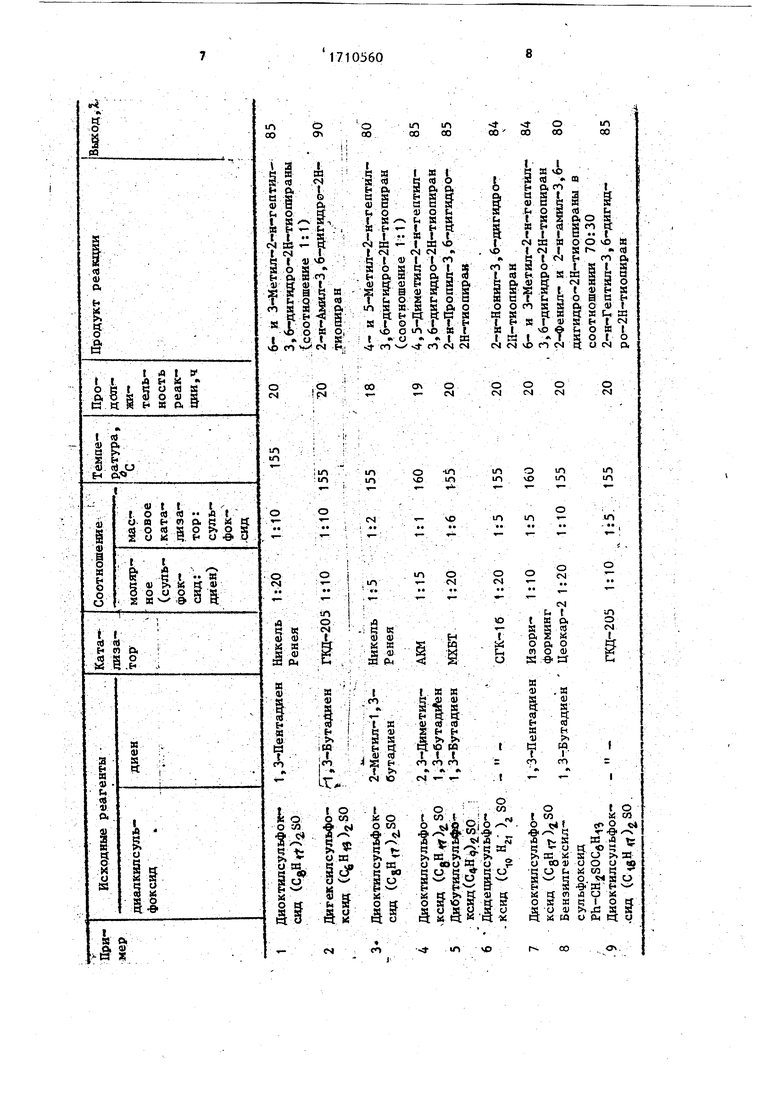
,- Данный способ осуществляют следующим образом: нагревают в автоклаве диоктилсульфоксид с бутадиеном, взятые в соотношении 1:20, при 8 ч в присутствии катализатора. Катализатор готовят зосстановлением ацетилацетонэ та палладия Pd(acac) J триэтилалюмини ем в среде абсолютного толуола при -20 С ,в присутствии дифенилфосфин: тана ().2 в атмосфере аргона. Оптимальное соотношение компонентов катализатора 1:1:4, а концентрация от носительно к сульфоксиду 1:50 (молярное соотношение). Получают после вакуумной перегонки 2 Н гептил-3,6 дигидро-2Н--тиопиран с выходом около 80% При 1фоведении реакции в присутствии катализатора Ni(acac)-() выход указанного тиоальдегида не превышает примерно 70%. В условиях опытов ди-н-октилсульфоксид расщепляется на 1 октен, fLQ и тиоальдегид, которьш. вступает в реакцию циклоприсоединения с бутадиенбм, давая 6-н-гелтил-3,6-дигидротиопиран. Существенные недостатки известного способа: Использование в качестве катализатора сложной трехкомпонентной каталитической системы (Pd(acac)2 : () : AlEtj. Большой расход катализатора (молярное соотношение катализатор) : : ksORj 1:50). Использование в качестве компонен- /та катализатора труднодоступного, дорогостоящего и токсичного дифешшфосфинэтана, производство которого от сутствует в нашей стране, Использование в качестве компонента катализатора (восстановителя) пожа РО-, взрывоогнеопасного алюминийоргаЙйческого соединения AlEtj.. Способ приготовления катализатора нетехнологичен, так как требует низких температур (-20с), инертной ат мосферы (аргон). 1 Цель изобретения - разработка уни,версального технологичного способа синтеза дигидротиопиранов с более высоким выходом и более широким ассрр тиментом целевых продуктов. , Сущность изобретения заключается в том, что диалкилсульфоксидудибутил ;()iSotl, дигексил С()а5оД, дигептил (CYK ,5)1503, диоктил (CgHiT )iSO , дидецил ( )lSOJ , бензилгексилсульфоксиды (СбН5СН2. ) нагревают в автоклаве с
1,3 диеном (бутадиен, изопрен, диметилбутадиен, липерилен), взятые в соотношении (1:5)-(1:20), предпочтитель о 1:4, в присутствии металлсодеращего промышленного катализатора. Состав катализатора, мас.%: икель Ренея А1 50 N150 Оксид кобальта 0,5 КД-205 Оксид молибдена 14,2 Оксид никеля 3,9 Цеолит 5-8 Оксид алюминия Остальное Оксид молибдена 6-8 ГК-16 Закись никеля 2-4 Цеолит Остальное Оксид кобальта 5 Оксид молибдена 12,5 Оксид алюминия Остальнов . Оксид меди Оксид хрома Оксид бария ОстальОксид меди ное Платина зориформинг Палладий Оксид никеля Оксид молибдена 56 Аморфньй и кристаллический алюмосиликаты остальноееокар-2 Оксид алюминия 8-10 Оксид кремния 87-88 3 (где R катионы редкоземельных : . элементов - цезия, рения, родия)„ Пример 1. В стеклянную ампулу (V 150 мл) помещают 1,09 г (0,005 моль) диоктилсульфоксида и 6,8 г (1 моль) 1,3-пентадиена, 30 мл толуола, 0,11 г катализатора - никеля Ренея, ампулу запаивают и нагревают 20 ч при . Затем смесь охлаждают, катализатор отфильтровывают. Растворитель упаривают, остаток перегоняют в вакууме. Получают 0,90 г (85%) 6- и 3-метил 2Н-гептил-3,6-дигидро-2Н-тиопирана в соотношении 1:1. Другие примеры представлены в таблице. 6(1а)- и 3 Метил-2 н-гептил-3,6-дигидро-2Н-тиапиран (Хб), т.кип. 104Юб С (1 мм рт.ст.), ИК-сиектр, .;: 980, 1650, 3030 (), 1385, 1475 . (СНз), Спектр (J, М.Д., J. Гц); ;0,88 т (СНз, J 5,0), 1,14-1,37 м (15Н, СН2., СН), 1,92-2,23 м-(2Н, )), 2,65-3,70 м (CHS, SCH--C C), 5,60-5,69 к (). . 9 V/ vj&ii . (, М.Д.) 14,14 KB (CHjCO, 21,08 KB и 23,46 KB (CHjC) 22,70 т (С ), 26,87 т, :27,20т( 16), , 29,26 т (С), 29,53 т (С«), 31,86 т (С ), 32,45 т, 33,05 т (С), 35,06 т, ю 35-22 т. .fiS т Гг.. г.- тя ,тя, 40,15 д ( 16), 126,40 д, 127,16 д, 130,30 д, 131,17 д (С, С). Найде- . но, %: С 73,2; Н 11,6; S 15,2, М 212. Н24S. Вычислено,%: С 73,6; Н 11,3; (5 S 15,1%. М 212,43. 2-н-Амил-3,6-дигидро-2Н-тиопирак, т.кип. 58-60 С (1 мм рт.ст.), ng 1,4950. йК-спектр, .: 980, 1650, 3030 (), 1380, 1460 (СН,). Спектр,о ЯМРН (S, М.Д., J, Гц): 0,85 т (CHj, J 8,0) , 1,23 - 1,45 м (11Н,С%, СНз) 1,96-2,18 м (2Н, ), 2,56-2,76 м (1Н, CHS), 2,86-3,38 м (2Н, ), м (2Н, ). Найдено, %: 25 С 71,0; Н 10,5; S 18,5. М 170. C oHigS. Вычислено, %: С 70,6; Н 10,6; S 18,8. 170,34. у 4(16)- и 5-метил-2-н-геатил-3,6-дигидро-2Н-тиопиран (la), т.кип,. 85-30 90 С (1 мм рт.ст.). ЯМРН (и, М.Д., J, Гц): 0,89 т (СН, J 5,1), 1,29rl,49 м (6CHi), 1,71 с (), 2,042,33 (2Н, CHiC), 2,46-3,26 м (ЗН, CHS, SCH2C C), 5,56 м (1Н, ). (f, М.Д.): 14,09 кв (С), 22,67 т (С), 24,23 кв, 24,75 кв (С ), 26,35 т, 27,09 т, 29,52 т, 29,86 т, 33,42 т,35,15 т, 35,41 т, 37,88 т (С, С, С®, с , ), 29,31 т (с ), 40 31,81 т (С), 39,198 д, 39,10 д (С), 117,72 д ( 1а), 122,18 д ( 16), 130, д ( 16), 134,93 д ( ia). Найдено, .: С 73,3; Н 11,7; S 15,0. М 212. Ci3H2,).S. Вычислено, %: С 73,6,45 Н 11,3; S 15,1. М 212,43. 4,5-ДимеТил-2-н-гептил 3,6-дйгид ро-2Н-тиопиран, т.кип, 108-110Р С (1 мм рт.ст.), 1,4840. Спектр ЯМР Н (а, м.д., J, Гц),88 , 50 J 8,0), 1,14-2,28 м (15Н, :СНз), 1,67-2,19 р(), 2,40-3,34 МоСЗП, CHS, ). Найдено, %: С 74,0; Н 12,0; S 14,0, М 226, . числено, %: С 74,3; Н 11,5; S 14,2, $5 М 226,46. 2-н-11ропил-.3,6-дйгидрр-2Н-тиониран, ,кип. 48-50 С (1 мм рт.йт,), п /1,4930. IIK-спектр,, ): 35 Тб55, 3030 (СН-СН), 1385, 1465 (СН,). Цпектр (5, М.Д., J, гц), 0,98 т (СН, J 8,0), 1,37-1,53 м (4Н, СН), 1,95-2,13 Н (2Н, ), 2,53-3,23 м (ЗН, CHS, SCH«C C, 5,68-5,75 м {2Н, ). Найдено, %: С 67,3} Н 10,0; 22,7. м 142. . Вычислено, %: С 7 « Т J1 /, 67,6; Н 9,9; S 22,5. М 142,28. 2-Фенил-3,6 дигиш)о-2Н-тиопиран, т.кип. 78-80 С (1 мм рт.ст.), п| 1,4920. ИК-спектр,, см-): 980, 1660, 3030 (), 775, 1600 (Аг). Спектр (tf, м.д., J, Гц): 1,95 м (2Н, СН), 2,92-3,33 м (2Н, ), 3,80 т (1Н, PhCHS, J 7,0), 5,8 м (2Н, ) , 7,2 м (5 Н, Аг) . Найде- ,но, %: С 75,1; Н 6,6; S 18,3. , Вычислено, %: С 75,0; Н 6,8; s 18,2, М . Ф о р м у л а изо 6 р е т е Н и я Способ получения дигидротиохшра-г нов путем взаимодействия диалкилсульфоксида с 1,3-диеном в присутствии ка тализатора при повышенной температуре в среде толуола, отличающийс я тем, что, с целью повышения выхода и расширения ассортимента целевых качестве дйалкилсульфокпродуктов в каче сида используют дибутил-, или дигексил-, или дигептил-, или диоктил-, или дидецил-, или бензилгексилсульфоксид, а в качестве 1,3-диена - бутадиен, или изопрен, или диметилбутадйен, или -- , .. рерилен и процесс ведут при молярном соотношении исходных реагентов 1:(520) и температуре 155-160 с в присутствии металлосодердсащего промьшшенного катализатора при массовом соотношении компонентов, %: А1 50, Ni 50; или оксид кобальта - 0,5, оксид молибдена - , оксид никеля 3,9, цеолит 5-8i оксид алюминия остальное; идш оксид мога бдена 6, закись никеля 2-4, цео лит остальное; или оксид,кобальта 5, оксид молибдена 12,5, оксид алюминия остальное; или оксид меди 42, оксид хрома 38, оксид бария 7,5, оксид алюминия остальное; или платина 0,6, палладий 0,6; оксид никеля 5-6, оксид молибдена 5-6, аморфный и кристаллический алюмосиликаты остальное;или оксид-алюминия 8-10, оксид кремния . 87-88, R203 3, где R - катионы редкрземельных элементов (цезий, рений, ррдий), взятого в количестве 1-10 мас,% на исходный сульфоксид.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения смеси изомеров алкилзамещенных ди- и тетрагидропиранов | 1989 |
|
SU1675299A1 |
| Катализатор для линейной олигомеризации замещенных 1,3-диенов | 1981 |
|
SU997798A1 |
| Способ получения норборнил-пиридинов | 1990 |
|
SU1735286A1 |
| Замещенные пиридины в качестве абсорбентов сернистого ангидрида и способ их получения | 1982 |
|
SU1100275A1 |
| Способ получения S-триметилсилиловых эфиров дитио- или тетратиофосфорных кислот | 1990 |
|
SU1735300A1 |
| 1-АМИНО-8,9- ДИГИДРО-5,8,8- ТРИМЕТИЛ-3,6Н- ПИРАЗОЛО[3,4-B] ТИОПИРАНО [4,3-D]ПИРИДИН ИЛИ ЕГО ГИДРОХЛОРИД, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 1989 |
|
SU1626648A1 |
| Способ получения бис-( @ -диалкиламиноалкил или циклоалкил)дисульфидов | 1988 |
|
SU1608185A1 |
| Способ получения производных моноили диацетиленовых арсинов дигидропирана, или -тиопирана, или -пиперидина | 1977 |
|
SU702028A1 |
| Производные пирроло[3,2- @ ]хинолина | 1985 |
|
SU1299113A1 |
| ФЕНИЛОКСАЗОЛИДИНОНЫ, ИМЕЮЩИЕ С-С-СВЯЗЬ С 4-8-ЧЛЕННЫМИ ГЕТЕРОЦИКЛИЧЕСКИМИ КОЛЬЦАМИ | 1996 |
|
RU2175324C2 |
Изобретение касается гетероцик-' лических веществ, в частности получе-*, .ния дигидротиопиранов, используемых в синтезе активных и гетероциклических веществ* Цель ~ расширение ассорти— ; мента целевых веществ и повышение, ихвыхода. Синтез ведут реакцией 1,Т~ди- 'ена —бутадиена, изопрена, диметилбута— 'диена, гшперилена с диалкилсульфокси— дом " дибутил-*, дигексил", диг'ептил-, диоктил-, дидецил- или бензилгексил- сульфоксидом при их молярном соотношении 

| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| и др | |||
| Новый метод, синтеза дигидротиопиранов | |||
| Изв | |||
| АН СССР, сер.'Гхим., 1988, № 11, ,с | |||
| Паросиловая установка | 1924 |
|
SU2646A1 |
| ' '.'•'•'•' | |||
Авторы
Даты
1992-02-07—Публикация
1989-11-29—Подача