Изобретение относится к биотехнологии и может быть использовано в процессе получения моноклинальных антител (МКА) к рекомбинантным белкам.
Традиционный путь получения МКА к рекомбинантным белкам включает ряд этапов: 1) клонирование гена белка; 2) получение варианта гена, пригодного для экспрессии в клеточной системе; 3) экспрессия гена; 4) наращивание культуры клеток, продуцирующих рекомбинантный белок; 5) очистка рекомбинантного белка, часто сопряженная с его денатурацией и последующим восстановлением пространственной структуры; 6) иммунизация животных путем последовательных введений рекомбинантного белка в смеси с адъювантом; 7) получение штаммов гибридом, продуцирующих МКА к рекомбинантному белку путем слияния иммунных сленоцитов и клеток родительской миеломы.
Такой способ является достаточно сложным в связи с большим количеством трудоемких этапов. Кроме того, полученные
со со
1
-ч
О
МКА могут не распознавать природные белки, что может быть связано с отсутствием углеводных остатков у рекомбинантных белков, изменениями их первичной или третичной структуры. Вместе с тем, МКА.рас- познающие природные и рекомбинантные белки являются основой для получения стандартных и абсолютно воспроизводимых реагентов со строго определенной специфичностью, использование которых в экспериментах и разных вариантах иммунного анализа возрастает в геометрической прогрессии.
Целью изобретения является повышение надежности способа получения гибридом, продуцирующих моноклональные °нтитела к рекомбинантным белкам.
Поставленная цель достигается за счет того, что экспрессию гена белка осуществляют в сингенных эукариотических клетках- продуцентах, которыми проводят иммунизацию сингенных животных.
Предлагаемый способ включает следующие этапы: 1) клонирование гена белка; 2 -экспрессия гена в сингенных эукариотических клетках-продуцентах (СЭКП); 3) иммунизация животных СЭКП; 4) получение штаммов гибридом, продуцирующих МКА к рекомбинантному белку путем слияния иммунных спленоцитов и клеток миеломы. При этом исключаются такие операции, как получение варианта гена, пригодного для экспрессии в прокариотической клеточной системе; наращивание культуры клеток, продуцирующих рекомбинантный белок; очистка рекомбинантного белка. Дополнительным преимуществом предлагаемого способа является то, что в клетках млекопитающих происходит гликозилирование рекомбинантного продукта и его пространственная структура формируется в условиях, близких к физиологичным. Это позволяет получить МКА, распознающие ре- комбинантиый и натуральный белки в равной степени. Кроме того, использование для иммунизации мышей СЭКП вместо растворимых рекомбинантных белковых антигенов не требует применения адъювантов.
Для получения моноклональных антител к рекомбинатным белкам на основе клеток млекопитающих, продуцирующих чужеродные белки, использованы фиброб- ласты Balb/ЗТЗ, сингенные мышам линии Balb/c, синтезирующие рекомбинантный гормон роста человека.
Пример 1. Специфический иммунный ответ у мышей Balb/c, иммунизированных клетками Balb/ЗТЗ, продуцирующими рекомбинантный гормон (ГР) человека.
Важным моментом гибридомной технологии является иммунизация животных. Оценка иммунного ответа перед слиянием клеток позволяет прогнозировать получение специфических моноклональных антител. Этот пример иллюстрирует индукцию иммунного ответа у мышей после введения сингенных эукариотических клеток-продуцентов.
0 Для получения СЭКП, синтезирующих ГР человека, был создан ретровирусный вектор pPS-neo-hSTH, содержащий безинт- ронный ген ГР человека в полилинкерном регионе оригинального вектора, несущего
5 устойчивость к неомицину. Первоначально была проведена трансфекция 2(5) клеток, которые в итоге содержали интегрированный рекомбинантный провирус (вектор) pHS-neo- hSTH и продуцировали икфекци0 онный ретровирус, несущий pPS-neo-hSTH РНК. Этот рекомбинантный ретровирус был использован для инфицирования фибробла- стов Balb/ЗТЗ, сингенных мышам линии Balb/c. Клонированные клетки Balb/ЗТЗ,
5 продуцирующие рекомбинантный гормон роста человека, были выделены посла двухнедельной селекции в присутствии неоми- цина.
Фибробласты Balb/ЗТЗ, продуцирую0 щие ГР, культивировали в среде IMDM (модифицированная Iscove s среда Дульбекко) с 10% эмбриональной телячьей сыворотки (ЗТС), 2 мМ L-глютамина, 100 мкг/мл пенициллина и стрептомицина. 0,05 мМ меркап5 тоэтанола. Монослой клеток отмывали средой без сыворотки, инкубировали в IMDM с 1 % сыворотки мышей Balb/c 1 ч при 37°С и снимали раствором трипсина в вер- сене. После трехкратной отмывки средой
0 без сыворотки клетки ресуспендировали в 0,02 М фосфатном буферном растворе с 0,15 М NaCI, Клетки вводили внутрибрю- шинно (в/б) по 10-20 млн, на мышь, что соответствует оптимальному количеству
5 клеток для получения МКА к корпускулярным антигенам и/или внутриселезеночно (в/с) по 200-400 тыс. клеток на мышь, как описано Spitz et al. При комбинированном способе иммунизации клетки вводили в/с
0 через 21 сут после иммунизации в/б.
Для оценки индукции иммунного ответа спленоциты культивировали в IMDM с 10% ЭТС в концентрации 3-5 млн/мл в течение 5 сут супернатанты тестировали методом
5 иммуноферментного анализа (ИФА) по следующей схеме. Рекомбинантный ГР или бычий сывороточный альбумин (БСА) сорбировали в лунках микроплат (Nunc Immunoplate 1) (500 нг/лунку в 0,1М карбонатном буфере, рН 9,5, 16 ч при 4°С). После
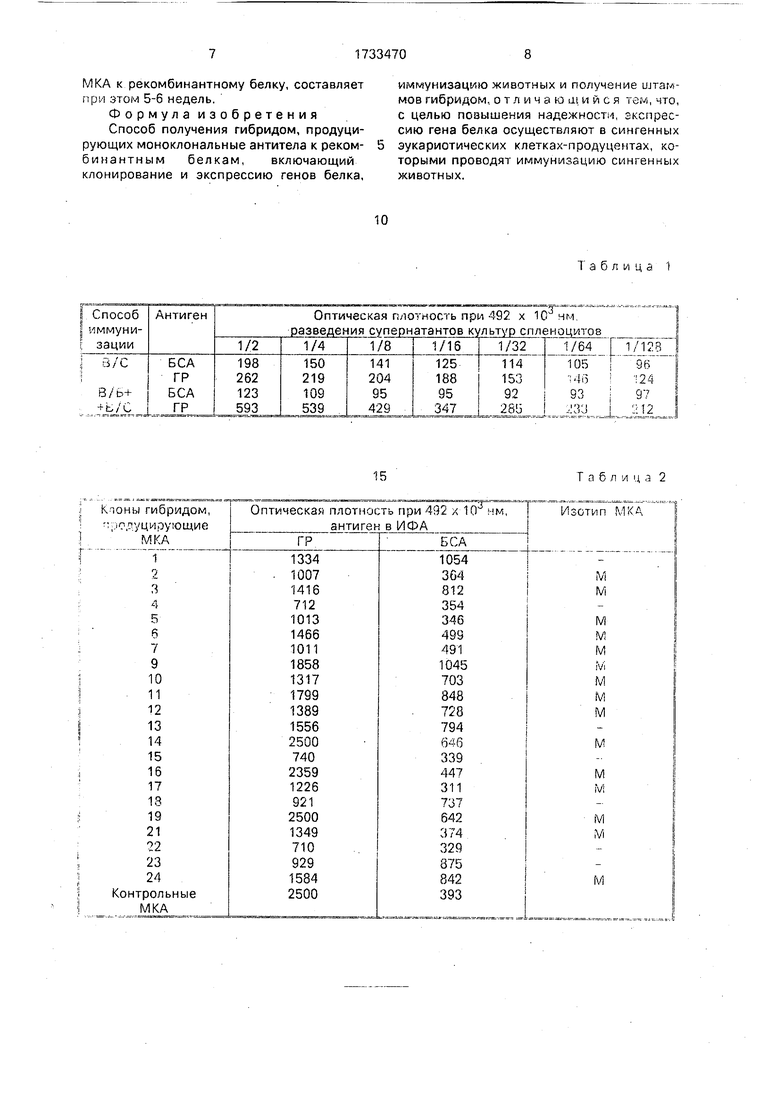
отмывки в лунки вносили по 50 мкл супер- натанта иммунных спленоцитов (последовательные двухкратные разведения) в 0,1 М фосфатном буфере, рН 7,4, 0,15 М NaCi, 1 % БСА (ЗФР-БСА) и инкубировали 1 ч при 20°С. Отмывали 5 раз бидистиллированной водой и вносили кроличьи противомыши- ные антитела (Lymed), разведенные 1 /2000 в ЗФР-БСА, по 50 мкл/лунку. После инкубации 1 ч при 20°С плату отмывали и вносили субстрат - ортофениленлиамин гидрохлорид (Sigma), 0.6 мг/мл в цитратном буфере, рН 4,7 с 0,03% На02. Через 10 мин останавливали реакцию 1 М серной кислотой и учитывалинаспектрофотометреEUSA-Processop II ( Boehring) при длине волны 492 нм. Результаты опыта представлены в табл. 1.
Из данных табл. 1 следует, что специфический иммунный ответ у мышей Balb/c существенно выше при комбинированном способе иммунизации СЭКП; не наблюдается образования значительного количества антител к БСА, несмотря на культивирование сингенных эукариотических клеток-продуцентов в среде, содержащей 10% ЭТС.
Результаты табл. 1 свидетельствуют. что иммунизация мышей сингенными эука- риотическими клетками-продуцентами, синтезирующими чужеродный рекомбинан- тный белок, может быть использована для индукции специфического иммунного ответа и, следовательно, получения гибридом, продуцирующих МКА к рекомбинантному белку.
Пример 2. Получение гибридом, продуцирующих МКА к рекомбинантному белку, при иммунизации СЭКП путем в/с введения.
Мышей Balb/c иммунизировали в/с как описано в примере 1. Спустя 4 сут проводили гибридизацию 1,4х 10 иммунных спленоцитов и 3,5x10 клеток миеломы мыши Х63-Ад8-653 50%-ным раствором полиэти- ленгликоля мол. массы 4000 (Merck), содержащим 5% диметилсульфоксида, в течение 1,5 мин. После гибридизации и отмывки от полиэтиленгликоля клетки высевали в 96-лу- ночные платы по 1x105 спленоцитов/лунку. Для культивирования и селекции гибридом использовали среду IMDM с 10% ЭТС, 10 М гипоксантина, М аминоптерина, 1, М тимидина. Скрининг положительных гибридом к ГР человека проводили методом ИФА как описано в примере 1.
После гибридизации клетки культивировали в трех микроплатах. Через 14 сут клоны гибридом выросли в 255 лунках, из них 20 оказались положительными в ИФА с гормоном роста в качестве антигена. Получение 20 гибридом, синтезирующих МКА к ГР человека, на 1, иммунных спленоцитов свидетельствует о значительной имму- ногенностиСЭКПприих
внутриселезеночном введении.
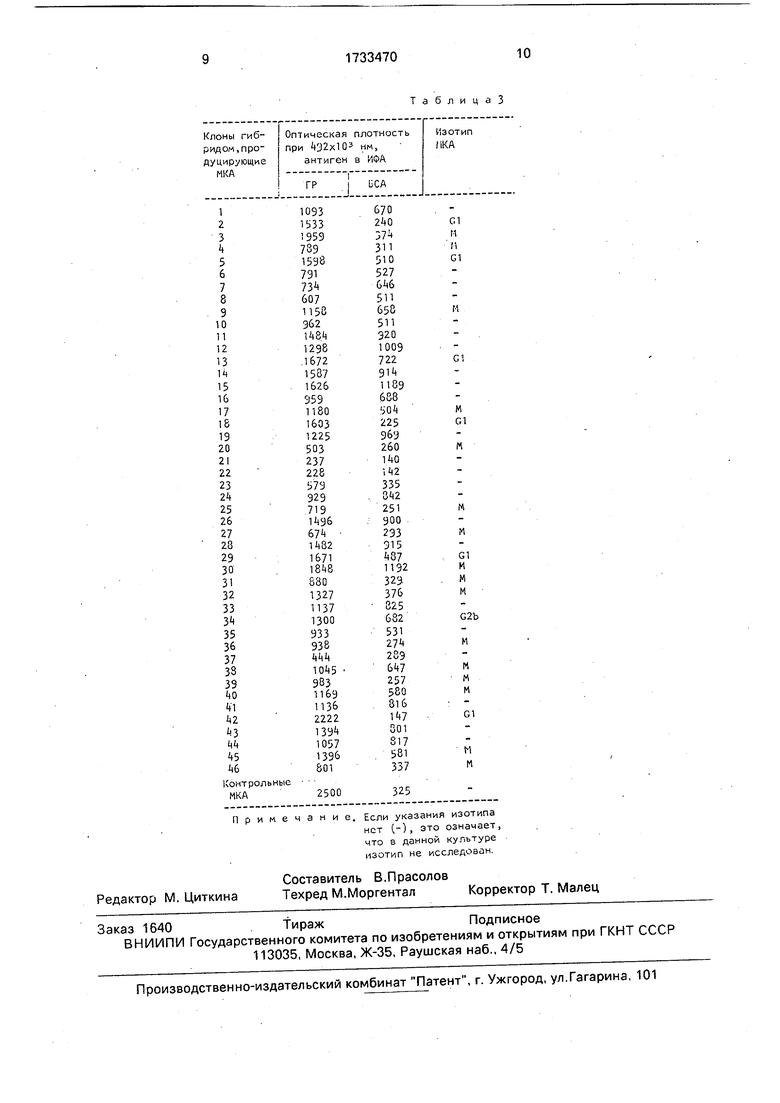
Супернатанты культур положительных гибридом были повторно тестированы в ИФА с использованием в качестве антигена рекомбинантного ГР и БСА.
0 Результаты опыта приведены в табл. 2, Из данных табл. 2 следует, что при внутриселезеночном введении СЭКП образуют- ся антитела с изотипом IgM , взаимодействующие в ИФА с гормоном ро5 ста в большей степени, чем с БСА, т.е. специфичные к рекомбинантному белку.
Таким образом, при внутриселезеноч- ной иммунизации сингенными эукариотиче- скимиклетками-продуцентами
0 чужеродного рекомбинантного белка можно в течение 2-3 недель получить монокло- нальные антитела с изотипом IgM к рекомбинантному белку. Время от начала иммунизации до получения штаммов поло5 жительных гибридом существенно сокращается по сравнению с традиционными тремя-четырьмя месяцами.
П р и м е р 3. Получение гибридом. продуцирующих МКА к рекомбинантному
0 белку, при комбинированном способе иммунизации сингенными эукариотическими клетками-продуцентами.
Мышей Balb/c иммунизировали последовательно в/б и в/с как описано в примере
5 1. Спустя 4 сут после иммунизации в/с проводили гибридизацию 1,2xtO иммунных спленоцитов и 3x10 клеток миеломы мыши ХбЗ-А 8-653 как описано в примере 2. После гибридизации клетки культивировали в G
О микроплатах. Через 14 сут рост клонов гибридом наблюдался во всех 480 лунках, из них 53 оказались положительными. Супернатанты культур положительных гибридом были повторно тестированы с использова5 нием рекомбинантного ГР и БСА,
Результаты представлены в табл 3. Приведенные в табл. 3 данные свидетельствуют о специфичности МКА к ГР человека Среди полученных гибридом имелись штам0 мы, продуцирующие МКА igM и gG классов.
Таким образом, данные, представленные в примере 3, свидетельствуют о возможности применения 3-недельного
5 комбинированного внутрибрюшинного и внутриселезеночного способа иммунизации СЭКП для получения моноклональных антител IgM и IgG классов к рекомбинантному белку. Общая продолжительность получения штаммов гибридом, продуцирующих
МКА к рекомбинантному белку, составляет при этом 5-6 недель.
Формула изобретения Способ получения гибридом, продуцирующих моноклональные антитела к реком- бинантным белкам, включающий клонирование и экспрессию генов белка,
иммунизацию животных и получение штаммов гибридом, отличающийся том, что, с целью повышения надежности, экспрессию гена белка осуществляют в сингенных эукариотических клетках-продуцентах, которыми проводят иммунизацию сингенных животных.


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К БЕЛКУ Р30 ВИРУСА АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ С ИСПОЛЬЗОВАНИЕМ РЕКОМБИНАНТНЫХ КОНСТРУКЦИЙ | 2013 |
|
RU2534343C1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS, используемый для получения моноклональных антител к @ - тимозину | 1988 |
|
SU1527260A1 |
| Штамм гибридных культивируемых клеток животных mus musculus α - продуцент моноклональных антител, специфичных к раково-тестикулярному антигену человека GAGE | 2017 |
|
RU2652885C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА К ТЕРМОСТАБИЛЬНОМУ АНТИГЕНУ, ОБЩЕМУ ДЛЯ ВОЗБУДИТЕЛЕЙ САПА И МЕЛИОИДОЗА | 1997 |
|
RU2117043C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ДИАГНОСТИКИ ВОЗБУДИТЕЛЕЙ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ | 2019 |
|
RU2733379C1 |
| ШТАММ БАКТЕРИЙ SALMONELLA ENTERIDITIS E-23 BMC120 ДЛЯ ИММУНИЗАЦИИ ПРОТИВ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2001 |
|
RU2192277C1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS,используемый для получения моноклональных антител к мембранному белку ЕSснеRIснIа coLI в препарате рекомбинантного интерлейкина-2 человека | 1987 |
|
SU1446157A1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus. Musculus, ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПЕЦИФИЧНЫЕ К ПЕПТИДУ, ОБЛАДАЮЩЕМУ АПОПТОТИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2009 |
|
RU2402605C1 |
| Штамм культивируемых гибридных клеток животных МUSмUSсULUS L - продуцент моноклональных антител против В-лимфоцитов крупного рогатого скота | 1988 |
|
SU1645295A1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS,используемый для получения моноклональных антител к рекомбинантному интерлейкину-2 человека | 1987 |
|
SU1437393A1 |
Изобретение относится к биотехнологии и может быть использовано в гибридомной технологии для получения антител против рекомбинантных антигенов, экспресси- рованных в клетках мыши. Изобретение состоит в иммунизации мышей непосредственно трансфектированными сингенными клетками (СЭКП). Таким образом, исключается необходимость очистки рекомбинантного антигена. При внутриселезеночном способе введения СЭКП образуются штаммы гибридом, продуцирующие антитела класса IgM. Общая продолжительность от начала иммунизации до получения штаммов гибридом составляет3-4 недели. При комбинированном внутрибрюшинном и внутриселезеночном способе введения СЭКП образуются штаммы гибридом, продуцирующие антитела классов IgM и IgG.Общая продолжительность от начала иммунизации до получения штаммов гибридом составляет 5-6 недель. Способ апробирован на антигене-гормоне роста человека. Ген гормона роста трансфектирован в мышиные фибробласты линии Balb/ЗТЗ. З табл. СП С
юны гибридом,
Оптическая плотность при 492 х 10 м, антиген в И ФА
1054
364
812
354
346
499
491
1045
703
848
728
794
6«б
339
447
311
737
642
374
329
875
842
393
Таблица 1
5
ть при 492 х 10 м, в И ФА
1054
364
812
354
346
499
491
1045
703
848
728
794
6«б
339
447
311
737
642
374
Таблица 2 Изотип МКА
М М
М VI М fvi М М М
IV
М .V
М
М
ТаблицаЗ
| Europ | |||
| J | |||
| Immunol., 1976, vol | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ УСТРАНЕНИЯ СКОЛЬЖЕНИЯ КОЛЕС АВТОМОБИЛЕЙ | 1920 |
|
SU292A1 |
| J | |||
| Immunol | |||
| Methods, 1987, vol | |||
| Приспособление для записи звуковых явлений на светочувствительной поверхности | 1919 |
|
SU101A1 |
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
Авторы
Даты
1992-05-15—Публикация
1989-11-20—Подача