Изобретение относится к физиологии и биохимии растений, может быть применено в молекулярной биологии развития при оценке функционального состояния интерфазных ядер.
Цель изобретения - повышение активности и выхода ядерных трипсиноподобных протеиназ и их ингибиторов.
Способ заключается в том, что перед выделением клеточных ядер растительную ткань консервируют, а очистку ядер проводят раствором, содержащим 0,5% тритон Х-100 с последующей экстракцией ядерных фракций возрастающими концентрациями 0,14 М, 0,35 М, 2 М хлористого натрия, 6 М гуанидин гидрохлорида с 0,1 % /3-меркапто- этанолом и 0,5 н, раствором гидроксида натрия при сопутствующей аффинной хроматографии вышеперечисленных ядерных фракций на сефарозе 4 В с иммобилизованным трипсином либо ингибитором трипсина,
Пример. Опыты проводили на покоящихся, 1-2-дневных проростках, 3-4-дневных тканях колеоптилей и листьев пшеницы Московской-35, Мироновской озимой и яровой. Проростки выращивали при температуре 25°С в термостатированной камере между слоями фильтровальной бумаги, смоченной дистиллированной водой. Отделенные от эндосперма зародыши, проростки, колеоптили и листья в течение 3 с промывали холодным эфиром и многократно дистиллированной водой. Проростки и ткани консервировали при -25°С в 80-90%-ном глицерине. Затем зародыши, проростки и ткани заливали гомогенизационной средой: 20% глицерин; 0,005 М MsCl2; 0,025 М KCI; 0,003 М CaCl2; 0,005 М NaCI; 0,004 М уЗ-мер- каптоэтанол; 0,02% триэтаноламин (ТЭА) HCI рН 6,8; 0,004 М н-октиловый спирт, ГоV
CJ
со
4
могенизацию проростков проводили 7 с при 15 000 об/мин (гомогенизатор МП8-302, Польша). Гомогенат фильтровали через 1 слой фланели, флюзелина и 3 слоя капрона (размер пор 70 мкм ). С грубым остатком растительного материала гомогенизацию и фильтрование проводили еще 2 раза 15 с и 30 с при 15 000 об/мин. Объединенные гомо- генаты центрифугировали при 500 об/мин (ЦЛР-1, СССР) в течение 5 мин с целью освобождения от грубых неразрушенных тканей и целых клеток, затем надосадок центрифугировали при 2700 об/мин (К-23, ГДР) в течение 20 мин. Осадок ядер собирали суспендированием средой гомогенизации (50 мл) и наслаивали на прерывистый глице- пиновый градиент, состоящий из 5 слоев (по 30 мл) возрастающей концентрации глицерина (50, 60,70, 80,90 вес/объем), приготов- ленный на ТЭА НС рН 6,8 со всеми перечисленными компонентами гомогени- Зсщионной среды, исключая 20%-ный глицерин. Градиентное центрифугирование проводили при 2 000 об/мин в течение 1 ч (ЦЛР-1, СССР). Осадок ядер промывали 0,5%-ным тритоном Х-100 на среде гомогенизации, но без глицерина, с последующим центрифугированием при 2 700 об/мин (К- 23, ГДР) в течение 15 мин, после чего ядра промывали трижды в среде следующего состава: 0,005 М MsCIa; 0,025 М 0,003 М CaOfc: 0,005 М NaCI; 0,01 М трис-HCI рН 6,8 с последующим центрифугированием при указанных условиях. 1 %-ным тритоном X- 100 промывать ядра нельзя, т.к. они набухают и разливаются.
Степень чистоты выделенных препаратов клеточных ядер определяли микроскопически, спектрофотометрически и по компонентному составу клеточных ядер (белок/ДНК, РНК/ДНК, табл. 1).
Сравнение процентного выхода ядер и их удельной ферментативной активности при использовании сахарозо-гуммиараби- кового и глицеринового методов изоляции ядер представлено в табл.2.
Из очищенных препаратов ядер нукле- оплазматические белки экстрагировали при низкой ионной силе 0,14 MNaCI, 0,01 М трис-HCI рН 6,8 буфером. Непрочносвязан- ные ядерные белки выделяли путем трех последовательных экстракций 0,35 М NaCI на том же буфере.
Далее осадок фракционировали суспендированием в трис-HCI буфере с 2 М NaCI. В осадке оставалась фракция, содержащая ядерный матрикс. Последующую экстракцию проводили 6 М гаунидин гидрохлоридом с 0,1 %-ным /5-меркаптоэтанолом на трис-HCI буфере рН 6,8 (ядерный матрикс )L
остаточные компоненты экстрагировали 0,5 н NaOH (ядерный матрикс М). Бее фракции ядерных компонентов получали путем трех последовательных экстракций. Достаточ- ность экстракций контролировали по выходу белка. Ядерные фракции хранили при -196° в азоте.
Аффинную хроматографию проводили на колонках (1X0,5 см) либо с иммобияизован0 ным трипсином(СПОФА, ЧССР), либо ингибитором трипсина (Reanal, Венгрия), ковалентно присоединенных к CNBr-активи- рованной агарозе (Институт химии АН ЭССР). Протеиназную активность трипсина и
5 трипсиноподобных протеиназ определяли по расщеплению низкомолекулярного белка протамина (Calbiochem, США),
Количество освободившегося аргинина рассчитывали, пользуясь калибровочным
0 графиком. В качестве стандарта использовали D, L-аргинин (Reanal, Венгрия). Активность трипсиноподобных протеиназ и их ингибиторов выражали в нмоль аргинина на 1 мг белка/с.
5 Анализ полноты выделения ядерных фракций (табл. 3) показал, что все фракции представляют собой не чистый белок, а комплексы нуклеиновых кислот и белка.
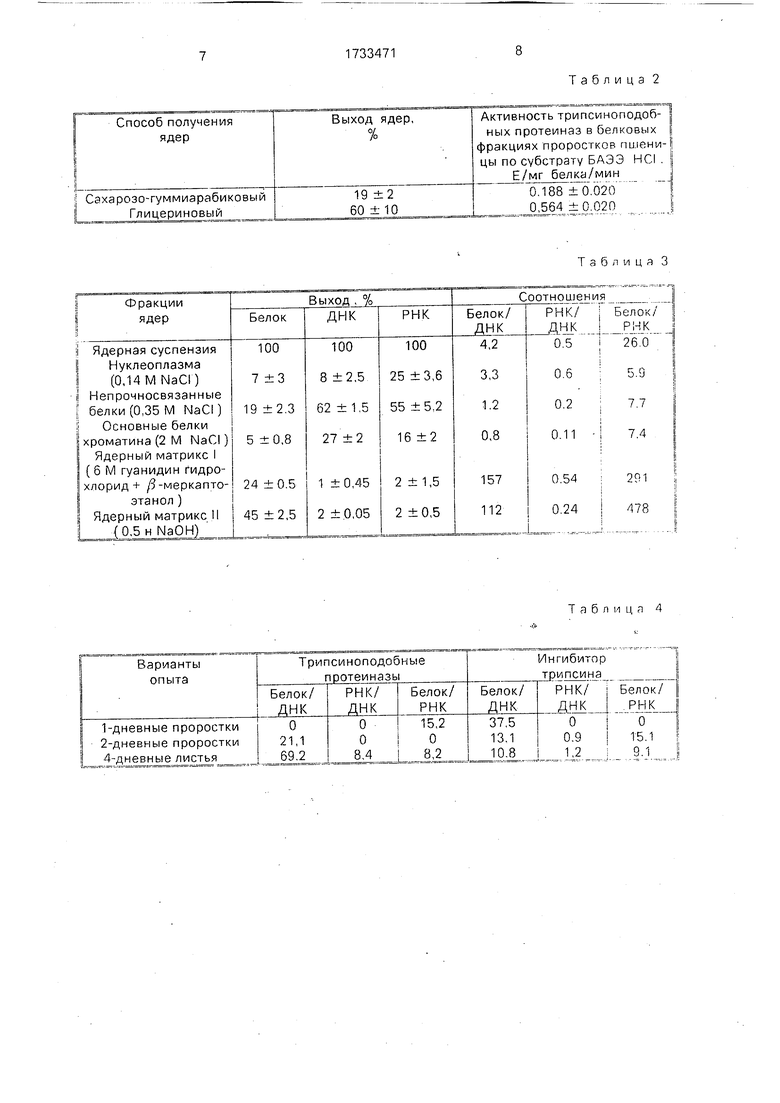
Эффективность последовательной сту0 пенчатой экстракции трипсиноподобных протеиназ и их ингибиторов с последующей идентификацией либо на колонках с иммобилизованным трипсином, либо ингибитором трипсина продемонстрирована на фиг.
5 1, 2, На оси ординат (фиг. 1) показано содержание протеиназных и ингибиторных нукле- опротеидных комплексов в расчете мкг белка на 10 000 штук семян. На оси абсцисс указан возраст проростков от покоящихся
0 зародышей (0) до 2-суточных проростков; 3-4 суточные колеоптили; 3-4 суточные листья; 3-4 суточные корни, Использованы следующие обозначения; 1-нуклеоплазма, 2-непрочносвязанные белки хроматина, 35 основные белки хроматина, 4-ядерный матрикс I, 5-ядерный матрикс II, А-протеиназы. Б-ингибиторы протеиназ,
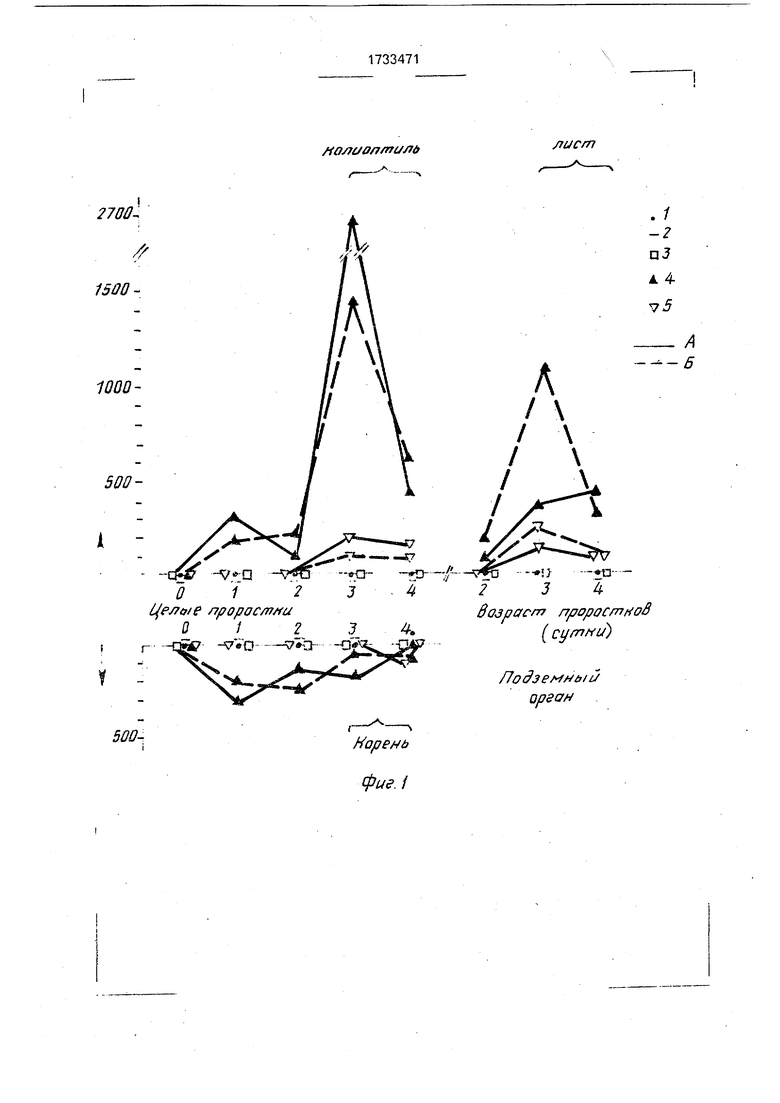
Если из ядер выделить нуклеоплазму (0,14 М NaCI), а затем сразу их экстрагиро0 вать 0,5 н NaOH (фиг. 2), то мы не получим эффекта, который изображен на фиг. 1, т.е. нарушение приведенной последовательности экстракций не дает эффекта выделения трипсиноподобных протеиназ и ингибиторов.
5 На фиг. 2 на оси ординат показана оптическая плотность растворов при длине волны 280 нм, а по оси абсцисс указаны номера проб. На фиг. 2 даны следующие обозначения: 1-колонка с иммобилизованным ингибитором трипсина, Н-колонка с иммобилизованным трипсином, а - трипси- ноподобные протеиказы. б - ингибитор трипсина,
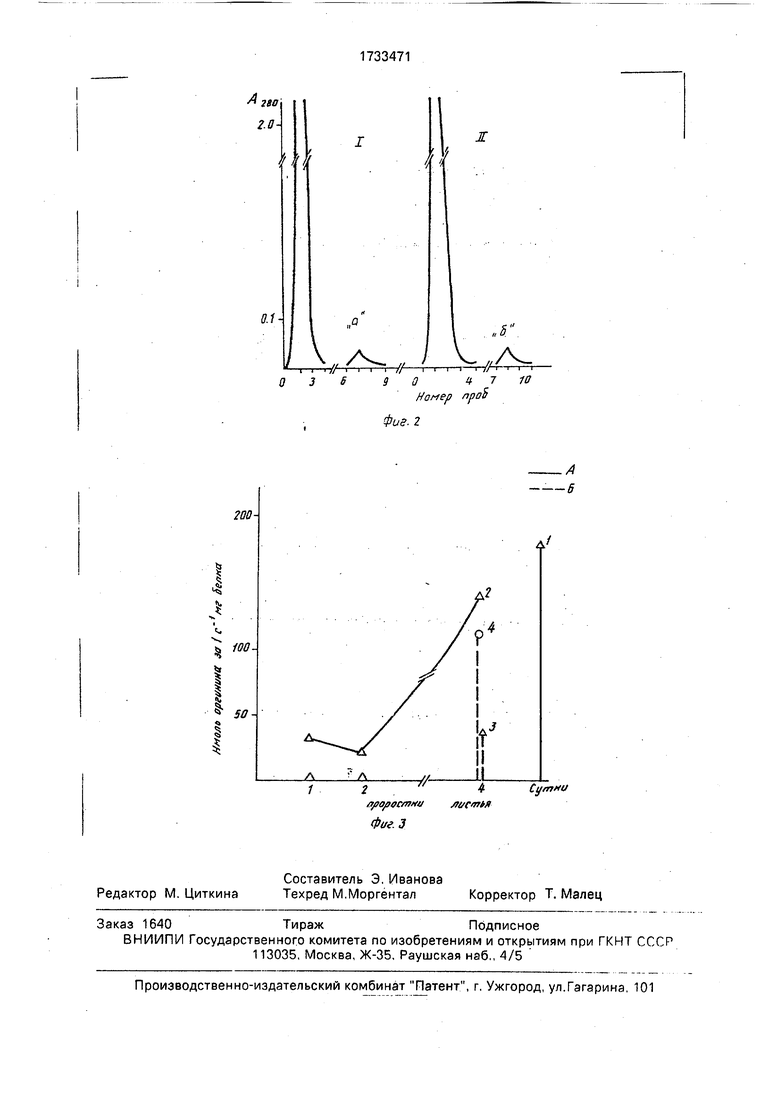
На фиг. 3 на оси ординат показаны единицы удельной протеолитической и ингиби- торной активностей, а по оси абсцисс указан суточный возраст проростков и листьев: 1,2- одно - двухсуточные целые проростки; 4 - четырехсуточные листья. На фиг. 3 - даны следующие обозначения: 1 - протеолитическая активность трипсина; 2 - протеолитическая активность проростков и листьев; 3 - ингибирование активности трипсина ядерным ингибитором; 4 - ингибирование ядерной протеиназы ядерным ингибитором; А - протеолитическая активность; Б - ингибиторная активность.
Исследование фракций, обладающих протеиназной и ингибиторной активностью, включает предварительную консервацию растительных тканей и выделение из них клеточных ядер в глицериновой среде. Табл, 1 показывает что структура клеточных ядер по содержанию генетического материала не нарушена; табл. 2 иллюстрирует увеличение процентного выхода удельной протеиназной активности; табл. 3 иллюстрирует полноту выделения ядерных фракций; табл. 4 иллюстрирует компонентный состав аффинновыделенных ядерных трип- синоподобных протеиназ и их ингибиторов.
Фиг. 1-2 иллюстрируют влияние ступенчатой последовательности экстракций ядерных фракций на выходтрипсиноподоб0
5
0
5
0
ных протеиназ и их ингибиторов: на фиг. 3 иллюстрирует про еиназную и ингибитор- ную активность аффинновыделенных трип- синоподобных протеиназ и их ингибиторов в сравнении с активностью трипсина.
Предложенный способ рекомендуется в исследовании молекул я рно-генетических механизмов эндогенной регуляции организации генетических, морфогенетических программ развития организма на разных онтогенетических стадиях дифференцированного роста растений.
Формула изобретения Способ получения ядерных фракций обладающих протеиназной и ингибирую- щей активностью, из проростков злаковых культур путем выделения клеточных ядер, очистки их раствором, содержащим тритон Х-100 и хлористый натрий, и оценки протеиназной активности, отличающийся тем, что с целью повышения выхода и активности целевого продукта, перед выделением клеточных ядер растительную ткань консервируют, а очистку ядер проводят последовательно растворами, содержащими 0,5% тритона X - 100 с возрастающими концентрациями 0,14 М, 0,35 М и 2.0 М хлористого натрия, далее раствором, содержащим 6 М гуанидин хлорид с 0,1 %-ным /3-меркаптоэта- нолом, затем 0,5 н. раствором гидроксида натрия и аффинной хроматографией на сефарозе 4В с иммобилизованным трипсином либо ингибитором трипсина.
35
Таблица 2

Изобретение относится к физиологии и биохимии растений. Целью изобретения является повышение выхода и активности целевого продукта. Растительную ткань консервируют в глицериновой среде, ядра последовательно обрабатывают сначала возрастающими концентрациями хлористого натрия в присутствии 0,5% тритона Х-100, затем растворами гуанидин гидрохлорида с / -меркаптоэтанолом и 0,5 н, щелочью натрия. Проводят аффинную хроматографию на сефарозе 4В с иммобилизованным либо трипсином, либо ингибитором трипсина. 3 ил., 4 табл.
Таблица 3
Т а б л ii ц л 4
Ингибитор
трипсина
РНК/ 7
.
О 0.9
1,2
l
-4 CO CO Ј -J
J Ch
D I -Јs Nj
А гаа
10Ч
0.1/V-. „ 1
т-1-rif- -i-i-г-//1- -
3 690it 7 ГО
Номер лрв& Фиг. 2
HU
/уюрд&яма Фиг. 3
| Бюллетень Всесоюзного селекционно-генетического института, Одесса, 1981, с | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| Экологические аспекты гомеостаза в биогеоценозе | |||
| Уфа, 1986, с | |||
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
Авторы
Даты
1992-05-15—Публикация
1990-02-07—Подача