сл
С


| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS - продуцент моноклональных антител к Са @ /М @ - зависимой эндонуклеазе клеточных ядер лимфоцитов селезенки человека | 1987 |
|
SU1497213A1 |
| Способ определения активности С @ /М @ -зависимой эндонуклеазы лимфоцитов | 1987 |
|
SU1541514A1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS - продуцент моноклональных антител к Са @ /MG @ - зависимой эндонуклеазе клеточных ядер лимфоцитов селезенки человека | 1987 |
|
SU1497214A1 |
| Способ получения ядерных фракций, обладающих протеиназной и ингибирующей активностью | 1990 |
|
SU1733471A1 |
| Рекомбинантная плазмидная ДНК альфа RI-7, предназначенная для маркирования 1-ой хромосомы человека | 1990 |
|
SU1792429A3 |
| Способ получения эндонуклеазы рестрикции @ | 1988 |
|
SU1634713A1 |
| МЫШИНАЯ ГИБРИДОМА S148 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА К БЕЛКУ ЯДРЫШКА SURF-6 МЛЕКОПИТАЮЩИХ | 2010 |
|
RU2421514C1 |
| Способ получения ДНК-полимеразы- @ из ядер печени крыс | 1984 |
|
SU1232261A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНОМАЛИИ УПАКОВКИ ХРОМАТИНА СПЕРМАТОЗОИДОВ ЧЕЛОВЕКА ПРИ МУЖСКОЙ ИНФЕРТИЛЬНОСТИ С ИСПОЛЬЗОВАНИЕМ БИОМЕДИЦИНСКОЙ ТЕСТ-СИСТЕМЫ | 2015 |
|
RU2595838C1 |
| Способ получения обратной транскриптазы из ЕSснеRIснIа coLI | 1989 |
|
SU1638162A1 |
Использование: биохимия, получение ингибитора Ca/Mg-зависимой эндонуклеа- зы лимфоцитов. Сущность изобретения: в качестве объекта выделения используют лимфоциты периферической крови или селезенки человека, или крупного рогатого скота при злокачественных лимфопролифе- ративных заболеваниях, наиболее предпочтительно - при хроническом лимфолейкозе, из лимфоцитов выделяют клеточные ядра в растворах сахарозы возрастающей плотности (от 0,25 до 2,0 М), клеточные ядра экстрагируют растворами 0,3-0,6 М NaCI или KCI в присутствии 0,075-0,1 %-ного тритона X- 100, экстракты высаливают сульфатом аммония в количестве 80-85% насыщения и из обессоленного осадка выделяют ингибитор с помощью высокоэффективной жидкостной колоночной хроматографии.
Изобретение относится к биохимии, в частности к получению ингибиторов нукле- аз.
Ингибиторы нуклеаз могут быть использованы для дифференциального подавления активности отдельных ферментов в инкубационных смесях, содержащих несколько нуклеаз. Они также могут применяться для получения интактных препаратов нуклеиновых кислот и для аффинной хроматографии нуклеаз. Исследование ингибиторов нуклеаз важно для понимания механизмов регуляции этих ферментов в клетке.
Ингибитор Ca/Mg-зависимой эндонук- леазы в литературе не известен и получен впервые. Известны природные ингибиторы бактериальных эндонуклеаз. В частности, получен ингибитор внеклеточной ДНКазы Actynomyces levoris 2789. Ингибитор выделяли из экстрактов мицелия культур, фракционируя их сульфатом аммония и хрома- тографируя на сефадексе G-100 и КМ-целлюлозе. Ингибитор был охарактеризован как лабильный белок с ph 7,8-8,2, специфичный к ДНКазе 1 A.levoris 2789 (1). Известны также природные ингибиторы эндонуклеаз, полученные из тканей животных. Например, из селезенки телят выделен ингибитор ДНКазы 1 (панкреатической). Ингибитор выделяли, фракционируя экстракт сульфатом аммония и хроматографируя активные фракции на геле окиси алюминия и ДЭАЭ-целлюлозе. Ингибитор был идентифицирован как G-актин или близкородственный ему белок (2). Данный ингибитор не действует на Ca/Mg-зависимую эндонукле- азу клеточных ядер, в частности из лимфо- идных тканей. Природные ингибиторы Ca/Mg-зависимой эндонуклеазы в литературе не описаны и нами получен впервые.
VJ
О СО N СО 00
Цель изобретения - получение природного ингибитора Ca/Mg-зависимой эндо- нуклеазы клеточных ядер лимфоцитов.
Поставленная цель достигается тем, что для получения ингибитора используют лимфоциты периферической крови или селезенки крупного рогатого скота или человека при злокачественных формах лимфопроли- феративных заболеваний - наиболее предпочтительно при хроническом лимфолейкозе (ХЛЛ), причем ингибитор выделяют не из целостных клеток, а из изоли- роваиных клеточных ядер. Для этого клеточные ядра экстрагируют раствором, содержащим 0,3-0,6 М KCI с 0-0,1%-ным тритоном Х-100, экстракт фракционируют сульфатом аммония до 80-85% насыщения и активные фракции после растворения и диализа подвергают обессоливанию на колонках с G-25 и высокоэффективной жидкостной колоночной хроматографии на катионообменных колонках Mono S (Фармация, Швеция), с элюцией градиентом хлористого натрия от 0 до 0,5 М. Способ позволяет получить препарат, обладающий выраженной ингибирующей активностью по отношению к Ca/Mg-зависимой эндонук- леазе клеточных ядер лимфоцитов. Ингиби- рующая активность специфична, так как препарат не ингибирует ДНКазу 1 и микрококковую нуклеазу и связана с белком.
Изобретение иллюстрируется следующими примерами.
П р и м е р 1. Лимфоциты периферической крови, полученные от коровы, большой хроническим лимфолейкозом, суспендировали в растворе, содержащем 10 тМ трис- HCI, рН 8,0, 3 mM MgCI2, 0,9 М сахарозу и 0,002% тритона Х-100(ТМС-0,9); на 107 лимфоцитов использовали 10 мл среды. Суспензию гомогенизировали в гомогенизаторе Звелыейма-Поттера и наслаивали на 10 тМ трис-HCI, рН 8,03 mM MgCl2,1,2 М сахарозу в соотношении 3:1. Пробы центрифугировали при 1500-2000 g 10 мин при 4°С. К осадкам добавляли 10 мл ТМС-0,9, тщательно суспендировали и повторно центрифугировали в том же режиме. Осадки были представлены интактными клеточными ядрами. Клеточные ядра суспендировали в 10 тМ трис-HCI, рН 7,4-7,6, до конечной концентрации 2 мг/мл (по ДНК). К суспензии добавляли 3 объема 0,4 М KCI, 0,1 % тритона Х-100 в 10 тМ трис-HCI, рН 7,4-7,6 (конечные концентрации KCI и тритона Х-100 составляли 0,3 М и 0,075% соответственно) и перемешивали на ледяной бане 30-60 мин. После этого пробы центрифугировали при 24000 g 15 мин, 4°С, Осадки отбрасывали. В над- осадках (экстрактах) содержались негистоновые белки хроматина и ингибирующие факторы. Специальные исследования относительно условий экстракции показали следующее. При конечной концентрации KCI в
экстрагирующей смеси 0,3 М (см. выше) степень экстракции ядерных белков составляет 21% (степень экстракции определяли по формуле (а/a+b) 100, где а - количество белка в экстракте, Ь - количество белка в
0 осадке). При снижении конечной концентрации KCI (до 0,2 и 0,1 М) степень экстракции существенно снижалась, снижался и выход целевого продукта. При повышении концентрации KCI до 1,0 М степень экстракции
5 белков возрастала до 45-50%, однако активность ингибитора в экстракте не возрастала после концентрации 0,6 М. Введение в экстрагирующую смесь тритона Х-100 в конечной концентрации 0,05-0,075% повы0 шало степень экстракции белков в присутствии 0,3 М KCI до 46%, при этом активность ингибитора возрастала на 20-25%. Другие исследованные условия экстракции ядерных белков - ультрозвуковая обработка
5 ядер, экстракция гуанидинхлоридом в присутствии дитиотрейтола, применение только триона - Х-100 - давали худшие результаты.
Полученные экстракты фракционирова0 ли высаливанием сульфатом аммония. Для этого пробы обессоливали на сефадексе G- 25 и при непрерывном перемешивании добавляли сухой сульфат аммония до 80% насыщения. Сформировавшийся осадок от5 деляли центрифугированием при 100000 g, 1 ч, 4°С; надосадок отбрасывали. Применение высаливания сульфатом аммония обеспечивало концентрирование образцов, освобождение от части балластных белков и
0 стабилизацию ингибитора. Полученные осадки могли храниться при 4°С без потери активности 1 месяц. Понижение концентрации сульфата аммония до 70% приводило к снижению выхода ингибитора на 10-15% и
5 снижению стабильности препарата. Повышение концентрации сульфата аммония до 85% и 90% не приводило к изменению результатов.
Осадок, полученный после высалива0 ния, растворяли в минимальном объеме 10 тМ трис-HCI, рН 7,4-7,6 и обессоливали на колонках с сефадексом G-25. Обессоленный образец, содержащий 1-1,5 мг белка в 1-2 мл, наносили на катионообменную колонку
5 Mono S (система FPLC, Фармация, Швеция), предварительно уравновешенную тем же буфером. Скорость нанесения составляла 0,1-0,2 мл/мин. После нанесения образца колонку промывали 5-7 мл того же буфера со скоростью 1 мл/мин, после чего
начинали элюцию сорбированных белков линейным градиентом NaCI от 0 до 0,5 М в том же буфере. Скорость элюции - 1 мл/мин, давление - 1,0-1,5 МРа, объем градиента - 10 мл. Собирали фракции объемом 0,5 или 1,0 мл и анализировали их на инги- биторную активность.
Активность ингибитора определяли следующим образом. Готовили инкубационные пробы, содержащие 40 мкл 10 тМ трис- HCI, рН 7,6, 10 mM MgCI2, 1 тМ CaCfc, 10 rrjM 2-меркаптоэтанол и 10 ед Са/Мд-зави- симой эндонуклеазы клеточных ядер лимфоцитов здоровых животных. Пробы готовили в лунках 96-луночных микроплат. За единицу активности фермента принимали его количество, достаточное для полного расщепления 0,1 мкг ДНК А-фага за 2 часа инкубации при 37°С в средах, содержащих 10 mM MgCIa, 1 тМ CaCJ2. Полноту расщепления контролировали электрофорезом в гелях 0,8% агарозы.
К инкубационным пробам добавляли 10 мкл каждой фракции градиента и инкубировали на льду 5-10 мин. Затем в пробы вносили 1 мкг ДНК А -фага и инкубацию продолжали в течение 2 часов при 37°С. После этого в пробы вносили 5 мкл 50% глицерина с 2,5% бромфенолового синего и наносили их на горизонтальный блок геля 0,8% агарозы. Электрофорез проводили при напряжении 150 В; гели окрашивали бромистым этидием и фотографировали в отраженном ультрафиолетовом свете с длиной волны 254 нм.
Во фракциях, соответствующих концентрации NaCI от 0,25 до 0,3 М, обнаруживалосьсохранениеинтактной(нерасщепленной) ДНК А-фага, что говорит о присутствии в них ингибитора Са/Мд-за- висимой эндонуклеазы.
За единицу активности препарата ингибитора было принято такое его количество, которое обеспечивало ингибирование 10 ед Ca/Mg-зависимойэндонуклеазы на 1%. Выход ингибитора составлял 12000 ед/мг ДНК исходных ядер, удельная активность - 600 ед/мкг белка, очистка - в 100 раз по отношению к экстракту.
По данным электрофореза в полиакри- ламидныхгеляхсдодецилсульфатом натрия и обработок препарата различными протеа- зами, ингибирующая активность препарата связана с полипептидами размерами от 60 до 67 кО.
П р и м е р 2. Все операции проводили аналогично примеру 1, за исключением того, что использовали лимфоциты периферической крови людей, больных хроническим
лимфолейкозом, и активность ингибитора определяли непосредственно к экстрактах клеточных ядер.
Примерз. Для препаративного выделения ингибитора использовали селезенку
КРС, больного спонтанным ХЛЛ,
Все процедуры выполняли как описано выше, за исключением того, что клеточные ядра выделяли следующим образом. В опыт брали 0,2 кг селезенки. Образец измельчали
0 в мясорубке. Полученную массу переносили в 5-литровую колбу и заливали 2 л охлажденного буфера А (0,9% NaCI, 0,5% Na-цитрат, 10 мМ трис-HCI, рН 7,6). Колбу переносили в баню со льдом и содержимое перемеши5 вали, интенсивно вращая колбу 30 мин. Полученную суспензию фильтровали через 4 слоя марли и фильтрат центрифугировали при 5000 g 30-40 мин. К осадку добавляли 1 л буфера В (0,25 М сахарозы, 0,4% нонидет
0 Р-40, 5 мМ CaCl2, 50 мМ трис-HCI, рН 8,5) и гомогенизировали порциями по 60 мл в гомогенизаторе Поттера. Гомогенат фильтровали через 4 слоя марли и центрифугировали при 5000 g 30 мин. По
5 данным микроскопии осадок более, чем на 90% состоял из лимфоцитов. К осадку добавляли 500 мл буфера С (1,0 М сахароза, 5 мМ CaCI, 50 мМ трис-HCI, рН 8,5, 0,4% нонидет Р-40) и интенсивно гомогенизирова0 ли. Гомогенат центрифугировали при 50000 g 30 мин. Осадки суспендировали в буфере С и наслаивали в 100-мл центрифужных пробирках на 20 мл буфера Е (2,0 М сахароза, 50 мМ трис-HCI, рН 8,5, 5 мМ CaCi2) и цент5 рифугировали при 70000 g 2 часа.
П р и м е р 4. Для выделения ингибитора использовали клеточные ядра, полученные из лимфоцитов периферической крови здорового животного. Все этапы проводили
0 аналогично примеру 1. Ингибирующей активности обнаружить не удалось.
П р и м е р 5, Все приемы выполняли аналогично примеру 1, за исключением того, что определяли действие ингибитора на
5 Ca/Mg-зависимую эндонуклеазу клеточных ядер лимфоцитов селезки здоровых животных и человека. 120 ед препарата ингиби- ровали активность фермента селезенки крупного рогатого скота на 100 %. а селезен0 ки человека - на 80%.
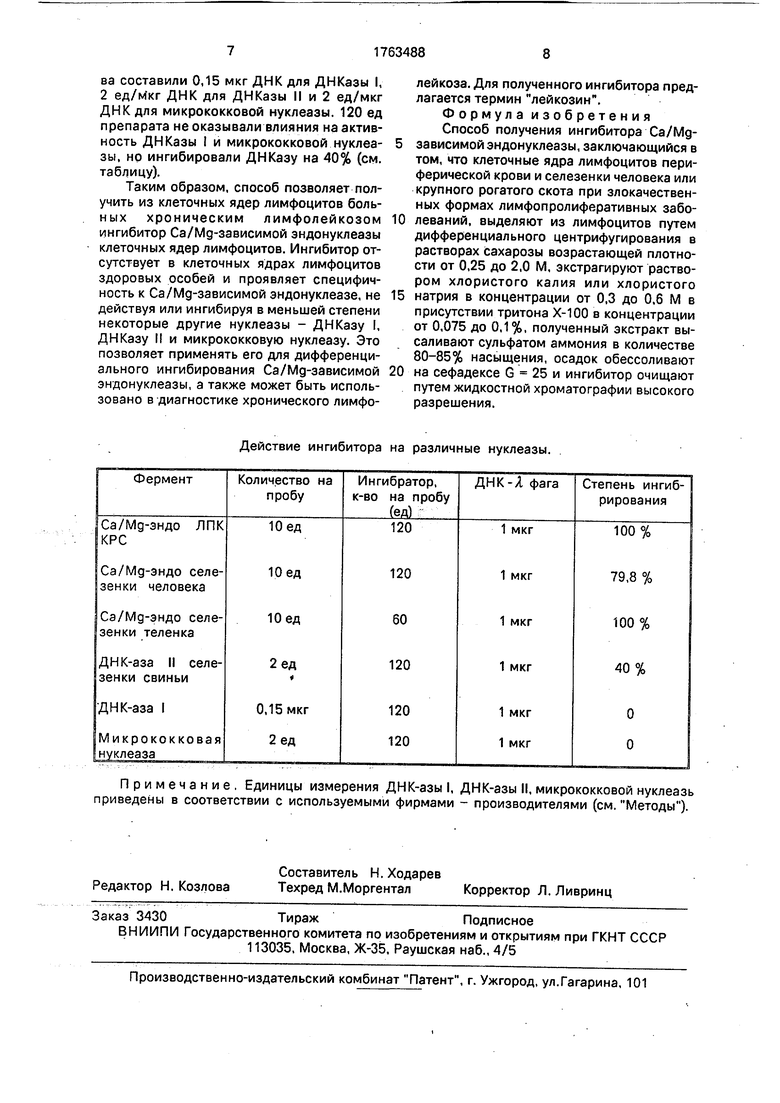
П р и м е р 6. Определяли действие ингибитора на коммерческие препараты ДНКазы I (панкреатической), ДНКазы II (селезенки свиньи) и микрококковой нуклеазы.
5 Количества фермента подбирали так, чтобы электрофоретическая картина расщепления ДНК А -фага была сходна с таковой для используемых количеств Ca/Mg-зависимой эндонуклеазы. Соответствующие количества составили 0,15 мкг ДНК для ДНКазы I, 2 ед/Мкг ДНК для ДНКазы II и 2 ед/мкг ДНК для микрококковой нуклеазы. 120 ед препарата не оказывали влияния на активность ДНКазы 1 и микрококковой нуклеазы, но ингибировали ДНКазу на 40% (см. таблицу).
Таким образом, способ позволяет получить из клеточных ядер лимфоцитов боль- ных хроническим лимфолейкозом ингибитор Ca/Mg-зависимой эндонуклеазы клеточных ядер лимфоцитов. Ингибитор отсутствует в клеточных ядрах лимфоцитов здоровых особей и проявляет специфичность к Ca/Mg-зависимой эндонуклеазе, не действуя или ингибируя в меньшей степени некоторые другие нуклеазы - ДНКазу I, ДНКазу И и микрококковую нуклеазу. Это позволяет применять его для дифференциального ингибирования Ca/Mg-зависимой эндонуклеазы, а также может быть использовано в диагностике хронического лимфои
Действие ингибитора на различные нуклеазы.
лейкоза. Для полученного ингибитора предлагается термин лейкозин.
Формула изобретения Способ получения ингибитора Са/Мд5 зависимой эндонуклеазы, заключающийся в том, что клеточные ядра лимфоцитов периферической крови и селезенки человека или крупного рогатого скота при злокачественных формах лимфопролиферативных забо10 леваний, выделяют из лимфоцитов путем дифференциального центрифугирования в растворах сахарозы возрастающей плотности от 0,25 до 2,0 М, экстрагируют раствором хлористого калия или хлористого
15 натрия в концентрации от 0,3 до 0,6 М в присутствии тритона Х-100 в концентрации от 0,075 до 0,1%, полученный экстракт высаливают сульфатом аммония в количестве 80-85% насыщения, осадок обессоливают 20 на сефадексе G 25 и ингибитор очищают путем жидкостной хроматографии высокого разрешения.
Авторы
Даты
1992-09-23—Публикация
1990-12-28—Подача