Изобретение относится к способу получения новых производных пиразоло ()пиримидина, обладающих ценны ми фармакологическими свойствами,, -которые могут найти применение в медицине.
Цель изобретения - способ получения новых производных пиразоло(3,4-d) пиримидина, обладающих более высокой противоспалительной активностью.
Поставленная цель достигается способом получения конденсированных
ы
J . 1739B50 4
производных пиразоло.-сОпиримиди- в диоксане (100 мл). Смесь перемешивают в течение 3 ч при комнатной температуре, затем выпавшие кристаллы отфильтровывают , Перекристаллизация из водног о спирта дает бесцветные кристаллы О4 г, ) с т,пл.
на общей формулы
О NRj-Л it t )
R.Vv-A .
(A.V4
(I)
152°С.
м vjВычислено,%: С 49,25 Н 6,79J
I,0 N 20 51R2CWH23N50 S
Найдено, С 49,31; Н 6,70;
где А группа - (CH2)n-CO-, -(CHZLMN 20,48.
или - (CHi)n- Аналогично получают соединения,
(п равно 1 или 2, или 3)U приведенные в табл. 1.
и Яг - алкил с 1,6-атомами уг-, Т а б л и ц а 1
лерода;RJ О
R3- водород, алкил или ацил тДч
с 1-6 атомами углерода,JL jl -Г-ЫНА
заключающийся в том, что циклизуют0 м NnAG
соединение общей формулыI
в диокс вают в ператур отфильт из водн кристал
152°С.


















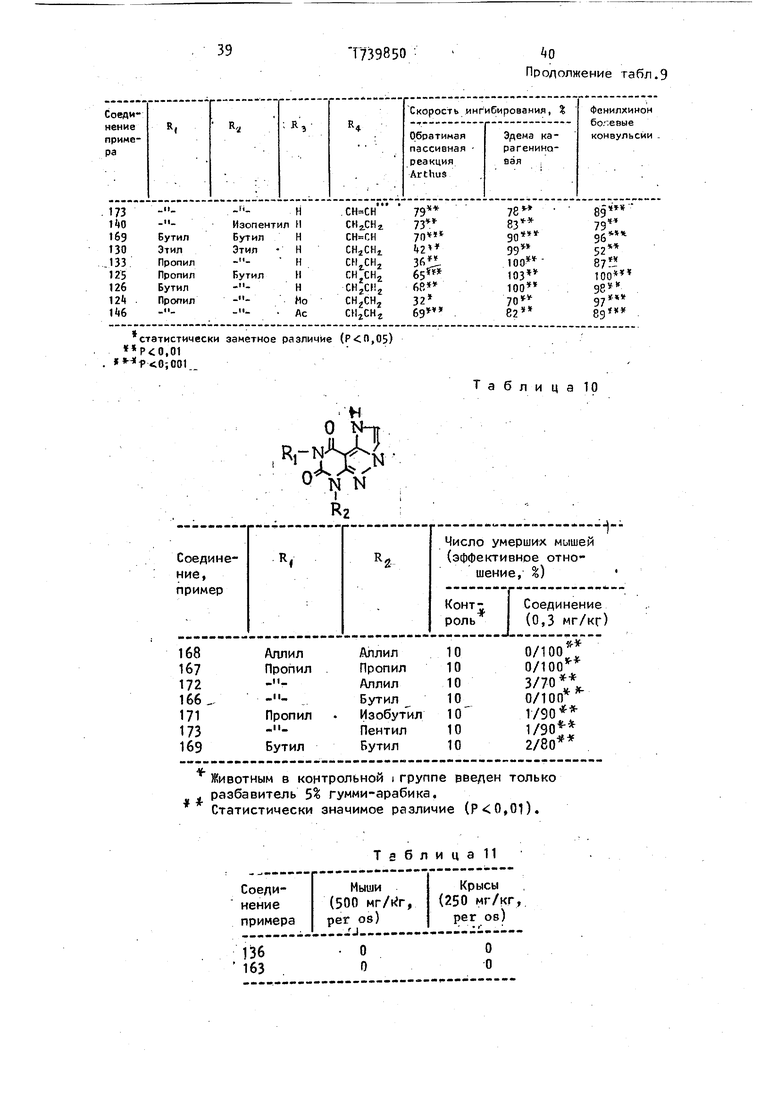

Изобретение касается гетероциклических веществ, в частности получения конденсированных производных пиразоло (3,4-d)пиримидина, общей ф-лы О NR3-X RiN-KvJ- A где А - -()-, -(СН2)П+Г, (СН,т)п,{ , при п 1-3; R, и Р.г - С,-С6-алкил; R% - Н, кил или , обладающих противовоспалительной активностью, что может быть использовано в медицине. Цель - создание новых более активных веществ указанного класса. Синтез ведут циклизацией соединения ф-лы О NHR3 N-VS oVVN (CHz) R, о В где Y - галоген, когда Z - Н, или Y - OR 4 при R4 - С,-Сз-алкил, когда Z - кислород, в присутствии основания с последующим выделением целевого продукта, или дегидрогенизацией Јпри А - (СНг)-, или ацилировани- ем, или алкилированием при R3 И. и А - -(СН4)П4., для получения соответствующих веществ. Новые соедине- ния малотоксичны и по активности пре- восхрдят известные. 12 табл. V) со со 00 ел
О NHR3
У ыЧснгъ-с--ч и N мг
кг
где И4,Кг
и R.J имеют указанные значения;
Y - галоген, когда Z - водород, или группа ОР4, где
, алкил с 3 атомами , углерода, когда Z - кислород,
действием основания с последующим выделением целевого продукта или дегидрогенизацией соединений (l), где А - группа СН4-СНг-, a Rf, R4 и R3 имеют указанные значения, или ацили- рованием, или алкилированием соединения (l), где водород; А - группа (CHt ,u1 , a R и R2 имеют указанные значения для получения соединения (l), где RJ - указанный ацил или алкил, и выделением целевого пррдукта.
Примеры 1-123 иллюстрируют синтез исходных продуктов.
П р и м е р. 1. 6-(-Ацетилтиосемикарбазидо)-1-бутил 3 прогтилпиримидин- 2,)-дион.
Ацетилизотиоцианат (А,В г) добавляют по каплям к перемешиваемому раствору 1-бутил-6-гидразино-З-про- пилпиримидин-2,(1Н,ЗН)-диона (8,0 г)
RПример 19. З-Ацетиламино-7 бутил-5 пропилпиразоло()пирими- дин-,6 (5Н,7Н)-лион.
6-(4-Ацетилтиосемикарба зидо)-1 - бутил-2-пропилпиримидин-2,4(1Н, ЗН)- дион (6,0 г) нагревают в диметилфор- мамиде (ЛМР) (60 мл) при 118-120°С в течение 60 ч. Реакционную смесь концентрируют досуха,.получают кристаллический продукт, который перекристалли- .гювывают из водного метанола, получают бесцветные кристаллы С, 61%) с т„пл. 15б-158°С„
Вычислено,%: С 54,71; Н 6,
N 22,79.
СцНдГ Оь
Найдено,%: С 54,63; Н 6,95 N 22,81,
Соединения, приведенные в синтезируют аналогично.
1739Й50
г, ВымисленоД: С 54,32; Н 7,22;
N 26,40, 89;C H Ns-Os
Найдено,%: с 54,66, Н 7,20; N 26,38,
Соединения, приведенные в табл.3, синтезируют аналогично. табл„2,
to
ТаблицаЗ
О NH,
Та,блица2
R. О NHAC
1-х и I
Пример ЗВ. З-Амино-7-бутил- . 5 (пропилпиразоло(3,-) пиримидин4,Ј-(5Н, 7Н)-дион.
3-Ацетиламино-7 бутил 5-пропил- пиразоло(3,- Опиримидин-,6(5И, 7Н) дион (10 г) кипятят с обратным холодильником в течение 5 ч в 80%-ном этаноле (100 мл), содержащем гидроокись натрия (2 г). Реакционную . смесь концентрируют, получают кристаллы. Кристаллы суспендируют в воде (100 мл), к которой добавляют 6н. соляную кислоту до слабокислой реакции, получают бесцветные кристаллы (8 г, 93%) с т„пл„ 209-211°С.
еденные в табл.3 чно.
ТаблицаЗ
R,.
О NH,
Й6
П р и м е р 57. 2-Амино-5-бутил- 7-пропил-4Н-пиримило(4,5-е)(1,3,4)- тиазин-6,8(5Н, 7Н)-дион.
К перемешиваемой суспензии М-хлор- сукцинимида (2 г) в хлороформе добавляют по каплям раствор 6-(А-аце- тилтиосемикарбазидо)-1-бутил-3-про- пилпиримидин-2,4(1Н, ЗН)-диона (3,8 г) в хлороформе (20 мл) при охлаждении льдом. Смесь перемешивают при комнатной температуре еще дополнительно 3 ч, после чего добавляют изопропиловый эфир (10 мл) и гексан (10 мл). Смесь охлаждают, образующиеся кристаллы собирают фильтрованием, затем промывают водой,
получают желтовато-коричневые КРИСГ таллы (3,1 г, 82%) с т.пл. 165-167Т
Вычислено,,: С 49,54; Н 6,24; N 20,63.
,N505S
НайденоД: С 49,49; Н 6,29; N 20,55.
Соединения, приведенные в табл. получают аналогично.
Таблица
п Г Гр Гз цётйламино- - 40 тилформамид (35 мл) и затем реакцибутил-б-пропилпиразолоО -сО пиримидин-,6(ЗН, 7Н)-дион.
Смесь 2-ацетиламино-5-бутил-7-про- пил- Н-пиримидо(,5-е) (1,3,)тиадиа- зин-6,8(5Н, 7Н)-диока- (2,8 г) в диок- сане (28 м) кипятят с обратным холодильником в течение 1 ч. Реакционную смесь концентрируют досуха и концентрат растворяют в метаноле, Образую- щуюся серу отфильтровывают, К фильтрату добавляют небольшое количество воды и смесь охлаждают, получают бесцветные кристаллы (2,3 г, 92%) с т.пл. 15б-158°С.
Вычислено,%: С 54,71; Н 6,89; N 22,79.
C44H2,
Найдено,%: С 54,70; Н 6,93; N 22,81,
онную смесь кипятят с обратным холо дильником в течение 3,5 м. Раствор концентрируют досуха с получением масла. Масло выливают в воду сох, ...-льдом4, получают кристаллы 6-хлор-1,3 диэтил-5-формилурацила (6 г) с т.п 88-89°С.
К раствору б-хлор-1,3-диэтил-5- формилурацила (50 г) в этаноле (1 л
-Q добавляют порциями гидрохлорид гидр оксиламина (50 г) и смесь перемешив ют при комнатной температуре в течение 30 мин.
К реакционной смеси добавляют воду (1 л) и образующийся осадок отфильтровывают, получают оксим 6- хлор-1, 3-ДИЭтил-2,-диоксо-1,2,3, тетрагидропиримидин-5-карбальдегида (32,5 г) с т.пл. 115-11б°С.
55
Аналогично получают соединения указанные в табл.5.
Таблица
п 0 МНАс
А
R2
тилформамид (35 мл) и затем реакционную смесь кипятят с обратным холодильником в течение 3,5 м. Раствор концентрируют досуха с получением масла. Масло выливают в воду сох, ..льдом4, получают кристаллы 6-хлор-1,3 диэтил-5-формилурацила (6 г) с т.пл. 88-89°С.
К раствору б-хлор-1,3-диэтил-5- формилурацила (50 г) в этаноле (1 л)
добавляют порциями гидрохлорид гидр- оксиламина (50 г) и смесь перемешива- - ют при комнатной температуре в течение 30 мин.
К реакционной смеси добавляют воду (1 л) и образующийся осадок отфильтровывают, получают оксим 6- хлор-1, 3-ДИЭтил-2,-диоксо-1,2,3,- тетрагидропиримидин-5-карбальдегида (32,5 г) с т.пл. 115-11б°С.
91
К перемешиваемому раствору окси- ма (16 г) в тетрагидрофуране (320мл) добавляют по каплям оксихлорид фосфора (ЗГ г). Реакционную смесь затем концентрируют при пониженном давлении. К концентрату добавляют диизо- пропиловый эфир (200 мл), получают 6-хлор 5 циано-1,З Диэтилпиримидин - 2,4(1Н, ЗН)-дион в виде желтых призм (12,4 г) с т.пл. 92-94°С. Вычислено,%: С 47,48; Н 18,46,
С,НюС1ЫэОг
Найдено,: С 47,29; Н 4,31; 18,35,
Соединения указанные в табл.6, получают аналогично.
4,43;
N
N
Таблицаб
Ro. О
2х
о
)Н
ЛАС1
N L1
Ri
25
30
90
пил Бутил
пил
Бутил
Промежуточные соединения, за исключением указанных (6-хлор-5-формил- соединений, 6-хлор-5-циано-соедине- ний), кристаллизуются с трудом и могут быть использованы в последующих реакциях без дополнительной очистки.
П р и м е р 91
пиразоло(3, )пиримидин-4,5 (5Н, 7Н) дион„ j
Смесь 6-хлор-5 Циано-1,3-диэтил-. пиримидин-2,4(1Н,ЗН)диона (5 г) и гидразина моногидрата (2,2 мл) в метаноле (220 мл) перемешивают в течение 10 мин при комнатной температуре, Реакционную смесь концентрируют доПример 95о З-Амино-7-бутил- 2-(2-хлорэтил)-5 пропил-2Н-пиразоло (3,4-d)пиримидин-4,6(5Н, 7Н)-дион0
Смесь 3-амино-7-бутил-5 пропил- пиразоло(3,4-а)пиримидин-4,6(5Н,7Н)- диона (8 г), 1-бром-2-хлорэтана (3,7 мл) и карбоната калия (6,2 г) в диметилформамиде (100 мл) перемешивают при 50-60°С в течение 12 ч. Реакционную смесь концентрируют досуха и концентрат экстрагируют смесью хлороформ/вода. Слой хлороформа промывают водой, сушат и концентрируют с получением коричневого сиропа, который очищают флеш-хромато- графией (силикагель 100 г, хлороформ) Получаемый сиропообразный продукт кристаллизуют из изопропилового эфи- З-Амино-5,7-диэтил- ., ра, получают бесцветные иглы (21,5 г,
ыылыы-ii Ь(Ы 7HU 66%) С Т.ПЛо 118-121°С„
94-96
35
40
50
Вычислено,%; С 51,30; Н 6,76; N 21,36,
CUH22N502C1
Найдено,%: С 51,44; Н 6,89; N 21,13.
Аналогично получают соединения, указанные в табл„8/
0
10
суха при пониженном давлении, концентрат кристаллизуют из водного ме- танола, получают бесцветные иглы (4,3 г) с т.пл. 246-248°С.
Соединения, указанные в табл„7, получают аналогично
Таблица 7
10
О NH2
ts
20
25
30
.,
.,
35
.,
40
Вычислено,%; С 51,30; Н 6,76; N 21,36,
CUH22N502C1
Найдено,%: С 51,44; Н 6,89; N 21,13.
Аналогично получают соединения, указанные в табл„8/
NHR3
Пример 121, 1-Путил-6-(4- этоксикарбонилметилтиосемикарбази- до)З-пропилпиримидин-2, (1Н,ЗН)- дион.
Зтоксикарбонилметилизотиоцианат (13 г) добавляют, по каплям к пере мешиваемому раствору 1-бутил-6-гид- разино-3-пропилпиримидин-2,М1Н,ЗИ)- диона (11 г) в диоксане (100 мл). Смесь перемешивают при комнатной, темТаблица8
пературе в течение 3 ч и получающиеся кристаллы отфильтровывают, промы- { вают небольшим количеством диокса- на, получают бесцветные кристаллы (18,8 г, 96) с т.пл. т-11Ј°С.
П р и м е р 122. 7-Бутил-З-этокси карбонилметиламино-5-пропилпиразо- ло (3, -d) пиримидин-, 6 (5Н, 7Н) -дион.
К перемешиваемой суспензии N-хлор-- сукцинимида (6,5 г) в хлороформе
(80 мл) добавляют порциями 1-бутил- 6-(4-этоксикарбонилметилтиосемикар- базидо)-3 пропилпиримидин-2,4(1Н,ЗН) дион (18 г) при охлаждении льдом. Смесь перемешивают 1 ч, после чего добавляют гексан (200 мл), получают твердый продукт. Этот продукт отфильтровывают и отбрасывают Фильтрат концентрируют досуха с получением коричневого сиропа (23 г), который суспендируют в диоксане (150 мл)„ Суспензию нагревают при 100°С в течение 1 ч. Образующийся : твердый продукт отфильтровывают и отбрасывают, фильтрат концентрируют, Концентрат кристаллизуют из смеси этилацетат изопропиловый эфир, получают бесцветные кристаллы (9,8 г, 67%) с т,пл„ 147-148°С.
Пример 123о 7-Бутил-З-карбок симетиламино-5-пропилпиразоло(3,) пиримидин-4,6(5Н, 7Н)-дион„
К раствору 7-бутил-З-этоксикарбо- нилметиламино-5 пропилпиразоло(3,4- с1)пиримидин-Ц,6(5Н, 7И)-диона (2 г) в этаноле (20 мл) добавляют по каплям 2 н„ водный раствор гидроокиси натрия (20 мл), смесь кипятят с обратным холодильником в течение 1 ч и затем концентрируют до половины объема, который доводят до слабокислой реакции добавлением соляной кислоты, получают бесцветные кристаллы (1,74 г, 95%) с т,пл, 233- 234°С (разложение)„
Примеры 124-180 иллюстрируют синтез целевых соединений
Пример 124, 6-Бутил-1-метил- 8-пропил-2,3-Дигидро-1Н-имидазо(2, 1 :5,1 )паразоло(3,4-д)пиримидин-7,9 (6Н,8н)-дион„
К раствору 7 бутил-2-(2-хлорэтил) 3-метиламино-5-пропил-2И-пиразоло (3,4-d)пиримидин-k,6(5Н, 7Н1-диона (1,28 г) в диметилформамиде (20 мл) добавляют порциями гидрид натрия (60% масло, 0,3%) при перемешивании при охлаждении льдом. Реакционную смесь перемешивают при комнатной температуре дополнительно в течение 2 ч, затем реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом; смесь перемешивают, при этом выпадают кристаллы. Кристаллы отделяют фильтрованием и пере- кристаллизовывают из смеси изопропи- ловый эфир/гексан, получают бесцветные кристаллы (0,66 г, 58%) с т,пл, 91-93°С.
Вычислено,%: С 59,00; Н 7,59; N 22,93.
C,sfHnN5Oz
Найдено,%: С 58,88; Н 7,63;
N 22,96,
П р и м е р 125. 6-Бутил-8-про- пил-2,3-Дигидро-1Н-имидазо(2 ,1;; 5,1 )пиразоло(3,4-с1)пиримидин-7,9
0 (6Н, 8Н)-дион.
К перемешиваемому раствору но-7 бутил-2-(2-хлорэтил)-5-пропил- 2И-лиразоло(3,4-d)пиримидин-4,6(5Н, 7И)-диона (3,3 г) в диметилформами5 Де (35 мл) добавляют порциями гидрид натрия (60% масло 1,2 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 2 ч, затем реакционную
0 смесь концентрируют досуха. Концентрат выливают в воду со льдом и смесь перемешивают, при этом выпадают кристаллы. Кристаллы отфильтровывают перекристаллизовывают из водного
5 метанола, получают бесцветные кристаллы (2,2 г, 76%) с ТоПЛ. 170-172 С,
Вычислено,: С 57,71; Н 7,26; N 24,04,
C,4H2,
Найдено,%: С 57,78; Н 7,29; N 24,01,
Пример 126. 6,8-Дибутил-2,5 дигидро-1Н-имидаэо (27,1 : 5,1)пира- золо(3,4-d)пиримидин-7,9(6Н, 8Н)-диен,
5 К перемешиваемому раствору но-2-(2-хлорметил)-5,7-Дибутил-2Н- пиразоло(3,4-d)пиримидин-4,6(5Н, 7Н)- диона (1,2 г) в диметилформамиде (20 мг.) добавляют порциями гидрид
0 натрия (60% масло, 0,3 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 2 ч, после чего концентрируют досуха. Концентрат выливают
5 в воду со льдом и смесь перемешивают, при этом выпадают кристаллы. Кристаллы отфильтровывают и пере- кристаллизовывают из смеси метанол/ /изопропиловый эфир, получают бес0 цветные кристаллы (0,65 г, 50%) с т.пл, Й1-142°С.
Вычислено,%: С 59,00; Н 7,59; N 22,93,
с« и23%«а 5 Найдено,%: С 68,69; Н 7,62;
N 22,80 l
П р и м е р 127. 6-Вутил-1,8-ди- метил-2.3-ДИгидро-1Н-имидазо (2 ,1 :
5,1 )пиразоло(3 ,-а)пиримидин-7,9(6Н, РН)-дион„
К перемешиваемому раствору тмл-5-метил-3-метиламино-2И-пиразоло (3,-d) пиримидин-, 6 (5Н, 7Н)-диона (1,76 г) в диметилформамиде (30 мл) добавляют порциями гидрид натрия (60% масло, 0,67 г) при охлаждении льдом„ Смесь дополнительно перемешивают в течение 2 ч при комнатной температуре, затем реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы. Кристаллы отфильтровывают и пере- кристаллизовывают из смеси ацетон/ /изопропиловый эфир/гексан, получают бесцветные кристаллы (0,9 г 58%) с т.пл. 166-168°C.
Вычислено,%: С 56,30; Н 6,91; N 25,25о
C19H,,NS04
Найдено,: С 56,47; Н 6,89;
N 25,30,
П р и м е р 128, 6-Иэобутил-8- пропил-2,3-дигидро-1Н-имидазо(21, 5,1 )пиразоло(3,-d)пиримидин-7,9(6Н, ВН)-дион„
К перемешиваемому раствору 3 амино-2-(2-хлорэтил)-7-изобутил-5 пропил-2Н-пиразоло(3,)пиримидин- 4,6(5Н, 7Н)-диона (2,0 г) в диметилформамиде (АО мл) добавляют порциями гидрид натрия (60% масло, 0,9 г) при охлаждении льдом. Смесь перемешивают в течение 2 ч при комнатной температуре, затем реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы. Кристаллы отфильтровывают, перекрис- таллизовывают из смеси этанол/гексан получают бесцветные кристаллы (0,91 51%) с т.Ил. 215-21б°С.
Вычислено,%: С 57,71; Н 7,26, N 24,04,
C H NgO-z
Найдено,%: С 57,53; Н 7,17; N 24,16.
Прим ер 129. 6-Пентил-8-про- пил-2,3-Дигидро-1Н-имидазо (2, 5,1 пиразоло(3, -d)пиримидин-7,9(6Н, 8Н) дион.
К перемешиваемому раствору 3-эми- но-2-(2-хлорэтил)-7 пентил-5-пропйл- 2Н-пира золо (3, b-d) пиримидин- ,6(5Н, 7Н)-диона (2,3 г) в диметилформамиде (30 мл) добавляют порциями гидрид
натрия (60% масло, 0,$Ц г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно
в течение 2 ч, затем реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы, которые перекристаллизовывают
из смеси этанол/гексан, получают бесцветные кристаллы (2,23 г, 60%) с т.пл. 1 5-И6°С.
Вычислено,%: С 59,00; Н 7.59J N 22,43
С,5Н25«50
Найдено,%: С 59,02; Н 7,62; N 22,94,
П р и м е р 130, -6,8-Лиэтил-2,3- дигидро-Т-имидазо 1, : 5, пиразоло()пиримидин-7,9(6Н, 5Н)-дион,
К перемешиваемому раствору 3-ами- но-2-(2-хлорэтил)-5,7-Диэтил-2Н-пира- золо()пиримидин- ,6(5Н, 7Н)-диона (1,0 г) в диметилформамиде (20 мл)
добавляют порциями гидрид натрия (60% масла, 0,28 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 2 ч, затем реакционную смесь
концентрируют досуха. Концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы. Кристаллы отфильтровывают, перекристаллизовывают из смеси метилен- хлорид/гексан, получают бесцветные
кристаллы (0,8 г, 55%) с т.пл, 201- 202°С,
Вычислено,%: С 53,00; Н 6,07; N 28,10.
НайденоД: С 53,02; Н 6,04; N 28,32.
Пример 131. 6,8-Диметил-2-, 3-дигидро-1Н-имидазо(21, 1Т: 5,1)- пиразоло(3,-d)пиримидин-7,9(6Й, 8Н)
дион,
К перемешиваемому раствору 3-ами- но-2-(2-хлорэтил)-5,7-диметил-2Н-пи- разоло(3,-d)пиримидин-4,6(5Н, 7Н)- Q диона (1,25 г) в диметилформамиде (50 мл) добавляют порциями гидрид натрия (60% масла, 0,3 г) при охлаждении льдом. Смесь .перемешивают при комнатной температуре дополнительно 2ч, затем реакционную смесь концентрируют досуха. Концентрат вылива-. ют в воду со льдом при перемешивании, при этом осаждаются кристаллы. Кристаллы отфильтровывают, перекристалли /1739850
зовывают из смеси метиленхлорид/мета н;ол, полумают бесцветные кристаллы (0,56 г, $2%) с т„пл. 2б7-2б8°С.
Вычислено,: С 48,87; Н 5,01; N 31,66,
CwRt4NeOa.
Найдено,: С 48,84; Н 5,01; N 31,51
П р и м е р 132, 6-Метил-8-пропил 2,3 ДИгидро-1Н-имидазо(2, 1 : 5,0 пиразоле(3f4-d)пиримидин-7,9(6Н, 8Н) дион.
К перемешиваемому раствору 3-ами- но-2-(2-хлорэтил)-7-метил-5 пропил- 2Н-пиразоло(3,4-с1) пиримидин -4, 6 (5Н, 7Н)-диона (2,5 г) в диметилформами- де (30 мл) добавляют порциями гидрид натрия (60 масла, 0,7 г) при охлаждении льдом Смесь перемешивают при комнатной температуре дополнительно 2 м. Реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом при перемешивании при этом выпадают кристаллы. Кристаллы отфильтровывают, перекристаллизо- вывают из водного спирта, получают бесцветные кристаллы (1,3 г, 60%) с т.пл. 246-2 8°С.
Вычислено,: С 53,00; Н 6,07; N 28,10.
С Ц H gNg-Oj.
Найдено,: С 52,98; Н 6,02; N 28,19.
П р и м е р 133. 6-Этил-Я-пропил- 2,3-Дигидро-1Н-имидазо(2, Р: 5,0- пиразоло(3,1)пиримидин-7,9(6Н, 8Н) дион.
К перемешиваемому раствору 3-ами- но-2-(2-хлорэтил)7-этил-5-пропил- . 2Н-пиразоло(3,сО пиримидин- А, 6 (5Н, 7Н)-диона (2,0 г) в диметилформами- де (25 мл) добавляют порциями гидрид натрия (60% масло, 0,53 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 2 ч. Реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы. Кристаллы отфильтровывают, перекристаллизовывают из смеси ме«- тиленхлорид/гексан, получают бесцветные кристаллы (0,98 г, 56) с т.пл. 212-214°С.
Вычислено,: С 54,74; Н 6,51; N 26,60.
С 2И„%02
Найдено,: С 54,58; Н 6,51; N 26,69.
18
0
5
0
5
П р и м е р 134. 8-Бутил-6-метил- 2,3-Дигидро-1Н-имидззо(2, 1; : 5,0 пиразоло(3,-d)пиримидин-7,9(6Н, 8н)- дион.
К перемешиваемому раствору 3-амит но-5 бутил-2-(2-хлорэтил)7 метил- 2Н-пиразоло (3, -d) пиримидин- ,6 (5Н, 7Н)-диона (2,0 г) в диметилформами- де (25 мл) добавляют порциями гидрид натрия ( масла, 0,4 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 2 ч. Реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы которые отфильтровывают и перекристаллизовывают из смеси метиленхлорид/ /гексан, получают бесцветные кристаллы (1,05 г, 51) с т.пл. 217-218°С.
Вычислено,: С 54,74; Н 6,51; N 26,60.
СиН 7Н5Ог,
Найдено,: С 54,55; Н 6,51; N 26,38. V
П ри ме р135. 8-Бутил-6-этил-2,3 дигидро-1Н-имидазо(2 , 5,1)пира- золо(3,)пиримидин-7,9(6Н, 8Н)-дион.
К перемешиваемому раствору 3-ами- но-5-бутил-2-(2-хлорэтил)-7-этил- 2Н-пиразоло(3,-д)пиримидин-4,6(5Н, 7Н)-диона (2,0 г) в диметилформами- де (25 мл) добавляют порциями гид- 5 РИД натрия (60 масла, 0,4 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 2 ч. Реакционную смесь концентрируют досуха. Концентрат вы- 0 ливают в воду со льдом при перемешивании, при этом выпадают кристаллы, которые отфильтровывают, перекристаллизовывают из смеси метиленхлорид/ /гексан, получают бесцветные кристаллы (1,01 г, 57) с т.пл. 162- 163°С.
Вычислено,: С 56,30; Н 6,91; N 25,25,
Ci4H«N5Oz
Найдено,: С 56,35; Н 6,85; N 25,19,
Пример 136. 6,8-Дипропил-2,3- дигидро-1Н-имидазо(2,17: )пира- золо(3,4-d)пиримидин-7,9(6Н, 8Н)-ди- 5 он.
К перемешиваемому раствору (2- хлорэтил)-5,7-дипропил-2Н-пиразоло (3,4)пиримидин-4,6(5Н, 7Н)-диона (2:5 г) в диметилформамиде (25 мл)
0
5
0
добавляют порциями гидрид натрия (60% масла, 0,5 г) в условиях охлаждения льдом. Смесь перемешивают еще в течение 2 ч при комнатной температуре. Реакционную смесь концентрируют досуха. Концентрат вносят в воду со льдом и смесь перемешивают, при этом осаждаются кристаллы, которые офильтровывают, после чего перекрис- таллизовывают из смеси метиленхло- рид/гексан, получают бесцветные криталлы (1,08 г, 61%) с т„пл. 207-209°С
Вычислено,%: С 56,30; Н 6,91; N 25,25.
14 14 .
НайденоД: С 56,32; Н 6,23; N 25,27с
Пример 137. 6,8-Либутил-1- метил-2,3 Дигидро-1Н-имидазо(2, 1 :
5,1)пира золо{3,d)пиримидин-7,9(6Н, 8М)-Лион.
К перемешиваемому раствору 5,7- Iдибутил-8-(2-хлорэтил)-3-метиламино- 2Н-пира золо (3,-d) пиримидин-, 6 (5Н, 7Н)-диона ( г) в диметилформами- де (60 мл) добавляют порциями гидрид натрия (60% масла, 1,3 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнител но в течение 2 ч„ Реакционную смесь концентрируют досуха, концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы которые отфильтровывают, перекрис- таллизовывают из смеси изопропиловый эфир/гексан, получают бесцветные криталлы (3,2 г, 61%) с т.пл. 119-121°С
ВычисленоД: С 60,17; Н 7,89; N 21,93.
C Z5N5°2НайденоД: С 60,12; Н 7,89; N 21,88.
Пример 138. 8-Бутил-6-про- пил-2,3 Дигидро-1Н-имидазо(2,l : ) пиразоло()пиримидин-7,9(6Н, 8Н)- дион.
К перемешиваемому раствору но-5 бутил-2-(2-хлорэтил)-7-пропил- 2Н-пиразоло(3, сОпиримидин-1,6(5Н 7Н)-диона (2,0 г) в диметилформамиде (25 мл) добавляют порциями гидрид натрия (60% масла, Qtk г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 2 ч. Реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы,
15
-jn
39850
отфильтровывают, перекристаллизо- вывают из смеси метйленхлорид/гек- сан, получают бесцветные кристаллы , (1,00 г, 56%) с т.пл„ 1 8-150°С.
ВычисленоД: С 57,71; Н 7,26; N 24,05.
CHH2,N502
НайденоД: С 57,63; Н 7,25; 10 N 24,020
Пример 139 8-Бутил-6-пентил- 2,3-Дигидро-1Н-имидазо(2,1 : 5,0 пиразоло Л-З) пиримидин-7,8 (6Н, 8Н)- дион„
К перемешиваемому раствору но-5-бутил-2-(2-хлорэтил)-7-пентил- 2Н-пиразоло(3,-сОпиримидин-4,6(5Н, 7Н)-диона (2,0 г) в диметилформамиде (25 мл) добавляют порциями гидрид 20 натрия (60% масла, 0,5 г) при охлаждении льдом о Смесь перемешивают при комнатной температуре дополнительно (в течение 2 ч„ Реакционную смесь концентрируют досуха Концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы, которые отфильтровывают и перекристаллизовы- вают из смеси метиленхлорид/гексан, получают бесцветные кристаллы (810мг, 5%) с т.пл, 130-132°С.
ВычисленоД: С 60,17; Н 7,89; N 21,93.
CiAtW O,
25
35
16n-Z.S11(srwf
НайденоД: С 60,14; Н 7,90; N 21,93.
Пример . 6-Изопентил-З- пропил-2,3 Дигидро-1Н-имидаэо(2, 5,Опиразоло(3,)пиримидин-7,9 (6Н, 8Н)-дион.
К перемешиваемому раствору 3 ами40 но-2-(хлорэтил)-7-изопентил-5-пропил 2Н-пиразоло ()пиримидин- ,6 (5Н, Н)-диона (1,3 г) в диметилформамиде (15 мл) добавляют порциями гидрид натрия (60% масла, 0,23 г) при охлаж 5 дении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение ч. Реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом при перемеши50 вании, образующиеся кристаллы отфильтровывают , перекристаллизовывают из смеси этилацетат/гексан, получают бесцветные кристаллы (0,87 г, 75%) с т.пл, 185-18 °С„
ВычисленоД: С 59,00; Н 7,59; N 22,93.
C 5H 3N50221
Найдено,2: С 58,75; Н 7,55; N 22,70.
Пример . 6-Аллил-8-пропил 2,3-Дигидро-1Н-имидазо(2,1;; 5,1)- пира3ono(3,k-d)пиримидин-7,9(6Н, 8Н) дион.
К перемешиваемому раствору лил-З-амино-2-(2-хлорэтил)-5-пропил- 2Н-пиразоло(3,4-d)пиримидин-4,6(5Н, 7Н)-диона (0,85 г) в диметилформа- миде (10 мл) добавляют порциями гидрид натрия (60% масла, 0,17 г) при охлаждении Льдом Смесь перемешивают при комнатной температуре дополнительно в течение 3 ч. Реакционную смесь концентрируют досуха. Концентрат добавляют в воду со льдом при перемешивании, образующиеся кристаллы отфильтровывают, перекристалли- зовывают из смеси метиленхлорид/гек- сан, получают бесцветные кристаллы (0,35 г, 7%) с т.пл. m-175°Ce
Вычислено,%: С 56,72; Н 6,22; N 25,44,
С13Н17%02.
Найдено,%: С 56,68; Н 6,23; N 25,40.
Пример 142. 6-Гептил-8-про- пил-2,3-Дигидро-1Н-имидазо(2 1 : 5,0 пиразоло(3,4-д)пиримидин-7,9(бН, 8Н) дион.
К перемешиваемому раствору 3-ами- но-2-(2-хлорэтил)-7 гептил 5-пропил- 2Н-пиразоло(3,4-б)пиримидин-4,6 (5Н, 7Н)-диона (1,93 г) в диметилформами- де (20 мл) добавляют порциями гидрид натрия (60% масла, 0-,32 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 5 ч. Реакционную смесь концентрируют досуха Концентрат выливают в воду со льдом при перемешивании, образующиеся кристаллы отфильтровывают, перекристиллазовы- вают из смеси этилацетат/гексан, получают бесцветные кристаллы (1,1 Ц г 66%) с т.пл. 133-134°С.
Вычислено,%: С 61,24; Н 8,16; N 21,00,
,
Найдено,%: С 61,32; Н 8,24;
N 21,05.
П р и м е р . 6-Гексил-8-про- пил-2,3-Дигидро-1Н-имидазо(21, 17: 5,0 Пиразоло(3,-d)пиримидин-7,9(6Н, 8Н) -дион.
К перемешиваемому раствору но-2-(2-хлорэтил)-7 Гексил-5-пропил- 2Н-пиразоло(3,й)пиримидин-4,6(5Н,
739850 2
7Н)-диона (1,85 г) в диметилформами- де (20 мл) добавляют порциями гидрид , натрия (60% масла, 0,32 г) при ох- лаждении льдом. Смесь перемешивают при комнатной температуре в течение
5ч. Реакционную смесь концентрируют досуха и остаток вносят в воду
со льдом при перемешивании, при этом
j0 осаждаются кристаллы. Кристаллы
перекристаллизовывают из смеси этилацетат/гексан, получают бесцветные кристаллы (0,99 г, 60%) с т.пл. 129-130°С.
15 Вычислено,%: С 60,17; С 7,89; N 21,93.
C,.
Найдено,: С 60,19; Н 7,93; N 21,94.
20 Примерив. 6-Этил-8-пентил- 2,3-дигидро-1Н-имидазо(2 , 1 : 5,0 пиразоло(3,)пиримидин-7,9(6Н, 8Н)- дион.
К перемешиваемому раствору 3 ами25 но-2-(2-хлорэтил)-7тэтил-5-пентил-2Н- пиразоло(3,b-d)пиримидин-4,6(5Н,7Н)- диона (3,0 г) в диметилформамиде) (АО мл) добавляют порциями гидрид натрия (60% масла, 0,56 г) при охлаждении льдом Смесь перемешивают при комнатной температуре в течение
6ч. Реакционную смесь концентрируют досуха и остаток вносят в воду со льдом при перемешивании, при этом выпадают кристаллы. Кристаллы отфильт35 ровывают и перекристаллизовывают из смеси метиленхлорид/изопропиловый эфир, получают бесцветные кристаллы (1,8 г, 68%) с т.пл. 153-154°П. Вычислено,%: С 57,71; Н 7,26;
40 N 25,04,
СпН21%02о
Найдено,%: С 57,83; Н 7,34; N 24,05,
Пример 8-Этил-6-пропил45 2,3-Дигидро-1Н-имидазо(2 , 1 : разоло(3,-й)пиримидин-7,9(6Н, 8Н)- дион.
К перемешиваемому раствору но-2-(2-хлорэтил)-5-ЭТИЛ-7-ПРОПИЛ50 2Н-пиразоло(3,)пиримидин-А,6(5Н, 7Н)-диона (2, г) в диметилформамиде (40 мл) добавляют порциями гидрид натрия (60% масла, 0,49 г) при охлаждении льдом. Смесь перемешива55 ют при комнатной температуре допол- , нительной в течение 5 ч. Реакционную смесь концентрируют досуха и остаток вносят в воду со льдом при перемешивании, при этом выпадают крис30
23
таллы Кристаллы отфильтровывают и перекристаллизовывают при смеси ме- тиленхлорид/гексан, получают бесцветные кристаллы 183-18VC.
(1,5 г, 89) с т.пл. : С 54,74; Н 6,51;
N
Вычислено,% 26,60.
СмгН„Н5Ог.
Найдено,: С 54,57; Н 6,49; 26,42..
Приме
Г
Йб,, 6-Бутил-8-этил-2, 2,3-Дигидро-1М-имидазо(21, 5,1) пиразоло(3,-сОпиримидин-7,9(6Н, 8Н)- дион.
К перемешиваемому раствору но-7 бутил-2-(2-хлорэтил)-5-ЭТИЛ-2Н- пиразоло(3, -) пиримидин-, 6 (5Н, 7Н)- диона (2,4 г) в диметилформамиде добавляют порциями гидрид натрия (60 масла, 0, г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение k ч. Реакционную смесь концентрируют досуха и остаток вносят в воду со льдом при перемешивании, при этом выпадают кристаллы.
Кристаллы отфильтровывают, после чего перекристаллизовывают из смеси метанол/этилацетат/изопропиловый эфир, получают бесцветные кристаллы (1,5 г, 68%) с т.пл. 168-1 0°С.
Вычислено,: С 56,30; Н 6,91; N 25,25
rM4HV3N5T°iНайдено,: С 56,34; Н 6,96;
N 23,29
1 Пример . 8-Этил-6-пентил- 2,3-дигидро-1Н-имидазо(27,Р: 5,1) пира золо(3, -) пиримидин-7,9 (6Н, 8Н)- ,ион.
17
К перемешиваемому раствору но-2-(2-хлорэтил)-5 этил-7-пентил- 2Н-пиразоло(3,-d)пиоимидин-А,6(5Н, 7Н)-диона (1,6 г) в диметилформами- де (20 мл) добавляют порциями гидрид натрия 60 масла, 0,3 г) в условиях охлаждения льдом. Смесь перемешивают еще в течение А ч при комнатной температуре, после чего концентрируют досуха Затем концентрат добавляют в воду со льдом при перемешивании, при этом осаждаются кристаллы. Кристаллы отфильтровывают, после чего их перекристаллизовывают из смеси метиленхлорид/ гексан, получают бесцветные кристаллы, (1,0 г, 72) с т.пл. 150-151°С.
«О
398502k
Вычислено,: С 57,71; Н 7,26; N 24,04.
C HnNyOj,.
Найдено,: С 57,72; Н 7,32; N 23,97.„
П р и м е р 1А8. 6-Бутил-8-пентил- 2,3 Дигидро-1Н-имидазо(2,1т: 5,1)пи- разолоО.-сО)пиримидин-7,9(6Н, 8Н) - дион„
К перемешиваемому раствору но- бутил-2-(2-хлорэтил)-5-пентил- 2Н-пира золоО -с) пиримидин-, 6 (6Н, 7Н)-диона (3,5 г) в диметилформамиде (80 мл) добавляют порциями гидрид натрия (60 масла, 0,55 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 5 ч. Реакционную смесь I концентрируют досуха, затем выливают ее в воду со льдом при перемешивании, при этом выпадают кристаллы. Кристаллы отфильтровывают, перекрис--- таллизовывают из смеси метиленхлорид/ 25 /гексан, получают бесцветные кристаллы (2,30 г, 73) с т.пл,, 12 - 125° С.
Вычислено,: С 60,17; Н 7,89; N 21,93
15
20
С16Н25 5-°2.
Найдено,: С 60,18; Н 7,95; N 21,92s
П р и м е р . 8-Пентил-6-пропил- 2,3-дигилро-1Н-имидазо(2,15: 5,1)пи- рззоло(3,-с)пиримидин 7,9(6Н, 8н)- дион.
К перемешиваемому раствору 3-ами- но-2-(2-хлорэтил)-5-пентил-7-пропил- 2Н-пиразоло(3,)пиримидин- 1,6(5Н, 7Н)-диона (3,5 г) в диметилформамиде (30 мл) добавляют порциями гидрид натрия (60 масла, 0,55 г) при охлаждении льдом.
Смесь перемешивают дополнительно при комнатной температуре в течение 5 ч. Реакционную смесь затем концентрируют досуха и остаток выливают в воду со льдом при перемешивании,
при этом выпадают кристаллы. Кристаллы отфильтровывают и перекристаллизовывают из смеси метиленхлорид/гек-- сан, получают бесцветные кристаллы (2,k г, 77) с т.пл. 15б-157°С.
Вычислено,: С 59,00; Н 7,59; N 22,93.
CIS-HZ V ZНайдено,,: С 58,9; Н 7,61;
N 22,60.
Пример 150. 6-Аллил-Р-пентил- 2,3 Дигидро-1Н-имидазо(2 , 1 : 5,0- пиразолоО -сО пиримидин-7,9 (6Н, 8Н) дион.
К перемешиваемому раствору лил-З-амино-2-(2-хлорэтил)-5-пентил- 2Н-пиразоло (3, -с1)пиримидин-4,6 (5Н, 7Н)-диона (,1 г) в диметилформами- де (80 мл) добавляют порциями гидрид натрия (60% масла, 0,6 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 5 ч. Реакционную смесь концентрируют досуха и остаток выливают в воду со льдом при перемешивании при этом выпадают кристаллы. Кристаллы отфильтровывают и перекристал- лизовывают из смеси этилацетат/гек- получают бесцветные кристаллы с т.пл. . fe: С 54,39; Н 6,98;
сан,
(2,2 г, 66%)
Вычислено, N 23,09.
НайденоД: С 59,44; Н 7,00;
N 23,18.
П р и м е р 151. 6-Изобутил-Р.- пентил-2,3-Дигидро-1Н-имидазо(21,I1: 5,1) пира золо(3, -) пиримидин-7,8 (6Н, ГН)-дион.
К перемешиваемому раствору 3 амино-2-(2-хлорэтил)7-изобутил-5 пентил-2Н-пиразоле(3, пиримидин- ,6(5Н, 7Н)-диона (3,6 г) в диметил- формамиде (80 мл) добавляют порциями гидрид натрия (60% масла, 0,55 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 5 ч. Реакционную смесь концентрируют досуха и остаток выливают в воду со льдом при перемешивании, при этом выпадают криталлы. Кристаллы отфильтровывают, перекристаллизовывают из смеси этил- ацетат/гексан получают бесцветные кристаллы (2,36 г, 73%) с т.пл. 171- 172°С.
Вычислено,%: С 60,17; Н 7,89; N 21 ,
С бН2 5%°2
Найдено,%: С 60,18; Н 7,95;
N 22,00.
Пример 152. 6,8-Диаллил-2,3- дигидро-1Н-имидазо(2 , 1 : 5,1)пиразо- ло(3,-d)пиримидин-7,9(6Н, 8Н)-дион.
К перемешиваемому раствору 5,7 диаллил 3-амино-2-(2-хлорэтил)-2Н- пиразоло(3,-d)пиримидин-,6(5Н, 7Н)- диона (6,17 г) в диметилформамиде
(80 мл) добавляют порциями гидрид натрия (60% масла, 1,2 г) при охлаждении льдом. Смесь перемешивают при
комнатной температуре дополнительно в течение 5 ч. Реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы.
Кристаллы отфильтровывают и перекристаллизовывают из смеси метиленхло- рид/гексан, получают бесцветные кристаллы (3,6 г, 66%) с т.пл. 181-183°С. Вычислено,%: С 57,13; Н 5,53;
5 N 25,63,
collisrw
Найдено,%: С 56,72; Н 5,56; N 25,18,
П р и м е р 153. 6,8-Диизобутил- 1-метил-2,3-Дигидро-1Н-имидазо(2, 1f : 5,1 )пиразоло(3,-с)пиримидин- 7,9(6Н, 8Н)-дион.
К перемешиваемому раствору 2-(2- хлорэтил)-5,7 дииэобутил-3 метилами- 5 но-2Н-пиразоло(3,)пиримилин-,6- (5Н, 7Н)-диона (0,7 г) в диметилфор- мамиде (10 мл) добавляют порциями гидрид натрия (60% масла, 6,2 г) при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 2 ч. Реакционную смесь концентрируют досуха. Концентрат выливают в воду со льдом при перемешивании, при этом выпадают кристаллы, которые затем перекристаллизовывают из изопропилового эфира, получают бесцветные кристаллы (О,А г, ) с т.пл. 109-111°С,
Вычислено,%: С 60,17; Н 7,89;
0
5
0
N 21,93.
C,ЈH,eN О,
l6n2S:4V 2.
Найдено,%: С 60,14; Н 7,90; N 21,95.
Пример 15. 6-Бутил-1-бути- рил-6-пропил-2,3-Дигидро-1Н-имидазо- ( 5,1 )пиразоло(3,)пиримидин- 7,9(6Н, 8Н)-дион.
Раствор 6-бутил-8-пропил-2, гидро-1Н-имидазо(2 ,1 : 5,1)пиразоло (3,-сОпиримидин-7,9(6Н, 8Н)-диона (1,2 г) и ангидрида масляной кислоты (1,3 мл) в пиридине (15 мл) перемешивают при 50-6(1°С в течение 15 ч. Реакционную смесь концентрируют досуха, получают сироп, который очищают флеш-хроматографией (силикагель8 хлоч роАорм), получают светло-желтый сироп, который кристаллизуют из смеси гексан/изопропиловый эфир, получают
27
сцветные кристаллы (0,6 г, т.пл. 60-63°С.
ВычисленоД: С 59,82; Н 19,38.
1739850
W 7,53;
ры лу та цв т
C«61I,,N,0,
N
i7 sv 2- НайаеноД: С 59,57; Н 7,54;
19,35.
Пример 155 о 6-Изобутил-1-про- пионил-8-пропил-2,3-Дигидро-1Н-ими- лазо(27,1 : 5,1)пиразоло(3,-й)пири- мидин-7,9(6Н, Р Н)-дион.
Раствор 6-изобутил-8-пропил-2,3- диrидpo-1 -имидaзo(27,1J : 5,1)пира- золо(3,)пиримидин-7,9(6Н, 8Н)-диона (1,2 г) и пропионового ангидрида (1 ,2 мл) в пиридине (20 мл) перемешивают при 100° С в течение М ч. . Реакционную смесь концентрируют досуха, получают сироп, который очищают хроматографией. Полученный сиропообразный продукт кристаллизуют из смеси метиленхлорид/гексан, получают бесцветные кристаллы (1,17 г, 98%) с т.пло 118-120°С.
ВычисленоД: С 58,77; Н 7,25; N 20,16,
С,7Нг5-%03.
НайленоД: С 58,66; Н 7,19; N 19,17.
П р и м е р 156. 1-Пропионил-6,8- дипропил-2,3-ДИгидро-1Н-имидазо(21, 1 : 5,1)пиразоло(3,-й)пиримидин-7,9 (6Н, 8Н)-дион.
Раствор 6,8-дипропил-2,3-дигидро- 1Н-имидазо(2,1 : 5,1)пиразоло(3, пиримидин-7,9(6Н, 8Н)-диона (1,5 г) и пропионового ангидрида (1,5 мл) в пиридине (20 мл) перемешивают при 100°С в течение 2 ч. Реакционную смесь концентрируют досуха, получают сироп, который очищают с помощью флеш-хроматографии. Полученный сиропообразнвй продукт кристаллизуют из гексана, получают бесцветные кристаллы (1,2 г, 67%) с т.пл. .
ВычисленоД: С 57,64; Н 6,95; N 21,ОГо
C16H«NS°3НайденоД: С 57,68; Н 6,89;
, N 20,67.
Пример 157. 1-Бутирил-6,8-ди пропил-2,3 Дигидро-1Н-имидазо(21,1 : : 5,1) пиразоло()пиримидин-7,9 (6Н, 8Н)диона (1,5 г) и ангидрида масля ной кислоты (1,6 мл) в пиридине (20 мл) перемешивают при 100°С в течение . 2 ч. Реакционную смесь концентрируют досуха с получением сиропа, кото28
5
0
S
0
рый очищают Флеш-хроматографией. Полученный сиропообразный продукт крис- таллизуют из гексана и получают бесцветные кристаллы (0,82 г, %) ч , т.пл. .
Вычислено Д: С 58,77; Н 7,25; N 20,16.
С17Н2 °3
НайденоД: С 58,99; Н 7,21;
N 19,84о
П р и м е р 158. 6,8-Диаллил-1- пропионил-2,3-дигидро-1н-имидазо(21,
5,1)nnpa3ono(3,-d)nnpHMHflHH-7,9 (6Н, Р-Ю-дион.
Раствор 6,8-диаллил-2,3-дигидро- 1Н-имидазо(2;, 5,1 )пиразоло(3, d)nnpHMHflHH-7,9(6H, 8Н)-диона (1,0 г) и пропионового ангидрида (1,0 мл) в пиридине (16 мл) перемешивают при 100°С в течение 3 ч. Реакционную смесь концентрируют досуха с получением сиропа, который очищают флеш- хроматографией. Полученный сиропообразный продукт кристаллизуют из смеси метиленхлорид/изопропиловый эфир, получают бесцветные кристаллы (0,89 г, 7) с т„пл„ 11б-1180С«,
ВычисленоД: С 58,35; Н 5,81; N 21,26.
0
S
I С,6Н19М5Оз
НайленоД: С 57,97; Н5,82; N 20,97.
Пример 159. 6-Пентил-1-пропи- онил-8-пропил-2,3-Дигидро-1Н-имида- 5 зо(2,1 : 5,1)nиpaзoлo()пиpими- дин-7,9(6Н,8н)-Диона (1,5 г) и пропионового ангидрида (1,5 мл) пиридине (30 мл) перемешивают при 100°С в течение 2 ч. Реакционную смесь концентрируют досуха с получением сиропа, который очищают флеш-хроматогра- фией. Полученный сиропообразный прот дукт кристаллизуют из смеси изопро- пиловый эфир/гексан, получают бесцветные кристаллы (1,16 г, 65%) с т„пл„ 99-ЮО°С.
ВычисленоД: С 59,82; Н 7,53; N 19,38.
С18нггМ °3
Найдено,Г:: С 59,52; Н 7,52; N 19,29.
П р и м е р 160, б-Аллил-1-про- пионил-8-пропил-2,3-дигидро-1Н-ими- дазо(2,1 : 5,1)пиразоло(3,-а)пири- мидин-7,9(6Н, 8Н)-дион.
Раствор 6-аллил-8-пропил-2,3-ди- гидро-1Н-имидазо(2,1): 5,1)пиразо- ; ло(3,4-а)пиримидин-7,9(6Н, 7Н)-дио0
на (0,8 г) и пропионового ангидрида (1,0 мл) в пиридине (15 мл) перемешивают при 100°С в течение 44 ч. Реакционную смесь концентрируют досуха с получением сиропа, который очищают флеш-хроматографией. Полученный сиропообразный продукт кристаллизуют из смеси изопропиловый эфир/гексан, получают бесцветные кристаллы (0,8 г
Ооо/ . О- О г-О г-
83Ј) с т„пл. 83-85°С
Вычислено, С 57,99; Н 6,39; N 21,13,
C,6H2|Ny09.
Найдено,: С 57,82; Н 6,39; N 21,14.
П р и м е р 161, 6,8-Дибутил-1-бу тирил-2,3 Дигидро-1Н-имидазо(2,1 : 5,1) пира золо(3,) пиримидин- 7,9 (6Н, 8Й)-дион.
Раствор 6,8 дибутил-2,3-дигидро- 1Н-имидазо(27,1; : 5, )пиразоло(3,4-с пиримидин-7,9(бН, 8Н)-диона (8,94 г) и ангидрида масляной кислоты (0,5 мл) в пиридине (10 мл) перемешивают при 30-60°С в течение 15 ч. Реакционную смесь концентрируют досуха, получают сироп, который очищают с помощью флеш-хроматографии (силикагель, хлорформ) , получают бледно-желтый сироп. Продукт кристаллизуют из смеси гек- сан/изопропиловый эфир, получают бесцветные кристаллы (0,45 г, 39%) с т.пл. 83-86°С.
Вычислено,: С 60,78; Н 7,78; N 18,65,
СН9Н2 %Оз
. НайденоД: С 60,44; Н 7,89; N 18,51.
П р и м е р 162. 1-Ацетил-6,8-ди- бутил-2,3 ДИГИдро-1Н-имидазо(27,1 : 5,1) пиразоло (3, 4-d) пиримидин-7,9 (бН, 8Н)-дион.
Раствор 6,8-дибутил-2,3-дигидро- 1Н-имидазо(2, 1 : 5,1 )п-иразоло(3,4-3 пиримидин-7,9(6Н, 8Н)-диона (1,5 г) и уксусного ангидрида (1, мл) в пиридине (20 мл) перемешивают при 50-60°С в течение 15 ч. Реакционную смесь концентрируют досуха и очищают с помощью флеш-хроматографии (силикагель , хлороформ), получают бледно- желтый сироп. Продукт кристаллизуют из водного метанола, получают бесцветные кристаллы (1,2 г, 70%) с т.пл. 120-122°С„
Вычислено : С 56,19; Н 6,93; N 19,27,
Cl7H2sNS03°
5
0
5
0
0
5
Найдено,: N 19,37,
р и м е
30 С 55,94; Н 6,92;
: П р и м е р 163 1-Ацетил-6-бутил1 5 |8-пропил-2,.игидро-1 Н-имидазо(2,
1 : 5,1 )пиразоло(3,-с1)пиримидин-7,9 (6Н, 8Н)-дион.
Раствор 6-бутил-8-пропил-2, гидро-1Н-имидазо(2,1 : 5,1)пиразо- ло(3,-d)пиримидин-7,9(6Н, 8Н)-диона
0
0
(1,0 г) и уксусного ангидрида (1,0мл) в пиридине (15 мл) перемешивают при 50-60°С в течение 15 ч. Реакционную (смесь концентрируют досуха, получают сироп, который очищают флеш-хроматографией (силикагель, хлороформ), получают бледно-желтый сироп„ Сироп кристаллизуют из смеси гексан/изопро- пиловый эфир, получают бесцветные кристаллы (0,79 г, 69%) с т.пл. 98- 100°С.
ВычисленоД: С 57,64; Н ,6,95: N 21,01.,
C,gK23N 03,
Найдено,%: С 57,55; Н 6,96; N 20,96.
П р и м е р 6,8-Дибутил-1-про- пионил-2,3 дигидро-1Н-имидазо(2 , 1 : 5,1 )пиpaзoлo(3,)пиpимидин-7,9 (6Н, 8н)-дион.
Раствор 6,8-дибутил-2,3-дигидро- 1К-имидазо(2), 1 : 5,1 )пиразоло(3,) пиримидин-7,9(6Н, 8Й)-диона (1,5 г) и пропионового ангидрида (0,9 мл) в пиридине (20 мл) перемешивают при 5 50-60°С в течение 20 ч. Реакционную смесь концентрируют досуха, получают сиропообразный продукт, который очищают с помощью флеш-хроматографии (силикагель, хлороформ), получают бледно-желтый сироп. Сироп кристаллизуют из смеси гексан/изопропиловый . эфир, получают бесцветные кристаллы (0,75 г, 42%) с.т.пл. 93-95°С.
Вычислено,%: С 59,82; Н 7,55; N 19,38.
C18H27N503.
НайденоД: С 59,72; Н 7,61; N 19,360
Пример 1б5о 6,8-Дибутил-1- метокси ка рбонил-2,з-дигидро-1Н-ими- дазо(2,1 5,1 )пиразоло(3,4-а)пири- мидин-7,9(6Н, 8Н)диоНо
К суспензии 6,8-дибутил-2,3 Дигид- ро-1Н имидазо(2, 5,1)пиразоло(3,4- 5 d)nnpHMHflHH-7,9(6H, 8Н)-диона (1,5 г) и триэтиламина (2,0 мл) в диоксане (50 мл) добавляют по каплям метил- хлорформиат (0,75 мл) при перемешивании при охлаждении льдом, затем смесь перемешивают при комнатной температуре в течение 5 ч, после чего дополнительно перемешивают при 50-60°С в течение 20 ч„ Реакционную смесь концентрируют досуха, концентрат экстрагируют хлороформом. Слой хлороформа промывают водой, сушат и концентрируют с получением сиропообразного продукта, который очищают с помощью флеш-хроматографии (сили- кагель, хлороформ), получают бесцветные кристаллы (0,8 г, Ь$%) с т„пл, 138-11 0°П.
Вычислено,3: С 56,19; И 6,93; N 19,27.
С,.
Найдено,: С 55,94; Н 6,92; |Н 19,37.
П р и м е р 166. 6-Бутил 8-про- пил-1Н-имидэзо(2 5,1)пиразоле (3,А-d)пиримидин-7,9(6Н, 8Н)-дион.
- К раствору 6-бутил-8-пропил-2,3 дигидро-Ш-имидазо(27,1 : 5,1)пира- золо(3,с1)пиримидин-7,9(бН, 8Н)-ди- она (0,6 г) в диметилформамиде (12 мл добавляют карбонат калия (0,32 г) И смесь перемешивают при 100°С в течение 3 ч. Реакционную смесь концентрируют досуха. К концентрату добавляют метиленхлорид, и нерастворимое вещество отфильтровывают. Фильтрат концентрируют до сиропообразного продукта, который очищают флеш-хромато- графией (силикагель,хлороформ) с получением кристаллов, которые пере- кристаллизовывают на смеси метилен- хлорид/гексаи, получают бледно-желты призмы (0,29 г, 9) с т.пл, 235 - 236°С.
ВычисленоД: С 58,12; Н 6,62; N 24,20.
.
Найдено,: С 58,17; Н 6,61; N 24,28.
Пример 167. 6,8-Дипропил-1Н- имидазо,( : 5,1 )пиразоло(3, пиримидин-6,9(6Н, 8Н)-дион. 1 Раствор 6,8-дипропил-2,3-дигидро- 1Н-имидазо(2,11: 5,1)пиразоло(3, пиримидин-А,6(5Н, Н)-диона (1,6 г) и перекиси бензоила (2,1 г) в хлороформе (50 мл) кипятят с обратным холодильником в течение 15 ч. Реакционную смесь концентрируют досуха, концентрат растворяют в хлороформе, после чего промывают водным растворо карбоната натрия. Полученный раствор сушат и концентрируют досуха. Концентрат очищают с помощью флеш-хроматографии ,
Кристаллы-перекристаллизовывают из смеси метиленхлорид/гекстн, получают бесцветные кристаллы (1,1 г, 7U) с т.пл .
ВычисленоД: С 56,72; Н 6,22; N 25,44.
C1 1I 7N5°2.
Найдено,: С 56,33; Н 6,24; N 25,38.
Пример 1680 6,8-Диаллил-1Н- имидазо(2,1 : 5,1)пиразоле(З -сОпи5 римидин-7,9(6Н, 8Н)-дион.
Раствор 6,8-диаллил-2,3 дигидро- 1Н-имидазо(2г ,17: 5,1)пиразоло(3,) пиримидин-А,6(5Н, 7Н)-диона (2,1 г) и перекиси бензоила (2,8 г) в хлороформе (60 мл) кипятят с обратным холодильником в течение 15 ч. Реакционную смесь концентрируют досуха, концентрат растворяют в хлороформе, после чего промывают водным раствором
5 карбоната натрия. Полученный раствор сушат и концентрируют досуха. Концентрат очищают флеш-хроматографией, получают кристаллический продукт, который перекристаллизовывают из вод ного этанола, получают бесцветные кристаллы (1,5 г, 62) с т.пл. 235- 239°С.
ВычисленоД: С 57,56; Н 4,83; N 25,82.
С,3Н13%Ог
5 Найдено,: С 57,47; Н 4,90; N 25,69.
П р и-м е р 169. 6,8-Дибутил-1Н- имидазо(2 , 1J: 5J )пиразоло(3,-й)пи- римидин-7,9(6Н, 8Н)-дион.
0
Раствор 6,В-дибутил-2,3-Дигидро- 1Н-имидазо(2,11 :5,1)nHpa3ono(3,-d) пиримидин-,6(5Н, 7НУ-диона (1,9 г) и перекиси бензоила (2,26 г) в хло5 реформе (30 мл) кипятят с обратным холодильником в течение 10 ч. Реакционную смесь концентрируют досуха и концентрат растворяют в хлороформе, после чего промывают водным раствором
0 карбоната натрия. Полученный раствор сушат и концентрируют досуха, концентрат очищают с помощью флеш-хроматографии. Кристаллы, полученные таким образом, перекристаллизовывают из
5 смеси хлороформ /изопропиловый эфир, получают бесцветные кристаллы (1,2 Г, ) с т.пл. 200-202°С.
ВычисленоД: С 59,39; Н 6,98; N 23,09.
33
(N50
Найдено,%: С 59,37; Н 6,98; N 23,17,
Пример 170. 6,8-Дибутил-1- метил-1Н-имидазо(2,1 : 5,1)пиразоле- (З.-сОпиримидин Э Н, 8Н)-дион.
Раствор 6,Я-дитубил-1-метил-2,3 дигидро-1Н-имидазо(2,1 : 5,1)пиразо- ло (3,-d) пиримидин-, 6 (5Н, 7Н)-диона (1,3 г) и перекиси бензоила (1,7 г) в хлороформе (50 мл) кипятят с обратным холодильником в течение 5 ч. Реакционную смесь концентрируют досуха и концентрат растворят в хлороформе. Раствор промывают водным раствором карбоната натрия, после чего сушат и концентрируют досуха. Концентрат очищают с помощью флеш-хрома- тографии, получают кристаллы, которые перекристаллиэовывают из изопро- пилового эфира, получают бесцветные кристаллы (1,1 г, ) с т„пл. 153- 155°С.
Вычислено,: С 60,55; Н 7,30; N 22,07.
С 6Н23%02
Найдено,%: С 60,58; Н 7,33; N 22,19.
Пример 171. 6-Изобутил-3 про- пил-1И-имидазо(2 ,1 : 5,1)пиразоле (3,d)пиримидин-7,9 (6Н, 8Н)-дион. Раствор 6-изобутил-8-пропил-2,3 дигидро-1Н-имидазо(2,1 : 5,1)пира- золо(3,d)пиримидин- ,б(5Н, 7Н)-дио- на (1,3 г) и перекиси бензоила (1,6 г) в хлороформе (40 мл) кипятят с обратным холодильником в течение 15 ч. Реакционную смесь концентрируют досуха и концентрат растворяют в хлороформе. Раствор промывают водным раствором карбоната натрия, сушат и концентрируют досуха. Концентрат очищают флеш-хроматографией, получают кристаллический продукт, который , перекристаллизовывают из водного этанола, получают бесцветные кристаллы (О,и г, 63%) с т.пл. 283-287°С.
Вычислено,%: С 58,12; Н 6,62; N 24,20,
Найдено,%: С 58,01; Н 6,67; N 23,99.
Пример 172. 6-Аллил-8-пропил- 1Н-имидазо(2), 1 : 5,1 )пиразоло(3,) пиримидин-7,9(6Н, 8Н)-дион„
Раствор 6-аллил-8-пропил-2, гидро-1-имидэзо(2-,1 : 5,1)пиразоло ()пиримидин-,6(5Н, 7Н)-дионл
-
-
- - ) )
10
20
739С503
(1,5 г) и перекиси бензоила (2,0 г) в хлороформе (50 мл) кипятят с обратным холодильником в течение 15 ч. Реакционную смесь концентрируют досуха и концентрат растворяют в хлороформе, после чего промывают водным раствором карбоната натрия, полученный раствор сушат и концентрируют досуха. Концентрат очищают с помощью флеш-хроматографии, получают кристаллический продукт, который перекристаллизовывают из водного этанола, получают бесцветные кристаллы (1,0 г,
15 70%) с т.пл. 2 0-242°С.
Вычислено,%: С 37,13j H 5,33; N 25,63.
C H NgOfc
НайденоД: С 36,00; Н 3,57; N 25,52.
П р и м е р 173. С-Пентил-3- пропил-1Н-имидазо(2т1 : 5,1)пиразоло (3,4-d) пиримидин-7,Э (6Н, 8Н)-п,ион. Раствор б-пентил-Я-пропил-З, дигидро-1Н-имидазо(2, 1 : 5,1)пира- золо(3, -d)пиримидин-4,6 (5Н, 7Н) -дио- на (1,8 г) и перекиси бензоила (2,1 г) в хлороформе (60 мл) кипятят с обратным холодильником в течение 15 ч.
30 Реакционную смесь концентрируют досуха и концентрат растворяют в хлороформе, после чего промывают водным раствором карбоната натрия. Полученный раствор сушат и концентрируют до- суха. Концентрат очищают флеш-хроматографией, получают кристаллический продукт, который перекристаллизовывают из водного этанола, получают бесцветные кристаллы (1,1 г, 62%) с т.пл. 223-22W.
Вычислено,%: С 59,39; Н 6,98; N 23,09.
с)5нг %°г
Найдено,%: С 59,35; Н 7,01; N 22,89.
Пример 7/t. 6--Вутил-8-про- пил-1Н-имидазо(27,I7: 5,1)пиразоле (3,-а)пиримидин-2,7,9(ЗН, 6Н, 8H)-i трион.
Раствор-3-амино-7-бутил-2-этокси- карбонилметил-5 пропил-2Н-пиразоло (3,b-d)пиримидин-4,6(5Н, 7Н)-диона (1,85 г) в этаноле (35 мл), содержа- .щем натрий (0,31 г), перемешивают при комнатной температуре в течение 30мин. Реакционную смесь концентрируют досуха, концентрат растворяют в воде со льдом, раствор подкисляют до слабокислой реакции 1 н. соляной кис/то40
45
50
55
35
той с Выпавшие кристаллы отфильтровывают, перекристаллизовывают из смеси метиленхлорид/этанол и получают бесцветные иглы (0,84 г, 52%) с т.пл. 7.66-269 °С.
Вычислено,%: С 55,07; Н 6,27; N 22,94,
С14Н„Ыу03
Найдено,;: С 54,99; Н 6,23; N 22,82.
П р и м е р 175. 1-Бутил-З-пропил- 5,6,7,8-тетрагидропиримидо(2 ,1Т : 5,1) пира aonoO -d) пиримидин-2, (1Н, ЗН)- дион.
К перемешиваемому раствору но-7 бутил-2-(-хлорпропил)-5-пропил- 2Н-пира зол о (3,-d) пиримидин-, 6 (5Н , 7Н)-диона (2,1 г) в диметилформамиде (30 мл) добавляют гидрид натрия (60% масла, 0,7 г) порциями при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 5 ч. Реакционную смесь концентрируют досуха и концентрат вносят в воду со льдом при перемешивании, при этом осаждаются кристаллы, Кристаллы отфильтровывают и перекристаллизовывают из водного срирта, получают бесцветные кристаллы ( г, .32%) с т.пл. 1 7-150°С.
17
Вычислено Д: С 59,00; Н 7,59; N 22,93о
с,5к25МуОе
Найдено,%: С 59,19; Н 7,58;
N 22,83.
П р и м е р 176. 1 Бутил-5-метил3-пропил-5,6,7,8-тетрагидропиримидо
( : 5,1)пиразоле(3,-d)пиримидин-2,М1Н, ЗН)-дион.
К перемешиваемому раствору 7-бу- тил-2-(3-хлорпропил)-З-метиламино-5- пропил-2И-пира золо(3,-d)пиримидин- ,6(5Н, 7Н)-диона (2,0 г К в диметил- формамиде (30 мл) добавляют гидрид натрия (60% масла, 0,6 г) порциями/ при охлаждении льдом. Смесь переме- шивают при комнатной температуре дополнительно в течение 5 ч. Реакционную смесь концентрируют досуха и концентрат вносят в воду со льдом, при этом смесь перемешивают. Выпавши кристаллы отфильтровывают и перекристаллизовывают из изопропилового эфира, получают бесцветные кристаллы (1,55 г, 90%) с т.пл. 9 -98вС.
Вычислено Д: С 60,17; Н 7,89; N 21,93.
)
, i
15
25
е73985036
C leHaoN
Найдено,%: С 60,19; Н 7,89; N 21,95.
Пример 177. 1-Бутиг,5-метил- 3-пропил-6,7,8,9-тетрагидро-5Н-пири- мидо(5, ,3) пира золо (1,5-а) (1 ,3) диазепин-2,М1Н, ЗН)-дион.
К перемешиваемому раствору 7-бу- щ тил-2-(А-хлорбутил)-3-метиламино- 5 пропил-2Н-пиразоло(3,-d)-пирими- дин-,6(5Н, 7Н)-диона (2,0 г) в диметилформамиде (30 мл) добавляют гидрид натрия (60% масла, 0,65 г) порциями при охлаждении льдом. Смесь перемешивают при комнатной температуре дополнительно в течение 5 ч. Реакционную смесь концентрируют досуха, после чего остаток вносят в воду со 20 льдом, затем нейтрализуют 1 н. соляной кислотой и экстрагируют хлороформом. Хлороформенный слой промывают водой, сушат и концентрируют, получают сиропообразный продукт. Этот остаток очищают с помощью флеш-хромато - рафии (силикагель, хлороформ), получают кристаллы, которые перекристаллизовывают из смеси изопропиловый эфир/гексан, получают бесцветные кристаллы (1,2 г, 67%) с т„пл. 63-65°С.
ВычисленоД: С 61,24; Н 8,16;
N 21,00„
C,H27NyOfc
НайденоД: С 61,38; Н 8,12} N 21,00.S
П р и м е р 17.8. 6,8-Диизобутил- 2,3-Дигидро-1Н-имидазо(2,I7: 5,1) пиразоло(3,|)пиримилин-7,9(6Н, 8Н)- дион.
К перемешиваемому раствору 2-(2- хлорэтил)-6,8-диизобутил-2Н-пиразо- no(3,-d)пиримидина (3,6 г) вдиметилформамиде (50 мл) добавляют порциями гидрид натрия (60% масла, 0,6А г) при охлаждении льдом. Смесь перемешивают при комнатной температуре в течение Зч и концентрируют досуха. Полученный остаток вносят в воду со льдом, получают кристалличёЬкий продукт. После фильтрации кристаллы перекристаллизовывают из смеси мети- ленхлорид/изопропиловый эфир, получают бесцветные кристаллы (2,15 г, 67%) с т.пл. 7М-..
ВычисленоД: С 59,00; II 7,49; 55 N 22,93.
НайденоД: С 58,74; Н 7,47; N 22,75.
30
35
40
4S
50
37
Пример 179. 6,Р.Диизобутил- 1-пропионил-2,3-дигидро-1Н-имида зо (2, Р: 5,1)пиразоло(3 ,4-с1)пирими- дин-7,9(6Н, ВИ)-дион.
Раствор 6,8-диизобутил-2,3-дигид ро-1Л-имидазо(2,1 : 5,1)пиразоле (3,)пиримидин-7,9(6Н, 8н)-диона (2 г) и пропионового1ангидрида (2 м в пиридине(20 мл) перемешивают при 50-60°С в течение 18 ч. Реакционную смесь концентрируют досуха, получаю сироп. Сироп очищают с помощью флеш хроматографии (силикагель, гексан/ /этилацетат), получают бледно-желты сироп. Кристаллизация из н-гексана дает бесцветные кристаллы (1,4 г, 60%) с т.пл. 122-123°С.
Вычислено,%: С 59,82; Н 7,53; N 19,38.
С|« г Т1У°г
Найдено,-;: С 59,68; Н 7,46;
N 19,18.
П р и м е р 180. 6,8-Диизобутил- 1Н-имидазо(2,Р: 5,1)пиразоло(3,4пиримидин-7,9(бН, 8Н)-дион.
Раствор 6,8-диизобутил-2,З-дигид ро-Ш-имидазо , 5,1)пиразоло (3,)пиримидин-4,6(6Н, 7Н)-диона (20 г) и перекиси бензоина (1,6 г) в хлороформе (150 мл) кипятят с обратным-холодильником в течение 16 ч реакционную смесь концентрируют до- суха и полученный остаток растворя
38
ют в хлороформе, после чего промывают водным раствором карбоната.-натрия Органический слой сушат и концентрируют досуха, полученные кристаллы перекристаллизовываюу на смеси мети- ленхлорид/этилацета, получают бесцветные кристаллы (9,1-Г, 46%) с т.пл, ЗЮ-311°С,
Вычислено,%: С 53,39; Н 6,98; N 23,09,
,%02
Найдено,%: С 59,24; Н 6,32; N 22,80тЭкспериментальный пример 1. Антивоспалительное действие (метод кара- ганиновой эдемы) исследовали с использованием группы из шести крыс Jck. SD ( возраст 6 недель, самцы) в соответствии с методом Винтера и др. Через 1 ч после орального введения 50 мг/кг исследуемого соединения животным подкожно ввели по , ., 0,05 мл 1%-ного раствора карагени- на в физиологическом растворе (в ступню) . Через 3 ч измерили объем задней лапы, сравнили с объемом перед инъекцией и по ргГзнице определили объем отека. Путем сравнения объема отеков групп животных, обработанных и необработанных исследуемыми соединениями, определяли скорость ингибиро- вания. Результаты представлены в табл.9,
39
статистически заметное различие (,05) ,01 - 0;001.
-„и
Животным в контрольной I группе введен только разбавитель 5% гумми-арабика. Статистически значимое различие (,01).
Т739В50
40 Продолжение табл.9
Таблица 10
Таблица 11
41
Н
СН3(СН2)Ч 0 Nn
$№
О NN
СНэССЬУз
СН3С
сн3(сн2)2ч
лА А/4
O N N снэ(сн,Ъ
Н
СНЭ(СН2)2ч О N
nutf
О N N СН3(СН2Ь
снэ(сн2)2ч о инсн3
Nrr N-coocH3
oVv
СН3(СН2)з
Статистическая достоверность ,01,
Антивоспалительное действие (обратимая пассивная реакция Артюса) исследовали использованием группы, состоящей из шести крыс (возраст 7 недель, самцы). Сняли волосяной покров со спинок животных под эфирной анестезией, в хвостовую вену каждого из животных ввели по 1 мл 0,5% ного раствора яичного альбумина в физиологическом растворе, после чего провели интрадермальную инъекцию по 0,1 мл антисыворотки к яичному альбу1733850
42 Таблица 12
юз7
1,53
82
Не определяли
109
Не определяли
601
8,6
мину кролика на левую и правую стороны спины и дополнительную интрадер- мальную инъекцию по 0, мл физиологического раствора на левую сторону спины. Через 3 ч животным внутривенно ввели по 1 мл 1%-ного голубого Эван- са в физиологическом растворе. Через 30 мин отслоили кожу животных и измерили площадь каждого голубого пятна. Испытуемое соединение при дозе 12,5 мг/кг орально было применено з 1 ч до инъекции яичного альбумина.
По сравнению площади голубого пятна в испытуемой группе с площадью пятен в контрольной группе определили ско- рость йнгибирования.
Результаты представлены в табл.9.
Экспериментальный пример 2. Обезболивающее действие (метод фиксации боли фенилхинином) исследовали с использованием группы из 10 мышей Scl: SD (возраст недели, самцы) в соответствии с методом Siegmund. Применили орально испытуемое соединение при дозе 50 мг/кг и через 30 мин интраперитонеально ввели 0,02%-ный водный раствор фенилхинона из расчета 0,1 мл на 10 г веса животного. Через 20 мин после инъкции для каждого животного оценили число болевых конвульсий. С помощью сравнения групп необработанных и обработанных животных для каждого ряда реакций определяли скорость йнгибирования болей.
Результаты представлены в табл.9.
Экспериментальный пример 3. Ис- пользовали группу из 10 мышей BALB/c- (возраст 7 недель, самцы). Каждой мыши ввели в хвостовую вену P. acnes, нейтрализованные нагреванием, при дозе 1 мг/мышь. Через семь дней каждой мыши ввели внутривенно LPS (1 мкг/мышь), полученный из Salmonella enteritides, чтобы вызвать острое гепатитовое нарушение. Обычно в группе из мышей, которым внутривен но ввели LPS, 90-100% животных умирают через 2k ч. С помощью этой модели было испытано каждое соединение. Каждое соединение (I), представленное в табл.10, суспендировали в 5%-ном разбавителе гумми-арабике и орально применили к животным при д оз е 0,3 мг/кг за 1 ч перед инъекцией LPS затем через 48 ч определили число умерших мышей. Мышам в контрольной группе был орально введен раз бавитель гумми-арабик за 1 ч перед применением LPS. Результаты представлены в табл.10.
Как видно из табл.10, соединение (l) существенно защищает мышей от летального исхода за счет острой печеночной недостаточности.
Экспериментальный пример . Использовали группу из 5 крыс Jcl: Wis tar (возраст 5 недель, вес 90-110.г, самцы, Japan Clia) и группу из 5 мышей Jcl : JCR (возраст 5 недель, .ес
г, самцы, Japan Clia). Каждой из крыс орально ввели 10 мл/кг испытуемого соединения (250 мг/кг), а
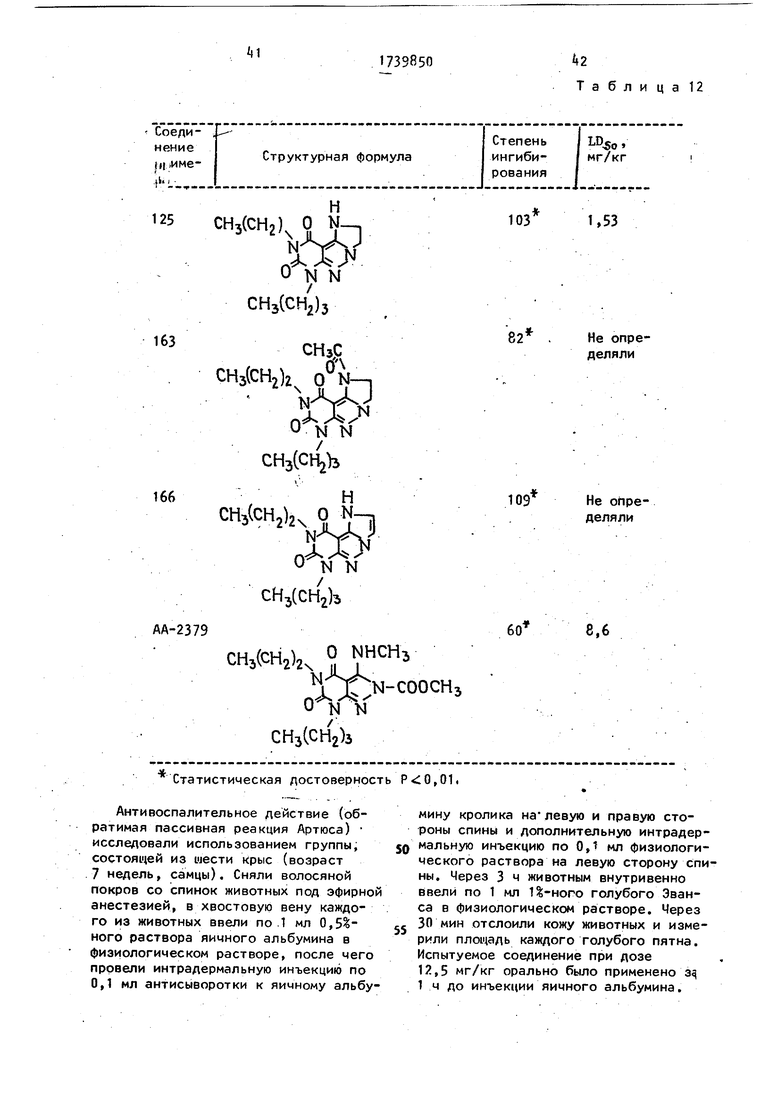
каждой из мышей орально ввели 20 мг/кг испытуемого соединения (500 мг/кг). Эти оральные введения сделаны в виде суспензии в 5%-ном гумми-арабике. Через неделю подсчитали число павших животных.
Результаты представлены в табл.1 К Сравнение известного соединения 7-бутил-2-метоксикарбонил-З-метилами- но -пропилпиразоло -З иримидин5 ,6(5Н, 7Н)-диона (АА-2379) с соединениями общей формулы (l) показывает, что последние по противовоспалительной активности при пероральном введении превосходят известное соединение и обладают малой токсичностью для теплокровных животных (см„ табл.12)о
Формула изобретения
Способ получения конденсированных производных пиразоло(3,4)пири- мидина общей формулы
R3
о V
(D
R U |N ,
,
ПЖА
0 NN
А
;
V
R-:
5
где А - группа - (СНг)п-СО-, -(CH4)nf или -(СНг)и, - , п 1 или 2, или 3;
R и RЈ - алкил с 1-6 атомами углерода;
R водород, алкил или ацил с 1-6 атомами углерода, отличающийся тем, что циклизуют соеди- нение общей формулы
О NHR3
-(CH2)n-C-Y 0 N Nz
Ra
(ID
где R0 R и R3 имеют указанные значения;
Y - галоген, когда Z - водород, или группа OR4, где алкил с
5 1739850№
1-3 атомами углерода, когда Z - кис- рованием, -или алкилированием соединелород,ния (I), где R3- водород, А - группа действием основания с последующим вьс(СН2) Пч.{ a R и R имеют указанные
делением целевого продукта или де-5 значения для получения соединения
гидрогенизацией соединения (I), гдеi (О, где R3- указанный ацил или алА - группа - ,-, a R, R2 и R3кил, и выделением целевого продукта, имеют указанные значения, или ацили

| АНТЕННАЯ СИСТЕМА ИЗ КОЛЬЦЕВЫХ ИЗЛУЧАТЕЛЕЙ НА КОНИЧЕСКОЙ ПОВЕРХНОСТИ | 0 |
|
SU166054A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1992-06-07—Публикация
1988-08-30—Подача