Изобретение относится к новым противогрибковым органическим соединениям, а именно к 2-замещенным-6-метокси-1,3-оксазин-4-онам общей формулы
R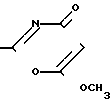 где R - 2-фурил, n-CH3-C6H4-,
где R - 2-фурил, n-CH3-C6H4-,
n-CH3O-C6H4-, n-Cl-C6H4-, обладающим противогрибковой активностью.
Данная группа соединений может найти применение в медицине при лечении микозов, а также в народном хозяйстве для защиты различных материалов и покрытий от биодеструкции.
В качестве прототипа по структуре выбран 2-фенокси-6-арил-1,3-оксазин-4-он общей формулы
X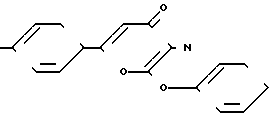 где Х - водород или бром, являющийся полупродуктом в синтезе биологически активных соединений.
где Х - водород или бром, являющийся полупродуктом в синтезе биологически активных соединений.
На сегодняшний день в клинике используются следующие противогрибковые препараты: нистатин (минимальная подавляющая концентрация (МПК 1,5-100 мкг/мл), амфотерицин В (МПК 0,03-40 мкг/мл), гризеофульвин (МПК 0,2-1,5 мкг/мл). Недостатком данных соединений является то, что за время их использования у микроорганизмов выработалась резистентность к ним.
Целью изобретения является создание препаратов, обладающих более широким спектром действия и более высокой фунгицидной активностью.
Указанная цель достигается синтезом 2-замещенных-6-метокси-1,3-оксазинов-4-онов формулы
R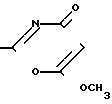 где R - 2-фурил, n-CH3-C6H4,
где R - 2-фурил, n-CH3-C6H4,
n-CH3O-C6H4-, n-Cl-C6H4-, обладающих противогрибковой активностью.
В отличие от прототипа заявляемые соединения обладают противогрибковой активностью, появление которой связано с гетероциклом, имеющим в положении 4 карбонильную группу, а в положении 6 гетероцикламетокси группу. Величина биологической активности зависит от характера заместителя во втором положении цикла.
Заявляемые соединения синтезированы в Ленинградском химико-фармацевтическом институте (R - 2-фурил, N гос. регистрации 9676190, R - n-CH3-C6H4, N гос. регистрации 9676390, R - n-CH3O-C6H4, N гос. регистрации 9676490, R - n-Cl-C6H4, N гос. регистрации 9676290).
Заявляемые соединения получаются взаимодействием амидов органических кислот с хлористым оксалилом с последующей циклизацией с помощью метоксиацетилена по следующей схеме:
R-CONH2+ (C0C1)2_→ R-CONCO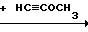 R
R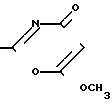 где R - 2-фурил, n-CH3-C6H4-,
где R - 2-фурил, n-CH3-C6H4-,
n-CH3O-C6H4-, n-Cl-C6H4-.
П р и м е р 1. В раствор 4,3 г (0,031 моль) 2-фураноилизоцианата в 20 мл дихлорэтана при 5-10оС приливают 2,64 г (0,047 моль) метоксиацетилена. Смесь перемешивают 48 ч. Растворитель отгоняют. Остаток перекристаллизовывают из смеси хлороформ-гексан (1:3). Выход 4,9 г (82%), т.пл. = 148-150оС с разложением, Rf = 0,14 (этилацетат).
Найдено, %: C 55,4; H 3,8; N 7,0
C9H7O4N
Вычислено, %: C 55,9; H 3,6; N 7,3.
УФ-спектр (этанол), λмакс, нм (lg 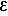 ): 229 (4,05); 289 (4,30).
): 229 (4,05); 289 (4,30).
ПМР-спектр (CDCl3), δ, м.д.: 6,6-7,7 (3Н фуранового цикла), 5,4 (с, 1Н, С5Н), 4,0 (3Н, ОСН3).
ИК-спектр (крист., вазелиновое масло), ν, см-1: 1645 (С=О), 1590 (C=N), 1535 (C=C).
П р и м е р 2. В раствор 1,9 г (0,01 моль) n-метоксибензоилизоцианата в 15 мл дихлорэтана при 5-10оС прибавляют 1,05 мл (0,84 г, 0,015 моль) метоксиацетилена, перемешивают 24 ч. Растворитель отгоняют и остаток перекристаллизовывают из смеси хлороформ-гексан (1:3). Выход 1,21 г (52%), т.пл. = 120-123оС с разл, Rf= 0,23 (этилацетат).
Найдено, %: C 61,0; H 4,1; N 5,9.
C12H11O4N
Вычислено, %: C 61,0; H 4,7; N 6,0
УФ-спектр (этанол), λмакс, нм: 227 (4,13); 301 (4,40).
ПМР-спектр (ДМСО-D6), δ, м.д.: 7,05, 7,95 (4Н фенильного цикла); 5,75 (с, 1Н, С5Н); 4,0 (с, 3Н, ОСН3); 3,85 (с, 3Н, ОСН3).
ИК-спектр (крист., вазелиновое масло), ν, см-1: 1650 (C=O), 1660, 1550 (C=C); 1575 (C=N); 1500 (C=C).
П р и м е р 3. В раствор 5 г (0,031 моль) n-метилбензоилизоцианата в 20 мл бензола при 5-10оС прибавляют 1,96 г (0,035 моль) метоксиацетилена, перемешивают 120 ч. Растворитель отгоняют, остаток перекристаллизовывают из смеси хлороформгексан (1:4). Выход 3,4 г (51%), т.пл. = 133-134оС с разл., Rf = 0,22 (этилацетат).
Найдено, %: C 66,9; H 4,9; N 6,7.
C12H11O3N
Вычислено, %: C 66,3; H 5,0; N 6,4.
УФ-спектр (этанол), λмакс, нм (lg 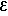 ): 269 (4,53).
): 269 (4,53).
ПМР-спектр (ДМСО-D6), δ, м.д.: 7,29; 8,10 (4Н бензильного цикла); 5,40 (с, 1Н, С5Н); 3,97 (с, 3Н, ОСН3); 2,24 (с, 3Н, СН3).
ИК-спектр (крист., вазелиновое масло), ν, см-1: 1650 (С=О), 1605, 1505 (С=С), 1580 (C=N); 1410 (C=C).
П р и м е р 4. В раствор 3,5 г (0,019 моль) n-хлорбензоилизоцианата в 15 мл дихлорэтана при 5-10оС прибавляют 1,29 г (0,023 моль) метоксиацетилена, перемешивают 3 ч. Растворитель отгоняют и остаток перекристаллизовывают из смеси хлороформгексан (1:3). Выход 3,85 г (85,5%), т.пл. = 140-142оС c разл. Rf = 0,18 (этилацетат).
Найдено, %: C 55,2; H 4,0; N 3,5; Cl 15,2.
C11O3H8NCl
Вычислено, %: C 55,5; H 3,3; N 3,8; Cl 14,9
УФ-спектр (этанол), λмакс, нм (lg 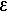 ): 236 (4,09), 270 (4,32).
): 236 (4,09), 270 (4,32).
ПМР-спектр (ДМСО-D6), δ, м.д.: 7,65; 8,1 (4Н бензоильного цикла); 5,6 (с, 1Н, С5Н); 4,0 (с, 3Н, ОСH3).
ИК-спектр (крист., вазелиновое масло), ν, см-1: 1620 (С=О); 1580 (С=С), 1545 (С=N); 1470 (С=С).
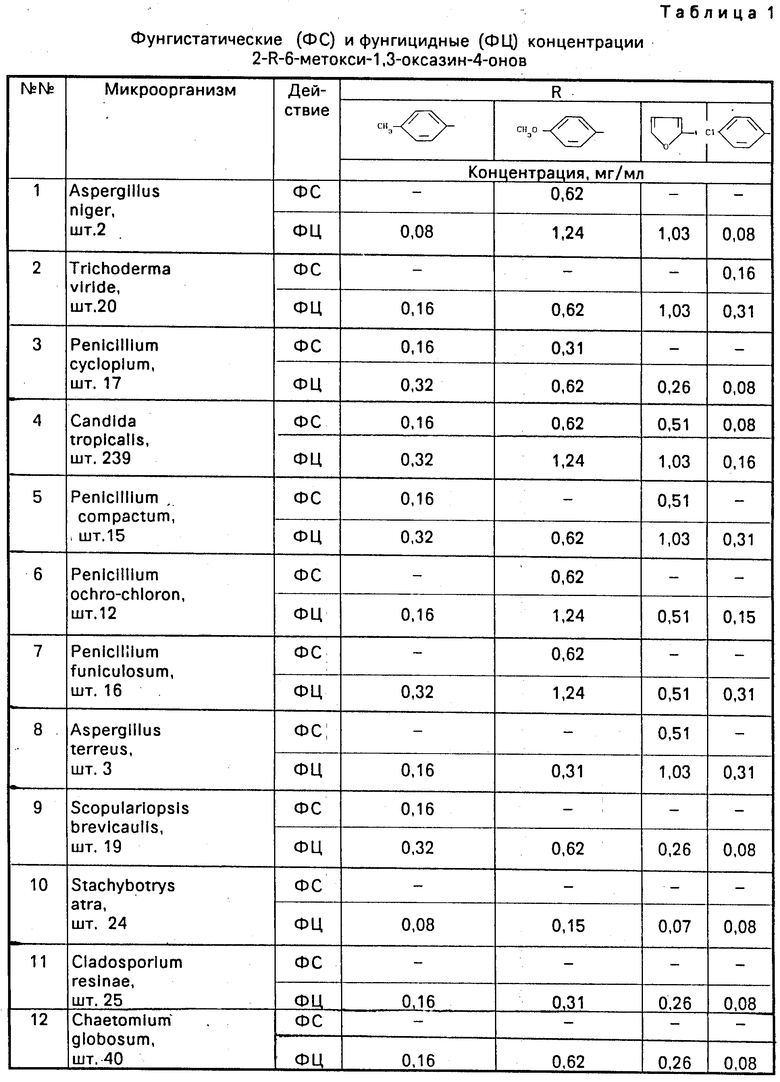
П р и м е р 5. Изучение противогрибковой активности проводят в жидкой среде методом серийных разведений. К серийно разведенному препарату в пробирках добавляют микробную взвесь и определяют минимальную концентрацию вещества, способную задерживать рост тест-культуры. Пробирки термостатируют при 24оС в течение 48 ч. С целью определения характера действия (фунгистатическое или фунгицидное) производят высевы на чашки Петри с суслом-агаром из всех пробирок. Чашки помещают в термостат на 48 ч при 24оС.
В качестве тест-культур используют Aspergillus niger, Trichoderma viride, Penicillium cyclopium, Penicillium compactum, Penicillium ochro-chloron, Penicillium jumiculosum, Aspergillus ferreus, Scopulariopsis brevicaulis, Stechybotrys atra, Cladosporium resinae, Chactomium globosum, являющиеся активными биодеструкторами, а также культуру Candida tropicalis. Результаты исследований представлены в табл.1.
П р и м е р 6. Токсичность определяют на мышах SHR массой тела 18-20 г. Препараты вводят внутрибрюшинно в виде взвеси в физиологическом растворе (изотоническом) NaCl. Вводимые дозы 200-600 мг/кг.
Наблюдения за животными продолжают в течение 2 недель после введения препаратов, но гибель при введении токсичных доз наступает в течение первых двух суток. Сразу после введения высоких доз у животных развиваются клонико-тонические судороги и появляется цианоз.
ЛД50 определяют по методу Литчфилда и Уилкоксона. Результаты исследований представлены в табл.2.
Таким образом, заявляемые соединения в отличие от прототипа по структуре обладают фунгицидной активностью, сопоставимой с активностью применяемых на сегодняшний день противогрибковых препаратов.

Использование: в качестве противомикробных препаратов в медицине. Сущность изобретения: продукт - 2-замещенные 6-метокси-1,3-оксазин-4-оны общей ф-лы 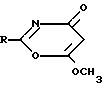 где R2-фурил (1), N-толил (2), n-метоксифенил (3), N-хлорфенил (4). БФ выход % и Т.пл (°С) соответственно C4H7NO4, 82, 148-150 (1); C12H11NO3, 51, 133-134 (2); C12H11NO4, 52, 120-123 (3); C11H8ClNO3, 85,5, 140-142 (4). Реагент 1:R-CONCO. Реагент 2: метоксиацетилен. Условия реакции: в среде дихлорэтана или бензола при 5-10°С. 2 табл.
где R2-фурил (1), N-толил (2), n-метоксифенил (3), N-хлорфенил (4). БФ выход % и Т.пл (°С) соответственно C4H7NO4, 82, 148-150 (1); C12H11NO3, 51, 133-134 (2); C12H11NO4, 52, 120-123 (3); C11H8ClNO3, 85,5, 140-142 (4). Реагент 1:R-CONCO. Реагент 2: метоксиацетилен. Условия реакции: в среде дихлорэтана или бензола при 5-10°С. 2 табл.
2-ЗАМЕЩЕННЫЕ-6-МЕТОКСИ-1,3-ОКСАЗИН-4-ОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОГРИБКОВОЙ АКТИВНОСТЬЮ.
2-Замещенные-6-метокси-1,3-оксазин-4-оны формулы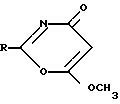
где R - 2 - фурил, n-толил, n-метоксифенил или n-хлорфенил, обладающие противогрибковой активностью.
| Там же, с.357. |
Авторы
Даты
1995-01-20—Публикация
1990-07-20—Подача