Изобретение относится к новым соединениям, обладающим биологической активностью, а именно к производным 1-оксо-3,3,5-триметил-1,2-оксафосфолена-4 общей формулы 1
CH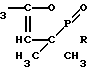 где R - эфирный или амидный заместитель, содержащий гетероциклический фрагмент, включающий в качестве гетероатомов кислород, азот или их комбинацию, например
где R - эфирный или амидный заместитель, содержащий гетероциклический фрагмент, включающий в качестве гетероатомов кислород, азот или их комбинацию, например
R
 O
O CH
CH CH2
CH2 N
N O
O
Указанные соединения обладают выраженной антибластомной активностью.
Перечисленные соединения в литературе не описаны.
Известны антибластомные препараты, содержащие эпоксидные группы: метилдиглицидилфосфат (цидифос, базовый преперат); содержащие этилениминные группы: трис(этиленамид) тиофосфорной кислоты (тиофосфамид, базовый препарат); содержащие бисхлорэтиламидную группу; 2-оксо-2-бис-(2-хлорэтил)-амино-1,3,2-оксазафосфо-ринан, (циклофосфан, базовый препарат) и их аналоги. Условием проявления такой активности является наличие в одной молекуле не менее двух циклических фармакофорных групп. Производные кислот фосфора, содержащие одну эпоксидную или этилениминную группу и обладающие высокой антибластомной активностью, не известны.
Известен ближайший структурный аналог - 2-тиоксо-2-морфолино-3,3,5-триметил-1,2-оксафосфолен-4 O о котором лишь в одной публикации имеется упоминание, что он проявляет слабую активность по отношению к мышиной опухоли ЕО 771 (Schroeder D.C., Corcoran P.O., Holden C.L., Mulligan M.A. J.Org. Ghem. , 1962, vol. 27, No. 3, p. 1098). Фосфорильные его аналоги получены и изучены не были.
O о котором лишь в одной публикации имеется упоминание, что он проявляет слабую активность по отношению к мышиной опухоли ЕО 771 (Schroeder D.C., Corcoran P.O., Holden C.L., Mulligan M.A. J.Org. Ghem. , 1962, vol. 27, No. 3, p. 1098). Фосфорильные его аналоги получены и изучены не были.
Целью изобретения являются новые соединения в ряду производных 2-оксо-1,2-оксафосфоленов, обладающие высокой антибластомной активностью. Поставленная цель достигается новыми производными 2-оксо-1,2-оксафосфолена-4 общей формулы 1, обладающими высокой активностью по отношению к перевивным опухолям животных.
Соединения формулы 1 получают взаимодействием 2-оксо-2-хлор-3,3,5-триметил-1,2-оксафосфолена-4 с глицидиловым спиртом или морфолином соответственно в присутствии акцептора хлористого водорода (В) в среде органического растворителя по общей схеме H
H B_→
B_→ 1)
1) B·HCl
B·HCl
Все целевые продукты обладают способностью тормозить рост ряда солидных и асцитных опухолей. При этом активность заявляемых соединений по отношению к солидной опухоли Эрлиха и асцитной гепатоме Зайделя, являющимся моделями таких распространенных злокачественных опухолей, как рак молочной железы и печени, соответственно превосходит активность широко применяемых в клинической онкологии лекарственных средств - циклофосфана и тиофосфамида, а также нового диэпоксидного фосфорного препарата цидифос.
В отличие от известных противоопухолевых средств (тиофосфамид, цидифос и их аналоги), для которых необходимым условием проявления антибластомной активности является наличие в молекуле не менее двух эпоксидных или этиленимидных фрагментов, в предлагаемых целевых продуктах роль одной из фармакофорных структур выполняет 1-оксо-1,2-оксафосфоленовый гетероцикл, который обеспечивает высокую антибластомную активность соединений, содержащих сочетание этого гетероцикла только с одним эпоксидным или этиленимидным фрагментом или даже с морфолиновым радикалом, для которого антибластомные свойства не являются специфичными.
Для лучшего раскрытия существа изобретения методики получения заявляемых соединений и результаты изучения их биологической активности иллюстрируются следующими примерами.
П р и м е р 1. Получение 2-оксо-2-(2,3-эпоксипропилокси)-3,3,5-триметил-1,2-окса-фосфолена-4 (1а).
К 81 г (0,45 г-моль) 2-оксо-2-хлор-3,3,5-триметил-1,2-оксафосфолена-4 в 300 мл диэтилового эфира прибавляют по каплям раствор 33,3 г (0,45 г-моль) глицидилового спирта и 45,4 г (0,45 г-моль) триэтиламина в 200 мл диэтилового эфира. Смесь выдерживают 24 ч при комнатной температуре, выпавщий осадок солянокислого триэтиламина отфильтровывают, фильтрат упаривают в вакууме водоструйного насоса и из остатка двукратной вакуумной фракционной перегонкой выделяют 37,7 г (38,4% ) целевого продукта С19Н15О4Р. Т.кип. 115-117оС/0,04 мм рт.ст.; nD20 1,4725; d420 1,1788.
ЯМР31 Р: 52 м.д.
Найдено/вычислено, % : С 49,69/49,54; Н 6,88/6,93; Р 13,79/14,20; МRD 51,86/51,40.
ЯМР1Н: гемдиметильная группа - дублет при 1,30 м.д., 3Jн-р 17,8 Гц; метил при двойной связи - синглет при 1,90 м.д., метиленовая группа эпоксидного кольца - мультиплет с центром при 2,77 м.д.; метиновый протон эпоксидного кольца - мультиплет с центром при 3,26 м.д.; метиленовая группа пропильного заместителя - мультиплет с центром при 4,23 м.д.; этиленовый протон - дублет при 5,13 м.д., 3Jн-р 31,0 Гц.
П р и м е р 2. Получение 2-оксо-2(N-морфолино)-3,3,5-триметил-1,2-оксафосфолена-4(1b).
Из 86 г (0,48 г-моль) 2-оксо-2-хлор-3,3,5-триметил-1,2-оксафосфолена-4, 41,5 г (0,48 г-моль) морфолина и 48,2 г (0,48 г-моль) триэтиламина в условиях эксперимента 1 получают 90 г (81,2%) целевого продукта. С10Н18NO3P. Т. кип. 124-126оС/0,22 мм рт.ст.; nD20 1,4952; d420 1,1592;
ЯМР31Н: 52 м.д.
Найдено/вычислено, % : С 51,81/51,94; Н 8,20/7,85; Р 13,73/13,40. МRD 58,18/58,22.
ЯМР1Н: гемдиметильная группа - два дублета при 1,22 и 1,25 м.д. с 3Jн-р 18,5 и 16,0 Гц соответственно; метил при двойной связи - синглет при 1,86 м.д.; метиленовые группы морфолинового кольца - два характерных мультиплета при 3,11 и 3,55 м.д.; этиленовый протон - дублет при 4,90 м.д., 3Jн-р 29,0 Гц.
П р и м е р 3. Острая токсичность производных 2-оксо-3,3,5-триметил-1,2-оксафосфолена-4.
Оценка острой токсичности при однократном внутрибрюшинном введении препаратов проведена на 90 мышах и 90 крысах. Использованы свежеприготовленные водные растворы. Средние смертельные дозы определены по методу Беренса, их средние ошибки - по формуле Геддама (Беленький М.Л. Элементы количественной оценки фармакологического эффекта. Л.: Медицина, 1963).
Из табл. 1, отражающей результаты токсикологических исследований, видны особенности видовой чувствительности животных к препаратам. Так, морфолиламид (1b) менее токсичен для мышей, чем для крыс, а глицидиловый эфир (1а) - наоборот.
П р и м е р 4. Антибластомная активность 2-оксо-2-(2,3-эпоксипропилокси)-3,3,5-триметил-1,2-оксафосфолена-4 (1а).
Эксперименты проведены на 20 крысах и 20 мышах с перевивными асцитными и солидными опухолями. При солидных опухолях лечение начинали на пятые, а при асцитных - на вторые сутки после трансплантации. Свежеприготовленный водный раствор препарата вводили ежедневно внутрибрюшинно. В качестве критериев эффективности использованы % торможения роста опухоли или накопления асцитической жидкости, а в качестве интегрального показателя токсичности - коэффициент прироста (по В.А.Чернову). Результаты приведены в табл. 2.
П р и м е р 5. Антибластомная активность 2-оксо-2-морфолино-3,3,5-триметил-1,2-оксафосфолена-4 (1b).
Эксперименты приведены на 80 мышах и 20 крысах по схеме, описанной в примере 4. Результаты приведены в табл. 3.
Как видно из сравнительной табл. 4, заявляемые соединения обладают преимуществами перед известными препаратами как по специфической активности, так и по токсическим характеристикам. (56) Система создания противоопухолевых препаратов в СССР и США./ Под ред. Н.Н.Блохина и Ч.Г.Зуброда, М.: Медицина, 1977, с. 20.
Машковский М. Д. Лекарственные средства, ч. 2, М.: Медицина, 1987, с. 437.
Там же, с. 433.
Schroeder D.C. et al. J. Org Chem, 1962, v. 27, N 3, p, 1098.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения замещенных 1,3-оксафосфоленов | 1983 |
|
SU1114681A1 |
| Производное класса N-гликозидов индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов - N-{ 12-(β-D-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с] карбазол-6-ил} пиридин-2-карбоксамид, обладающее цитотоксической и противоопухолевой активностью | 2017 |
|
RU2667906C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-МЕТИЛ-2-ОКСО-2-ХЛОР-1,2-ОКСАФОСФОЛЕНА-3 | 2007 |
|
RU2340620C1 |
| КОМПОЗИЦИЯ АМИНОКИСЛОТ С МИКРОЭЛЕМЕНТАМИ, ОБЛАДАЮЩАЯ ПРОТИВООПУХОЛЕВОЙ И АНТИГИПОКСИЧЕСКОЙ АКТИВНОСТЬЮ | 1994 |
|
RU2125874C1 |
| ПРОИЗВОДНОЕ БЕНЗОТИАЗОЛА ИЛИ ЕГО ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 1992 |
|
RU2041216C1 |
| 4(5)-(3-НИТРО-4-(3,3-ДИМЕТИЛТРИАЗЕНО-1)ФЕНИЛ)ИМИДАЗОЛ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1982 |
|
SU1074091A1 |
| N -ФОСФОРИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ 3- β -ФЕНИЛИЗОПРОПИЛСИДНОНИМИНА, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2036914C1 |
| 5-БЕНЗИЛ-11,13 -ДИМЕТИЛ-2,8,12- ТРИОКСО-1,5,9- ТРИАЗАТРИЦИКЛО [9,3,1,1] ГЕКСАДЕКАН, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1985 |
|
SU1285754A1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АЛКИЛ-(АРИЛ)-2-ТИОНО-1,2- ОКСАФОСФОЛЕНОВ-4 | 1968 |
|
SU218176A1 |
| 2-БИС-( β -ХЛОРЭТИЛ)АМИНО-ИЛИ 2-ФЕНОКСИ-5,7-ДИМЕТИЛ -2,6-ДИОКСО-1,3-ДИАЗА -2-ФОСФААДАМАНТАНЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 1985 |
|
SU1282521A1 |


Использование: в медицине в качестве антибластомного препарата. Сущность изобретения: продукт 2-оксо-2- [2,3-эпокси (пропил)окси] -3,3,5- триметил-1,2- оксафосфолен-4.  , БФ C19H15O4P, выход 38,4% , т.кип. 115 - 117°С /0,04 мм рт.ст.; 2-оксо -2-(N- морфолино)-3,3,5- триметил-1,2- оксафосфолен-4
, БФ C19H15O4P, выход 38,4% , т.кип. 115 - 117°С /0,04 мм рт.ст.; 2-оксо -2-(N- морфолино)-3,3,5- триметил-1,2- оксафосфолен-4  БФ C10H18NO3P , выход 81,2% , т.кип. 124 - 126°С/ 0,02 мм рт.ст. Реагент 1
БФ C10H18NO3P , выход 81,2% , т.кип. 124 - 126°С/ 0,02 мм рт.ст. Реагент 1  . Реагент 2: HR, где
. Реагент 2: HR, где  . Условия реакции в присутствии акцептора хлористого водорода - триэтиламина в среде органического растворителя. 5 пр. 4 табл.
. Условия реакции в присутствии акцептора хлористого водорода - триэтиламина в среде органического растворителя. 5 пр. 4 табл.
Производные 2-оксо-3,3,5-триметил-1,2-оксафосфолена-4 общей формулы
CH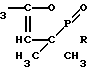
где
R 
 O
O CH
CH CH2
CH2
обладающие антибластомной активностью.
Авторы
Даты
1994-06-15—Публикация
1990-10-16—Подача