Изобретение относится к области биологически активных химических соединений, конкретно к 2-стирил-5,5-диметил-4(5Н)-оксазолонам, обладающим антигипоксическим действием, ослабляющим патологическое влияние гипоксической гипоксии патологического процесса, развивающегося при недостатке кислорода в воздухе.
Указанное свойство позволяет предполагать возможность применения этих соединений в клинической и космической медицине.
Известно использование аминазина, гепарина, метионина, гутимин пирувата, гексенала, цитохрома С, АТФ, ПАД, НАДФ, аденозина, глютаминовой кислоты, γ-оксибутирата натрия в качестве препаратов антигипоксического действия.
Одним из наиболее эффективных является γ-оксибутират натрия. Однако его антигипоксический эффект достигается при высоких дозах.
Целью изобретения является расширение арсенала средств воздействия на живой организм и снижение активной дозы препарата.
Эта цель достигается новыми 2-стирил-5,5-диметил-4(5Н)- оксазолонами формулы I
 (I) где R1 и R2 атом водорода, или R1 метил, R2 атом водорода, или R1- атом водорода и R2 метоксигруппа, в качестве веществ, обладающих антигипоксическим действием.
(I) где R1 и R2 атом водорода, или R1 метил, R2 атом водорода, или R1- атом водорода и R2 метоксигруппа, в качестве веществ, обладающих антигипоксическим действием.
Соединения формулы I получают взаимодействием производного α-оксиизомасляной кислоты формулы II с ангидридом алифатической кислоты в присутствии эквимольного количества 70%-ной хлорной кислоты и последующей конденсацией полученного перхлората III с ароматическим альдегидом с депротонированием образующегося соединения IV.
Взаимодействие проходит по схеме: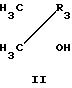

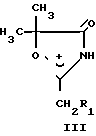 • ClO
• ClO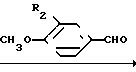
___→ 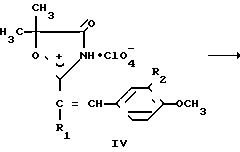
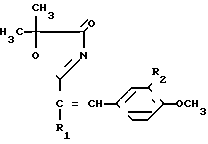
где R1 и R2 имеют вышеприведенные значения и
R3 нитрильная или амидная группа.
Синтез перхлората III осуществляют взаимодействием соединения II с шестикратным избытком уксусного или пропионового ангидрида. Соль IV получают кипячением (10 мин) перхлората III с 20%-ным избытком анисового или вератрового альдегида в смеси уксусного ангидрида и уксусной кислоты (1:1,5). Перхлораты III и IV выделяют в кристаллическом виде при охлаждении реакционной смеси. Продукты не требуют дополнительной очистки для дальнейших синтетических целей.
В качестве депротонирующего агента используют триэтиламин или воду.
Структура и состав синтезированных соединений подтверждены данными элементного анализа, ИК и ПМР спектроскопии.
П р и м е р 1. Получение 2-(4-метоксистирил)-5,5-диметил-4(5Н)- оксазолона (Ia, R1=R2=H).
а) Перхлорат 2,5,5-триметил-4(5Н)-оксазолония (III, R1=H).
К раствору 0,85 г (0,01 моль) ацетонциангидрина (II, R3=CH) в 6 мл уксусного ангидрида прибавляют по каплям 1 мл (0,01 моль) 70%-ной хлорной кислоты и реакционную смесь нагревают на водяной бане 20 мин. Закристаллизовавшуюся при охлаждении смесь разбавляют абсолютным эфиром и получают 2,03 г (92% ) бесцветных кристаллов с т.пл. 180-181оС (разл. из ледяной уксусной кислоты).
Найдено, C 31,56; H 4,27; N 5,97; Cl 15,32
C6H9NO2 ·HClO4
Вычислено, C 31,71; H 4,40; N 6,16; Cl 15,63
ИК-спектр: 3180, 1832, 1610, 1590, 1545, 1100 см-1.
Спектр ПМР (в CF3COOH): 1,42 [6H, c, C(CH3)2] 2,55 м.д. (3Н, с, 2-СН3).
б) Перхлорат 2-(4-метоксистирил)-5,5-диметил-4(5Н)-оксазолония (IV, R1= R2=H).
Смесь 2,27 г (0,01 моль) перхлората III (R2=H), 1,6 г (0,012 моль) анисового альдегида в 4 мл уксусного ангидрида и 6 мл ледяной уксусной кислоты кипятят 10 мин. Выпавший при охлаждении смеси продукт отфильтровывают, промывают абсолютным эфиром и получают 2,8 г (80%) желтых кристаллов с т.пл. 201-202оС (разл. из ледяной уксусной кислоты).
Найдено, C 48,35; H 5,00; N 4,37; Cl 10,80
C14H15NO3 ·HClO4
Вычислено, C 48,69; H 4,63; N 4,06; Cl 10,28
ИК-спектр: 1810, 1630, 1610, 1560, 1100 см-1.
Спектр ПМР (CF3COOH, 20оС, ГМДС): 1,50 (6Н, с, С(СН3)2); 3,62 (3Н, с, ОСН3); 6,62 (1Н, д, J 15 Гц, α -СН=); 8,25 (1Н, д, J 15 Гц, β -СН); 6,77 и 7,55 м.д. (дублеты, J 8,25 Гц, фениленовые протоны).
в) 2-(4-метоксистирил)-5,5-диметил-4(5Н)-оксазолон (Ia).
К 3,45 г (0,01 моль) перхлората IV (R1=R2=H) добавляют 20 мл воды и через 30 мин отфильтровывают 2,45 г (100%) кристаллического продукта желтого цвета с т.пл. 171-172оС (из бентозола).
Найдено, C 68,12; H 6,50; N 5,32
C14H15NO3
Вычислено, C 68,57; H 6,12; N 5,71
ИК-спектр: 1748, 1635, 1610, 1580, 1540 см-1.
Спектр ПМР (CF3COOH, 20оС, ГМДС): 1,50 (6Н, с,С(СН3)2); 3,62 (3Н, с, ОСН3); 6,52 (1Н, д, J 15 Гц, α -СН); 8,20 (1Н, д, J 15 Гц, β-СН=); 6,75 и 7,47 м.д. (дублеты, J 8,25 Гц, фениленовые протоны).
П р и м е р 2. Получение 2-[ α-метил- β-(4-метоксифенил)винил]-5,5- диметил-4(5Н)оксазолона (Iб, R1=CH3, R2=H).
а) Перхлорат 2-этил-5,5-диметил-4(5Н)-оксазолония (III, R1=CH3).
К смеси 1,03 г (0,02 моль) амида α-оксиизомасляной кислоты (II, R3=CONH2) в 7,8 мл пропионового ангидрида прибавляют по каплям 1 мл (0,01 моль) 70% -ной хлорной кислоты и реакционную смесь нагревают на водяной бане 20 мин. Закристаллизовавшуюся при охлаждении смесь разбавляют абсолютным эфиром и получают 1,9 г (89%) бесцветных кристаллов с т.пл. 197-198оС (разл. из ледяной уксусной кислоты).
Найдено, C 34,97; H 5,70; N 5,47; Cl 14,38
C7H11NO2 ·HClO4
Вычислено, C 34,35; H 4,97; N 5,80; Cl 14,73
ИК-спектр: 3170, 1831, 1590, 1515, 1100 см-1.
б) Перхлорат 2-[ α-метил- β -(4-метоксифенил)винил] -5,5-диметил- 4(5Н)оксазолония IV (R1=CH3, R2=H).
Получают описанным в примере Iб способом из перхлората III (R1=CH3) и анисового альдегида. Выход 86% т.пл. 187-188оС (разл. из ледяной уксусной кислоты).
Найдено, C 49.75; H 5,32; N 3,56; Cl 10,23.
C15H17NO3 ·HClO4
Вычислено, C 50,13; H 5,01; N 3,89; Cl 9,88
ИК-спектр: 1820, 1610, 1560, 1100 см-1.
Спектр ПМР (CF3COOH, 20оС, ГМДС): 1,50 (6Н, с, С(СН3)2); 2,12 (3Н, с, α-СН3); 3,67 (3Н, с, ОСН3); 6,75 и 7,55 (дублеты, J 8,25 Гц, фениленовые протоны), 8,10 (1Н, с, β-СН=).
в) 2-[ α-метил- β-(4-метоксифенил)винил]-5,5-диметил-4(5Н)- оксазолон (Iб).
К суспензии 3,60 г (0,01 моль) перхлората IV (R1 CH3, R2=H) в абсолютном бензоле добавляют 1,0 г (0,01 моль) сухого триэтиламина. Через 1,5 ч бензольный слой отделяют, упаривают и получают 2,30 г (88%) кристаллов светло-желтого цвета с т.пл. 78-90оС.
Найдено, C 69,13; H 6,95; N 5,06
C15H17NO3
Вычислено, C 69,49; H 6,56; N 5,4.
ИК-спектр: 1750, 1622, 1610, 1570, 1530 см-1.
Спектр ПМР (CCl4, 20oC, ГМДС), 1,47 (6Н, с, С(СН3)2); 2,22 (3Н, с, α-СН3); 3,80 (3Н, с, ОСН3); 6,82 и 7,38 (дублеты, J 8,25 Гц, фениленовые протоны); 7,70 м.д. (1Н, с, β -СН=).
П р и м е р 3. Получение 2-(3,4-диметоксистирил)-5,5-диметил- 4(5Н)оксазолона (Iв, R1=H, R2=OCH3).
а) Перхлорат 2-(3,4-диметоксистирил)-5,5-диметил-4(5Н)- оксазолония IV (R1=H, R2=OCH3).
Получают описанным в примере Iб способом из перхлората III (R1=H) и вератрового альдегида. Выход (90%), т.пл. 183-184оС (разл. из ледяной уксусной кислоты).
Найдено, C 47,62; H 4,43; N 3,98; Cl 9,84
C15H17NO4 ·HClO4
Вычислено, C 48,00; H 3,80; N 3,73; Cl 9,46.
ИК-спектр: 1802, 1626, 1609, 1581, 1560, 1525 (пл).
б) 2-(3,4-диметоксистирил)-5,5-диметил-4(5Н)-оксазолон (Iв).
Получен описанным в примере 2в способом из перхлората IV (R1=H, R2= OCH3). Выход 2,33 г (85%), т.пл. 189-190оС (из смеси бензол-этанол).
Найденo, C 65,60; H 4,52; N 5,27
C15H17NO4
Вычислено, C 65,45; H 6,18; N 5,09.
ИК-спектр: 1750, 1640, 1608 (пл.), 1591, 1545 см-1.
О противогипоксическом действии исследуемых соединений судили по их влиянию на среднюю продолжительность жизни мышей при относительно медленно развивающейся гипоксической гипоксии. Животным внутрибрюшинно вводили испытуемые вещества в дозах 25 мг/кг и 50 мг/кг. В качестве растворителя использовали диметилсульфоксид. Через один час после введения препаратов, животных помещали в гермокамеры емкостью 0,5 л. О моменте гибели судили по остановке дыхания. Первой группе контрольных животных внутрибрюшинно вводили дистиллированную воду, второй группе диметилсульфоксид в объемах, равных объемам растворов инъецированных препаратов. По влиянию на среднюю продолжительность жизни исследуемые соединения сравнивали с активностью широко используемого в медицинской практике γ-оксибутирата натрия (ГОМК), вводимого в дозе 200 мг/кг. Острую токсичность препаратов определяли в опытах на мышах по методике Беренса. Устанавливали величину ЛД50 и величину максимально переносимой дозы.
Результаты испытаний
Как показали опыты на 174 мышах, соединения Ia N гос. регистрации 1984178, Iб N 1984278 и Iв N 1984378 в дозах 25 мг/кг и 50 мг/кг статистически достоверно увеличивали среднюю длительность жизни мы- шей (см. таблицу), что свидетельствует о наличии у этих веществ противогипоксической активности. Изменения средней длительности жизни под действием доз 25 мг/кг и 50 мг/кг практически не разнятся, поэтому в таблице приведены результаты, полученные при испытании дозы 25 мг/кг. В таблице также приведены данные о влиянии на величину средней продолжительности жизни γ-оксибутирата натрия в дозе 200 мг/кг.
При сравнении обращает на себя внимание высокая противогипоксическая активность препарата Iв, который превысил среднюю длительность жизни контрольной группы на 65% Менее эффективными оказались препараты Ia и Iб, увеличивающие среднюю длительность жизни по сравнению с контролем, соответственно на 28% и 12%
При сопоставлении противогипоксической активности новых соединений с аналогичной активностью широко используемых фармакологических препаратов (оксибутират натрия), учет средней длительности жизни животных производили по отношению к контрольной группе, которой вводили дистиллированную воду. Как видно из таблицы, противогипоксическая активность новых препаратов незначительно отличалась от противогипоксической активности γ -оксибутирата натрия, а у препарата Iв превосходила ее. Однако, если учесть, что доза оксибутирата натрия, вызывающая наркотический и противогипоксический эффект (200 мг/кг), в восемь раз превосходит антигипоксическую дозу исследуемых соединений, можно считать, что исследуемые соединения относительно активнее γ-оксибутирата натрия, и к тому же не обладают наркотическим действием.
Результаты исследования острой токсичности показали, что ЛД50препарата Iб составляет 534 ±54,3 мг/кг, препарата Ia 828±64,2 мг/кг. Ввиду низкой токсичности ЛД50 препарата Iв не устанавливалась. Выявлена максимально переносимая доза этого соединения, имеющая величину 1310 ±125 мг/кг.
Таким образом, исследуемые соединения Ia, Iб, Iв обладают, при сравнительно низкой токсичности, явно выраженной противогипоксической активностью в дозе значительно ниже эффективной дозы широко используемого в медицинском аспекте противогипоксического средства γ -оксибутирата натрия.

2-Стирил-5,5-диметил- 4(5Н) -оксазолоны формулы 1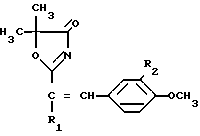
где R1 и R2 - атом водорода, или R1 - метил и R2 - атом водорода, или R1 - атом водорода и R2 - метоксигруппа, обладающие антигипоксическим действием.
2-Стирил-5,5-диметил- 4(5Н) -оксазолоны формулы 1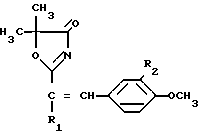
где R1 и R2 атом водорода, или R1 метил и R2 атом водорода, или R1 атом водорода и R2 метоксигруппа, обладающие антигипоксическим действием.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Шашков В.С | |||
| и др | |||
| Противогипоксические средства | |||
| (обзор литературы), Фармакология и токсикология, N 4, 1977, с.504-509. | |||
Авторы
Даты
1996-05-27—Публикация
1978-12-13—Подача