Иредлагается способ получения новых соедипений нафтиридинового ряда, которые могут найти применение в фармацевтической промышленности. Использование известных в органической 5 химии условий проведения процесса окисления, например пермапгапатом калия применительно к соединениям нафтиридинового ряда дало возможность получить новые соединения общей формулы10 где RI - Водород, низший алкил, низший алкоксил, фтор, хлор, бром, трифторметил или 25 нитрогрунна; R2 - водород, хлор, низший алкил или низший алкоксил; Кз - метоксигруппа или оба Rs вместе - метилендиоксигруппа, обладающие высокой биологической активностью, Предлагаемый способ заключается в том. что соединения общей формулы где RI, Rs и Ra имеют указанные значения и цис-связапы в положеппях 4а, 106, подвергают окислепию, например, перманганатом калия в среде ипертного оргапического растворителя. В качестве растворителя используют, папример, циклические простые эфнры, такие как диоксан, низшие кетопы, такие как ацетон. В качестве окислителей молсно применять также двуокись ларганца, ацетат ртути, хромовую кислоту.
Низшие алкильпые и алкоксигруппы в радикалах Rt и Rz состоят из 1-4 атомов углерода, иредиочтительпо из 1-2 атомов углерода.
Полученные соединения могут быть иереведеиы с иомотцью иеоргаиических или оргаиических кислот в соответствуюнхие соли.
Пример 1. tfuc-l,2,3,4,4:a,lQb-VcKcan-i:{po8,9-диметокси-2-метил-6-феиилбеизо- с 1,6 нафтиридии.
А. г{ыс-1,2,3,4,4а,5,6,106 - Октагидро-8,9-дпметокси - 2-метил-6-фенилбензо- с 1,6 -иафтиридии.
5 г г(«с-4-амино-3-(3,4-диметоксифенил)-1метилпииерадин-дигидрохлорида и 7 г беизальдегида иагревают до 100°С в 50 мл копцентрированиой соляной кислоты и 50 мл диоксаиа в течение 16 час. Реакционную смесь затем сильио концентрируют в вакууме, разбавляют вОхТ,ой и водную фазу экстрагируют для удаления избыточиого беизальдегида два раза простым эфиром. Водную фазу доводят до щелочной реакции ири номон,и разбавлеиного раствора гидроокиси натрия (рН 12) и экстрагируют три раза метиленхлорндом. После высушивания соедииенных органических фаз над сульфатом натрия и вынаривапи в вакууме досуха остается сырая смесь диастереоизомеров, которую можио иснользовать для осуществления следующей стадии без дальнейшей очистки.
Б. г{«с-1,2,3,4,4а,10&-Гексагидро-8,9-диметокси-2-метил-6-фенилбеизо - с 1,6 -нафтиридии.
1 г иолучеииой в нункте Л смеси диастереоизомеров растворяют в 10 мл диоксана и к пей прибавляют ири комнатной темнературо раствор 0,5 г пермаигаиата калия в 15 мл воды в течение 15 мин но каилям. 30 мни сиустя раствор отфильтровывают от выиавигей двуокиси марганца, фильтрат вынаривают досуха, остаток расиределяют между метиленхлоридом и водо1, оргатшческую фазу иад сульфатом натрия и вынаривают в вакууме досуха. Получа оиин 1ся масляиьи остаток растворяют в 5 мл абсолютного сннрта и осаждают нутем введеиня хлористого водорода дигидрохлорид иолучаемого ве1н,ества. Из него выделяют синтезируемое соединение обычиым образом и кристаллизуют из уксусного эфира/петролейиого эфира, т. ил. 126-128°С.
Пример 2. ,2,3,4,4а,10/;-Гексагидро8,9-диметокси-2-метил-6-феии.лбензо- с 1,6 иафтиридин.
К раствору 2 г иолучешюй по нриме)у 1.Л смеси диастереоизомеров в 30 мл воды и 3 м.т уксусной кислоты прибавляют 10 г ацетата ртути (II) и кннятят 10 час с обратным холодильииком. Выиавгний ацетат ртути (I) отфильтровывают и из фильт)ата осажда от имеющиеся еще ионы ртути серогюл,ород()м. После фильтрования реакциоииую лгассу доводят до щелочной реакци) иатровым нлелоком и экстрагируют метиленхлоридом. Из нродукта-сырца выделяют получаемое соединение путем хроматографирования иа колонне (силикагель) и кристаллизуют его, как в
нримере 1, т. ил. 126-128Т..
Пример 3. .(«с-1,2,3,4,4а,06-Гексагидро8,9-диметокси-2-метил-6-феиилбеизо- с 1,)тиридии.
1 г иолученной но примеру 1А диастереоизомерной смеси иагревают до кииения в 20 мл толуола в присутствии 5 г активированного угля 24 час с обратным холодильником. После удаления иеоргаиического материала путем филь-1роваиия раствор выпаривают досуха и
остаток распределяют между метилегьхлоридом и водой. Органическую фазу выиаривают в вакууме и полученный таким образом остаток хроматографируют иа силикагеле. После кристаллизации, как оиисаио в примере 1, получают указаиное соедииеиие, т. пл. 126- 128С.
Пример 4. ,2,3,4,4а,106-Гексагидро8, 9-диметокси-2-метил-6-феиилбеизо- с 1,6 нафтиридин.
К 1 г полученной по примеру 1А диастереоизомерной смеси, раствореппой в 10 мл воды и 0,2 мл серной кислоты, ирибавляют раствор 2 г бихромата патрия в 5 мл .воды и 1,2 мл
коицентрированной серной кислоты. Реакционную массу зате.м иагревают 3 час до 80°С, потом доводят до щелочной реакции иатровы.м щелоком, фильтруют и остаток на фильтре промывают иитеисивио метилеихлоридом.
Органическую фазу отделяют, сушат над сульфатом патрия и вынаривают. Соедииеиие получа;от в чистом виде из сырой реакциоииой смеси иутем хроматографировапия иа силикагеле, т. пл. 126-,128°С.
Аналогичио описаппым примерам можио получить следующие соедииеиия:
{ас-6-(3,4-дихлорфеиил) - 1,2,3,4,4а,10&-гексагндро-8,9-диметокси - 2-метилбеизо- с 1,6 нафти 1пдпи, т. ил. 183-184°С;
,2,3,4,4а,10&-гексагидро - 8,9-диметокси6-(3,4-диметоксифеиил) - 2-метилбепзо - с ,6 -иафтиридин, т. ил. 199-201°С;
.{wc - 1,2,3,4,4а,106-гексагидро - 8,9-диметокси-2-метил-6-(4-иитрофенил)-бецзо - с 1,6 пафтнридин, т. пл. 194-19 э°С, т. пл. дигидрохлорида с 225 по 230°С;
/Шб-1,2,3,4,4а,106-гексагидро - 8,9-диметокси-2-метил-6-(я-толил) - 6eii3o- c 1,6 -нафтиридин, т. пл. дигидро.хлорида 257°С;
;{ыс-1,2,3,4,4а,106-гексагидро - 8,9,-диметокси-6-(4-метоксифеиил - 2-метилбензо- с 1,6 нафтиридии, т. пл. дигидрохлорида 250-
252°С;
- 6-(4-хлорфеиил) - 1,2,3,4,4а,106-гексагидро-8,9-диметокси - 2-метилбензо- с 1,6 пафтиридип, т. пл. дигидрохлорида 245°С (разложеиие);
ijuc - 6-(2-хлорфеиил) - 1,2,3,4,4а,106-гексагндро-8,9-диметокси - 2-метилбепзо- с 1,6 иафтиридин, т. пл. 223-226°С (разложение);
г «с-б-(4-фторфенил) - 1,2,3,4,4а,106-гексагидро-8,9-диметокси - 2-метилбепзо- с 1,6 иафтиридии, т. пл. 250-255°С;
цис-1,2,3,4,4а,10Ь - гексагидро-8,9-диметокси2-метил-6-(3-трифторметилфенил) - беизо- с 1,6 -нафтиридин, т. пл. дигидрохлорида 215- 217°С;
цис - ,2,3,4:,4а,ОЬ - гексагидро-2-метил-8, 9метилендиокси- с 1,6 -иафтиридин, т. пл. дигидрохлорида 248°С (разложение);
цис-,2,3,4,4а,10Ь - гексагидро-6-(3,4-диметоксифе11ил)-2-метил-8,9 - метилендиоксибен30- с 1,6 -нафтиридип, т. пл. б«с-гидрогенмалеинатов 193-194°С.
Предмет изобретения
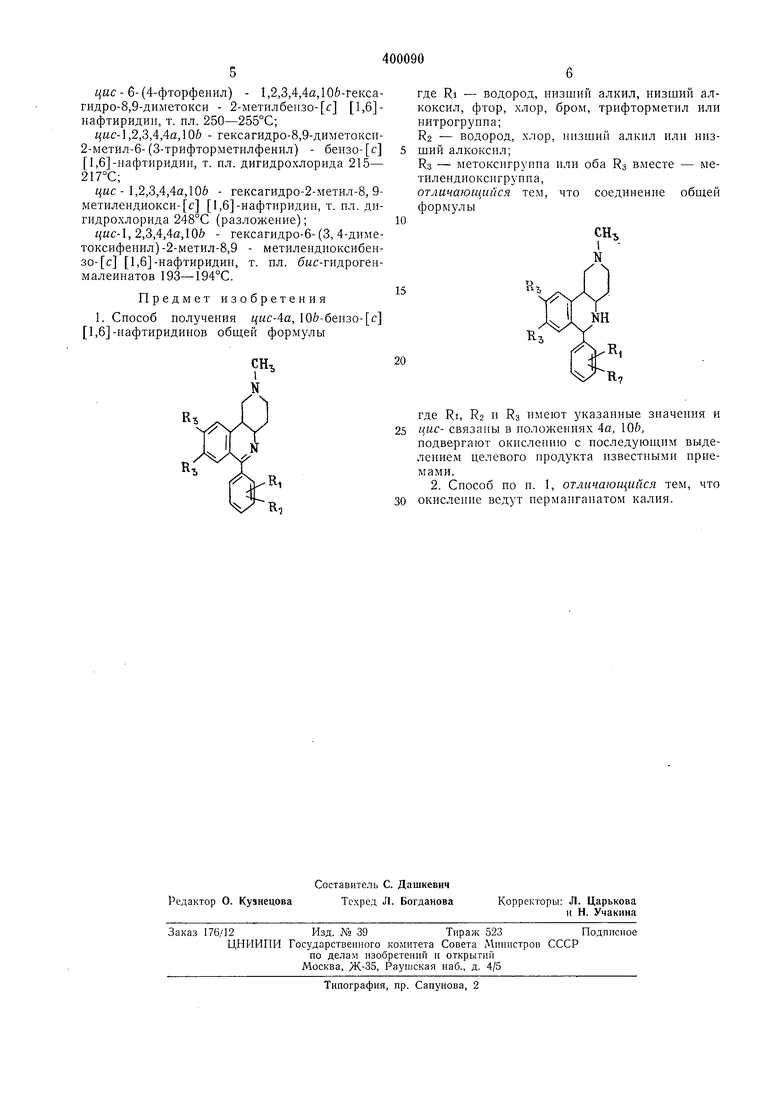
1. Способ получения цис-4а, 10&-бензо- с 1,6 -нафтиридинов общей формулы
где RI - водород, низший алкил, низший алкоксил, фтор, хлор, бром, трифторметил или нитрогруппа;
Кз - водород, хлор, низший алкил или низший алкоксил;
Ra - метокснгрунпа или оба Rs вместе - метилепдиоксигрунпа,
соединение
отличающиися
тем.
что формулы
Б.
где RI, R2 и RS имеют указанные значения и цис- связаны в положениях 4а, ОЬ,
подвергают окислению с последующим выделением целевого продукта известными приемами.
2. Способ но п. I, отличающийся тем, что окисление ведут перманганатом калия.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БЕНЗО-[с] [1,6]-НАФТИРИДИНОВ | 1971 |
|
SU423296A3 |
| ВСЕСОЮЗНАЯ | 1973 |
|
SU374824A1 |
| ПРОИЗВОДНЫЕ ПИРИДО(2,1-А)ИЗОХИНОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ DPP-IV | 2002 |
|
RU2297417C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОНДЕНСИРОВАННЫХ ТРИЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ | 1973 |
|
SU408473A1 |
| Способ получения производных пиперидина или их солей | 1975 |
|
SU634665A3 |
| вСЕСОЮЗНАЯ/ | 1973 |
|
SU376942A1 |
| Способ получения пиридоиндолов | 1974 |
|
SU592359A3 |
| Способ получения производных бензоциклогептаизохинолина | 1971 |
|
SU451242A3 |
| Способ получения транс- а-фенил/зАМЕщЕННый фЕНил/- A- ОКТАгидРО- - -пиРиНдиНОВ или иХСОлЕй | 1978 |
|
SU841586A3 |
| ОПТИЧЕСКИЕ ИЗОМЕРЫ (+)- И (-)-ТРАНС-2,3,4,4a,5,9b-ГЕКСАГИДРО-2,8-ДИМЕТИЛ-1Н-ПИРИДО[4,3-b]ИНДОЛА | 2005 |
|
RU2330852C1 |


Авторы
Даты
1973-01-01—Публикация