1
Изобрете;1ие относится к области получения аддуктов перфторалки.тиоднда-олеф:}и1а, имеющих в перфторалкильном остатке 6-24 атомов углерода и замещенных алифатическим или ци.клоалифатическим олефином с числом углеродиых атомов яе более 12.
Эти соединения, раиее не описанные в литературе, представляют собой важные промежуточные продукты, которые используются в качестве новых мономеров. Наличие в указанных соединениях та;ких функциональных групп как амидная, сложноэфирная позволяет получать поли.меры с улучщенными свойствами. Эти соединения используются для отделки текстильных материалов, бумаги и т. д.
Способ получения указаиных соединений основан на известной взаимодействия перфторалкилиодида с олефином в присутствии катализатора-соли металла и амина при повыщенных температуре .И давлении.
Ио предлагаемому способу перфторалкиллодид с числом углеродных атомов в перфторалкильном остатке подвергают взаимодействию с алифатическим или циклоалифатическим .или замещенным алифатическим или циклоалифатическим олефином с числом угеродных атомов не более 12 с последующим выделе}1ием целевого продукта известными приемам.
Процесс осуществляют при температуре 0°-350°С, дапленщ О-200йгг/ в пржутствии амина и соли металлов групп 1а-IV а или 16-Vni6 периодической системы элементов. 1 моль нерфторалкилиодида подвергают взаимодействию с 1 -10 молями соединения, содержащего двойиую связь, в присутствии 0,05-10 молей амина и 0,003-20 молей соли металла.
Используемые в данном процессе перфторалкилиодиды могут быть моно-, так и диидидамн. Эти нерфторалкилиодиды представляют собой разветвлеииые ил)1 иеразветвле)ные перфторалкилаюдиды с 16-18, предпочтительно с 6-14 атомами углерода.
В качестве второго компонента используют замещенные функциональными группами а.ткеиы, содержащие 2-6 атомов углерода, или замещенный стирол.
Замещенными функциональными группами алкенами являются, например аллиловый
спирт, ВИИИЛХЛОрИД, ВИИИЛИДеНХЛОрИД, В31НИЛфторид, винилиденфторид, винилацетат, 1/ 2-дихлорэтен; сложные эфиры, например низшие алкиловые эфиры, и амащы акриловой, метакриловой, кротоиовой, малеиновой, фумаровой или нтаконовой кислот, в частности алл;;1лфармиат, и аллилацетат, диаллилфумарат и диаллилитаконат дивипилфумарат и дивинилитаконат.
Полученные в данном процессе аддукты часто являются изомерными смесями, в которых перфторалкилостато.к может присоеднпяться, как к а - так и ,к р-атому углерода этиленовоненасыщекной связи олефииа. Для ясности в большинстве случаев указана только одна изомерная форма.
Амины, которые п рименяют в данном ироцеосе-тпервнч«ы€, вт оричмые третичные алифатические, гетероциклические или ароматические амины. Предпочитают амины, которые содержат по меньшей мере один атом кислорода -в молекуле. Особенно пригодны а.мины, которые содержат одну гидроксильную группу в молекуле. Амины, способные к образованию амфотерпых конфигураций, как например ал:каноламины, особенно интересны.
Такие алканоламмны содержат пред почтительно 2-б атомов углерода.
Следует назвать, например, следующи-еа.мины: N-этилэтаноламин, аминоэтилизопропаноламин, днэтилэтаноламин, Н-(2-оксиэт1Ил)этнлендиамин, .изопропаноламин, триизопропаноламин; К-этилэтаноламии, N-метилэтаноламин, в частности диэтаноламин, триэтаноламин, .и предпочтительно моноэтаноламин. Кроме того, принимают во вннмание и такие амины, как N-оксиэтилморфолнн, морфолин, Ы-0;КСиэтилп1И1пераз 1н, 3-диэтиламинофенол, глицин или диэтил-амии.
В числе применимых в данном процессе солей металлов пригодны прежде всего соли металлов лрупп 16-VII16, в частности с 4-го ио 6-ой периоды периодической системы. Соли металлов прупп 16 и 116 особенно пригодны, как например, соли меди {), серебра, золота, дин«а, кадмия или ртути. Другими предпочтительными солями металлов являются соли металлов групп III6 или VIII6, в частности 4-го или 5-го периода, или металлов групп IV6 или V6, в частности с 4-го по 6-ой периоды периодической системы. Речь здесь.идет о солях кттр я, титана, циркония, ниобия, тантала, маргатца, железа, рутения ИЛ1И родия.
Пригодными представителями металлов группы la являются, например натрий или .калий и группы На, например магний, кальций, стронций или барий. К металлам группы Illo принадлежит галлий, таллий и индий и к прутпе IVa германий, олово или свинец.
Особенно пригодными оказались такие галогениды, как бромиды, йодиды или предпочтительно хлориды соответствующих металлов. Кроме того, могут быть применены и соответствующие фосфаты, карбонаты, нитраты, сульф,аты, цианиды, гидриды, ацетил ацетон аты пли алкоголяты, например этплаты или метилаты. Можно также применять смеси солей, даже металлов разной валентности.
Особенно пригодным оказался хлорид меДИ (I).
Реакцию можно проводить в отсутствии или в присутствии растворителя. Подходящими растворителями являются, например, фторированные галоидалканы, спирты, простые эфиры, ароматические углеводороды или циклоал.кен.
Пример 1. 500 г теломеризата перфторалкилиодида, состоящего из 30%; н-перфторгексилиодида, 46%; н-перфтороктилиодида, 20,5% н-лерфтордецилиодида и смеси перфторалкилиодндов €4, , Си, загружают вместе с 1 г CuCl и 5 г этанола.мина в авто-клав из стали высокого качества емкостью л. Потом .подают избыток этилена. Автоклав нагревают до 140°С в течение 45 ишн и выдерживагот при этой температуре в течение 45 мин. Уже незадолго до получееия реа;кц«онтой температуры да/влевне в автоклаве нач:итает .снижаться от 138 до 130 ати «i через 30 мин Становится постоялнькм.
530 г твердого, воскообразного вещества выгружают из автоклава и дистиллируют в вакууме. При этом выделяют общую фракцию 484 г (т. кип. 29 до 150°С при 5 мм рт. ст.) полутвердого, белого вещества.
22 г ИСХОД1ЮГО материала выделяют из холодильной ка.меры. Газохроматографические и масс-.снектрометрические анализы дают следующие результаты:
М 474 СРз(СР2)5СН2СН2Л 36%, М 574 CF3(CF2)7CH2CH2J 34,5%. М 674 CF3(CF2)9CH2CH2J 9,8%. М 502 CF3(CF2)5(CH2)4J 8,2% М 602 CF3(CF2)7(Cl-l2)4J 8,7%. М 702 CF3(CF2)9(CH2)4J 2,0%+за рязнения, где М - молекулярный вес.
Выход перфторалкилнодида (М 574), рассчитанный на прореалировавщий исходный материал () но исходному уравнению
484 пг л го/
-, „ 90,41 7о от теоретического.
Пример 2. 500 г теломеризата перфторалкилиодида, состоящего ai3 30% н-нерфторгексилиодида, 46% н-иерфтороктилиодида, 20,5% н-.перфтор.децилнодида ш с.меси перфторалкилиодидов С4, Ci2, Си, загружают -вместе с 1 г CuCl и 5 г этанола мина в автоклав емкостью il л из стал.и повышенного качества и подают избыток пропилена. В течение 45 мин автоклав иагревают до 140°С и оставляют при этой тем.пературе в течение еще 45 мин. По достиженни реакционной температуры давлениеснижается в течение20 мин от 20 до 15 аги 31 до о.кончания реакции остается постоянным.
500 г светло-коричневого вязкого вещества выгружают из автоклава и дистиллируют в вакууме. При этом выделяют общую фракцию 460 г (т. кип. 33-150°С, 10 мм рт. ст.) жидкотвердого вещества. 33 г исходного материала выделяют из холодильной камеры. Газохроматограф ич еские ;и .масс-спектрометрические анализы дают следующие результаты:
СНз
М 488 CF3(CF2)5-СИ.-СН-J 40% .М 588 СРз(СР2)7-СНз-СН-J 51,3% СНз -J 8,7%. (CF2)o-СНг-СИ688 С Fa Вы.ход надфторалкилиодида () рассчитан ia прореагировавший исходный материал () по исходному уравнению. т 96,27%: от теоретического. При м е р 3. 54,6 г теломеризата перфторалкилиодида, состоящего из 30% н-перфторгексилиодида, 46% и-перфтороктилиодпда 20,5% н-перфтордецилиодида и смеои перфторалкилиодидов С, Ci2, См вместе с 11,2 г Л тетрагидробе1 зиловым спиртом загружают в автоклав емкостью 3000 мл из стал-и повышенного качества. В качестве катализатора берут 100 лг CiiCl и 1 г этаноламина. Реакционную массу нагревают до 100°С, вследствие чего быстро повышается температура в автоклаве до 150-160°С. В течение 90 мин реакиия идет при этой температуре. Давление составляет 2 ати. По охлаждении автоклава получают 5 г темпо-коричневого жидкого вешества. Этот продукт-сырец растворяют в 250 мл диэтилового эфира и трижды промывают 50 .1/л воды, сушат над сульфатом натрия и простой эфир дистиллируют. Дистилляцией в вакууме 58 г очиш.енного вещества получают: Отброшен На основании масс-спектра фракции 2, имеющего характерные пики (М 558, 658, 758), соединение можно идентифицировать и представить формулой |.где п--5,7,9 CHgOHj Выход продуктов из фракций I и 2 описанной реакции, рассчитанный на средннй молекулярныи вес Ьо8, составляет ,- 33,5% от теоретического. Пример 4. 54,6 г теломеризата перфторалкиллодида, состоящего из 30% н-перфторгексилиодпда, 46% н-перфтороктилиодида, 20,5% н-перфтордецплиодида н смеси перфторалкилподидов С4, Cjo, Ci4 загружают .вместе с эноксило г в автоклав из сн-сн сн. СНтО/ стаЛП новышеиного качества емкостью 300 .и.г. В качестве катализатора берут 100 мл CuCl и 1 г траэтаноламнна. В Teneiine 135 .i/;/M реакцню проводят при 40-158°С и потом прекращают. Давление 1 атм. 97 г KOpiiMiicBoro продукта-сырца растворяют в 250 мл простого эфира }1 П|рол1ЫБают три раза водо11 по 50 ..ы, сушат над сульфатом натрня и отгоняют простой эфир. Выход 95 г, что составляет 937о от теоретического. Рассчитан на соедипс-ше формулыIJ / -fH-CH..jjCF, .V 742 п 7. Содержаиле эноксида составляет 100%. Записью массового спектра получают М+Н 643, 743, 843 М-Н 641, 741, 841, а также относящийся сюда ряд распада, который нач.инается с М 515, 615, 715. npiiMep 5. 54,6 г теломернзата перфторалкилиодида, состоящего из 30% н-перфторгексилиодида, 46% и-перфтороктилиодида, 20,5% н-перфтордецилиодида и смеси перфт0 ралкил;1одндов С, , Си, загружают в.месте с 5,8 г аллилового спирта в автоклав из стаЛИ повышенного качества емкостью 300 мл. в качестве катализатора используют 100 мг Cud и 1 г этаюламнна. Автоклав нагревают до 100°С, вследствие чего температура реакции быстро повышается до 140-155°С. Эта температура сохраняется в течение 120 мин. Давление 2 атм. По охлаждении автоклава получают 50 г коричневого вяЗКОго вещества. Это вещество дистиллируют в вакууме. ХолодильнаяИс.ходиый камера 17 гматсрма.ч фракция 1 29 ; 2 мм рт, ст. 40-ПО С Реакционный с помощью масс-снектроскопни фракции 1 идентифицируют соединение формулы СРз(СР-,)пСИ,-СН-СН.ОИ , J
где n 3, 5, 7,
М 504, 604, 704.
Выход, рассчитанный «а средний .молекулярный вес 604, составляет
29 ,0% от теоретического.
Пример 6. 55 г соединения формулы
J
СРз(СР2)п-СН2-С-СООСНз ,
СНз
где , 7, 9, растворяют в смеси 100 мл этил ацетата и 20 мл ледя-ной уксусной кислоты.
К раствору Прибавляют 6 г цинковой пыли и в течение 5 мин вводят газообразный НС1 со скоростью 20 пузырьков в 1 мин. Реакционную смесь в течение 5 мин выдерживают гари температуре обратного потока, потом охлаждают, фильтруют л раствор концентрируют. Остаток дистиллируют в высоком вакууме и получают 18,6 г вещества кремового цвета. Т. пл. 167-204°С при 0,1 мм рт. ст.
Выход составляет 42%; от теоретического.
Записью массового oneKTipa (М 420, 520, 620) подтверждается следующая структура
CF. (CFs) n-СН,-СН-СООСНз
СНз « 5,7, 9
Приведенный сложный эфир можно перевести в свободную кислоту путем омыления.
По описанному примеру получают л другие сложные эфиры, например
Нг-СНг-СН--СООСНз- RF-СН,-СН,-СООСНз
Rr-СНг-СН-(СН2)8-СООСНз--Rr-(СНо),о
J -СООСНз
j-C J-сооснГЧ ЛсоосНз
RF GF3(CF,)n п 5, 7, 9, 11
Примеры 7-72. Вычисление оптимального выхода по примеру 7.
Во всех примерах (7-72) берут для реакции 150 г (0,3 ) теломеризата 5 перфторалкилиодида, состоящего «з 23,5%, н-перфторгексил«одида (), 44,9%: иперфтороктилиодида (М -546), 32,1%; н-перфтордецилиодида (М 646), 2,0%: н-перфтордиодецилиодида и смеси других перфториро0 ванных соединений, и 68 г (0,6 ) октена-, проводят опыт по примеру 1 и получают 36,04 г октеиа-1 (107%), 5 г перфторалкилиодида (3,4%) и 141,25 г реакционного продукта.
5 Продукт идентифицируЕОт с помощью газовой хроматографии и масс-спектрометрии.
Оптимальный выход продукта, полученного из 145 г (150-5) исходного перфторалкилиодида составляет n
141,25 . -pry-- 79,58% от теоретического.
177,48 г соответствуют теоретическому (выходу при 100%,-ном взаимодействии. Выходы рассчитаны на средний молекулярный вес перфторалкилиодида 546, используемое количество перфторалкилиодида составляет 96,6%, да.нные в процентах для используемыхолефинов указаны.
В примерах 7-72 в качестве исходного продукта применяют перфторалкилиодиды СРз(СР2)пЛ, где п 5, 7, 9, 11.
В . 1 приведены названия ил.и форму5 лы использованных в примерах 7-72 олефинов и конечных продуктов.
В табл. 2 приведеиы условия и результатг Е опытов примеров 7-72. В табл. 3 приведены данные по проведению опыта примера 73. 0
Обозначения, принятые в табл. 2:
ЭА - этаиоламии ДЭА - диэтаноламин ТЭА - триэтаиоламин
- окись алюм1иния для хроматографии
SiOo-силикагель для использования в распределительной хроматографии, кизельгур или молекулярное сито
Rf - перфторалкилостаток.
Использзе.мый олефмп
Пример Л2
Октен-1
Т а б л 11 ц а I
Конечный продукт
СРз(СР2)п-СН-СН (СН,)5СНз
I J
О СНгОС-СНf Bf- iiil
j-fjLcH.occH-,






| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения перфторалкилалкильных сложных эфиров ненасыщенных карбоновых кислот | 1973 |
|
SU516342A3 |
| Способ получения кремнийорганических соединений | 1975 |
|
SU612633A3 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ «-ЙОДПЕРФТОРМОНОКАРБОНОВЫХ КИСЛОТ | 1971 |
|
SU322983A1 |
| Способ получения бензимидазолкарбаматов и его вариант | 1979 |
|
SU1169532A3 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРЗАМЕЩЕННЫХ КИСЛОРОДСОДЕРЖАЩИХ СОЕДИНЕНИЙ | 1971 |
|
SU311892A1 |
| СПОСОБ МОДИФИКАЦИИ СИЛОКСАНОВОГО КАУЧУКА | 1987 |
|
SU1746690A1 |
| ФТОРЭЛАСТОМЕРЫ | 2005 |
|
RU2383555C2 |
| ФОТОГРАФИЧЕСКИЙ МАТЕРИАЛ | 1972 |
|
SU341260A1 |
| СПОСОБ ПОЛУЧЕНИЯ АНАЛОГОВ ПРОСТАГЛАИДИНА Ео | 1972 |
|
SU330616A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРФТОРАЛКИЛИОДИДА ВЫСОКОГО МОЛЕКУЛЯРНОГО ВЕСА | 1974 |
|
SU440819A1 |

СН2 С-С-ОСНз
12-15
; и
СНзО
16-20
СН2 СНСООСНз
21
Сложный диметиловыП эфир маленновой кислоты
22
Днмстнловый эфир нтаконовой кислоты
-CHjOH
26
СНзСН СНг 32
С.Г12 C-H2
СИг СН-СНгСООСНз 45 СНз-СИ СН-СООСНз
5
Кр- Г-ПГз
- -с-сооск,. J-N-cff.
Кр- рсп-СООГНз
j-jL/H,
1 г fi
IV; j-c-coocfb j-| -c-cnociij
All
R F-CH,-CJ-СООСНз СНа-СООСНз
1чр
CKjOIi
СНз СРз(СР,)„СН.,-СН
I j
RpCHjCHaJ
RF-СНг-СНСООСНз J
Rr-CH-CH-COOCHs
I I СНз J
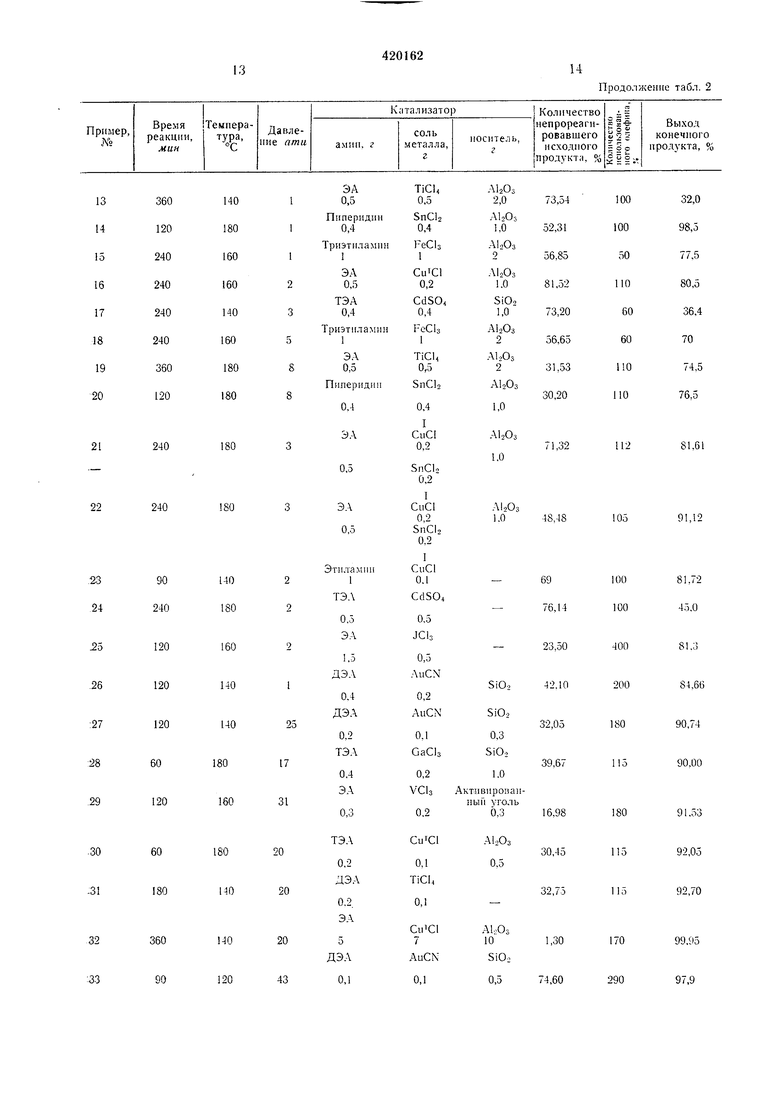
Таблица 2
13
14
Продолжение табл. 2
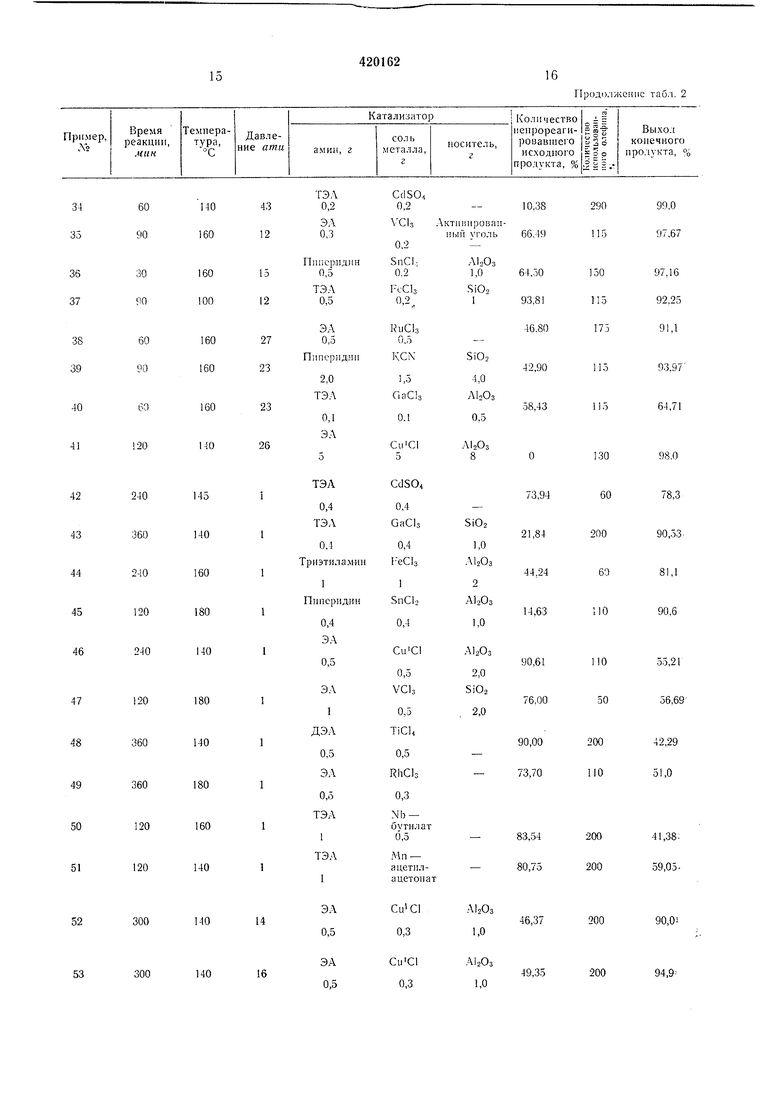
15
16
Прод|)л ксп11С табл. 2
17
18
Продолжение тпбл. 2
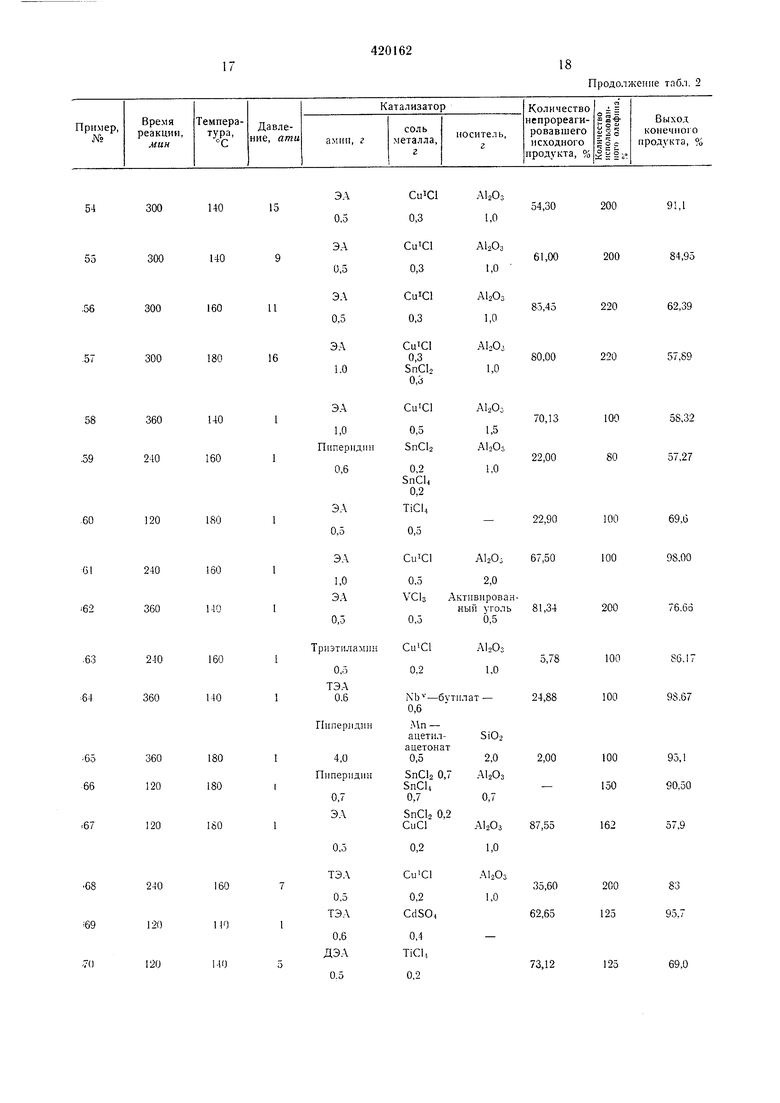
19
180
10
60
10
) продукт примера 71 содержит , КгСИо-СМ--СМ2
) Конечный продукт примсрл 72 содержит -- 59Ь RrCIl2-СМ-Clb В последних каталнзатора отшеиляет HJ из аддукта R кСМа-СМ-СМзОМ реакции, кроме выделенного эиоксида, оГ))азу1отся смолистые иобочн1 1с н юдукты. к
20
8(),3
-iOO
-о/
J
Т а б л к и. а 3 в) Газовая хроматограмма: 75,9% C7Fi5OH C 19,6% CjFisC-CM-СНз 2,9% С7Р,5-СН,-С (сНз + небольшие колнчеетва примесей других соедииеннй. Предмет изобретениякилыюм остатке 6-24 атомов углерода и за1. Способ получения аддукта перфторал- ческим радикалом с числом углеродных атолиодида-олефина, имеющего в перфторал- мов ие более 12, отличающийся тем, что, /СНз Л1еще«ного алифатическим или цикоалифати21фтора.жилиодид с числом углеродных атомов в перфторадкильном остатке 6-24 подвергают взаимодействию с алифатическим или циклоалифатичеоким или замещеиным али4)ати1ческим или циклоалифатическим олефи-5 ном с чисом углеродных атомов не более 12 22 при температу-ре 0°-350°С н давленц) 0-200 ати в присутствии амина и сол-и металла групп lo-IVа или 1 б-VIII б иериодическ-ой системы элементов а качестве катализатора, с последующим выделением целевого продукта известными приемами.

Даты
1974-03-15—Публикация
1971-08-19—Подача