R.
X
r- VT
Re
где R.T, R4, Rs, Rg - водород или алкил с 1-4 углеродными атомами, или А - триметилеи, д;кклоге1шилен- ,2-:Ц1И1клогек€ен;иле н - 1,2-1,ИКлогексадибнилеи-1,2 или о-фен.илен.
Способ состоит в том, что моно- N-(3,5-4Hгалогенфе1нил)-амиддикарбо1103ой кислоты общей формулы
О -NH-CA-COOH
подвергают дегидратации при температуре 20-250° С.
В качестве дигидрат.ирующего агента можно применять ангидрид кислоты, пят.ихлористый фосфор, хлорокись фосфора, пятиокись фосфора, ацетилхлорид -или тионилхлорид. Процесс МОЖ1НО вести в присутствии инертного органического растворителя.
Соединения, полученные согласно изобретению, обладают повышенной биологической активностью по сравнению с известными.
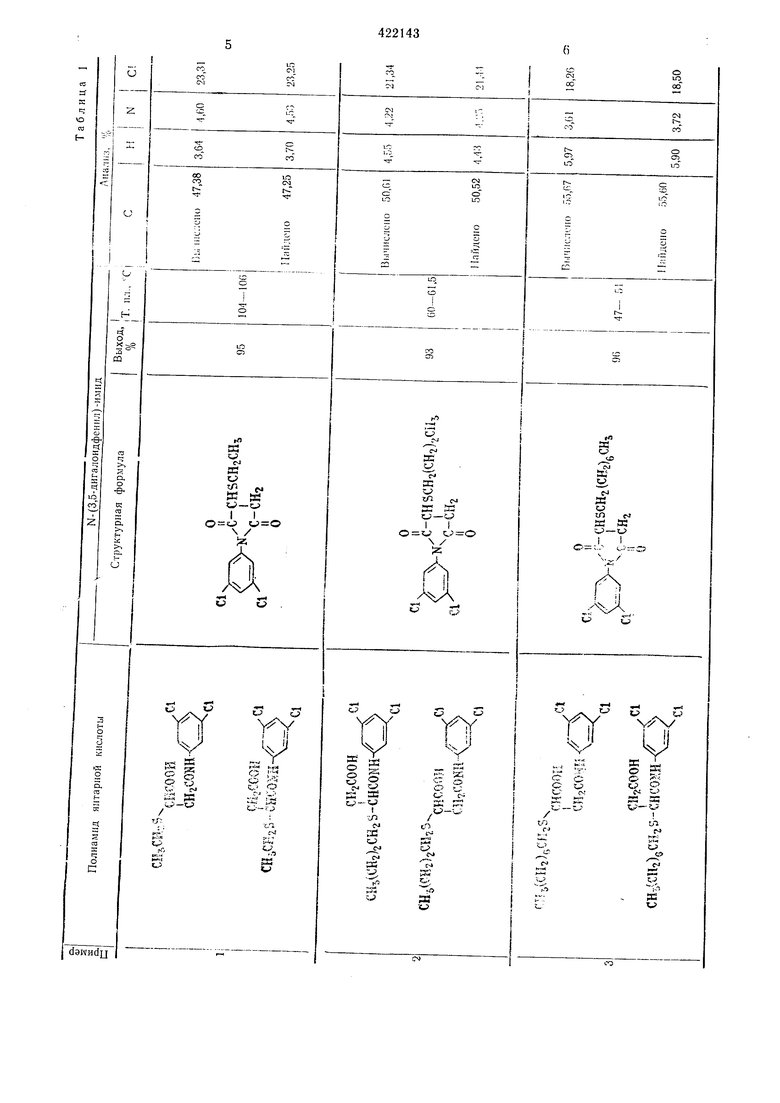
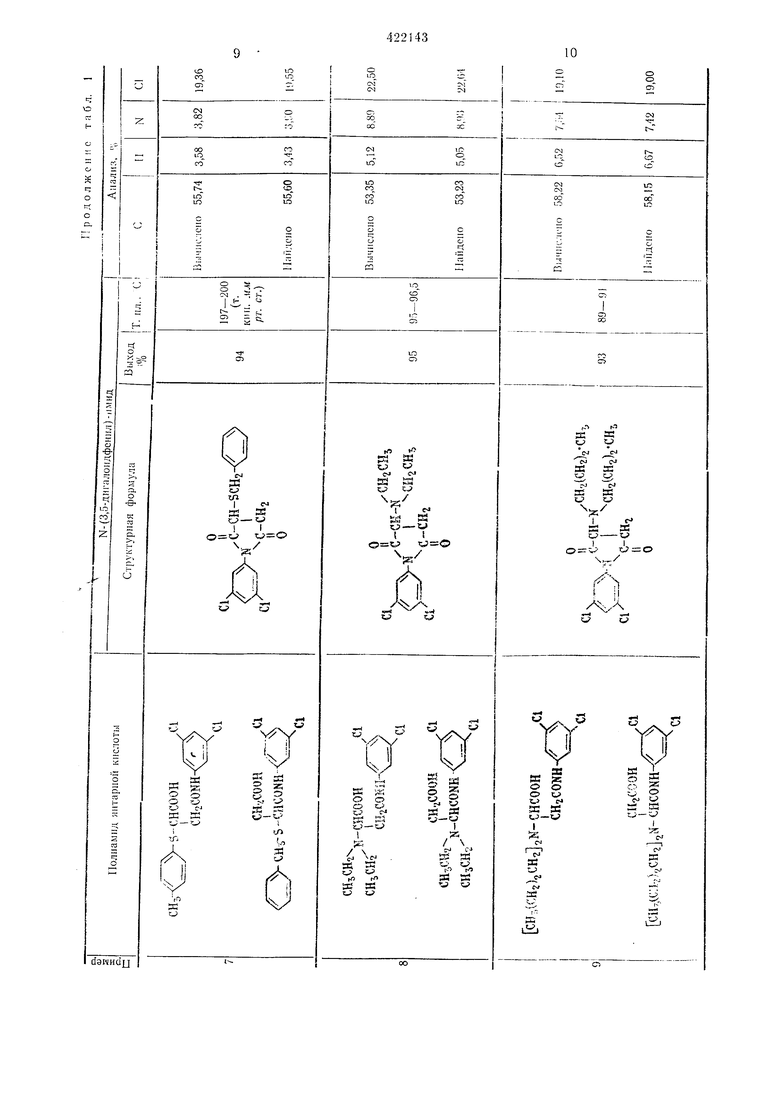
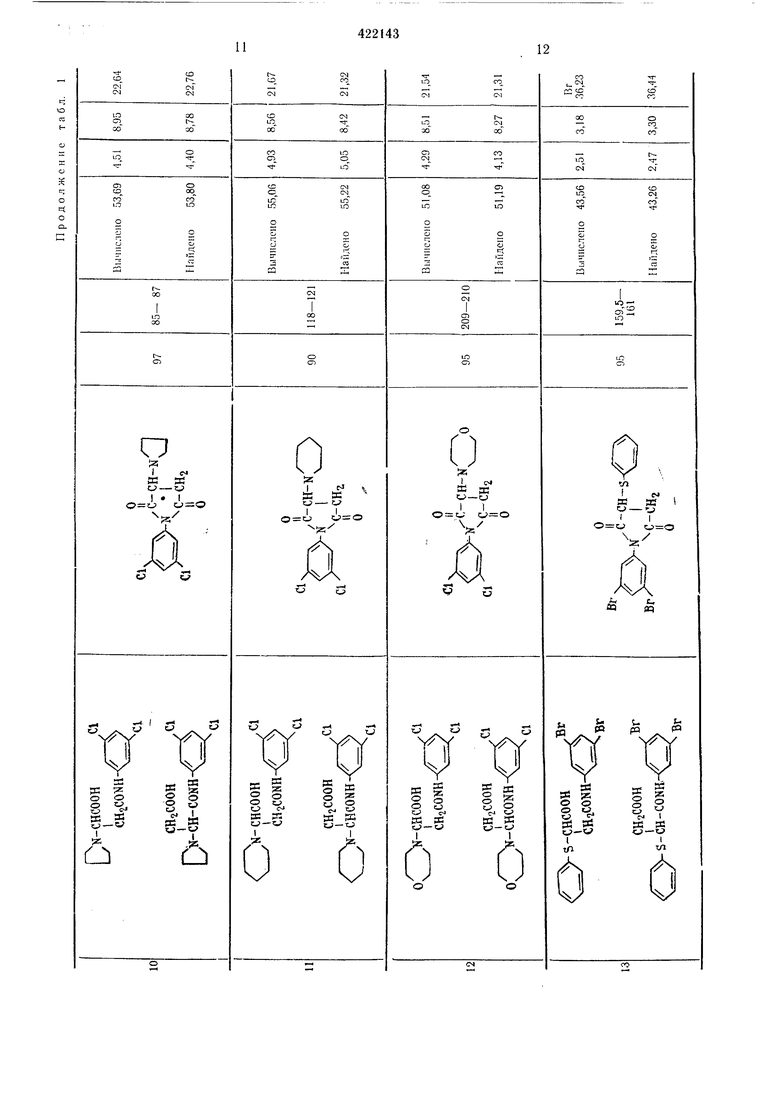
Пример 1. Смесь, состоящую из 0,1 моль полуам.ида N- (3,5-дигалоидфенил) -янтарной кислоты, 50 мл уксусного ангидр.ида и 1 г безводного ацетата натрия загружают в четырехгорлую колбу на 100 мл и нагревают при перемешивании при 100° С в течение I час. После этого уксусную кислоту и уксус:1ый ангидрид отгОНяют в вакууме, остаток промывают водой и сушат, при этом получают N- {3,5-дигалоидфенил)-сукЦ|Инимид с хорошим выходом. Если нужно, то ведут перекристалллзацию из этанола для получения чистого продукта.
Полуамид N-фенилянтарной кислоты легко получают из соответствующего производного ангидрида янтарной кислоты и производного ащилина. Типичные представители янтарного ангидрида и анилина приводятся ниже.
Получают следующие ангидриды янтарной кислоты;
2-метилтиоянтарный;
2-этилтиоянтарный;
2-н-прО:П,илтиоянтарный;
2-изопропилт1Иоянтаряый;
2-н-.бутилтиоянтарный;
2-изобутилтиоянтарлый;
2-ого/р-бутилтиоянтарный;
2-г/5ег-бутилтиоя«тарный;
2-н-амилтиоянтарный;
2-изоамилтиоянтарный;
2-т;5ег-амилтиоянтарный;
2-гексилтиоянтарный;
2-гептилтиоянтар1НЫЙ;
2-октилтиоянтарный;
2-ноНИлтиоя1Нтарный;
2-децилтиоянтарный;
:2-фенилтиоя«тарный;
2- (о-хлорфеиилтио) -янтарный;
2- (л1-хлорфенилтио) -янтарный;
2- («-хлорфенилтио) -янтарный;
2- (о-метилфенилтио) -янтарный;
2-(.дг-метилфенилтио)-янтарный;
2- (п-метилфенилтио) -янтарный;
2-(л-иитрофеиилтио)-яитарный;
2-бензилтиоянтарный;
2-диметиламиноянтарный;
2-(ди-н-пропиламино)-янтарный;
2-(ди-изоцропил а мино)-янтарный;
2-(ди-н-бутиламино)-янтарный;
2- (ди-изобутиламино) -янтарный;
2- (ди-н-амилоамино) -янтарный;
2-(ди-изоа мил а мино)-янтарный;
2 - д и ге КС и л а м И1н о я I-:T ар i ы и;
2-1 ирролид1 нянт;1 П ЫЙ:
2- илер1 Динянтарный;
2-морфолинянтариый.
Получены также следующие анилины:
3,5-дифтораиилин;
3,5-дихлор анилин;
3,5-диброма1 илии;
3,5-дииоданили1Н.
Таким образом иолучают соединения, указанные в табл. 1.
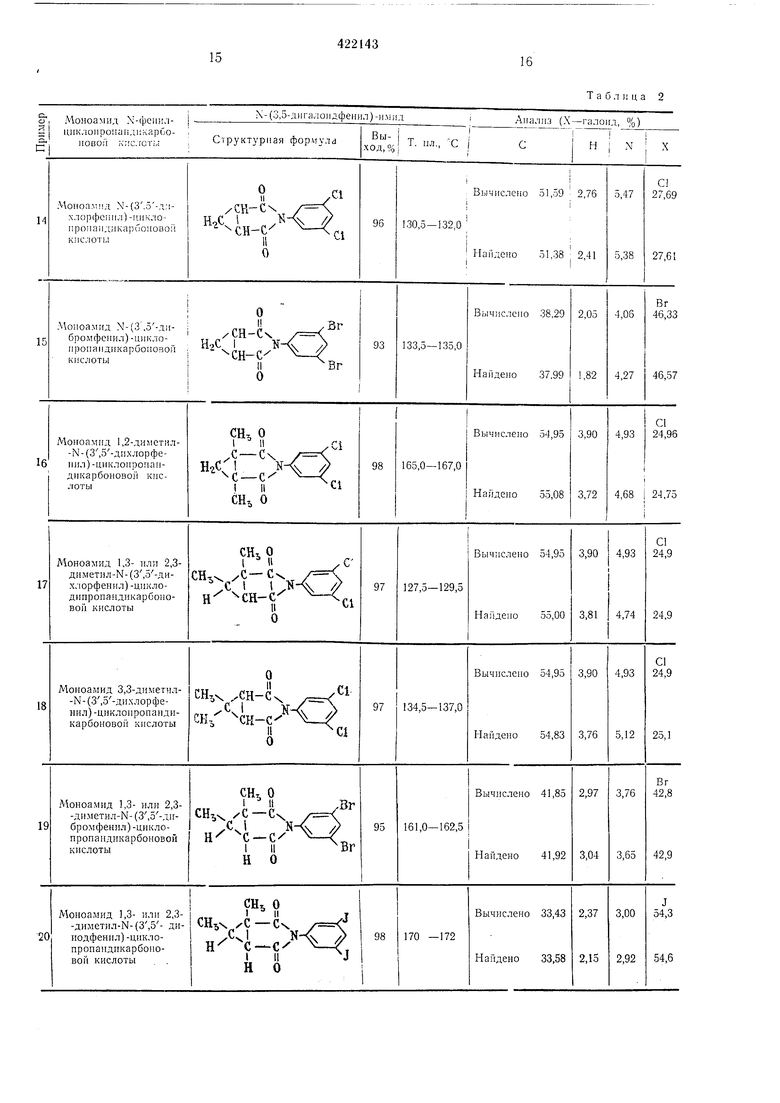
Пример 2. Смесь, состоящую из 0,1 моль производного моноа-мида N-фeнилц,ИKЛOпpoпандикарбоновой кислоты, 50 г уксусного аигидрида и 1 г безводного ацетата натрия, загружают в четырелгорлую колбу на 100 жл и нагревают при перемешивании и 100° С в течение 30 мин. Потом уксусный ангидрид и укс/сную кислоту отгоняют в вакууме, остаток промывают водой и сушат. При этом (получают N-фe илциклoпpoпa,ндикapбoкcимiИднoe производное. Для получения чистого продукта ведут нерекристаллизацию из этанола.
Произво-Д|ное моноамида Ы-фенилциклоп-ропaидикapбo 0iвoй кислоты, применяемое в этом способе, легко получают ио обычно му способу, из соответствующих ангидрида ЦИКлопропандижарбоновой кислоты и анилина. Ти.пичны-ми представителями циклопронандиKapGCiHOBoro ангидрида и анилина я-вляются приведенные ниже соединения, но они не ограничивают сущность этого изобретения. Ангидриды:
1-метилциклопропандикарбоновый;
3-метилциклонропандикарбоновый;
1,2-,диметил1ЦИ1КЛОПрапандика рбойовый;
1,3-диметилци КЛ01Пропа1НД1икарбоновый;
3,3-диметилцикло1пропандикарбоновый;
1,3,3-триметнлциклопропандикарбоновый;
1,2,3,3 - тетраметилциклопропандикарбо-но1ВЫЙ.
Анилины: 3,5-дихлоранилин; 3,5-диброма,нили1н; 3,5-дииоданилин; 3,5-дифторанилин.
ю
сч
со
со


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения циклических имидов | 1970 |
|
SU578868A3 |
| Способ получения красителей полициклического ряда | 1970 |
|
SU458984A3 |
| СПОСОБ ПОЛУЧЕНИЯ АРИЛОКСИОКСИПРОПИЛЕН-ПИПЕРАЗИНИЛАЦЕТАНИЛИДОВ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СЛОЖНЫХ ЭФИРОВ, ИЛИ КИСЛОТНОАДДИТИВНЫХ СОЛЕЙ | 1984 |
|
RU2071471C1 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СЛОЖНЫЕ ЭФИРЫ И КИСЛОТНО-АДДИТИВНЫЕ СОЛИ | 1991 |
|
RU2083570C1 |
| Депрессорная присадка к нефти и нефтепродуктам | 1973 |
|
SU543356A3 |
| ВСЕСОЮЗНАЯ 1ПДТЕ[!ТНО-ЩНИ^;Е^:?Д;ГБИБЛИОТгпл | 1972 |
|
SU342337A1 |
| КОМПОНЕНТ КАТАЛИЗАТОРА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ПОЛИМЕРИЗАЦИИ ПРОПЕНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СОДЕРЖАЩИЙ ЕГО КАТАЛИЗАТОР | 2015 |
|
RU2690192C2 |
| МИКРОБИОЦИД | 1970 |
|
SU453814A3 |
| СПОСОБ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ИНГИБИТОР 5-АЛЬФА-РЕДУКТАЗЫ | 1992 |
|
RU2125879C1 |
| СПОСОБ ПОЛУЧЕНИЯ D-ГЛЮКОФУРАНОЗИДОВ | 1968 |
|
SU453822A3 |

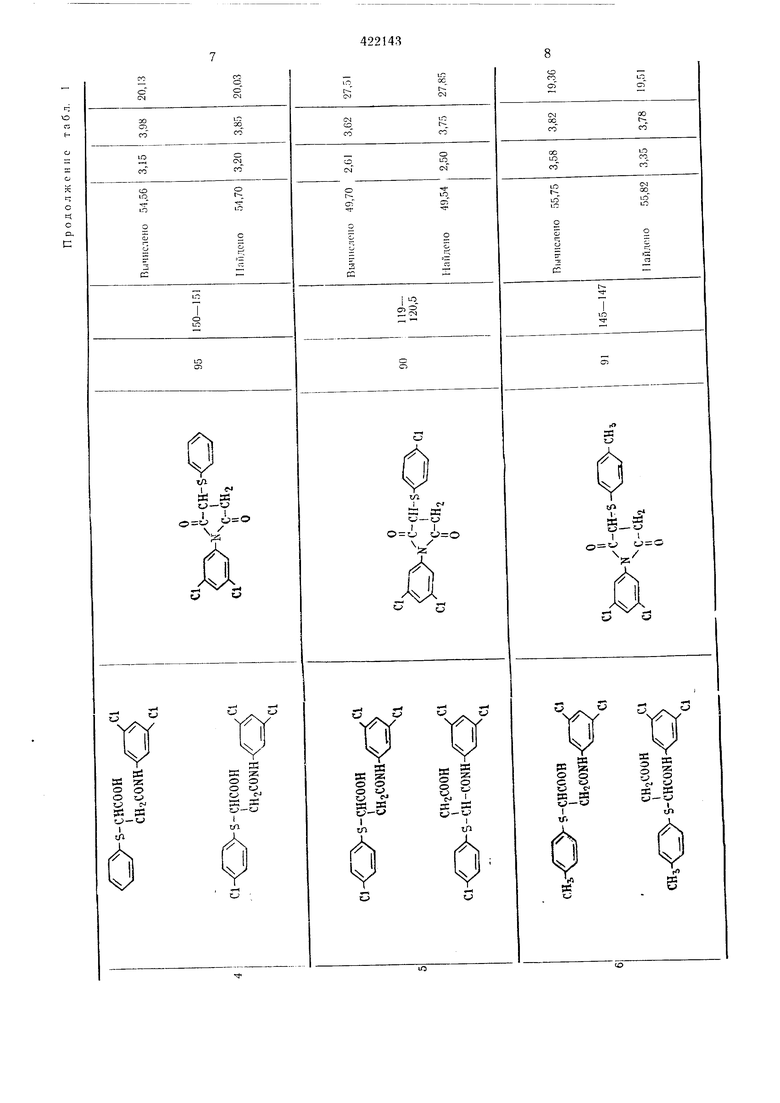
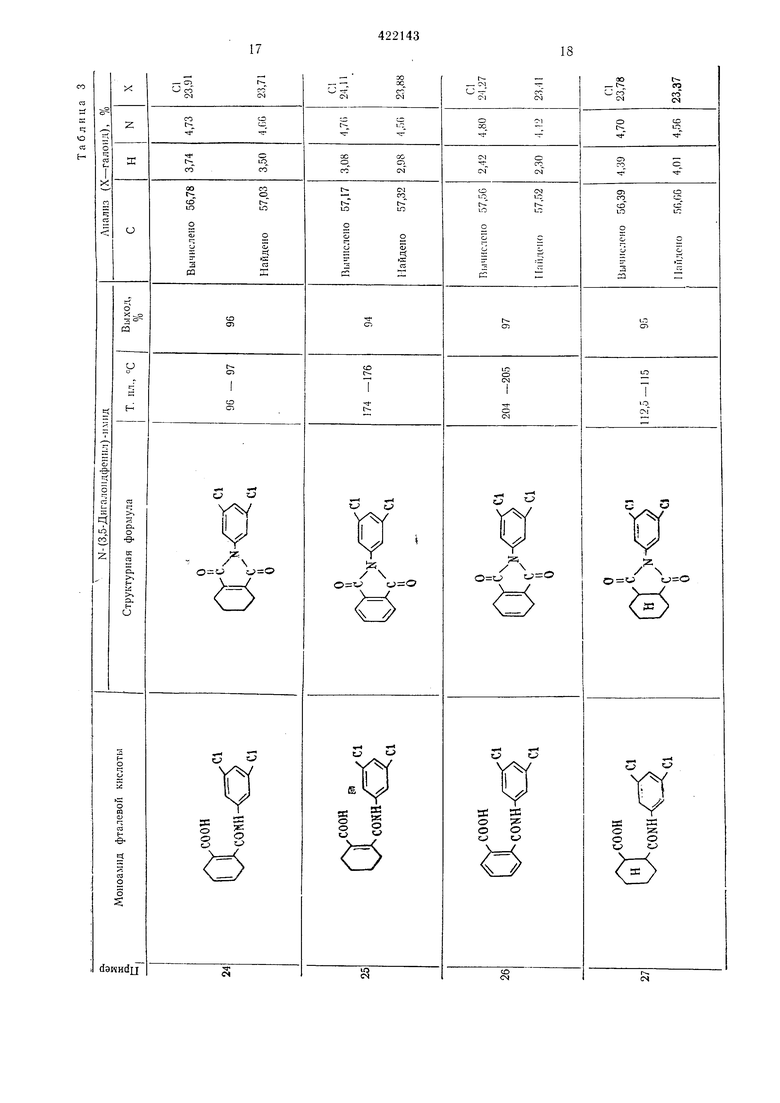
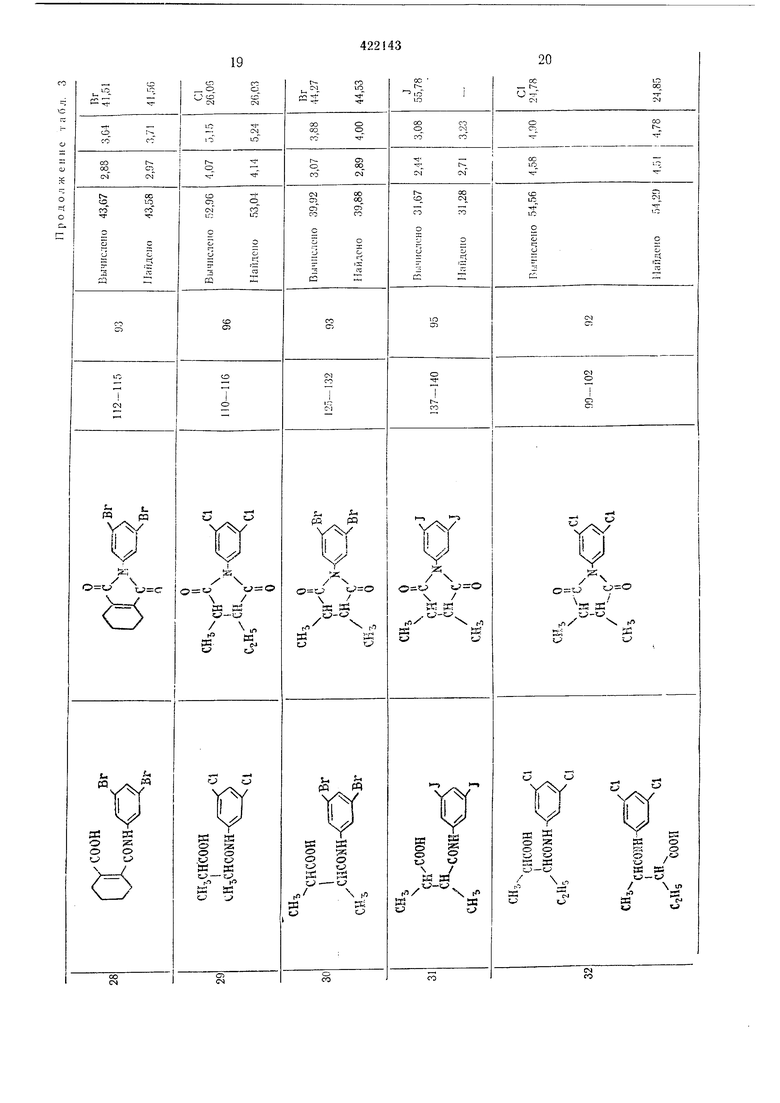
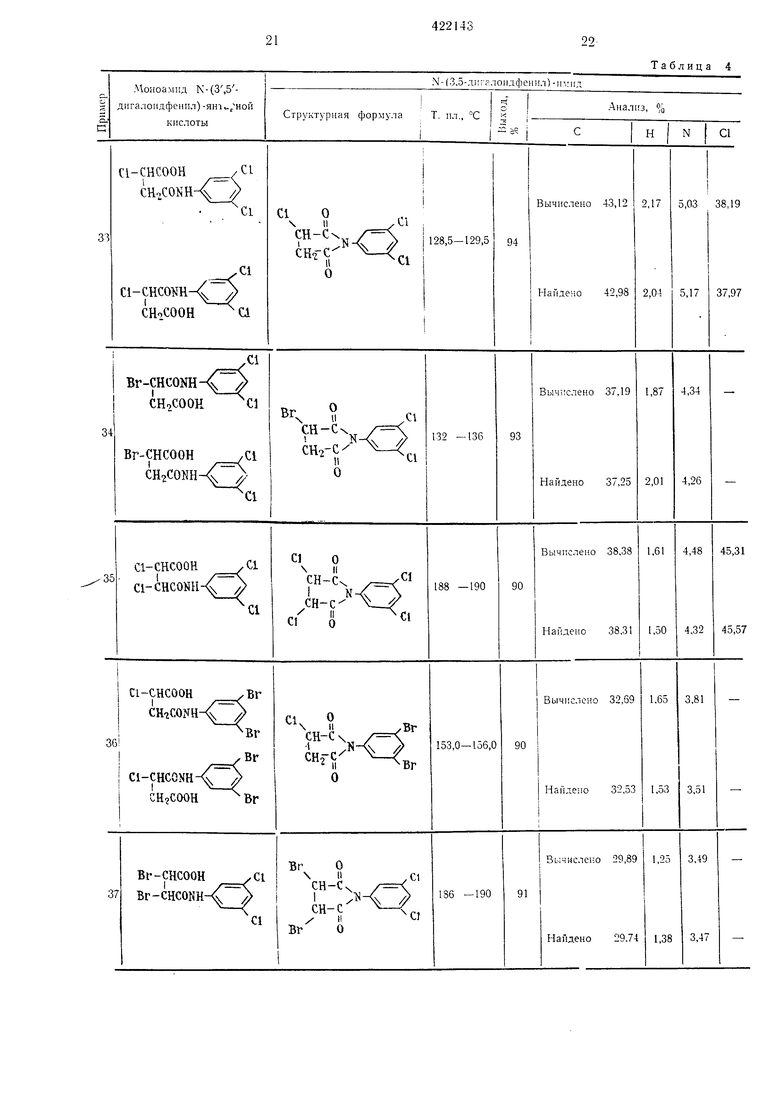
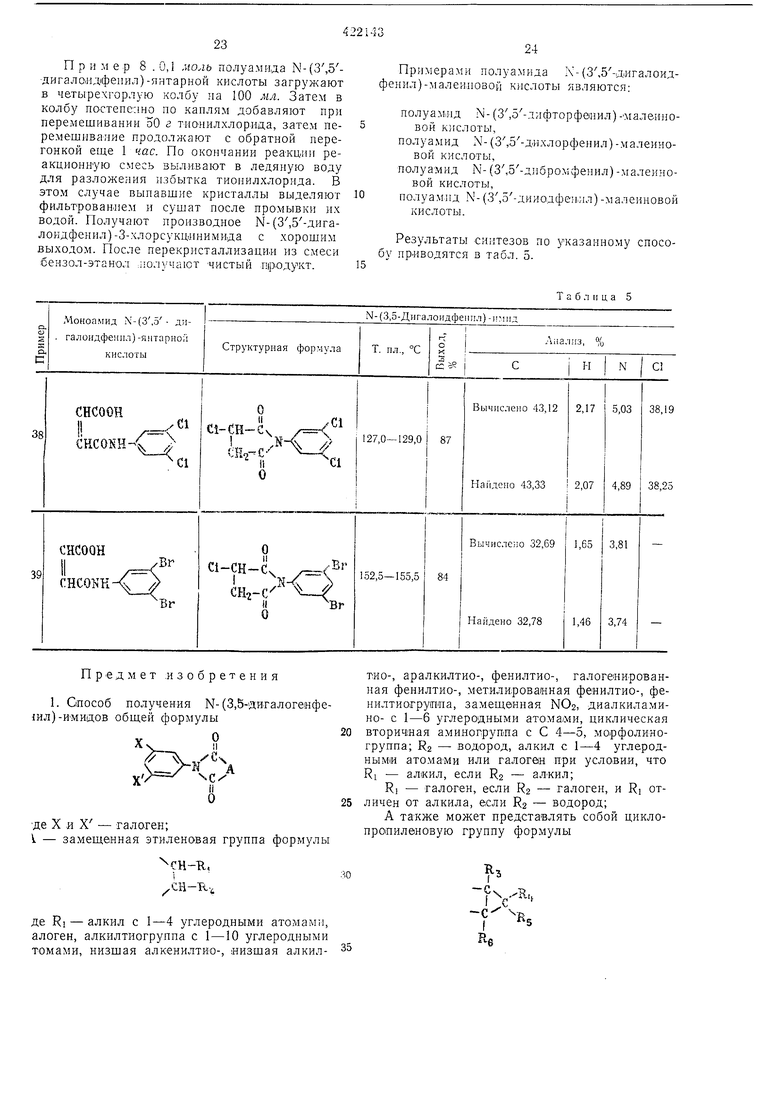
13 Результаты, полученные ори осущестзгеliiin этого способа, приводятся в табл. 2. Пример 3. М-(3-5-Ди.лорфенил)-глутаримиа. Смесь, состоящую из 27,6 г мо} оамида .-(3,5-дихлорфенил)-глутаровой кнслоты, 50 г уксусного ангидрида и I г безводного ацетата натрия, загружают в четьирехгорлую колбу на 100 мл и .нагревают при перемешивании при 80-90° С в течение 1 час. Затем уксусную кислоту и уксусный антидрид отгоняют в вакууме, остаток промьшают водой и сушат; получают 24,8 г соединения в виде белых кристаллов с т. ,пл. 172,5-174,5° С. Вычислено для CuHsOzNCla, %: С 51,19; Н 3,51; N 5,43; С1 27,47. Найдено, %: С 51,22; Н 3,24; N 5,49; С1 27,47. Пример 4. -(3,5-Дибрамфеннл)-глутаримид. 36,5 г .молоамида К-(3.5-1Дибромфе ил)- Глутаровой кислоты загружают или в колбу Клайзепа на 50 лгл и нагревают при 170-180° С в течен ие 30 .мин, образовавшуюся воду отгоняют. Получанный сырой .продукт парекристаллизовывают из смеси этанол-беизол и получают 28,4 г соединения в виде белых кристаллов с т. пл. 161,5-163,5° С. Вычислено для CnHgOoNBrg, %: С 38,07; П2,62; N 4,06; Вг 46,06. Найдено, %: С 37,94; Н 2,66; N 4,13; Вг 46,09. Пример 5. К-(3,5-Дииодфенил)-глутари лид. Смесь 23,0 г моноа.мида К-(3,5-дииодфеннл)нглутаровой кислоты, 50 г уксусного ангидрида и 1 г безводного ацетата натрия загружают В четырехгорлую колбу на 100 .мл, нагревают щ перемешизанин пр,и 80-90° С в течение I час. После этого уксусную кислоту и уксусный ангидрид отгоняют ,в вакууме, остаток промььвают водой и :Сушат, получают 21,2 г соединения в внде белых кристаллов с т. пл. 177-178,5° С. Вычислено для CiiHj02N42, %: С 29,96; Н 2,06; N 3,18; I 57,55. Найдено %: С 29,81; Н 2.32; N 3,16; I 57,39. П|р1и.меры 6, 21-23. Омесь 0,1 моль пролззодн.ого Моноавгкгда Х-феннлфталевой кислоты, 50 г уксуоного а,н плдрида 1И 1 г безводного адетага натр|ия :з.агружают в четырехгорлую колбу «а 100 мл и нагревают при (леремс-ши.Ба1н:и,и iB течежие 1 час при 80-100° С. Затем уксусную мислоту 1и ук1сусный а«ги;дрИд отго1НЯЮТ в вакууме, остаток .промывают водой н сушат, пр1и эт,0;М 1иолуч,ают «ужиое п.роизводное N-фe нlилфiтaлимlидa с хорош|им выходом. Если нужно, то получают очищекный продукт переКр,исталли1за1цией ,из этанола.
14 Согласно -прописи прИ1.мера 6 получены соединения, указан ые IB табл. 3. Исходное про зводное моноам ида N-фенилфталевоЛ кислоты легко получают обычным спссобо-м из фталевого ан-гидрида и анилина. Типи;;1ые примеры фталевого ангидрида ,и акиллиа представлены :нии-;е, они, однако, не ограничивают суш,ность .изобретения. iПoлyчaют следуюии е фталевые ангидриды:1,2-диг)Дрофталевый; 1,4-дпгидрофталевый; 1,6-дигидрофталевый; 3.4-дигпдрофталевый; 3,6-д.игидрофталевый; 4,5-диг1гдрофталевый; 1,2,3,4-тетраг,идрофталевый; 1.2,3,6-тетрагидрофта левый; 1,4,5,6-тетрагидрофталевый; 3,4,5,6-тетрагидрофталевый; гексагидрофта левый. Анилины: 3,5-дифтораиил1ип; 3,5-днхлораш1лпн; 3,5-диб ром анилин; 3,5-дпиодаиилин. П р и м е р 1. Стандартный способ. Смесь 0,1 .моль производного маноамида N- (3.5-дигалоидфе1шл) -янтарной кислоты, 50 г уксусного ангидр.ида и 1 г безводного ацетата натрия загружают в четырехгорлую колбу на 100 .мл и нагревают при перемеш.иванин при 80-100° С в течение 1 час. Затем уксусн}ю кислоту и уксусный ангидрид отгоняют в вакууме, остаток промывают водой ,и сушат. Получают производное Ы-(3,5-дигалоидфеннл)-сукциниМИда с хорошим выходом. Если нужно, то ведут очистку перекрнсталлизац.ией из этанола. Исходный моноамнд Х-(3.5-дигалоидфеил)-ЯНтарной кислоты легко получают обычным способом из соответствующих янтарного ангидрида и анилина. Типичные примеры янтарного ангидрида и алилина приводятся ниже, они не ограничивают существа изобретения. Янтарные ангидриды: 2-фторЯ11тарной; 2-.хлорянтарной; 2-бромянтарный; 2-иодянтарный; 2.3-диф10рянтар 1ый; 2,3ндихлорянтариой; 2,3-д1юром янтарный; 2,3-дииодянтарный. Анилины: 3,5-д.ифторанилин; 3,5-дихлОранили.н; 3,5-диброманилин; 3,5-дииоданнлин. Результаты синтезов таких соединений приводятся в табл. 4.
Таблица 2
17
18
и
О
ч о о.
с
12
21 -Моноамид К-(3,5Д11гало11дфеипл)-ян11.;ной Структурная формула кислоты
С1-СНСООН /
CHnCONH
Cl
С1 о
II,- I
-M-/f ; 128,5-129,5
3
ru - у
V-Hv
о1
Cl
Ci-снсоун у сносоон а
Br-CHCONH-( СНОСООН С
о
Br
иС1
СН-Сх /
™,
Вг-СНСООН .С1
CH CONH- T Cl о
С1 о
С1-СНСООН ,С1
II
С1-СНСОЯН- / С1 CH-Cv
I сн-сС1 11
С1-СНСООН .Вг
CH-jCONH- / Вг
0
Cl
11 CH-C
61
L. „;N4
CHj-C/ 0
j.Br
I ci-cHcoNH- : /
Br
Br 0
Br-CHCOOH Cl и
CH-Cx
Br-CHCOKH
-4
CH-C
/ II
Cl Br 0
Таблица 4
Анализ, %
С1
Н
Вычислено 43,12
2,17
5,03 38,19
94
Найдено 42,9
37,97
2,04
5,17
4,34
Вычислено 37,19
1,87
93
132 -136
4,26
2,01
Найдено 37,25
4,48
Вычислено 38,38
1,61
45,31
С1
188 -190
90
Cl
45,57
4,32
Найдено 38,31
3,81
Вычислено 32,69
1,65
Br
153,0-156,0
90
Br
1,53
Найдено 32,53
3,51
3,49
Вычислено 29,8
,ci
186 -190
91
CJ
3,47
Найдено 29,74
1,38 .-(3,5-ди;-алО11дфе111 л)-1р,;11,т Т. ил., °С
23
П р и м ер 8 . 0,1 моль полуамида N-(3,5дигалолдфепил)-янтарной кислоты загружают в четырехгорлую колбу на 100 мл. Затем в колбу постепенно по каплям добавляют при перемешивании 50 г тионилхлорида, затем перемешивание продолл ают е обратной перегонкой еше 1 час. По окончании реакц.ии реакционную смесь выливают в ледяную воду для разложения избытка тиоиилхлорида. В этом случае выпавшие кристаллы выделяют фильтрован-ием и сушат после промывки их водой. Получают производное М-(3,5-дигалоидфенил)-3-хлорсукц,инимида с хорошим выходом. После перекристаллизации из смеси бензол-этанол :1юлучают чистый продукт. П р -е д М е Т .изобретения 1. Способ получения N-(3,5-Дигалоге«фе1ил)-ими1дов обш,ей формулы де X и X - галотен; - замещенная этиленовая группа формулы €Н-Т1, сн-к-, де RI - алкил с I-4 углеродными атомами, алоген, алкилтиогруппа с 1-10 углеродными томами, низшая aлкeнИv тиo-, низшая алкил24
Примерами полуамида л-{3,5-д.игалоидфеппл)-малеи:иовой кислоты являются:
полуамйд -(3,5-дифторф0нил)-малешшВОЙ К1 СЛОТЫ,
полуамид 1 -{3,5-дихлорфенил)-малеиновой кислоты, полуамид N- (3,5-дибро : Ьенил) -малеиновой кислоты, полуамид N-(3,5-дииодфен1ил)-малеиповой
кислоты.
Результаты синтезов по указанному способу приводятся в табл. 5.
Таблица 5 20 25 ло 35 Т.ИО-, аралкилтио-, фенилтио-, галогеиированная фенилтио-, метилированная фенилтио-, фенилтиогругопа, замещенная NOg, диалкиламино- с 1-6 углеродными атомами, циклическая вторичная аминогруппа с С 4-5, морфолиногруппа; R2 - водород, алкил с 1-4 углеродными атомами или галоген при услО|Вии, что RI - алкил, если R2 - R, - галоген, если R2 - галоген, и Ri отличен от алкила, если R2 - водород; А также может представлять собой циклопропиленовую группу формулы 3 -fx-n. -Г «
25
где Rs, R4, Rs Re - водород или алкил с 1-4 углеродными атоимами, или А-триметилен, Щ клогексилен-1,2-циклогексеНилен - 1,2-;Ц:И1Клогексадиенилен - 1,2- или о-фенилен, отличающийся тем, что моно-(3,5-дигалоге1{феиил)алигдаикар бановой Jiиглoты общей формулы:
.vH ел-гООН
X
где X, X, А имеют вышеуказанные значения, подвергают дегидратации при температуре 20-250° С.
26
СН -RO,
где RI и RO каждый обоз-начаег алкил I-4 атэмов углерода, а X :i X - галоген; 27.05.69, № 41501/69 при А CH-R,
где RI - галоген; Ro - водород ;пл; галоген, а X ;П X обозначают галоген:
i СН-RS,
Где R: - алкенилтиогруппа; R; - водород; X и X - галоген.

Даты
1974-03-30—Публикация
1970-03-18—Подача