где и 1 имеют указанные значения и находятся в 5-ом или 6-ом положении ди оксанового я/фа, конденсируют с диэтилрвым эфиром мети ленм а лоновой кислоты. Образующееся при этом соединение общей формулы (1У) CgiSooC подвергают циклизации с помощью хлорокиси фосфора при нагревании с образованием 4Н-диоксино(4,5- ) хинолина в случае, если R представляет собой мети л, находящийся в 5-ом положении бензодиоксанового ядра общей формулы (У) или его изомера, производного lHwj-диоксино 15,4- j хинолина общей формулы (У1 СООСзНз , В случае, если R - водород или метил, находящийся в 7-ом положении бензодиоксанового ядра. Полученное при этом соединение подвергают взаимодействию со вторич1шм амином общей формулы .,,... , ::ин: . где и fj взятые отдельно, могут представлять собой низшие алкиловые радикалы, или и , взятые вместе, могут образовьтать с атомом азота, с которым они связаны, 5- или 6-членное гетероциклическое кольцо, которое может содержать второй гетероатом, с образованием соответствующего диалкиламинового производного общей формулы (У0) СООС2Н5 или его изомера общей формулы (УШ) сооСзН : 1 2 к имеют указанные значения. Полученное соединение формулы У Ц или yiii кватернизуют соединением общей формулыRX , | где R - низший алкил, имеющий не более 4 атомов углерода, а X - галоидная или эфирная группа, с образованием соединения общей формулы (IX) , СООСзНз или его изомера общей формулы (X) COOCaHs Х-. Г.. ; Ч 2 ° где R,, RO, R , R X имеют указанные значения, с последующим гидролизом и омыление соединения формулы IX или X гидроокись щелочного металла в водном или водно-сп товом растворе с последующим подкислени ем и выделением целевого продукта в сво бодном виде или в виде соли известным способом. Соединения, содержащие m-диоксановы цикл формулы Г|, очень удобно приготовит на основе хлорного производного У1, которое преобразуют воздействием вт ричного жирного или гетероциклического амина где R, R, взятые отдельно, представляю низшие алкиловые радикаль, а взятые вм сте образуют с атомом азота, с которым они связаны, азотный гетеродикл с пать1р или щестью цепочками, который может со держать второй гетероатом, такой как пи перидин) в соответствующее третичное аминовре производное формулы УШ. Для Toiro преобразования особенно желателен пиперидин. Полученный третичный амин формулы yill затем кватернизуют в гетероциклический азот посредством галоидной соли алкила или алкилового эфира, предпочтительно нейтрального алкилового сульфата или алкилового арипсупьфоната RX (где R яв-i ляется низшим алкиловым радикалом, имею- , щим не более 4 атомов углерода, а X - га IOиднaя группа или эфир). Полученное тшсим образом лрризводаое хинолина X обычно подвергают гидролизу и омылению гидратом щелочного металла в одном или водно-спиртовом растворе. После подкисления получают жедаемые произ- I водные формулы П с высоким выходом. ; Третичные амины Ylil обычно получают путем воздействия избытка (2,5-5 молей) . вторичного амина на галоидное производное У1 в нейтральном растворе, предпочтительно бензола или толуола; в течение 3-7 час при 80-1 ОО°С. Кватернизацию третичных аминов У111 осуществляют предпочтительно с низшими алкиловыми сульфатами. Действуют либо нагреванием до 80-10О° в присутствии ( большого количества алкилирующего агента, используемого в качестве растворителя, либо в растворе в присутствии 2-5 молей алкилового сульфата. Применение некоторьцс биполярных апротонных растворителей, такихцкак диметил- сульфоксид (ДМСО) позволяет проводить Кватернизацию при обычной температуре. Независимо от того, каким способом была проведена кватернизация, когда она закончена, полученная после реакции смесь выливается в воду, где растворяются четвертичные компоненты X. Избыток реактива и использованного растворителя удаляют путем извлечения с помошью растворителя, не смешивающегося с водой. К водному раствору добавляют избыток щелочного гидрата (2-5 молей) и смесь нагрева,ют при орошении до полного разложения четвертичного аммония (1-5 час). После обработки животным углем и фильтрования раствор делается кислым при помощи . сильной минеральной кислоты: осаждающаяся кислота fl отжимается, промывается водой и и перекристаллизовывается в соответствующем растворе. Галоидные производные У1 получаются путем циклизации замещенных производных WJ-бензодиоксанила этилового аминометилового малоната 1У. Когда R представ.ляет собой заместитель, отличный от Н i(R - метил), и связан в положении 7 С . |бе1шодаоксановым я/фом, реакция приводит только к получению производаого 1Н даок:сино (5,4-Sr ) хинолина У1. эта циклиКогда R - атом водорода, зация теоретически может привести либо к производному IH/г -диоксино (5,4-i } :хинолину У1, либо к производному 4Н-диоксино (4,5- ) хинолину У. Однако на практике реакция направлена на образование производных i Н)-диоксино (5,4- ) хинолина У1, которые приводят к кислотам П. Характер продукта циклизации может быть установлен путем изучения спектра RMV хлорных производных или со ответствующих продуктов пиперидинового замещения, являющихся более стабильными Наоборот, когда , состоит из замести теля иного, чем водород (), и свя eLС) зан в положении 5 с бензодиоксановым ядр ром, циклизация приводит к производному 4Н-ДИОКСИНО (4,5-. о ) хинолину У, Пример 1.|Диметил-5,5-оксо-1О-дигидро-7,10,1Нгл-диоксино (5,4- ) хинолин-9 -карбоновая ислота, 28,65 г амино-6-метил-8-бензодиоксан -1,3 и 41,34 г этилового этокси етиленмалоната нагревают в течение ЗО мин при 12О С. После охлаждения твердое вещество размалывают и помещают в петролейный эфир, затем отжимают и высушивают. Полу чают (метил-8цг} -бензодиоксанил-6 )-этиловый аминометиленмалонат с т. пл. 138 :Н весом 56,6 г (97% от теоретического). В 56,6 г этого тонко размолотого вещества добавляют при перемещивании566с хлорокиси фосфора. Смесь подогревают в течение 6 час при орощении. Больщую часть РОС удаляют в водяной бане в вакууме, а остаток растворяют в 500 см хлороформа. Раствор выливают на 5ОО г толченого льда и смесь перемешивают в течение 30 мин. Органическую фазу отделяют декантированием, снова перемешивают в течение 10 мин с 500 см 10%-ного раствора СО , декантируют, промывают насыщенным раствором ji/aCp и высушивают на (Va $О в присутствии животного жира. После ф4Шьтрования и выцаривания растворителя твердый остаток, перекристаллизованный из 500 см циклогексана, дает 39 г (75% от теоретическоч-г --. го) ,метилг.5-карбэтокси-9-хлор-10,
-диоксино (5,4- J ) хинолина с т. пл. 122--124°С, ;.
Вынислено, %:(i 58,54гН 4,58; Н 4,48..
3 Найдено, %: С 58,43;щ 4,51; N4,48. 39 г этого хлорного производного и 32,4 г пиперидина, растворенного в 400см j толуола, нагревают в течение 6 час при i орошении. Продукт реакции изолируют так I же, как в предыдущем примере. После двух :перекристаллизации в гексане получено 24 г (53% от теоретического) метил-5-карб этокси-9-пиперидино-10,1Н га-диоксино (5,4- ) хинолина с т. пл, 115-116 С. Вы р1слено, %: С 67,39; Н 6,79; N7,86. Найдено, %: С 67,2О; Н 6,89; N7,83. Спектр в 5, М, -дейтерированном хлороформе подтверждает эту структуру: ароматический протон Н (Г 7,75 ррг«, О СН„ аром. (Г 2,38 рр иг. Имеет место спаривание между ароматическим СН и Hg J /1Н 2 это спаривание аллилового типа соответствует структуре СН /1/(7 5,5 ppivx , СН /3/ б 5,35 рр fn, 7,12 гуказанного третичного амина во взвеси в 30 см ДМСО и 2,95 г нейтрального метилового сульфата перемещива;ЮТ в течение 2,5 час при 5О°С. Л осле охлаждения и добавления 100 см воды смесь экстрагируют при помощи диэтилового .эфира. Водный раствор с добавлением 7 г поташа подогревают в течение 1,5 час при орошении, обрабатывают животным углем, фильтруют и подкисляют кислотой HCi .Осадок отжимают и получают после промывки в воде и спирте 5,11 г (92,@% от теоретического) Сдиметил-5,7-оксо-10-дигидро-7,10,1 HTYV -диоксино (5,4- ) хинолино-ЭД-карбоновой кислоты, очищенной путем перекристаллизации в диметилформамидэ, с т. пл. ыше 26О°. Вычислено, %: С 61,09, Н 4,76; )А/5,09. Найдено, %: С 60,46; Н 4,87; Л/5,10. Пример 2. (,Хлоро-.5-метил-7-ок- - |- . ... j , . ч- -ivJCVinJI- I -TJtV си-1О-дигидро-7ДО,1Н -диоксино (5,4- ) хинолцно-9}-карбоновая киспсуга. 85,1 г амино-6-хлоро-9- бен;мдиоксан& -1,3 и 104 г этилового этоксиметиленмало ната прдогревают в течение 1 часа при 160°С в колбе объемом 500 см, снабжен ной нисходящим холодильником (31леевиком) предназначенным для сбора спирта, образующегося при реакции. После охлаждения твердая масса пере;к51исталлизовывается из этанола. Получают 152 г, или 93,5% от теоретического, (хлоро-8 щ -бензодаоксанил -6)-этилового аминометиленмалоната с т. пл. 145-146°С. Выяислено. %: С 54,01; Н 5,10; N3,9 6 18°б Найдено, %: С 54,4О; Н 5,01; Д/4,02. Амин, необходимый для этого синтеза (т. пл.-110-111°С), был приготовлен путем восстановления .нитрО 6-Хлоро-8-бензо диоксана-1 3.; 71,1 г произвошого малонового амино метилена и 710 см хлорокиси фосфора по .догревают в течение 18 час при орошекйк, После удаления в вакууме РОС оста ток растворяют в 800 см 10%-ного раст вора . Хлороформовый раствор промывают водой, затем высушивают (МьЬО ) в присутствии животного угля. После фильтрования и выпаривания растворителя остаток перекристаллизовывают в бензоле. Получают 35,04 г (53,8% от теоретического) дихлоро-5,1О-карбэтокси-9,1Нт-диоксино (5,4-j- ) хинолина с т. пл. 163°С. Вычислено, %: С 51,26; Н 3,38; А/4,2 Найдено, %: С 51,44; Н 3,51; 4,42. 26,24 г этого производного, содержащего два атома хлора, растворенного в 25О см толуола с добавлением 21 г пиперидина, после прогревания в течение 3 ча при орошении дают 28,2 г (94% от теоретического) хлоро-5-карбвтокси-9-пиперидино-1О,1Нтп-диоксино-(5,4-J ) хинолина с т. пл. 125 С, изолированного, как указано в примере 2, и очищенного путем ;перекристаллизации в этаноле. Вычислено, %: С 60,56; Н 5,62;Д/ 7,43 Найдено, %: С 60,72; Н 5,85; ,47. 3,76 г шшеридинового производного, взвец ённого в 10 см ДМСЮ, кватерни зуется при 50-60°С 1,5 см диметилсульфата, как указано в предыдущем прима; ре, Кватернизация проходит полностью в течение 1 часа. После охлаждения массу - о ( . заливают 100 см воды. К водному раствору, экстрагированному 3x2,5 см ди; этилового эфира, затем 5О см толуола, добавляют 3,4 г поташа и прогревают при орошении в течение 1 часа. Раствор подкисляют кислотой НС , образующийся осадок отжимают, промывают водой и высу|шивают. Собирают 2,46 г (8О% от теоретического) хлоро-5-Мётил-7 -оксо-10-диlги цэo-7,10,lHm-ДИoкcинo (5,4-/ ) хи;нолино-9-карбоновой кислоты, очищенной путем перекристаллизации в ДМФ, с т, пл. 260°С. Вычислено, %: С 52,8О; Н 3,41; h/ 4,74. Найдено, %: С 52,56; Н 3,56; А/4,55. Пример 3. иДиметил-6,7-оксои1О-дигидро-7,10,1Н/1г-диоксино..(5,4-.р ) v хинолино-Э -карбоновая кислота. . Смесь из 12 г амино-6-метил-7-бензодиоксана-1,3 и 16,2 г этилового этокси;метиленмалоната подогревают в течение 2 час при 11О°С. После охлаждения мас.са перекристаллизовывается в этаноле. Получают 22 г (мeтил-7-бeнзoдиoкcaшIЛ:-6)-этилового аминометиленмалоната с IT. пл. 1180С. Вычислено, %: С 6О,88; Н 6,31;|V4,18. Найдено, %: С 60,78; Н 6,08; |V 4,26. Амин, необходимый для этого синтеза i (т. nn.jl2O°C), был получен путем катаI литического восстановления нитро-6-метил-7-бензодиоксана-1,3 в присутствии никеГля Ренея. 1 17 г малонового аминометилена и jl40 см ..хлорокиси фосфора подогревают в течение 5 час при opomeifflH. После обычной обработки изолируют метил-6-хлоро-10-карбэтокси-9,1Н№-диоксино (5,4- ) хинолин,перекристаллйзованный из этилацетата, с т. пл. 159°С. Выход-8,6 г. i Вычислено, %: С 58,54; Н 4,58; Ct 11,52. Найдено,,62;Н 4,64||,53;С(&11,32. 5,8 г хлорного производного и 5,7см пиперидина, растворенных в 60 см толуола, подогревают при орошении в течение 7 час. Продукт реакции изолируют, как описано в предыдущих примерах. Перекристаллизованный из изопропилоксида метил -6 -пиперидино-10-карбэтокси-9,1Н т-диоксино (5,4- ) хинолин имеет т. пл. 128°С, Выход-5,8 г. Вычислено, %: С 67,39; Н 6,79; V7,86. Найдено, %: С в7,2р; Н 6,62; N8,01 3,56 г пиперидишэвого производного и 21 см диметилсульфата подогревают в течение 13 час в масляной бане при 6О-70 С и перемешивании. ГЬсле охлаждения смесь заливают 30 см воды, неJ растворимое вещество экстрагируют Ърй, помощи диэтилового эфира. Водная фаза концентрируется в вакууме до половины своего объема и становится щелочной бла го даря добавлению . Легкое нерастворимое вещество экстрагируется при помощи бензола. Водный раствор с добавлением 2 г поташа юдогревается при орошении. Подкисление кислотой НС1 дает осадок, который отжимается и кристаллизуется из ДМФ А .Полученная диметил6,7 -ОКСО-1О-ДИГИДРО-.7, 1О,1 HITJдиоксшю (5,4 - карбоновая кислота представляет собой белое твердое вещество с т. пл. вьщ1е 29О°С. Вычислено, %: С 61,09; Н 4,76; Л/5,09. Найдено, %: С 6О,80; Н 4,80; ,82 Пример 4, Диметил-5,6-оксо-9-дигидро-6,9,4Н-дцоксино (4,5-0 ) хинолино-З -карбоновая кислота. 6,3 г амино-6-метил-5-бензодиоксана -1,3 и 8,5 г этилового этоксиметиленмалоната подогревают в течение 2 час при 120-13О С. После охлаждения твердое в щество перекристаллизовывается из этано ла. Выход-12 г, т. пл.-110°С. Вычислено, %: С 60,88; Н 6,31; ,1 Найдено, %: С 60,78; Н 6,40; 4,17 Необхо/дамый для этого синтеза амино-ыетил-5-бензодиоксан-1,3 ( т. пл.-126° был приготовлен путем каталитического восстановления при/помощи палладированного угля, амино-6-хлоро-8-бензодиоксана-1,3 (т. пл.-106-108°С), полученного в резудьЦ тате каталитического восстановления, при помощи никеля Ренея, метил-5-нитро-6хлоро-8-бензодаоксана-1,3 (т. пл.-150°С). Этот последний был приготовлен путем кон- : денсации формальдегида и окси-З-хлоро-4-нитро-6-толуола в присутствии серной кислоты. 19 г малонового аминометилена подогревают в течение 6 час при орошении вместе с 150 м хлорокиси фосфора. Продукт реакции изолируют, как в предыдущих примерах,ja перекристаллизовывают из этилацетата. Получают 1О,7 г метил-5-карбэтокси-8-хлоро-9,4Н-диоксино (4,5-и ) хинолина с т. пл. . Вычислено, %: С 58,54; Н 4,58; Л/4,55; Ct 11,52. Ci n cet/0 5 144 Н 4,56; ,77; Найдено, %: С 58,15; Ct 11,61. 12,2 г хлорного производного, 11,5см пиперидина и 150 cм толуола подогревают в течение 7 час при орошении. Образе- вавшийся третичный амин изолируется, как в предыдущих примерах, и перекристаллизовывается из изопропилоксида. Т. пл.-105°С, выход-10 г. Вычислено, %: С 67,39; Н 6,79; А/7,86. Найдено, %: С 67,ОЗ; И 7,00; |V8,O6. 3,56 г третичного основания и 21,4см нейтрального диметилсульфата подогревают в течение 7 час в масляной бане при 6Оо7О С. Последующие операции ведут как указано в примере 3. Диметил-5,5-оксо-9-дигидро-6,9,4Н-диоксино (4,5-0 ) xннoлинo-8J-карбоновая кислота, полученДая путем щелочного, гидролиза четвертичного аммониевого компонента с последующим подкислением кислотой НСС , перекристаллизовьтается из ДМФ А. Это твердое вещество с т. пл. 29О°С. Вычислено, %: С 61,09; Н 4,76; :Л/5,09. Найдено, %: С 6О,97; Н 4,87; f/4,86.
i3
Предмет изо 6 p e т e н и я
1, Способ получения оксо-9-дигидро-6,9,4Н-даоксино (4,5-g ) хинолино-8}-карбоновых кислот обшей формулы (1)
I4i
подвергают циклизации с помощью хлор окиси фосфора при нагревании с образованием 4Н-диоксино (4,5-е ) хинолина в случае, если „ представляет собой метил,
находящийся в положении 5 бензодиоксанового яара обшей формулы (У)
4Т5 ,
Г 1П7
или их изомеров - 1,оксо-1О-дигищю-7, 10,1Н-диоксино (5,4- ) хинолино-Э -карбоновых кислот обшей формулы (Ц) 2
А
О
где R - низший алкил, имеюший не более 4 атомов углерода; 1 - водород, метил, хлор
- водород, метил,
или их солей, отличаюшийс тем, что амино-6-бензодиоксан-1,3 обшей формулы (Ш)
где 1.| и R имеют указанные значение
я: Находятся в 5-ом или 6-ом положении i диоксанового ядра,
конденсируют с диэтиловым эфиром метиленмалоновой кислоты, образуюшееся при этом соединение обшей формулы (1У)j
CgHsOoc COOC.HS
n V
.0. 1II
СИ
10
COOCgHs
15
или его изомера, производного IHrrj. -диоксино (4,5-4 ) хинолина обшей фор20 ;Мулы (У1)
25
СООСзН
30
: в случае, если Ц, означает водород или
i метил, находяшийся в положении 7 бензодиок35 санового , получённоё прй этомсоеди, нение подвергают взаимодействию со вто- :
;ричным амином обшей формулыI
401
X
45
, где и , «зятые отдельно, могут представлять собой низшие а/исиловые радикалы, или R и R , взятые вместе, могут образовывать с атомом азота, с которым они связаны, 5- или 6-членное гетероциклическое кольцо, которое может содержать второй гетероатом,
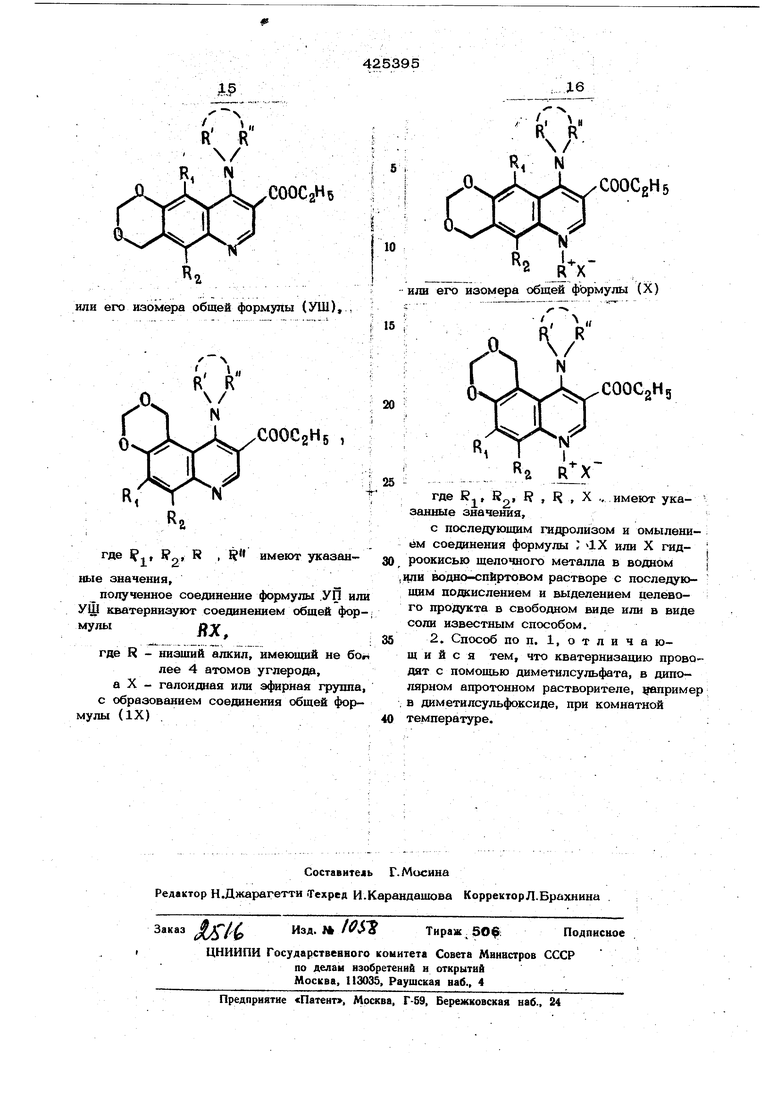
с образованием соответствуюшего ди- ; алкиламинового производного обшей формулы (УП): cooCgHg или его изомера общей формулы (УШ), , COOCgHs , где 9j, fi,j, R , R имеют указаиные значения, полученное соединение формулы .УП и уф юватерниэуют соединением обшей фор мулыоу ЛЛ, где R - низший алкил, имеюший не б лее 4 атомов углерода, а X - галоидная или эфирная групп с образованием соединения обшей фор мулы (IX) . Г7Он N .0 J JL xCOOCgHg ИЛИ его изомера обшей фЬрмулы (X) COOCgHg где К.., , I , , л ..имеют указанные значения, с последующим гидролизом и омылением соединения формулы ; 1Х или X гидроокисью шелочного металла в водном | |ли водно-спиртовом растворе с последую- шим подЕислением и выделением целевого продукта в свободном виде или в виде соли известным способом. 2. Способ по п. 1, о т л и ч а юш и и с я тем, что кватернизацию проводят с помощью диметилсульфата, в диполярном апротонном растворителе, например в диметилсульфоксиде, при комнатной температуре.:





| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ3- | 1971 |
|
SU430543A1 |
| АМИНОМЕТИЛ-2,3,8,9-ТЕТРАГИДРО-7H-1,4-ДИОКСИНО[2,3-Е]-ИНДОЛ-8-ОНОВЫЕ СОЕДИНЕНИЯ И СПОСОБ ЛЕЧЕНИЯ | 1996 |
|
RU2178416C2 |
| Способ получения производных тиазолхинолина | 1972 |
|
SU458980A3 |
| Замещенные бензо( )хинолизин2-карбоновые кислоты или их производные по карбоксильной группе | 1974 |
|
SU522183A1 |
| СПОСОБ ПОЛУЧЕНИЯ СПИРОБЕНЗОЦИКЛАНУКСУСНЫХ | 1973 |
|
SU379082A1 |
| ВСЕСОЮЗНАЯ I | 1973 |
|
SU376940A1 |
| СПОСОБ ПОЛУЧЕНИЯ ХИНОЛИНКАРБОНОВОЙ КИСЛОТЫ ИЛИ ЕЕ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ И СОЕДИНЕНИЕ | 1990 |
|
RU2044734C1 |
| Способ получения замещенных бензо ( ) хинолизин-2карбоновых кислот или их производных | 1972 |
|
SU521842A3 |
| Способ получения производных тетрагидрохинолина или их фармацевтически приемлемых солей | 1982 |
|
SU1277896A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХИНОЛИНКАРБОНОВЫХ КИСЛОТ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1988 |
|
RU2049783C1 |


Авторы
Даты
1974-04-25—Публикация
1971-08-05—Подача