(54) ЗАМЕЩЕННЫЕ БЕНЗО (ii) ХИНОЛИЗИН-.2-.КАРБОНОВЫЕ КИСЛОТЫ ИЛИ ИХ ПРОИЗВОДНЫЕ ПО КАРБОКСИЛЬНОЙ ГРУППЕ
применения способность растворяться в воде обычно является важной и поэтому для этой цели обычно используются соли полученных соединений. Сложные эфиры и гапоидангидриды кислот пригодны для получения соответствующих кислот и они, а гакже ацилгидразиды, соли и амиды, тоже полезны для изменения растворимости и устойчивости соединений.
Соединения, в которых гп равно 1, а R представляет собой метил, являются предпочтительными.
Когда Y является галогеном, то он может быть фтором, хлором, бромом или йодом. Особенно предпочтительными явл5потся фтор и хлор.
Предпочтительными соединениями являются также те, где Y - метил, метиленДИОКСИ-, этилендиокси, метокси-, ацетамидогруппа, фтор или хлор. Когда п больше единицы, каждый из Y может быть одинаксвым или различным.
Антимикробная активность соединения может быть продемонстрирована известным стандартным чашечным методом разведения для бактериальной чувствительности к антибиотикам. Примененная культуральная среда позволяет проводить чувствительные испытания чувствительных микроорганизмов по отношению к антибиотикам, сульфамидам 1и другим химикотерапевтическим агентам. Культуральной средой является триптоновый соевый агар (оксоид) следующего состава
(в г)-.:
Оксоид триптоновый15
Оксоид соевый пептоновый5
Хлористый натрий5
Оксоид агар-агаровый N 315
Вода1 л.
При использовании этого теста обнаружено, что соединения обладают широким спектром активности в отношении граммположительных и грамм-отрицательных микроорганизмов.
Предлагаемые соединения являются активными против микроорганизмов как в присутствии, так и в отсутствии десяти процентов лошадиной сыворотки.
Испытания, проведенные для определения активности, дают данные о количестве соединения, требуемого для полного подавления, частичного подавления и полного отсутствия подавления развития микроорганизмов в агаровых ча1иках. При испытаниях выбранное соединение добавляется в агаровую среду для получения концентраций О, 1, 1О и 1ОО мг/л. Готовятхзя серии чашек с этими концентрациями. В одну из серий добавляются 1О% лошадиной сыворотки. Аликпотныо пасти бульонной культуры каждого из 11 образцов микроорганизме BHtv
|сят в агаровые чашки, содержащие различные концентрации соединения. Чашки выдерживают в инкубаторе при в атмосфере, содержашей 10% двуокиси углерода, в течение 18-24 час. В каждой чашке визуально определяют рост микроорганизмов и записывают минимальную концентрацию, по-. давляющую этот сост.
Многие из соединений активны при введении их животным через рот. Они выделяются с мочей и являются эффективными антибактериальными агентами для мочевого тракта млекопитающих.
Таким образом, предлагаемые соединения имеют широкий спектр антимикробной активности и хороший терапевтический коэффициент ( СП Это следующие соединения:
6,7-дигидро-5ДО-диметил-1-оксо-1Н 5Н-6eH3o ij хинолизин-2-карбоновая кислота;
9-хлор-б,7-дигидро-5-метил-1-оксо-1Н, 5Н-бензо 1 j J хинолизин-2-карбоновая кислота;
натрИй:6,7-Дигидро-9-фтор-5-метил-1-оксо-1Н,5Н-бензо 1 j хинолизин-2-карбо- ксилатгидрат;
метил 6,7-дигидро-9-фтор-5-метил-1-OKcc -lH,5H-6eH3o i з хинолизин-2-карбо|ксилат;
6,7-дигидро-9-фтор-5-метил-1-оксо-1Н, 5H-6eH3oQi3 хинолизин-2-1карбоксамид;
1О-ацетамидо-6,7-дигидро-5- метил-1- -оксо-1Н,5Н-ёензо i j хинолизин-2-карбонсжая кислота;
6,7-дигидро-6,8,10-триметил-1-OKco-lH 5H-6eH3oQi J3 хинолизин-2-карбоновая кислота;
8-хлор-6,7-дигидро-5-метил-1-оксо-1Н, 5Н-бензо 1з хинолизин-2-карбоновая кислота;
6,7-дигидро-8-метокси-5-метил-1-оксо-1Н,5Н-бензо i 3 J хинолизин-2-карбоновая кислота;
6,7-дигидро-6,7-димeтил-9-фтop-l-cкco-lH,5H-бензо,1 J} хинопизвн-2- арбоновая кислота;
6,7-дигидро-5,8-диметил-1-оксо-1Н,5Нбензо 1з хинолизин-2-карбонс®ая кислота;
2,3-днгидро-3-метил-7-оксо-1Н,7Н-1,3-диоксо-(9,1О)бензо 1 j J хинолизин-6-карбоновая кислота;
3-метил-7-оксо-2,3,10,11-тетрагидро-1Н,7Н-1,4-дис ссо{9,1О) бензо i J XHHO- лизин-6-карбоновая кислота;
6,7-дигидро-9-фгор-5-метия-1-ОКСО-1Н, 5Н-бензоfi j 3 хинолиэии-2-карбоновая кисло« 6,7-дигидро-9-ф тор-l-OKco-5-трифторме- тил-1Н,5И-бензо i j хияолиэин-2-карбоновая кислота. Полученные кислоты после очистки обычн имеют белый цвет или от желтоватого до коричневого и представляют собой кристаллические или аморфные вещества. Они плохо растворимы в воде, низших спиртах и углеводородах и лучше растворимы в галоидированных растворителях, диметилформамиде и тому подобных. Сложные эфиры и амиды обы но несколько лучше растворимы в органических растворителях. Соли щелочных металлов имеют значительную растворимость в воде и низших спиртах. Соединения могут быть смешаны со стандартными фармацевтическими наполнителями как органическими, так и неорганическими, которые пригодны для орального или внутрибрюшинного применения. Для использования вне организма или (ДЛЯ местного применения наиболее обычным
диалкилалкоксиметиленмалонат
Бт соон 90 С
где Y, Я , R, m имеют указанные значения.
Амиды соединений получают, например, взаимодействием соответствующей кислоты с соединением обшей формулы L, например с тиояилхлоридом, и с последующим взаимодействием полученногохлорангидрида кислоты с аммиаком или амином до получения амида. Гидразиды получают, например вз имодействием соответствующего сложного эфира с гидразином в подходящем растворителе, например в спирте.
Пример. 32,2 г (О,2 моля) 2,6-Диметилтетрагидрохинолина смешивают с диэтилэтоксиметиленмалонатом и полученную смесь нагревают при 125-1 ЗО°С в течение 3 час. Добавляют 200 г полифосфорной кислоты и раствор постепенно нагревают до 115-12О Ю на масляной бане при периодическом поремешивании. Температура поддерНС С() :-N
100 - 200°С (1-2 часа)
Rm
111 I
живается в течение часа, затем смесь в 60О мл воды и нейтрализуют 40%|ным раствором гидроокиси натрия. Выпав ший в осадок сложный эфир форму.Щ51 111 от-, деляют фильтрованием, промывают водой и суспендируют в 2 л 10%-ного раствора гидроокиси натрия. Смесь нагревают на паровой бане в течение часа, обрабатывают обесцвечивающим ее активированным углем, фильтруют и, наконец, нейтрализуют концентрированной соляной кислотой. Твердый продукт выделяют фильтрованием из диметилформамида. Белый кристаллический продукт представляет собой 6,7-дигидр -5,9-диметнл-1-OKco-lH,5H-6eH3o i j хииолнзни-2-кар- боковую кислоту с т.пл. .
Вычислено,%: С 70,0; И 5,9; J 5,45. .NO,
Найдено,%: С 70,0; И 5,7; N 5,4. (1-2 часа, нейтрализация) у BS является применение простых водных растворов или суспензий. Для этой цели пригодны концентрации порядка от ЮОч./млн. примерно до 5 ч./тыс. и составы используются для погружения в них объектов для обработки или применяются для локальной дезинфекции зараженной поверхности. Количество соединения, необходимого для использования, например для оральной обработки микробной мочевой инъекции, является менее эффективным, чем токсичное количество. Количество вещества, которое способно оказывать воздействие на инфекцию, будет зависеть от вида животного, пола, веса, физического состояния и многих других факторов. Обычное количество составляет менее 100 мг/кг на дозу. Обычно оно назначается в виде стандартных (фармацевтических препаратов таких, как капсулы, таблетки, эмульсии, растворы. Соединения получают по следующей схеме; Полифосфорная кислота ( 1ОО-140°С) NuOHyiHaO . П р и м е р 2. Аналогично примеру 1 готовят смесь из 2-этилтеграгидрохинопина и диэтилэтоксиметиленмалонагом, нагревают ее при 125-130 С в течение 2 час, добавляют полифосфорную кислоту и снова нагревают при 115°С в течение часа. Полученную смесь вливают в воду, нейтрализуют 40%-иым раствором гидроокиси натрия, полученный продукт реакции выделяют и омыляют раствором гидроокиси натрия. Раст
Таблица 1 вор нейтрализуют, и выделившийся твердый продукт, представляющий собой 6,7-дигидро-5-этил-1-окс -1Н,5Н-бензо 1 j хинолизин-2-карбоновую кислоту, выделяют фильтрованием. При использовании методики, описанной в примере 1, и исходя из соответственно замещенных тетрагидрохинолинов, получены соединения, приведенные в табл. 1.
Продолжение таблицы -I

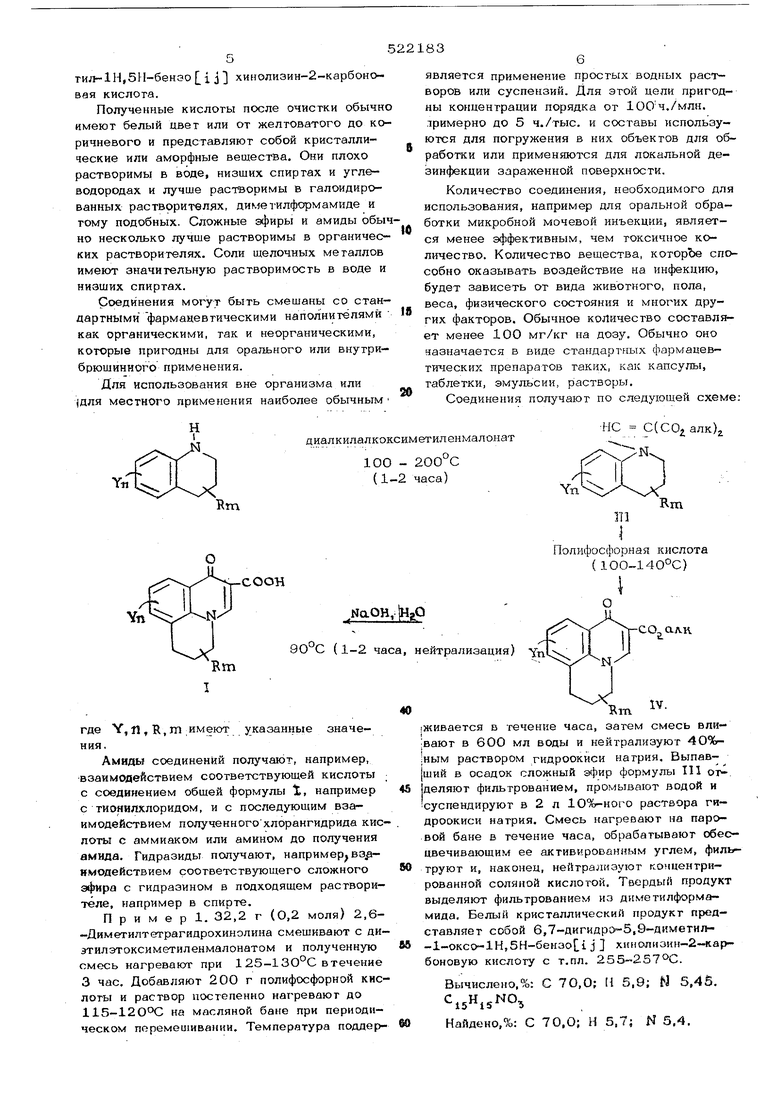










Пример 25. 25 г (0,132 моля) р-( N -диметиламин)-2-метилгетра1-идрохи- нолика смешивают с 28,4 г (0,132 моля) диэтилэтоксиметиленмалонага и полученную смесь нагревают при 12О°С в течение Зчас Добавляют полифосфорную кислоту (200 г) и полученный раствор постепенно нри периодическом перемешивании нагревают до12ОО Раствор выдерживают при 120-130°С в течение часа и затем вливают в 5ОО мл воды при перемешивании. Полученный раствор нейтрализуют (г-пым раствором гидроокиси натрия. Желтый продукт отделяют фильтрованием и при перекристаллизации из этанола получают этиловый эфир 6,7-дигидро-9- ( N,N - диметиламин) - 5 -метил - -1-оксо-1Н,5Н-бензо fj j хинолизин-2-карбоновой кислоты с т.пл. 210-222°С.
Пример,
№
Этиловый jxtiiip 6,7-дигидро-9-фтор)-5-метил-1- оксо-1П,5И-бензо i j х11иолизин-2-карбоновой
кислоты
Этиловый aijinp 9-хло(-6,7-дигилро-5-метил-1- ,5t -6on3o i хинолизин-2-Кс«р5онопой
КИСЛОТ1Л
Этиловг;1й э||1Ир 8-хло : -6,7-дигидрс -5,9-дкмоти/ -1-оксо-1П,511-бензо i Л хинолизин-2 карооновой
кислоты
Э-гнлсхМИ jii() 0,7-ди(гчл(о-9-МОТОКГ1Г-5-vtoTiui- --1-сж ::с -1 П,ГЛ1-6о1к о i j J х111 ОЛ1131 н-2-кор6оиоHoii hif лоты
Вычислено,7о: С 68,9; И 7,1; N 8,9.
Найдено,%: С 68,6; М 7,0; N8,9,
Пример 26. Аналогично примеру 25 проводят реакншо между 2,7-диметилтегра ; гидрохинолином и диэтилэтоксиметиленмало.натом для получения твердого этилового эфира 6,7-дигидро-5-1О-диметил-1-оксо-1П,5Н-бензо i J хинолизин-2-карбоновой кислоты с т.пл. 106-1О8°С.
Вычислено,%: С 71,6; Н 6,7; N 4,9.
Найдено,%: С 71,5; Н 6,9; N 4,9. При использовании методики примера 25 |получены соединения, предегавленные в табл.
Таблица 2
Температура
Соединение плавления,
176-173
190-192
Этиловый эфир 6,7-дигидро-5 метил-1-оксо 1Н, 5Н-6eH3o ij хинояизин-2-карбоновой кислоты
Этиловый эфир 6,7-дигидро-5,9--диметил-1 оксс -lH,5H-6eH3o i j хинолизин-2-карбоновой кислоты
Этиловый эфир 9-бром-6,7-дигидро 5-метил 1оксо-1Н,5Н-бенэо i j хинолизин 2-карбоновой кислоты
Этиловый эфир 6,7-дигидро-9-фтор-1-оксо-5-трифторметип-1Н,5Н-бензо i j хинолиаин-2-карбоновой кислоты
Метиловый эфир 6,7-дигидро-9-фтор-5-метил-1оксо-1Н,5Н-бензо i j хинолизин-2-карбоновой кислоты
Исходным веществом является диметилэгоксиметиленмалонат. Пример 36. 43,2 г (О,20 моля) диэтилэтсксиметиленмалоната и 32,6 г (0,2О моля) 6-иетокситетрагидрохинолина смешивают и нагревают при 125-130°С в течение 3 час. Зйтем добавляют 20О г полифосфорной кислоты и смесь постепенно на|гревают до , поддерживая температуру в течение часа. Полученную смесь, содержащую сложный эфир общей формулы 11Ц вливают в-600 мл воды, подщелачивают 40ЪНым раствором гидросжиси натрия и нагревают на водяной бане в течение 2 час Раствор для обесцвечивания обрабатывают активированным углем, фильтруют и подкисляют. Выделившийся твердый продукт отдеСоединение
Пример,
N
Этиловый эфир 6,7-аигидро-1-оксо-1Н,5Н-бенао i j хинолизин- -2-чсарбоновой кислоты
Этиловый эфир 6,7-дигидро-9- 4етокси-1-оксо-1Н,5Н-бензо 1 j хинолиэин-2- арбоновой кислоты
З гилоаыЙ эфир 9-хлор-6,7-дигидро-1-оксо-1Н, 1 j хннолизин-2-карбоновой кислоты.
Продолжение таблицы 2
243-245
200-202
232-234
Таблица 3
Таблица 4 ляют .фильтрованием, промывают водой и этанолом и перекристаллизовывают из i jjfl-диметилформамида для получения 6,7-дигидро-9-метокси-1-оксо-1Н,5Н-бенао 13 хинолизин-2-карбоновой кислоты с т.пл. 2632570С. Вычислено,%: С 64,9; Н 5,1; N 5,4. 14 13«04 Найдено,%: С 64,8; Н 5,0; N 5,4. Другие соединения, полученные аналогично примеру 36, представлены в табл. 3. Соединения общей формулы Щ , полученные аналогично примеру 26, представлены в табл. 4. Пример 42. Раствор 4,6 г (0,02 м ля) 6,7-дигидро-1-оксо-1Н,5Н бензо 1з хинолизин 2-карбоновой кислоты в 30 мл концентрированной серной кислоты при температуре ниже 30°С обрабатывают смесью из 30 мл серной кислоты и 2 мл концентрированной азотной кислоты. Полученный раствор перемешивают при 25°С в течение 24 час, вливают в лед и обрабатывают гидроокисью аммония до рН 1-2. Смесь филь труют, диспергируют в метаноле и твердый продукт отделяют фильтрованием. Получен:ная 6,7-дигидро-10 нитро-1 оксо-1Н,5Н-бензо 1з хинолизин-2 карбоновая кислота перекристаллизованная из N,N -диметилформамида, образует желтые иглы с т.пл. (разложение). Аналогично примеру 42 получены еледук щие соединения: 6,7-дигидро-5,10-димегил -9™нитро- 1 -OKco-lH,5H 6eH3o i j хинолизин 2 карбоновая кислота с т.пл. 273-2750С; 6,7-дигидро-5- метил-1О-нитрс -1-оксо -1Н,5Н-бензо 1 хинолизин-2-карбоновая кислота с . 300°С. Пример 43. 9,9 г {0,035 моля) твердой 6,7 Дигидро--5-метил 9-метокси-1-OKCo-lH,5H-6eH3o i хинолизия-2 карбоноаой кислоты доба. к 1ОО мл 48%-но го водного рас ТВора бромистоводородной кис :ЛОТы и смбсь нагревают с обратным хблогдйльником в течение 6 час. Полученную сме разбешляют водой, и выпавший твердый осадок отделяют фильтрованием. Твердое вещество растворяют в водном 1О%-ном раствор гидроокиси натрия и снова освящают концентрированной соляной кислотой. .Продукт ;отде ляют фильтрованием, промывают водой и эта нолом и сушат. Не совсем белое твердое ве .щество представляет собой 6,7 ДИгидро-9- -гидроокиси-1-Оксо-1Н 5Н-бензо 1 j3 хинолизин-2 карбоновую кислоту с т.пл. (разложение). Вычислено,%: С 64,8; Н 5,03; N 5,4, .HO Найдено,%: С 65Д; Н 4,9О; N 5,4. Пример 44. 1О г (О,О345 моля) 6,7-дигидро--5-метил-10 нитро-1--оксй--1Н, 5H-6eK3o ij хинолизин 2 карбоновой кислоты растворяют в 300 мл водного раствора 1,9 г (О,0345 моля) Г5щроокиси калия игидрогенизируют в аппарате Рерра с применением никеля Ренея в качестве катализатора при начальном давлении водорода {3,5 атм). Смесь фильтруют и фильтрат доводят до рН 6 концентрированной соляной кислотой. Желтый осадок отделяют фильтрованием, промывают водой, сушат и перекрис таллизоБЫвают из N,N -ди fвтилфopмaмндa для выделения 6,7-дигидро-5-метил-1-оксо-1Н,5Н-бензо i j хинолизин-2-карбоновой кислоты, с т.пл. 247-249°С. Пример 45. Используя методику, описанную в примере 43 и проводя взаимодей:ствие 6,7-дигидро-8-метокси-1-оксо-1Н,5НЦбензо { jj хинолизин-2-карбоновой кислоты .с бромистоводородной кислотой, получают 6,7-дигидро-8-гидроокси-5-метил-1-оксо-lH,5H-6eH3o i j хинолизин-2-карбоновой :кислоты с т.пл. выше 300°С. Пример 46. Используя способ, описанный в примере 46, восстанавливают 6,7;-дигидро-10-нитро-1Н,5Н-бензо i j хино:лизин-2-карбоновую кислоту для получения 10-амино-6,7-дигидро-1чзксо-1Н, хинолизин-2-карбоновой кислоты с т.пл. выше . Вычиспено,7о: С 63,9; Н 5,0; N 11,5. ., Найдено,%: С 63,6; Н 4,8; N 11,5. Пример 47о 5,0 г {0,018 моля) 10--Амино-6,7-дигидро-5-метил-1-оксо-1Н, 5H-6eH3o i хинолизин-2-карбоновой кислоты fj 50 мл уксусного ангидрида перемешивают и нагревают на водяной бане в течение 3 час. После охла5кдения твердый осадок отделяют фильтрованием, промывают водой, сушат и перекристаллизовывают из N,N -диметилформамида для получения 1О-ацетамидр,7-дигидро-5-мети/t-1-оксо-1Н,5Н-бензо ij хинолизин-2-карбоновой кислоты с т.пл. 277-2790С. Вычислено,%: С 64,0; Н 5,4; N 9,3. C..H,.N,,O, 14: 14 2. э Найдено,%: С 63,8; Н 5,3; N 9,3. . Пример 48. Аналогично ;примеру 47 осушествляют взаимодействие кислоты с ангидридом грифторуксусной кислоты для получения 6,7-дигидро-5-метип-1-оксо-1О-трифторацетамид-1Н,5Н-бензо i j xинoлизин-2-карбоновой кислоты с т.пл. 301-303 С. Пример49. Аналогично примеру 47 проводят взаимодействие 8-амино-9-хлор-6,7-дигидро-5-метил-1-оксо-1Н,5Н-бензо ij хинолизин-2-карбоновой кислоты с уксусным ангидридом для получения 8-ацетамид- -9 хлор-6,7-дигидро-5-метил-1-оксо-1Н,5Н6eH3o ij хинолизин-2-карбоновой кислоты с т.пл. 234 236°С. Пример 5О. Аналогично примеру 47 проводят взаимодействие. 1О-амино-6,7- -дигидро 1-оксо-1Н,5Н-беизо i j хинолизин 2-карСоновой кислоты с уксусным антидридох для получения 10-пцотямид-6,7- -ДИГИДР&-5-метип-1-OKCO-IH.SH-бензо 1 j3 хинолизин-2-карбоновой кислоты с т.пл. выше . Пример 51. Аналогично примеру проводят взаимодействие 1О-амиио-в,7-ди- )ГИДр -5-метил-1-оксо-1Н,5Н-бензо i i хиНОПИЗИН--2-карбоновой кислоты с ангидридом И -пропионовой кислоты для получения 6,7-дигидро-5-метил-1-оксо-1О-н-пропи6намид-1Н,5Н-бензо Cij3 хинолизин-2-карбоновой кислоты с т.пл. 253-255°С. Пример 52. Аналогично примеру 47 проводят взаимодействие 1О-амино-6,7-дигвдро-5-метил-1 оксо-1Н,5Н-бензоfi хи- нолизин-2-карбоновой кислоты с ангидридом н-масляной кислоты для получения 10-н-бугирамидс -6,7-дигидро-5-метил-1-оксо-1Н, хинолизин-2-карбоновой кислоты с т.пл. 225-227°С. ПримербЗ. Смешивают 31 г (0,12 моля) 6,7-дигидр о-9-фтор-5-метил-1-оксо-1Н,5Н-бензо i i хинолизин-2-карбоновой кислоты, 4,75 г (0,12 моля) гидроокиси нагрия и к полученной смеси при перемешивании добавляют около 85 мл воды. Через час смесь фильтруют и фильтрат упаривают досуха. Остаток дважды перегоняют с азеотропной смесью бензола с этанолом. Твердое вещество растворяют в метиловом спирте, раствор фильтруют, и полученный про- , дукт осаждают добавлением диэтилового эфи ра. Получают гидратированную натриевую соль 6,7-дигидро-9-фгор-5-метил-1-оксо-lH,5H-6eH3o i j 3 хинолизин-2-карбоновой кислоты с т.пл. выше . Вычислено,%: С 56,8; Н 4,3; N C H FNNaO,. ДН,0 Найдено,%: С 56,6; Н 4,4; N
Соединение
Пример,
№ Амид- N,N -диметил-6,7метил-1-оксо-1Н,5Н-бенз карбоновой кислоты Морфолинамид 6,7-дигидр l-оксо-1Н,5Н-бензо fij нов ой кислоты Пример 57. 10 г (0,0347 моля) этилового эфира 6,7-дигидро-9-фтор-5-метил-1-оксо-1Н,5Н-бензо 1 j xинoлизинa-2-карбоновой кислоты растворяют в 200 мл метанола, содержащего 25 мл 97%-ного гидрезина.. Для ускорения растворения смесь нагревают. Раствор перемешивают при комнатной температуре, и немедленно начинает выделяться твердое вещество. Осадок отде-, ляют фильтрованием, промывают метанолом и перекристаллизовывают ий водного этанола для получения гидразида 6,7-днгидро-9-фтор-5-метил-1-оксо-1Н,5Н-бензо 1 J хинолизин-2-карбоновой кислоты с т.пл. 236i38°C.
Температура плавления, °С Пример 54. А. Получение хлорангидридного производного. 5,0 г (0,0192 моля) в,7-дигидро-9-фтор-5-метил-1-оксо-1 H,5H-6eH3o i j хинолизин-2-карбоновой кислоты перемешивают с 75 мл хлористого тионила и смесь нагревакзт до кипения с обратным холодильником и выдерживают при этой температуре в течение 18 час. Смесь выпаривают досуха я затем трижды порциями по 50 мл с бензолом перегоняют для получения не совсек белого твердого вещества, представляющего собой хлорангидрид 6,7-дигидро-9--фтор-5-метил-1-оксо-1Н,5Н-бензо 1 хинолизин-2-карбоновой кислоты с т.пл. 183186°С. Б. Получение амидного производного. 5,4 г (0,192 моля) продукта, полученного выше, добавляют при перемешивании кЮОмл раствора аммиака в воде и смесь перемешивают в течение 4 час. Желтый осадок отделяют фильтрованием,. промывают водой и перекристаллизовывают из этанола для получения гидрата амида 6,7-Дигидро-9-фтор-5-ме.Ил-1-оксо-1Н,5Н-бензо{1Л хинолизин-2-карбоновой кислоты с т.пл. выше ЗОООС. Вычислено,%: С 60,3; Н 5,4; NIO.O. 14«1Ь гОа-«аО Найдено,%: С 60,2; Н 5,4; 1Я 9,8. Другие аналогично полученные соединения, но с использованием других аминов в качестве исходных веществ, приведены в табл. 5. Таблинаб идро-9-фтор-5j хинолизин-2242-244фгор-5-мeтилолизин-2-карбо253-256С 61,1; Н 5,1; N 15,3. Вычислено,; Найдено,%: С 61,4; Н 5,1; N 15,5. Пример 58. 6-Фтор-2-трифторметил- тетрагидрохинолин конденсируют с эквимо- лярным количеством диэтилэтоксиметиленмалонатом аналогично примеру 1. Промежуточный сложный эфир формулы П1 гидролизу- ют по примеру 1, и полученный твердый продукт перекристаллизовывают из N,N -диметилформамида для получения крисТ.шлов 6,7-дигидро-9-фтор-1-оксо-5-трифторметнл-lH,5H-6eH3o i J хинолизин-2-карбонопой кислоты с т.пл. 295-297 С.
14H9F4 5
Найдено,9&: С 53,1; Н 2,8; N4,4.
Пример 59. Исходя иэ 2,4-димегилтетрагидрохинолина и используя методику примера 60, получают белые кристаллы 6,7-дигидро-5,7-диметил-1-оксо-1Н,5Н-бензо ij хинолизин-2-карбоновой кислоты (т.пл.
Пример,
№
9-Хлор-6,7-дигидро-1-оксо-5-трифторметил1Н,5Н-бензо 1 j хинолизин-6-карбоновая кислота
6,7-Дигидрс -9-метокси-1-оксо-5-трйфтор.метилlH,5H-6eH3o ij хинолизин-2-карбоновая кислота и промежуточное соединение
Этиловый эфир 6,7-дигидро-9-метокси-1-оксо5-трифторметил-1Н,5Н-бензо ij хинолизин-2карбоновой кислоты
6,7-Дигидро-1-оксо-5-трифторметил-1Н,5Нбензо i J хинолизин-2-карбоновая кислота
6,7-Дигидро-5,6-диметил-9-фтор-1-оксо-1Н,5Нбензо { j хинолизин-2-карбоновая кислота
6,7-Дигидро-5,6-диметил-1-оксс -1Н,5Н-бензо i j хинолизин-2-карбоновая кислота П р и м е р 65, 2,5 г (0,014 моля; 5-амино-2,6-диметилтетрагидрохинолинасмешивают с 6,2 г (О,028 моля) диэтилэток симетиленмалоната и смесь при периодическом перемешивании нагревают при 110-12О° в течение 1,5 час. Добавляют 10 г полифосфорной кислоты и раствор нагревают 5 ми при 11О-120°С. Горячий раствор вливают в 300 мл воды. Образующийся твердый осадок отделяют фильтрованием и смешивают с 200 мл 39&-НОГО раствора гидроокиси натрия При нагревании смеси в течение получаса при 100°С добавляют 100 мл этанола. Для обесцвечивания раствор обрабатывают активированным углем, фильтруют и подкисляют до рН 3-4 концентрированной соляной кислотой. Желтый осадок отделяют фильтрован11ем промывают водой и дважды перекристаллизовывают из смеси N,N -диметилформамида и воды для получения 1О-амино-6,7-дигидро -5,9-диметил-1-оксо-1Н,5Н-беизо 1 J хино лизин-2-карбоновой кислоты с т.пл. 264266°С. Вычислено.: С 66,2; Н 5,9; N 10,3. С15 16«гОз Найдеко,%: С 65,2; Н 5,9; N 1О,О.
3
18
269-272С) после перекристаллизации из смеси N,N -диметилформамида с водой. Вычислено,%: С 70,О; Н 5,9; N 5,5.
Найдено,%: С 7О,О; Н 5,8; N 5,4.
Соединения, полученные аналогично примеру 60, но исходя из соответственно замещенных тетрагидрохинолинов, приведены в табл. 6.
Таблица 6
Температура
Соединение плавления, С
275-277
249-251
212-214
234-236 203-2 Об П р и м е р 66. Аналогично примеру 1 соединение 7-ацетамид-6-хлрр-1,2,3,4-твтрагидрохинолин превращают в 8-амин-9- i-хлор-б ,7-дигидро-5-метил-1-оксо-1 Н, 5Нбензо i J хинолизин-2-карбоновую кислоту с т.пл. выше . Следующие новые промежуточные тетрагидрохинолины представляют собой масла при комнатной температуре, которые получают из известных соединений путем восстановительного дегалоидирования и инденти фицированы ИК-спектральным анализом и используются как масла без дальнейшей очистки;4-хлор-6-фторхинальдин восстанавливают в присутствии родия на активированном угле в 6-фтор-2-метилтетрагкдрохинолик; 4,6-дихлорхинальдин- в присутствии р(дия на активированном угле в 8-хлор-2-метилтетрагидрохинолин;6-метоксихинальдин - в присутствии родия на активированном угле в 6-метокс -2-метилтетрагидрохинолин;6-( -диметиламин)-хинальдин - в присутствии родия на активированном угле в 6-{ Д-аиметиламин) -2-метялтвтрагидр(Р хннсшик;
5-хпор-6-метипхинальдин - в присутстви платины на активированном угле в 5-хпор- -2,6-димвтилтетрагидрохинопин;
4-хлор-5 метоксихинальдин - в присутствии платины на активированном угле в 5-метокси-2--метилтетрагидрохинолин;
4-хпор-6 фтор-2- трифторметилхинолин в присутствии платины на активированном угле в 6-фтор-2-трифтор-метилтетрагидрс хинолин;
4--хлор-метсжси-2-трифторметилхинолинв присутствии платины на активированном угле в 6-метокси-2-трифторметилтетрагидрохинолин;
4-хлор-6-метокси-2-трифторметил(хинолин - в присутствии платины на активированном угле в 6-метокси-2-трифторме тилтетрагидрохинолин;
4,6-дихлор-2-трифторметилхинолин - в присутствии платины на активированном угле в 6 хлор-2-трифторметилтетрагидрохинолин.
Примере. 5-Хлор-2-метилтетрагидрохинолин конденсируют с эквимопярным количеством диэтилэтоксиметиленмалонатом аналогично примеру 1. Промежуточный сложный эфир формулы 1П выделяют, его т.пл. 17 1-17 . После гидролиза по примеру 1 получают твердое кристаллическое вещество представляющее собой 8-хлор-6,7-дигидро-5-метил-1-оксо-1Н,5Н-бензо хинолизин-2-карбоновую кислоту с т.пл. 2772790С,
Пример 68. Смесь из 75 мл 6 н. соляной кислоты и 12,9 г (0,05 моля) 1О-амино-6,7-дигидро-5-метил-1 оксо-бензо j 3 хинолизин-2 карбоновой кислоты диазотируют при 5-1О°С нитритом натрия (12,9 г, 0,О5 моля растворено приблизительно в 10 мл воды). Холодную смесь фнгль труют и затем добавляют к смеси из 19,7 г (О,1 моля) хлористой меди (1) и 15О мл концентрированной соляной кислоты при под держании температуры ниже . После перемешивания в течение часа смесь разбавляют водой для получения кремово-белого твердого вещества, которое отделяют фильтрованием. После двукратной перекристаллизации из N,H -диметилформамида получают 1О-хлор-б,7-дигидро-5-метил-1-OKco-lH,5H-6eH3o i j хинолизин-2--карбс иовую кислоту с т.пл. 219-222ОС.
Пример 69. Смесь 7О мл 6 н. соляной кислоты и 10 г (0,039 моля) 1О аминс -6,7--дигидр| -5-метил-1--оксо-бензо П |хинолизин-2-карбоновой кислоты обрабатывают при раствором 2,7 г (О,39 моля) нитрита натрия в1О мл воды .Раствор перемешивают в гечонио примерно 10 мин и нейтрализуют добавлением растрора натрия. Смесь из i растворов 4,7 г (О,О48 моля) хлористой меди (1) в 20 мл воды и 4,75 г (0,097 моля) цианистого натрия в 10 мл воды охлаждают до и к ней при энергичном перемешивании по каплям добавляют диазониевый раствор. После перемешивания в течение 30 мин при 0°С смесь в течение 15 мин нагревают при 50°С и снова перемешивают примерно при 25°С в течение 65 час. Раствор подкисляют до рН 6 ледяной уксусной кислотой для получения коричневого твердого вещества, которое отделяют фильтрованием, промывают водой и затем дважды по 2 00 мл экстрагируют кипящим дихлорэтаном. Горячие дихлорэтановые экстракты фильтруют и фильтраты упаривают до получения оранжевого твердого вещества. Его основательно промывают гексаном, перекристаллизовы- вают из MiN -диметилформамида, растворяют в разбавленной щелочи, снова осаждают ледяной уксусной кислотой и снова перекристаллизовывают из N,N -диметилформамида для получения 1О-циан-6,7-дигидро-5 метил-1-оксо-1Н,5Н-бензо i j хинолизин-2-карбоновой кислоты с т.пл. выше .
Приме р7О. 6-Ацетамид-4-хлор-2 -метилхинолин восстанавливают каталитически в 6-ацетамид-2-метил-1,2,3,4-тетрагидрохинолин. Тетрагидрохинолин конденсируют с диэтилэтоксиметиленмалонатом при нагревании без растворителя в течение часа при 14О- С. Добавляют полифосфорную кислоту и раствор нагревают при 1ОО°С в течение получаса. Полученную 9-амино-6,7-Дигидро-5-метил-1-оксо-1Н,5Н-6eH3o i j} хиноли- зин-2-карбоновую кислоту подвергают взаимодействию с уксусным ангидридом по примеру 49 для получения 9 ацетамид-6,7- -дигидpo-5-метил-1-оксо-1Н,5Н-бензо i j хинолизин-2-карбоновой кислоты с т.пл. выше . Продукт .идентифицирсваж спектральным и элементарным анализами.
I
Испытания полученных соединений. Острая тифозная инфекция у мышей. Группам по 10 самок мышей типа Vebstat (18-22 г) орально вводят 1,О мл переме0 шанной в течение ночи культуры штамма W SaCmoneeea tvphimurium. Зараженных грызунов помещают в снабженные крышкой пластмассовые коробки, основанне которых покрыто деревянными стружками.
Пищу и воду дают по желанию.
Соединения суспендируют в 4 1г-ной водной акации при концентрации 4 мг/мл. Эту суспензию механически измельчают и гомогенизируют на дробилке. Через 24 часа пос-
ле инъекции начинают оральную дачу соедн-
пений. Их дают каждый день в течение двух недель. За подопытными животными наблюдают в течение 20 дней после заражения.
В табл.7 приведена активность 10-ацетамидо-6,7-дигидро-б-метил-1-оксо-1Н,5НСоединения I и И обеспечивают лучшую защиту млекопитающих животных от вызываемся SaCmonetta fyphimuriuin инфекции, чем неомидин. Хроническая инфекция в мочевом канале у крыс. Семки крыс типа Si топ sen (род Syragftfe -Daw ley) анестизируются a( и моются спиртом. В середине над лобковой костыо через кожу мышцу и брюшину делают продояьное, пигидиальное углубление длиной приблизительно 2,5 см. На пузырь легко надавливают с обеих сторон, поднимают пинцетом, частично перевязывают в верхушке перед мочеиспус- :кательным каналом с применением хромовых ниток. Затем в просвет пузыря впрыс кивают О,1 мл перемешанной в течение ночи культуры или другую пригодную для за;ражения бактерию с тем, чтобы вызвать равномерное заражение пузыря, игродолжающееся, по крайней мере, в 10 дней. Затем закрывают пигидиальное углубление зажимами из нержавеющей стаяв и помешают крыс в пластмассовые коробки, основание которых покрыто деревиоЕоомми стружкам Пищу и воду дакхт по желанию. 6,7-Дигидро-9-фгор-5-мепгл-1-оксо-1Н 5Н-6eH3ofi 13 хинолизин-2 варбоновую кисло ту (III) суспендируют в 4%-«ой водной ака ции при концентраики 25 ««г/м л для животных, которым дают бояьшвую дозу (100 мг/к Эту суспензию механически измельчают и гомогенизируют д|эобшвсой. Более низкие концентрации приготейляют разбавлением лиш акацией. Соединение III вводится орально через 24 час после операции и затем ежедневно в течение 20 дней. По истечении 21 дня животных убивают и мочевой пузырь подвергают культивации в чашке с триптоаовсЛ соевой агаровой средой. При этом зараженный организм проявляется образованием характерных многочисленных пятен. В
6eH3oCij хинолизин-2-карбоиовой кислоты (I), 6,7-дигидро-5,8-диметил-1-окс{ -1Н, 5H-6eH3o ij хинолизин-2-карбоноБОй кислоты ( 11 ) и неомицина (известное соединение ).
Таблица 7 Каждый опыт входит и группа зараженных не обработанных контрольных животных. Параллельными опытами также определяют активность известных соединений. Результаты опытов. Полученные при при- |менении Ppoteus VuCg-afis :ревультаты свка&г&1ъствукгс о том, что описанным методом достигалось равномерное продолжительное заражение пузыря. В большинстве случаев заражение распространялось и на почки. Число погибших от заражения до окончания опыта животных |указано в табл. 8. Для лечения от заражения требовалось оральное введение соединения П1 в коли1честве 1ОО мг/кг в день в течение более 1О дней. Стерилизацию мочевого канала крыс осуществляют при применении соединения ill быстрее, чем при применении налидиксиновой кислоты при одинаковых дозах 100, мг/кг. На основании количества положительных культур пузыря, полученных различными дозами, эффективной дозой для соединения Щ Т.е. 5О% (ЕД ), является 10 мг/кг в день. анные не являются суммой всех положительных культур на каждую дозу, так как по окончании лечения животных с зараженными пузырями за определенное время за- ражаются и почки. Активность соединений III сравнивается с .хинолонами, налидиксиновой кислотой и нитрофурантоином. Все соединения применяют в количестве 2,5 дозы ЕД. соединения 111, определенной ранее проведенными опытами, т.е. 25 мг/кг в день. При применении соединения III образуется меньше положительных культур. Активность подопытных соединений а OTNношении вызываемого Ppoteus sp- хронического заражения мслевого канала кры приведена в габл. 8.
23 Примечание. Каждая группа состоит указывают соотношение животным.
Результаты опытов свидетельствуют о том, что соединение III является наиболее активным для борьбы с вызываемыми заражениями по сравнению с другими соединениями.
Формула изобретения
Замещенные 6eH3o iJ3 хинолизин-2-карбоновые кислоты или их производные по кар-i боксйгаьной группе формулы О
СООН
Rm
где V означает низший алкил, низшую алкоксигрушту, галоген, окси-, нитро-, циано- группу, трифторметил, аминогруппу, низшую алканамидо-, трифторацетамидо- или N,M Низшую диал кил аминогруппу;
R - метил, этил или трифторметил; И является целым числом от О до 2
522 J. 83
-2 Л Т a б л и ц а 8
и, когда п равно 2, то Y может бьггь метилендиокси- или этилендиоксигруппами, связанными с соседними положениями кольца;
nt является целым числом от О до 2 и, когда R означает трифторметил, тп равно 1, обладающие антимикробной активностью.
Приоритет по признакам:
аминогруппа, трифторацетамидо- или N ,Nнизшай диалкиламиногруппа;
0 1 N , N - низшая диалкиламиногруппа.
Источники информации, принятые во внимание при экспертизе: 1. &. Fodor, J.K is«, J.SQUay- Conii orationat
Correlation of Chloramphenicot with
Nor-i-ephedrinef
J. Chem.Socii95i, 1858 (прототип). из 1О животных, последние три КОЛОЕЖИ положительных культур к пережившим 
Авторы
Даты
1976-07-25—Публикация
1974-04-19—Подача