1
Предлагается способ получения повых производных цефалоспорина, обладающих биологической активностью, отличной от активности известных аналогичных соединений. Новые соединения могут найти применение в фармацевтической промышленности.
Известен способ получения 7-а|Циламино-3тиадиазолилтиометилцефалоспорановой-4 кислоты, заключающийся в том, что 7-аи,иламино-ацетоксиметилцефалоспорановую-4 кислоту -подвергают взаимодействию с тиадиазолилмеркаптаном с последующим выделением продуктов известным способом.
Предлагается основанный на известной реакции способ получения производных цефалосиррина общей формулы
ацил общей форгде R - атом водорода, мулы
R
снеов которой RI - фенил, циклогексил, тиенил, 3-амино-З-карбоксипропил, феноксигруппа;
RZ - атом водорода, аминогруппа;
X - атом водорода, атом галогена.
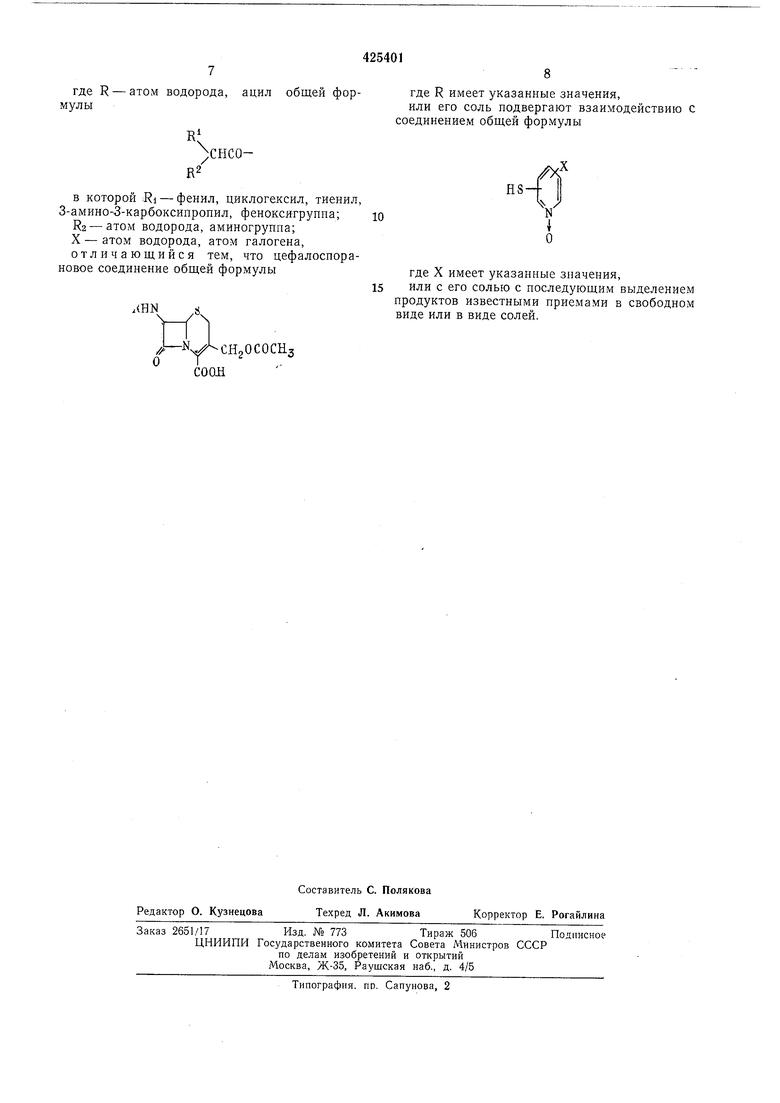
Способ заключается в том, что цефалоспорановое соединение общей формулы
RHN
20
CHgOCO-CHg
25 где R имеет указанные значения.
или его соль подвергают взаимодействию с соединением общей формулы
где X имеет указанные значения,
или с его солью. Продукты выделяют известным способом в свободном виде или в виде соли.
Реакцию желательно проводить в растворителе, например в воде или в органическом растворителе, который легко смешивается с водой, но инертен к исходному соединению.
Предпочтительными органическими растворителями являются, например, диметилформамид, диоксан, ацетон, спирт, ацетонитрил, диметилсульфоксид, тетрагидрофуран и т. п.
Температура реакции и ее продолжительность меняются в зависимости от типа исходных веществ, их количеств и пропорций, вида растворителя и т. п. Обычно температура реакции равняется О-100°С. Продолжительность реакции может составлять .от нескольких часов до нескольких дней, предпочтительно от 2 час до 2 дней. Желательно вести ее при рН 2-8, лучше . Очистку полученного таким образом продукта можно осуществлять с помощью хроматографической колонки, экстракцией, осаждением, противоточным разделением и т. п.
В приведенных примерах все части весовые, если нет других указаний.
Пример 1. 84 ч. 7-(2-тиепилацетамидо)цефалоспораната натрия и 30 ч. натриевой соли 1-окиси 2-меркапто1пиридина растворяют в 1000 об. ч. воды. Водный раствор нагревают до 60°С и выдерживают в течение 8 час при перемешивании. Реакционный продукт очищают на колонке, заполненной полистирольной смолой (Амберлит XAD-П), и получают 40 ч. натриевой соли Г-окиси 7-(2-тиенилацетамидо)-3-{2 -пиридилтиометил) - З-цефем-4 - карбоновой кислоты.
Этот продукт подвергают лиофильпой сушке, а затем тонкослойной хроматографии на силикагеле, применяя следующие системы растворителей:
система А-смесь насыщенного водного раствора хлористого натрия, изоамилацетата, метанола и м фавьиной кислоты (10:65:20:5 по объему);
система В - смесь пасыщепного водного раствора хлористого натрия, н-бутилового спирта и уксусной кислоты (1:3:1 по объему).
Эти системы растворителей оставляют стоять в течение 2 час, затем появляется на ловерхпости растворитель систем А и В, соответствующее проявление способствует получению одного пятна при . 0,3-0,4 и однопятна при Kf 0,2-0,3.
Найдено, %: С 46,15; Н 3,79; N 8,48. CgHieNaOsS Na. Вычислено, %: С 46,14; Н 3,46; N 8,49. ИК-спектр (таблетки КВг) для этого продукта показь1вают поглощение при 1750- 1760 см-1 благодаря присутствию р-лактама. ЯМР-спектр (в тяжелой воде, 100 мгц) указывает на поглощение типа АВ протонов в положении 2 щефемового кольца при 3,70 ч./млн, поглощение ( спз) протонов в положениях 6 и 7 при 5,18 и 5,77 ч./млн соответственно, мультиплетное поглощение пиридинового кольца и тиофенового кольца при 7,18-8,50 ч./млн.
Пример 2. 1420 ч. цефалоспорипа С и 450 ч. натриевой соли 1-окиси-2-меркаптопиридина растворяют в 10000 об. ч. воды. Водный раствор нагревают до 50-51°С и выдерживают в течение 21 час. Продукт реакции очищают на колонке, заполненной полистирольной смолой (Амберлит XAD-П), и получают 550 ч. патриевой соли Г-окиси 7-(5-амино-5-карбоксивалериламидо)-3 - (2 -пиридилтиометил) -З-дефем-4-карбоновой кислоты. Найдено, %: С 41,44; Н 4,84; N 10,26. Ci9H2iN4O7SkNa2-il/2H2O Вычислено, %: С 41,54; Н 4,77; N 10,19. В УФ-спектре поглощения (вода) предлагаемый продукт дает максимумы поглощения (При 236 ммк (е 28800) и при 265 ммк (е 17000).
ЯМР-спектр (тяжелая вода, 100 мгц) показывает квартет в положении 2 метиленовых водородов при 3,75 ч./млн, квартет метилено- вых водородов в положении 3 при 4,31 ч./млн и дуплеты для водородов в положениях 6 и 7 при 5,23 ч./млн и 5,77 ч./млн, соответственно. Пример 3. 8160 ч. 7-ам-иноцефалоспорановой кислоты, 2550 ч. бикарбоната натрия и .54000 ч. натриевой соли 1-окиси 2-меркаптопиридина растворяют в 160000 об. ч. воды. Смесь выдерживают при 40°С в течение 40 час. Затем после охлаждения смеси добавляют разбавленную соляную кислоту. Выпавший осадок собирают и получают 6280 ч. Г-окиси 7-амино-З - (|2-пиридилтиометил)-3цефем-4-карбоновой кислоты.
Найдено, %: С 44,74; Н 3,77; N 12,21. С1зН1зМз0452-1/2Н20 Вычислено, %: С 44,81; Н 4,04; N 12,06.
В УФ-спектре поглощения (0,6%-ный водный раствор бикарбоната натрия) продукт дает максимумы поглощения при 236 ммк (е 21300) и Г1ри 264,5 ммк (е 13800). ЯМР-спектр (водный раствор бикарбоната натрия, 100 мгц) показывает квартет метилеповых водородов в положении 2 при 3,76 ч./ /млн., квартет метиленовых водородов в положении 3 при 4,30 ч./млн., дуплеты водородов в положепиях 6 и 7 при 5,20 и 5,62 ч./млн. соответственно, поглощение водородов пиридинового кольца при 7,4 и 8,5 ч./млн.
Пример 4. 3640 ч. 7- (D-2-грег-бутоксикарбониламино-2 - фенилацетамидо)цефалоспораната патрия и 1200 ч. натриевой соли 1-окиси
2-меркаптопиридина растворяют в 60000 об. ч. воды. Смесь выдерживают 24 час при 50°С. Затем реакционную массу подкисляют разбавленной соляной кислотой, выпавший осадок отфильтровывают и получают 2970 ч. .Г-окиси 7-(О-2-трет - бутокеикарбониламино)-2- (фенила цетамидо)-3 - (2 -пиридилтиометил) - 3цефем-4-карбоновой кислоты.
Этот продукт обрабатывают трифторуксусной кислотой и получают 1 -окись 7-(D-2амино-2-фенилацетамидо) - 3-(2 -пиридилтиометил) -З-цефем-4-карбоновой кислоты.
ЯРМ-спектр (трифторуксусная кислота, 100 МГЦ) дает квартет метиленовых водородов в положении 2 при 3,64 ч./млн. квартет метиленовых водородов в положении 3 при 4,46 ч./млн., дуплеты водородов в положениях 6 и 7 при 5,19 и 5,80 ч./млн. соответственно.
Это соединение можно также получить при взаимодействии 405 ч. 7-(Д-2-амино-2-фенилацетамидо)цефалоспориновой кислоты, 84 ч. бикарбоната натрия и 149 ч. натриевой соли 1-окиси 2-меркаптопиридина в 6000 об. ч. воды.
Пример 5. 2090 ч. 7- (2-тиениладетамидо)цефалоспораната натрия и 750 ч. натриевой соли 1-окиси 4-меркаптопиридина растворяют в 30000 об. ч. воды. Смесь выдерживают при в течение 6 час. После отделения нерастворимых веществ фильтрованием в реакционную смесь добавляют разбавленную соляную кислоту. Выпавший осадок отфильтровывают и промывают небольшим количеством хлороформа, получают 2000 ч. Г-окиси 7-(2тиенилацетамидо)-3 - (4 -пиридилтиометил)3-;цефем-4-карбоновой кислоты.
Найдено, %: С 47,24; Н 3,71; N 8,65.
CisHirNsOsSs-HaO
Вычислено, %: С 47,38; Н 3,97; ,N 8,72.
В ЯМР-спектре (тяжелая вода, 100 мгц) натриевой соли этого продукта присутствует квартет метиленовых водородов в положении
2при 3,60 ч./млн., синглет метиленовых водородов тиенильной группы при 4,02 ч./млн.. квартет метиленового водорода в положении
3при 4,30 ч./млн., дуплеты водородов в положениях 6 и 7 при 5,14 и 5,47 ч./млн. соответственно.
Пример 6. 45000 ч. 1-(2-тиенилацетамидо)цефалоспораната натрия и 18000 ч. натриевой соли 1-окиси 2-меркаптопиридпна растворяют в 45000 об. ч. воды. Смесь выдерлшвают при 62°С в течение 6 час. После отделения нерастворимых веществ фильтрованием в реакционную массу добавляют разбавленную соляную кислоту. Выпавший осадок отфильтровывают и промывают небольшим колпчеством хлороформа, получают 47000 ч. 2 -окиси 7-(2тиенилацетамидо)-3 - (2 -пирпдилтнометил)З-цефем-4-карбоновой кпслоты . Натриевая соль этого продукта идентична во всех отношениях продукту из примера 1.
Пример 7. 418 ч. 7-(2-тиенилацетамидо) иефалоспораната натрия и 184 ч. натриевой соли 1-окиси 2-меркапто-4-хлорпиридина растворяют в 5000 об. ч. воды. Смесь выдерживают в течение 5 час при 55-57°С, после охлаждения в нее добавляют разбавленную соляную кислоту. Выпавший осадок собирают, 5 промывают хлороформом и получают 350 ч. Г-окиси 7-(2-тиенилацетамидо)-3-(4 -хлорпиридилтиометил) -З-цефем-4-карбоновой кислоты.
Найдено, %: С 45;73; Н 3,27; N 3,11.
0 CisHieNsOsSsCla
Вычислено, %: С 45,82; Н 3,23; N 8,41. Пример 8. 82,4 ч. 7-фенплацетамидоцефалоспораната натрия и 33 ч. натриевой соли 1-окиси 2-меркантопиридина растворяют в
5 800 об. ч. воды. Смесь выдерживают при 51°С в течение 22 час. Затем реакционную массу подкисляют разбавленной кислотой. Выпавший осадок собирают и промывают водой, получают 60 ч. Г-окиси 7-фенилацетамидо-3-(20 пиридилтиометил)-З-цефем-4-карбоновой кислоты.
В ЯМР-спектре (тяжелый диметилсульфоксид, 100 мгц) этот продукт дает квартет метилеповых водородов в положении 2 при
5 3,51 ч./млн., синглет метиленового водорода в положении 3 при 4,07 ч./млн., синглет метиленовых водородов в положении 7 фенилацетамидогруппы при 3,52 ч./млл., дуплет водорода в положении 6 при 5,05 ч./млн., квартет
0 водорода в положении 7 при 5,63 ч./млн., мультнплет водорода фенильного и пиридинового колец при 7,20 и 8,30 ч./млн.
Пример 9. 428 ч. 7-феноксиацетамидоцефалоспораната натрия и 180 ч. натриевой соли
5 1-окиси 2-меркантопиридина растворяют в 5000 об. ч. воды и выдерживают при 50°С в течение 20 час. Реакционную смесь обрабатывают, как в примере 7, и получают 190 ч. Г-окиси 7-феноксиацетамидо-З - (2-пиридил0 тиометил)-З-цефем-4-карбоновой кислоты.
В ЯМР-спектре (тяжелая вода - бикарбонат натрия, 100 мгц) продукт дает квартет метиленовых водородов в положении 2 при 3,56 ч./млн., квартет метиленовых водородов
5 в положении 3 при 4,21 ч./млн., синглет метиленовых водородов в положении 7 феноксигрунны при 4,72 ч./млн., дуплеты водородов в положениях 6 и 7 при 5,15 и 5,79 ч./млн. соответственно.
50
Предмет изобретения
Снособ получения производных цефалосно55 рина общей формулы
RHN
60
65
R - атом водорода, ацил общей форгде
мулы
R
снсоЕ
в которой iRi - фенил, циклогексил, тиенил, З-амино-З-карбоксипронил, феноксигрупна;
R2 - атом водорода, аминогруппа;
X - атом водорода, атом галогена,
отличающийся тем, что цефалоспорановое соединение общей формулы
.(HN
-К-У-сНгОСОСНз
/ О
соол
где R имеет указанные значения, или его соль подвергают взаимодействию с соединением общей формулы
где X имеет указанные значения,
или с его солью с последующим выделением
продуктов известными приемами в свободном
виде или в виде солей.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения цефалоспориновых соединений или их солей | 1972 |
|
SU591151A3 |
| Способ получения 3-йодметилцефалоспоринов | 1981 |
|
SU1069627A3 |
| Способ получения -незамещенных карбамоилоксиметилцефал оспоринов | 1972 |
|
SU457224A3 |
| Способ получения производных цефалоспорина | 1981 |
|
SU1087076A3 |
| Способ получения 7-ациламидо-7метокса-3-р-3-цефем-4-карбоновой кислоты | 1972 |
|
SU454742A3 |
| Способ получения цефалоспориновых соединений или их солей | 1974 |
|
SU563123A3 |
| Производные 7 @ -метоксицефалоспорина или их натриевые соли,обладающие противомикробной активностью | 1981 |
|
SU1130569A1 |
| Способ получения производных 7 @ -метоксицефалоспорина или их солей с щелочными металлами | 1982 |
|
SU1105117A3 |
| Способ получения производных -изомерного цефалоспорина | 1977 |
|
SU759053A3 |
| Способ получения ненасыщенных произ-ВОдНыХ 7-АцилАМидО-3-цЕфЕМ-4-КАРбОНОВОйКиСлОТы или иХ СОлЕй | 1977 |
|
SU845788A3 |


Даты
1974-04-25—Публикация
1971-07-30—Подача